- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Тамифлю инструкция по применению
Официальная инструкция лекарственного препарата Тамифлю порошок 13 г. Описание и применение Tamiflju, аналоги и отзывы. Инструкция Тамифлю порошок утвержденная компанией производителем.
Состав
действующее вещество: oseltamivir;
1 г порошка содержит осельтамивира 30 мг в виде осельтамивира фосфата 39,4 мг.
1 мл готовой суспензии содержит 6 мг осельтамивира в виде осельтамивира фосфата 7,88 мг.
Вспомогательные вещества: cорбит (Е 420), титана диоксид (Е 171), натрия бензоат (Е 211), ксантановая камедь, мононатрия цитрат, сахарин натрия, Тутти Фрутти PERMASEAL PHS-142000 (вкусовые добавки).
Лекарственная форма
Порошок для оральной суспензии.
Основные физико-химические свойства: гранулят или комковатый гранулят от белого до светло-желтого цвета восстановлена суспензия - непрозрачная суспензия от белого до светло-желтого цвета.
Фармакологическая группа
Противовирусные средства для системного применения. Противовирусные средства прямого действия. Ингибиторы нейраминидазы.
Код АТХ J05A H02.
Фармакологические свойства
Фармакологические.
Осельтамивира фосфат является пропрепаратом активного метаболита (осельтамивира карбоксилат). Активный метаболит является селективным ингибитором фермента нейраминидазы вирусов гриппа, представляет собой гликопротеин, который находится на поверхности вириона. Активность вирусного фермента нейраминидазы важна для проникновения вируса в неинфицированные клетки, высвобождение вновь вирусных частиц из инфицированных клеток и дальнейшего распространения вируса в организме.
Осельтамивира карбоксилат ингибирует нейраминидазу вирусов гриппа типов А и В in vitro . Осельтамивира фосфат ингибирует вирус гриппа и репликацию вируса гриппа in vitro. В случае орального применения озельтамивир подавляет репликацию вируса гриппа типов А и В и его патогенность in vivo на моделях гриппозной инфекции у животных при противовирусных концентрациях, подобные тем, которые достигаются у человека при дозе 75 мг два раза в сутки.
Антивирусная активность осельтамивира была подтверждена в отношении вирусов гриппа типов А и В в ходе экспериментальных исследований с участием здоровых добровольцев.
Значение IC 50 осельтамивира для фермента нейраминидазы клинических изолятов вирусов гриппа А колебались от 0,1 нмоль до 1,3 нмоль, а для вирусов гриппа В составили 2,6 нмоль. В данных опубликованных исследований отмечались высокие значения IC 50 для вирусов гриппа В с медианой 8,5 нмоль.
Резистентность к озельтамивиру
Клинические исследования . Риск появления вирусов гриппа с пониженной чувствительностью или выраженной резистентностью к озельтамивиру изучался в ходе клинических исследований. Развитие резистентности к озельтамивиру у вируса во время лечения наблюдался чаще у детей, чем у взрослых, варьируя от менее 1% у взрослых до 18% у младенцев в возрасте до 1 года. Дети-носители вируса, резистентного к озельтамивиру, в общем выделяли вирус в течение более длительного периода по сравнению с такими с нерезистентним вирусом. Однако вызванная лечением резистентность к озельтамивиру не влияла на ответ на лечение и не приводила к увеличению симптомов гриппа.
В общем более высокая частота резистентности к озельтамивиру наблюдалась у взрослых пациентов с ослабленным иммунитетом, получавших стандартную или двойную дозу осельтамивира в течение 10 дней [14,9% (10/67) в группе стандартной дозы и 2,8% (2/71) в группе двойной дозы] по сравнению с данными исследований с участием взрослых без других заболеваний, которые получали лечение озельтамивиром. Большинство пациентов, у которых развилась резистентность, были пациентами после трансплантации (8/10 пациентов в группе стандартной дозы и 2/2 пациентов в группе двойной дозы). Большинство пациентов с вирусом, резистентным к осельтамивира, были инфицированы вирусом гриппа типа А и выделяли вирус в течение более длительного срока.
Частота развития резистентности к озельтамивиру в клинических исследованиях
популяция пациентов | Пациенты с мутациями резистентности (%) | |
Фенотипирование * | Ген и фенотипирование * | |
Взрослые и подростки | 0,88 % (21/2377) | 1,12 % (27/2391) |
Дети (1-12 лет) | 3,89 % (66/1698) | 4,24 % (72/1698) |
Младенцы (<1 года) | 18,31 % (13/71) | 18,31 % (13/71) |
* Полное генотипирование во всех исследованиях не проводилось.
профилактика гриппа
Нет подтверждения возникновения резистентности к лекарственному средству, ассоциированной с применением препарата Тамифлю®, в проводимых сегодня клинических исследованиях профилактики гриппа после контакта (7 дней), членам семьи после контакта (10 дней) и сезонной профилактики гриппа (42 дня) у пациентов с ослабленным иммунитетом. Во время 12-недельного исследования профилактики у пациентов с ослабленным иммунитетом возникновения резистентности не наблюдалось.
Клинические данные и данные наблюдений. В вирусах гриппа типа A и B, выделенных у пациентов без экспозиции озельтамивиром, in vitro были обнаружены природные мутации, ассоциированные с пониженной чувствительностью к озельтамивиру. Резистентные штаммы, отобранные во время лечения озельтамивиром, были выделены у пациентов с нормальным и ослабленным иммунитетом. У пациентов с ослабленным иммунитетом и детей младшего возраста риск развития резистентности к озельтамивиру во время лечения более высокий.
Было обнаружено, что резистентные к озельтамивиру вирусы, выделенные у пациентов, получавших лечение озельтамивиром, и резистентные к озельтамивиру лабораторные штаммы вирусов гриппа содержат мутации в нейраминидазы N1 и N2. Мутации резистентности имели тенденцию быть специфическими к вирусному подтипа. С 2007 года спорадически оказывалась резистентность, которая возникала естественным путем и была ассоциирована с мутацией H275Y, в сезонных штаммах H1N1. Как оказалось, чувствительность к озельтамивиру и распространенность таких вирусов меняется сезонно и географически. В 2008 году H275Y была обнаружена в> 99% циркулирующих изолятов гриппа H1N1 в Европе. В 2009 году вирус гриппа H1N1 ( «свиной грипп») был почти однородно чувствительным к озельтамивиру, при этом поступали спорадические сообщения о резистентности при применении препарата с целью лечения и профилактики.
Фармакокинетика.
всасывания
После приема осельтамивира фосфат (пропрепаратом) легко всасывается в желудочно-кишечном тракте и в значительной степени превращается в активный метаболит (осельтамивира карбоксилат) преимущественно под действием печеночных эстераз. Не менее 75% принятой внутрь дозы попадает в системный кровоток в виде активного метаболита, менее 5% - в виде пропрепаратом. Плазменные концентрации как пропрепаратом, так и активного метаболита пропорциональны дозе и не зависят от одновременного применения с пищей.
распределение
У человека средний объем распределения осельтамивира карбоксилат в равновесном состоянии - примерно 23 л, что эквивалентно объема внеклеточной жидкости организма. Поскольку активность нейраминидазы является внеклеточной, осельтамивира карбоксилат достигает всех основных мест локализации гриппозной инфекции.
Связывания осельтамивира карбоксилат с белками плазмы низкое (около 3%).
метаболизм
Озельтамивир значительной степени превращается в осельтамивира карбоксилат под действием эстераз, находящихся преимущественно в печени. Ни озельтамивир, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450 в исследованиях in vitro . Никаких конъюгатов фазы 2 для обоих соединений не было обнаружено in vivo .
вывод
Озельтамивир Всосавшийся выводится главным образом (> 90%) путем преобразования в осельтамивира карбоксилат, не подвергается дальнейшей трансформации и выводится с мочой. У большинства пациентов максимальная концентрация осельтамивира карбоксилат в плазме крови снижается с периодом полувыведения 6-10 часов. Активный метаболит полностью (> 99%) выводится почками. Почечный клиренс (18,8 л / ч) превышает скорость клубочковой фильтрации (7,5 л / ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. С калом выводится менее 20% принятого внутрь радиоактивно обозначенного препарата.
Другие особые группы.
Дети <1 года
Фармакокинетика, фармакодинамика и безопасность препарата Тамифлю® изучались в 2 неконтролируемых открытых исследованиях с участием детей, инфицированных вирусом гриппа в возрасте до 1 года (n = 135). Скорость клиренса активного метаболита, корригированного в зависимости от массы тела, уменьшалась с возрастом до одного года. Также экспозиции метаболита более изменчивыми у детей раннего возраста.
Имеющиеся данные указывают на то, что экспозиция дозы 3 мг / кг в возрасте 0-12 месяцев обеспечивает экспозицию пролекарства и метаболита, которая ожидается быть эффективной по профилю безопасности по сравнению с таковым у детей старшего возраста и взрослых при применении утвержденной дозы (см. разделы «Показания», «Способ применения и дозы»). Уведомлены побочные явления соответствовали установленному профилю безопасности у детей старшего возраста.
Нет данных по профилактике гриппа у детей в возрасте до 1 года после контакта с больными гриппом. Профилактика во время эпидемии гриппа среди населения не изучалась у детей до 12 лет.
Профилактика гриппа после контакта у детей до 1 года во время пандемии .
Моделирование приема препарата 1 раз в сутки в дозе 3 мг / кг у детей до 1 года продемонстрировало экспозицию препарата в таком же диапазоне или выше, чем при применении препарата в дозе 75 мг у взрослых 1 раз в сутки. Экспозиция не превышает таковую при лечении детей до 1 года (3 мг / кг дважды в сутки) и ожидается, что приведет к сравниваемого профиля безопасности (см. Раздел «Побочные реакции»). Клинические исследования по профилактике у детей до 1 года не проводились.
Дети ≥ 1 года
Фармакокинетику осельтамивира изучали в возрасте от 1 до 16 лет в ходе фармакокинетического исследования с однократным приемом препарата и клинического исследования эффективности у небольшого количества детей при многократном применении. У детей младшего возраста выведение пропрепаратом и активного метаболита происходило быстрее, чем у взрослых, что приводило к более низкой экспозиции, выраженной в мг / кг дозы. Прием препарата в дозе 2 мг / кг дает такую же экспозицию осельтамивира карбоксилат, которая достигается у взрослых после однократного приема дозы 75 мг (что эквивалентно примерно 1 мг / кг). Фармакокинетика осельтамивира у детей и подростков в возрасте от 12 лет такая же, как и у взрослых.
Пациенты пожилого возраста
Экспозиция активного метаболита в равновесном состоянии была на 25-35% выше у лиц пожилого возраста (в возрасте от 65 до 78 лет), чем у взрослых в возрасте до 65 лет, получали сравнению дозы осельтамивира. Период полувыведения у лиц пожилого возраста был подобным таковому у молодых пациентов. Учитывая экспозицию препарата и переносимость, коррекция дозы не требуется для пациентов пожилого возраста, при отсутствии умеренной или тяжелой почечной недостаточности (клиренс креатинина менее 60 мл / мин) (см. Раздел «Способ применения и дозы»).
Нарушение функции почек
Прием 100 мг осельтамивира фосфата 2 раза в сутки в течение 5 дней пациентами с различной степенью почечной недостаточности продемонстрировал, что экспозиция осельтамивира карбоксилат является обратно пропорциональной снижению функции почек. По дозировке см. раздел «Способ применения и дозы».
Нарушение функции печени
In vitro исследования показали, что не ожидается ни значительного увеличения экспозиции осельтамивира, ни значительного снижения экспозиции активного метаболита у пациентов с нарушением функции печени (см.раздел «Способ применения и дозы»).
беременные женщины
Объединенный популяционный фармакокинетический анализ свидетельствует о том, что режим дозирования препарата Тамифлю®, описанный в разделе «Способ применения и дозы», вызывает меньшую экспозицию (в среднем 30% в течение всех триместров) активного метаболита у беременных женщин по сравнению с небеременными женщинами. Меньше прогнозируемая экспозиция, однако, остается выше ингибирующих концентраций (IC95) и для терапевтического уровня для диапазона штаммов вируса гриппа. Кроме того, существуют данные, полученные в исследованиях наблюдения, показывают пользу такого режима дозирования в этой популяции пациентов. Поэтому беременным женщинам коррекция дозы для лечения или профилактики гриппа не требуется (см. Раздел «Применение в период беременности или кормления грудью»).
Пациенты с ослабленным иммунитетом
Данные популяционного фармакокинетического анализа свидетельствуют, что применение осельтамивира у взрослых пациентов с ослабленным иммунитетом (как указано в разделе «Способ применения и дозы») приводило к повышению экспозиции (до 50%) активного метаболита по сравнению со взрослыми пациентами с нормальным иммунитетом с сопоставимым клиренсом креатинина. В связи с широким диапазоном безопасности активного метаболита взрослым пациентам с ослабленным иммунитетом коррекции дозы не требуется. Однако для взрослых пациентов с ослабленным иммунитетом и нарушением функции почек дозу следует откорректировать в соответствии с рекомендациями в разделе «Способ применения и дозы».
Клинические характеристики
Тамифлю Показания
лечение гриппа
Препарат Тамифлю® показан взрослым и детям, в том числе доношенным новорожденным, у которых имеются симптомы, характерные для гриппа, при циркуляции вируса гриппа. Эффективность была продемонстрирована, когда лечение было начато в течение двух дней после появления симптомов.
профилактика гриппа
- Профилактика гриппа у взрослых и детей старше 1 года после контакта с лицом с клинически диагностированным гриппом во время циркуляции вируса гриппа.
- Соответствующее применение препарата Тамифлю® с целью профилактики гриппа необходимо определять в каждом конкретном случае, учитывая обстоятельства и учитывая группу пациентов, которой нужна защита. В исключительных ситуациях (например, в случае разногласий между циркулирующим вирусом гриппа и вирусом гриппа, против которого проводилась вакцинация, и во время пандемии) сезонную профилактику можно проводить у лиц в возрасте от 1 года.
- Препарат Тамифлю® показан для профилактики гриппа у детей в возрасте до 1 года после контакта с лицом с клинически диагностированным гриппом во время пандемии гриппа (см. Раздел «Фармакокинетика»).
Применение препарата Тамифлю® не заменяет вакцинацию против гриппа.
Применение противовирусных средств для лечения и профилактики гриппа должна основываться на официальных рекомендациях. Решение о применении осельтамивира для лечения и профилактики следует принимать с учетом характеристик циркулирующих вирусов гриппа, доступной информации о чувствительности вирусов гриппа к лекарственным средствам в каждом сезоне и влияния заболевания в различных географических регионах и группах пациентов (см. Раздел «Фармакологические»).
Противопоказания
Повышенная чувствительность к озельтамивиру фосфата или к любому компоненту препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Фармакокинетические свойства осельтамивира, такие как слабое связывание с белками и метаболизм, который не зависит от систем CYP450 и глюкуронидазы (см. Раздел «Фармакокинетика»), свидетельствуют, что клинически значимое взаимодействие с другими лекарственными средствами маловероятно.
Пробенецид
При одновременном приеме осельтамивира и пробенецида пациентам с нормальной функцией почек коррекция дозы не требуется. Одновременное назначение пробенецида, который является мощным ингибитором анионного пути почечной канальцевой секреции, приводит к увеличению экспозиции активного метаболита осельтамивира примерно вдвое.
Амоксициллин
Озельтамивир не проявляет кинетической взаимодействия с амоксициллином, элиминация которого происходит тем же путем, что и осельтамивира, что свидетельствует о слабой взаимодействие с озельтамивиром на данном пути.
почечная элиминация
Клинически важно взаимодействие с другими лекарственными средствами, которая включает конкуренцию за почечную канальцевую секрецию, маловероятно в связи с известными пределами безопасности большинства этих средств, характеристиками элиминации активного метаболита (клубочковая фильтрация и анионная канальцевая секреция) и объемом экскреции с помощью данных путей . Однако следует проявлять осторожность при назначении осельтамивира пациентам, принимающим лекарственные средства с аналогичным путем экскреции с узким терапевтическим диапазоном (например, хлорпропамид, метотрексат, фенилбутазон).
Дополнительная информация
Фармакокинетические взаимодействия между озельтамивиром и его основным метаболитом при одновременном назначении с парацетамолом, ацетилсалициловой кислотой, циметидином и антацидными средствами (гидроксид магния и гидроксид алюминия, кальция карбонат), римантадином или варфарином (у пациентов, находящихся на стабильных дозах варфарина и не болеют гриппом ) не обнаружены.
В клинических исследованиях III фазы применения осельтамивира для лечения и профилактики гриппа Тамифлю ® назначали с общеупотребительными лекарственными средствами, такими как ингибиторы АПФ (АПФ) (эналаприл, каптоприл), тиазидные диуретики (бендрофлуазид), антибиотики (пенициллин, цефалоспорин, азитромицин, эритромицин и доксициклин), блокаторы Н2-рецепторов (ранитидин, циметидин), бета-блокаторы (пропранолол), ксантини (теофиллин), симпатомиметики (псевдоэфедрин), опиоиды (кодеин), кортикостероиды, ингаляционные бронходилататоры, анальгетики (ацетилсалициловая кислота, ибупрофен и парацетамол). При применении Тамифлю ® вместе с перечисленными препаратами изменения профиля безопасности и частоты возникновения побочных реакций не зарегистрированы.
Механизм взаимодействия с оральными контрацептивами отсутствует.
Особенности применения
Озельтамивир эффективен только против заболеваний, вызванных вирусами гриппа. Данных об эффективности осельтамивира при любых заболеваниях, вызванных другими возбудителями, кроме вирусов гриппа, нет (см. Раздел «Фармакологические»).
Применение препарата Тамифлю® не заменяет вакцинацию против гриппа . Применение препарата Тамифлю® не должно влиять на оценку состояния лиц по применению ежегодной вакцинации против гриппа. Защита от гриппа продолжается только во время приема препарата Тамифлю®. Препарат Тамифлю® следует применять для лечения и профилактики гриппа только при наличии надежных эпидемиологических данных, свидетельствующих о циркуляции вируса среди населения. Продемонстрировано, что чувствительность циркулирующих штаммов вируса гриппа к озельтамивиру имеет высокую вариабельность (см. Раздел «Фармакологические»). Поэтому врач должен учитывать самую свежую информацию о чувствительности к озельтамивиру циркулирующих в настоящее время вирусов перед принятием решения о применении препарата Тамифлю®.
Тяжелые сопутствующие состояния
Нет информации относительно безопасности и эффективности применения осельтамивира для пациентов с любыми достаточно тяжелыми или нестабильными заболеваниями с неизбежным риском госпитализации.
Пациенты с ослабленным иммунитетом
Эффективность осельтамивира для лечения и профилактики гриппа у пациентов с ослабленным иммунитетом четко не установлена. Однако продолжительность лечения гриппа у взрослых пациентов с ослабленным иммунитетом должна составлять 10 дней, поскольку у пациентов этой группы не проводились исследования менее длительного курса лечения озельтамивиром.
Заболевания сердца / дыхательной системы
Эффективность осельтамивира для лечения лиц с хроническими заболеваниями сердца и / или заболеваниями дыхательной системы не установлена. У таких пациентов разница в частоте осложнений между группами лечения и плацебо не отмечено (см. Раздел «Фармакологические»).
дети
На сегодняшний день нет данных, позволяющих дать рекомендации по дозированию для недоношенных детей (гестационный возраст менее 36 недель).
Тяжелая почечная недостаточность
Коррекция дозы Тамифлю® при применении для лечения и профилактики рекомендуется взрослым и подросткам (13-17 лет) с тяжелой почечной недостаточностью. Недостаточно клинических данных по младенцев и детей в возрасте от 1 года с почечной недостаточностью для рекомендаций по дозировке (см. Разделы «Способ применения и дозы», «Фармакокинетика»).
нейропсихические расстройства
У больных гриппом (преимущественно у детей и подростков) при применении препарата Тамифлю® были зафиксированы случаи нейропсихических расстройств. Такие расстройства также были зарегистрированы у больных гриппом, не применяли озельтамивир. По состоянию пациентов следует тщательно наблюдать для выявления изменений поведения, а польза и риск от продолжения лечения следует оценивать с осторожностью каждого пациента (см. Раздел «Побочные реакции»).
Это лекарственное средство содержит сорбит. Пациентам с редкими проблемами врожденной непереносимости фруктозы не следует принимать этот препарат.
Сорбит может иметь легкий слабительный эффект.
Применение в период беременности или кормления грудью
беременность
Грипп ассоциируется с вредным воздействием на течение беременности, развитие плода и с риском значительных врожденных пороков развития, в том числе врожденных пороков сердца. Большое количество данных по применению осельтамивира во время беременности, полученных в послерегистрационный период и в ходе обсервационных исследований (более 1000 последствий экспозиции во время первого триместра), свидетельствуют об отсутствии в осельтамивира мальформативнои или фетальной / неонатальной токсичности.
Однако в одном обсервационном исследовании на фоне отсутствия повышения совокупного риска врожденных пороков развития результаты по значительных врожденных пороков сердца, диагностированных в течение 12 месяцев после рождения не были убедительными. В этом исследовании частота возникновения значительных врожденных пороков сердца после воздействия осельтамивира в первом триместре составляла 1,76% (7 младенцев из 397 беременностей) по сравнению с 1,01% для беременностей без влияния осельтамивира в общей популяции (отношение рисков 1,75, 95% доверительный интервал от 0,51 дo 5,98). Клиническое значение этих данных непонятное, поскольку данное исследование носило ограниченный размер выборки. Также это исследование было недостаточно масштабным для достоверной оценки отдельных типов значительных врожденных пороков; кроме того, было невозможно сравнить в полном объеме женщин с экспозицией осельтамивира и без нее и,
Исследования на животных не свидетельствуют о репродуктивной токсичности.
При необходимости применения препарата Тамифлю во время беременности может рассматриваться с учетом имеющейся информации по безопасности и пользы, а также патогенности циркулирующего штамма вируса гриппа.
кормление грудью
У лактирующих крыс озельтамивир и активный метаболит экскретируются в молоко. Существует ограниченная информация в отношении детей, матери которых получали озельтамивир в период лактации, и по экскреции осельтамивира в грудное молоко. Ограниченные данные показали, что озельтамивир и его активный метаболит были обнаружены в грудном молоке, однако в низких концентрациях, что может привести к попаданию субтерапевтической дозы в организм младенца. Учитывая эту информацию, а также патогенность циркулирующего штамма вируса гриппа и состояние женщины, которая кормит грудью, можно рассмотреть вопрос о назначении осельтамивира при очевидной потенциальной пользы для женщины, которая кормит грудью.
фертильность
На основе доклинических данных доказательства о влиянии лекарственного средства Тамифлю® на фертильность мужчин или женщин отсутствуют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Препарат Тамифлю® не влияет на скорость реакции при управлении автотранспортом или другими механизмами.
Способ применения Тамифлю и дозы
Препарат Тамифлю® в виде суспензии и препарат Тамифлю® в виде твердых капсул является биоэквивалентными лекарственными формами. Дозу 75 мг можно принимать в виде одной капсулы 75 мг.
Взрослые, подростки и дети (> 40 кг), которые в состоянии проглотить капсулы, могут получить соответствующие дозы Тамифлю® в виде капсул.
лечение
Лечение следует начинать как можно раньше, в первые два дня появления симптомов гриппа.
Взрослые и подростки (13-17 лет)
Рекомендуемый режим дозирования препарата Тамифлю® - по 75 мг осельтамивира 2 раза в сутки на протяжении 5 дней.
дети
Дети в возрасте от 1 года
Рекомендуемая доза Тамифлю® 6 мг / мл в виде оральной суспензии указана в таблице 1.
Таблица 1. Дозировка с учетом массы тела рекомендуется детям в возрасте от 1 года
масса тела | Доза для приема в течение 5 дней | Количество оральной суспензии |
10—15 кг | 30 мг дважды в сутки | 5 мл дважды в сутки |
> 15—23 кг | 45 мг дважды в сутки | 7,5 мл два раза в сутки |
> 23—40 кг | 60 мг дважды в сутки | 10 мл дважды в сутки |
> 40 кг | 75 мг дважды в сутки | 12,5 мл дважды в сутки |
Дети с массой тела> 40 кг и дети, которые способны проглотить капсулы, могут получать лечение с применением дозы для взрослых - 75 мг в виде капсул два раза в сутки в течение 5 дней в качестве альтернативы рекомендуемой дозы Тамифлю® в виде суспензии.
Дети в возрасте до 1 года
Рекомендуемая доза для лечения детей 0-12 месяцев составляет 3 мг / кг дважды в сутки. По фармакокинетическим данным и данным по безопасности, которые свидетельствуют о том, что эта доза в возрасте от 0 до 12 месяцев обеспечивает клинически эффективные концентрации в плазме крови пропрепаратом и активного метаболита с профилем безопасности, подобным такого, который наблюдался у детей старшего возраста и взрослых (см. раздел «Фармакокинетика»).
Дозатор объемом 3 мл для орального применения препарата (градуированный с ценой деления 0,1 мл) следует применять детям 0-12 месяцев, для которых необходимой дозой является от 1 до 3 мл препарата Тамифлю® оральной суспензии 6 мг / мл. Для высоких доз следует применять шприц объемом 10 мл. Ниже представлен рекомендуемый режим дозирования для лечения детей в возрасте до 1 года
Таблица 2. Таблица дозирования осельтамивира для детей до 1 года 3 мг / кг два раза в сутки
Масса тела * | Доза для приема в течение 5 дней | Количество оральной суспензии | Объем дозатора для применения |
3 кг | 9 мг дважды в сутки | 1,5 мл два раза в сутки | 3 мл |
3,5 кг | 10,5 мг дважды в сутки | 1,8 мл два раза в сутки | 3 мл |
4 кг | 12 мг дважды в сутки | 2,0 мл два раза в сутки | 3 мл |
4,5 кг | 13,5 мг дважды в сутки | 2,3 мл два раза в сутки | 3 мл |
5 кг | 15 мг дважды в сутки | 2,5 мл два раза в сутки | 3 мл |
5,5 кг | 16,5 мг дважды в сутки | 2,8 мл два раза в сутки | 3 мл |
6 кг | 18 мг дважды в сутки | 3,0 мл два раза в сутки | 3 мл |
> 6 — 7 кг | 21 мг дважды в сутки | 3,5 мл два раза в сутки | 10 мл |
> 7 — 8 кг | 24 мг дважды в сутки | 4,0 мл два раза в сутки | 10 мл |
> 8 — 9 кг | 27 мг дважды в сутки | 4,5 мл два раза в сутки | 10 мл |
> 9 — 10 кг | 30 мг дважды в сутки | 5,0 мл два раза в сутки | 10 мл |
* Данная таблица содержит не все возможные варианты массы тела для данной популяции.
Эти, связанные с возрастом рекомендации по дозировке препарата, не предназначенные для недоношенных младенцев, то есть детей младше 36 недель после оплодотворения. Данных о таких пациентов, которым из-за незрелости физиологических функций могут потребоваться другие режимы дозирования, недостаточно.
профилактика
Профилактика после контакта с больным гриппом
Взрослые и подростки (13-17 лет)
Рекомендуемая доза Тамифлю® для профилактики гриппа после контакта с больным гриппом - по 75 мг осельтамивира 1 раз в сутки на протяжении 10 дней. Прием препарата следует начинать как можно быстрее в течение первых 2 дней после контакта с инфицированным лицом.
Дети в возрасте от 1 года
Рекомендуемые дозы препарата Тамифлю® для профилактики гриппа после контакта с больным гриппом:
Таблица 3.
масса тела | Доза для приема в течение 10 дней | Количество оральной суспензии |
10—15 кг | 30 мг один раз в сутки | 5 мл один раз в сутки |
> 15—23 кг | 45 мг один раз в сутки | 7,5 мл один раз в сутки |
> 23—40 кг | 60 мг один раз в сутки | 10 мл один раз в сутки |
> 40 кг | 75 мг один раз в сутки | 12,5 мл один раз в сутки |
Дети с массой тела> 40 кг и дети, которые способны проглотить капсулы, могут получать профилактическое лечение с применением препарата в виде капсул 75 мг один раз в сутки в течение 10 дней в качестве альтернативы рекомендуемой дозы лекарственного средства Тамифлю® в виде суспензии.
Дети в возрасте до 1 года
Рекомендуемая доза для профилактики гриппа у детей в возрасте до 12 месяцев во время пандемии гриппа составляет половину суточной дозы для лечения. Такой режим дозирования основывается на клинических данных по применению препарата детям> 1 года и взрослым; он продемонстрировал, что профилактическая доза, эквивалентная половине суточной дозы для лечения, клинически эффективной для профилактики гриппа (см. раздел «Фармакокинетика»).
В случае пандемии дозатор объемом 3 мл для орального применения препарата (градуированный с ценой деления 0,1 мл) следует применять детям в возрасте до 1 года, для которых необходима доза от 1 до 3 мл препарата Тамифлю® оральной суспензии 6 мг / мл . Для высоких доз следует применять шприц объемом 10 мл.
Ниже представлен рекомендуемый режим дозирования детям до 1 года
Таблица 4. Дозировка осельтамивира для детей до 1 года 3 мг / кг один раз в сутки
Масса тела * | Доза для приема в течение 10 дней | Количество оральной суспензии | Объем дозатора для применения |
3 кг | 9 мг один раз в сутки | 1,5 мл один раз в сутки | 3 мл |
3,5 кг | 10,5 мг один раз в сутки | 1,8 мл один раз в сутки | 3 мл |
4 кг | 12 мг один раз в сутки | 2,0 мл один раз в сутки | 3 мл |
4,5 кг | 13,5 мг один раз в сутки | 2,3 мл один раз в сутки | 3 мл |
5 кг | 15 мг один раз в сутки | 2,5 мл один раз в сутки | 3 мл |
5,5 кг | 16,5 мг один раз в сутки | 2,8 мл один раз в сутки | 3 мл |
6 кг | 18 мг один раз в сутки | 3,0 мл один раз в сутки | 3 мл |
> 6—7 кг | 21 мг один раз в сутки | 3,5 мл один раз в сутки | 10 мл |
> 7—8 кг | 24 мг один раз в сутки | 4,0 мл один раз в сутки | 10 мл |
> 8—9 кг | 27 мг один раз в сутки | 4,5 мл один раз в сутки | 10 мл |
> 9—10 кг | 30 мг один раз в сутки | 5,0 мл один раз в сутки | 10 мл |
* Данная таблица содержит не все возможные варианты массы тела для данной популяции.
Эти, связанные с возрастом рекомендации по дозировке препарата, не предназначенные для недоношенных детей, то есть детей с гестационным возрастом менее 36 недель. Данных для таких пациентов, которым из-за незрелости физиологических функций могут потребоваться другие режимы дозирования, недостаточно.
Профилактика во время эпидемии гриппа
Профилактика во время эпидемии гриппа у детей в возрасте до 12 лет не изучалась. Рекомендуемая доза для взрослых и подростков для профилактики гриппа во время вспышки гриппа составляет 75 мг осельтамивира один раз в сутки в течение периода продолжительностью до 6 недель.
Дозирование в особых случаях
Пациенты с поражением печени
Нет необходимости корректировать дозу для лечения или профилактики больным с нарушением функции печени. Исследование с участием детей с нарушениями функции печени не проводились.
Пациенты с поражением почек
лечение гриппа
Коррекция дозы Тамифлю® необходима взрослым и подросткам (13-17 лет) с умеренным и тяжелым поражением почек.
Таблица 5. Рекомендуемые дозы для лечения гриппа
КК | Рекомендуемая доза для лечения |
> 60 мл/хв | 75 мг дважды в день |
Вид> 30 до 60 мл / мин | 30 мг дважды в день |
Вид> 10 до 30 мл / мин | 30 мг один раз на день |
≤ 10 мл / мин | Не рекомендуется (Нет данных) |
Пациенты, находящиеся на гемодиализе | 30 мг после каждого сеанса гемодиализа |
Пациенты, находящиеся на перитонеальном диализе * | 30 мг однократно |
* Данные получены в результате исследований у больных, находящихся на постоянном амбулаторном перитонеальном диализе (АПД) клиренс осельтамивира карбоксилат, как ожидается, будет выше при использовании автоматизированного п остийного циклического перитонеального диализа (ПЦПД). Режим лечения может переключаться с ПЦПД на АПД, если нефролог признает это необходимым.
профилактика гриппа
Коррекция дозы Тамифлю® необходима взрослым и подросткам (13-17 лет) с умеренным и тяжелым поражением почек. Рекомендуемые дозы приведены в таблице 6.
Таблица 6. Профилактика гриппа
КК | Рекомендуемая доза для профилактики |
> 60 мл/хв | 75 мг один раз на день |
Вид> 30 до 60 мл / мин | 30 мг один раз на день |
Вид> 10 до 30 мл / мин | 30 мг через день |
≤ 10 мл / мин | Не рекомендуется (Нет данных) |
Пациенты, находящиеся на гемодиализе | 30 мг после каждого второго сеанса гемодиализа |
Пациенты, находящиеся на перитонеальном диализе * | 30 мг один раз в неделю |
* Данные получены в результате исследований у больных, находящихся на постоянном амбулаторном перитонеальном диализе (АПД) клиренс осельтамивира карбоксилат, как ожидается, будет выше при использовании автоматизированного постоянного циклического перитонеального диализа (ПЦПД). Режим лечения может переключаться с ПЦПД на АПД, если нефролог признает это необходимым.
Недостаточно доступных клинических данных по применению препарата младенцам и детям до 12 лет с нарушением функции почек, чтобы дать рекомендации по дозировке препарата.
Больные пожилого возраста
Нет нужды корректировать дозу, за исключением случаев умеренного или тяжелого нарушения функции почек.
Пациенты с ослабленным иммунитетом
Лечение . Рекомендуемая доза осельтамивира для перорального применения составляет 75 мг два раза в сутки в течение 10 дней для взрослых (см. Разделы «Особенности применения» и «Побочные реакции»). Лечение следует начинать как можно быстрее в течение первых двух дней появления симптомов гриппа.
Сезонная профилактика.
Удлиненная продолжительность сезонной профилактики заболевания до 12 недель изучалась у пациентов с ослабленным иммунитетом (см. Разделы «Особенности применения», «Побочные реакции»).
способ введения
Для дозирования в упаковке предоставляются пластиковые дозаторы для орального применения объемом 3 мл и 10 мл.
Приготовления суспензии для орального применения
- Осторожно встряхните несколько раз закрытую бутылку для рыхления порошка.
- Отмерьте 55 мл воды. Для этого используйте мерный стаканчик и заполнит его до нужного уровня (мерный стаканчик поставляется с упаковкой препарата).
- Добавьте всю воду (55 мл) до бутылки с порошком, закройте ее крышкой и встряхивайте закрытую бутылку в течение примерно 15 секунд.
- Снимите защитную крышку и вдавите пластиковый адаптер горловину бутылки.
- Плотно закройте бутылку защитной крышкой (сверху адаптера бутылки). Это обеспечит правильное положение пластикового адаптера в бутылке.
Таким образом получено бутылку с оральной суспензией препарата Тамифлю® готовой к дозирования.
Перед применением суспензию Тамифлю® нужно обязательно встряхивать!
Всегда используйте пластиковый дозатор, поставляемый вместе с лекарственным средством, для правильной дозировки.
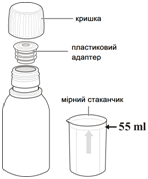

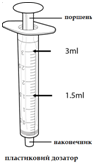
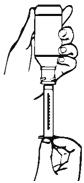
Рис. 1 Рис. 2 Рис. 3
- Проверьте, закрыта бутылка (см. Рис.1) и хорошо встряхните перед применением лекарственного средства Тамифлю ® , суспензии для орального затосування.
- В зависимости от необходимой дозы возьмите пластиковый дозатор по 3 мл или 10 мл (см. Рис. 2), поставляется с упаковкой препарата.
Вдавите поршень полностью к наконечнику пластикового дозатора.
- Снимите крышку с бутылки (см. Рис.1).
Присоедините наконечник пластикового дозатора к пластиковому адаптера бутылки.
Верните бутылку вверх дном вместе с соединенным с ним пластиковым дозатором (см рис. 3).
Медленно оттяните поршень, чтобы лекарственное средство поступил в дозатор, остановитесь на отметке, отображающий необходимую дозу.
Переверните бутылку вместе с пластиковым дозатором в вертикальное положение.
Медленно разъедините пластиковый дозатор с бутылкой.
- Выжмите суспензию прямо в ротовую полость, для этого нажмите на поршень пластикового дозатора.
Убедитесь, что суспензию проглотили. После приема лекарств можно пить и есть.
- Сразу после использования разберите пластиковый дозатор на две части и промойте их под проточной водой.
Дети
Имеющаяся информация по безопасности применения препарата Тамифлю ® для лечения гриппа у детей в возрасте до 1 года, полученная в проспективных и ретроспективных исследованиях наблюдения, и данные эпидемиологической базы данных и послерегистрационного применения свидетельствуют, что профиль безопасности у детей до 1 года сравним с установленным профилем безопасности в возрасте от 1 года.
Передозировка
Сообщение о передозировке лекарственного средства Тамифлю ® были получены в ходе клинических исследований и в течение постмаркетингового применения препарата. В большинстве случаев передозировки о побочных реакциях не сообщалось.
Побочные реакции, о которых сообщалось при передозировке, были по характеру и распределением подобными тем, которые наблюдались при применении терапевтических доз препарата Тамифлю ® (см. Раздел «Побочные реакции»).
Специфический антидот неизвестен.
дети
О передозировке сообщалось чаще у детей, чем у взрослых и подростков. Следует соблюдать осторожность при применении оральной суспензии препарата Тамифлю ® детям.
Побочные эффекты
В целом профиль безопасности лекарственного средства Тамифлю® базируется на данных лечения гриппа в 6049 взрослых / подростков и 1473 детей и на данных профилактики гриппа в 3990 взрослых / подростков и 253 детей, получавших Тамифлю® или плацебо во время клинических исследований. Кроме того, 199 взрослых пациентов с ослабленным иммунитетом получали Тамифлю® для лечения гриппа и 475 пациентов с ослабленным иммунитетом (включая 18 детей, из них 10 детей получали Тамифлю® и 8 пациентов получали плацебо) получали Тамифлю® или плацебо для профилактики гриппа.
У взрослых / подростков частыми побочными реакциями были тошнота и рвота - в исследованиях применения для лечения и тошнота - в исследованиях применения для профилактики гриппа. Большинство из этих побочных реакций наблюдались однократно, в первый-второй день лечения и исчезали спонтанно через 1-2 дня. У детей наиболее частой побочной реакцией было рвоты. В большинстве случаев эти побочные реакции не приводили к отмене препарата Тамифлю®.
Во время постмаркетингового применения осельтамивира редко повидомилялося о таких серьезных побочных реакциях анафилактические и анафилактоидные реакции, нарушения со стороны печени (молниеносный гепатит, нарушение функции печени и желтуха), ангионевротический отек, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, желудочно-кишечное кровотечение и нейропсихические расстройства (относительно нейропсихических расстройств см. раздел «Особенности применения»).
Для описания частоты побочных реакций использовали такие категории: очень часто (≥ 1/10), часто (≥ 1/100, <1/10), нечасто (≥ 1/1000, <1/100), редко (≥ 1 / 10000, <1/1000), очень редко (<1/10000). Побочные реакции отнесены к определенной категории согласно анализу объединенных данных клинических исследований.
Лечение и профилактика гриппа у взрослых и подростков
Побочные реакции, которые возникали чаще всего у взрослых / подростков в исследованиях лечения и профилактики при применении рекомендуемой дозы (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки в течение 6 недель для профилактики), приводятся ниже.
Профиль безопасности, известность у лиц, получавших препарат Тамифлю® в рекомендованной дозе для профилактики (75 мг 1 раз в сутки до 6 недель), был подобен такого, который наблюдался в исследованиях лечения, несмотря на большую продолжительность дозирования в целях профилактики.
Побочные реакции, о которых сообщалось в исследованиях препарата Тамифлю® для лечения и профилактики гриппа у взрослых и подростков или при постмаркетинговом наблюдении:
- инфекции и инвазии : часто - бронхит, простой герпес, назофарингит, инфекции верхних дыхательных путей, синусит,
- Со стороны системы крови и лимфатической системы: редко - тромбоцитопения
- со стороны иммунной системы: редко - реакция гиперчувствительности; редко - анафилактические и анафилактоидные реакции;
- психические расстройства: редко - ажитация, патологическое поведение, тревожность, спутанность сознания, бред, делирий, галлюцинации, ночные кошмары, самотравмування;
- со стороны нервной системы: очень часто - головная боль; часто - бессонница иногда - нарушение сознания, судороги
- со стороны органов зрения: редко - нарушение зрения;
- со стороны сердечно-сосудистой системы: редко - аритмия;
- со стороны дыхательной системы, органов грудной клетки и средостения: часто - кашель, ринорея, боль в горле
- со стороны желудочно-кишечного тракта: очень часто - тошнота; часто - рвота, боль в животе (включая боль в верхних отделах), диспепсия редко - желудочно-кишечное кровотечение, геморрагический колит
- со стороны пищеварительной системы: редко - повышение уровня печеночных ферментов редко - молниеносный гепатит, печеночная недостаточность, гепатит
- со стороны кожи и подкожной клетчатки: иногда - экзема, дерматит, сыпь, крапивница, редко - ангионевротический отек, мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз
- общие расстройства и реакции в месте введения: часто - боль, головокружение (включая вертиго), слабость, гипертермия, боль в конечностях.
Лечение и профилактика гриппа у детей
В общем 1473 ребенка (включая здоровых детей 1-12 лет и детей с астмой в возрасте 6-12 лет) приняли участие в клинических исследованиях осельтамивира для лечения гриппа. Среди них 851 ребенок получал лечение суспензией осельтамивира. В общем 158 детей получали рекомендованную дозу лекарственного средства Тамифлю® 1 раз в день в исследованиях профилактики после применения препарата в домашних условиях (n = 99) в 6-недельных исследованиях сезонной профилактики (n = 49) и в 12-недельных исследованиях сезонной профилактики среди детей с ослабленным иммунитетом (n = 10).
Побочные реакции, которые чаще всего наблюдались в клинических исследованиях применения препарата Тамифлю® для лечения и профилактики гриппа у детей (дозировка в зависимости от возраста / массы тела - от 30 мг до 75 мг 1 раз в сутки):
- инфекции и инвазии: часто - средний отит;
- со стороны нервной системы: часто - головная боль;
- со стороны органов зрения: часто - конъюнктивит (включая покраснение глаз, выделения из глаз и боль в глазах)
- со стороны органов слуха и вестибулярного аппарата: часто - боль в ушах иногда - нарушения со стороны барабанной перепонки;
- со стороны органов дыхания, грудной клетки и средостения: очень часто - кашель, заложенность носа, часто - ринорея;
- со стороны желудочно-кишечного тракта: очень часто - рвота часто - боль в животе (включая боль в верхней отделах), диспепсия, тошнота
- Со стороны кожи и подкожной клетчатки: иногда - дерматит (включая аллергический и атопический дерматиты).
Описание отдельных побочных реакций
Психические и неврологические расстройства
Грипп может быть связан с различными неврологическими нарушениями и расстройствами поведения, которые могут включать галлюцинации, делирий и неадекватное поведение, в некоторых случаях - с летальным исходом. Указанные явления могут наблюдаться как проявление энцефалита или энцефалопатии, но могут возникать без очевидного тяжелого заболевания.
Во время постмаркетингового применения препарата Тамифлю® у больных гриппом также были зафиксированы случаи судом и делирия (включая такие симптомы, как изменение уровня сознания, спутанность сознания, неадекватное поведение, бред, галлюцинации, возбуждение, тревога, ночные кошмары), которые в отдельных случаях приводили к случайному самоповреждения или летальному исходу. Указанные явления были зафиксированы в основном у детей и подростков и часто имели внезапное начало и быстрое завершение. Неизвестно, связаны психоневротичные нарушения с применением препарата Тамифлю®. Такие психоневротичные расстройства также наблюдались у больных гриппом, не применяли препарат Тамифлю®.
гепатобилиарной системы
У пациентов с гриппоподобными заболеванием наблюдались расстройства пищеварительной системы, случаи гепатита и повышение уровня печеночных ферментов. Указанные случаи включали летальный фульминантной гепатит / печеночную недостаточность.
Дополнительная информация об отдельных группах пациентов
Дети в возрасте до 1 года
В 2 исследованиях, в которых изучались фармакокинетика, фармакодинамика и профиль безопасности терапии озельтамивиром в 135 детей в возрасте до 1 года, инфицированных вирусом гриппа, профиль безопасности был подобным среди возрастных групп, при этом рвота, диарея и опрелость были частыми сообщаемых побочными явлениями (см. раздел «Фармакокинетика»). Недостаточно данных о возрасте после оплодотворения менее 36 недель.
Имеющаяся информация по безопасности применения осельтамивира для лечения гриппа у детей в возрасте до 1 года, полученная в проспективных и ретроспективных исследованиях наблюдения в более 2400 детей этой возрастной группы, и данные эпидемиологической базы данных и послерегистрационного применения свидетельствуют, что профиль безопасности у детей до 1 года сравнимый с установленным профилем безопасности у детей от 1 года.
Пациенты пожилого возраста и пациенты с хроническими заболеваниями сердца и / или дыхательной системы
Исследуемая популяция для лечения гриппа включала здоровых взрослых / подростков и пациентов с факторами риска (пациенты с повышенным риском развития осложнений, связанных с гриппом, например пациенты пожилого возраста и пациенты с хроническими заболеваниями сердца или дыхательной системы). В общем профиль безопасности у подростков и взрослых с указанными факторами риска был качественно сравним с таковым у здоровых взрослых / подростков.
Пациенты с ослабленным иммунитетом
В двойном слепом исследовании лечения гриппа всего 199 взрослых пациентов с ослабленным иммунитетом (что обследовались для оценки безопасности) были рандомизированы получать Тамифлю® в течение 10 дней: 98 пациентов получали стандартную дозу препарата (75 мг дважды в сутки) и 101 пациент получал двойную дозу ( 150 мг дважды в сутки). Профиль безопасности лекарственного средства Тамифлю®, наблюдавшийся в данном исследовании, отвечал таком, который наблюдался в предыдущих клинических исследованиях, в которых Тамифлю® применяли для лечения гриппа у пациентов без иммунодефицита (пациентов без других заболеваний или пациентов с факторами риска [сопутствующие заболевания сердца и / или дыхательной системы]). Процент пациентов, у которых наблюдались побочные явления, был меньше в группе стандартного дозирования по сравнению с группой двойного дозирования (49% и 59,4% соответственно)
Во время 12-недельного исследования профилактики в 475 человек с ослабленным иммунитетом, в том числе у 18 детей в возрасте 1-12 лет и старше, профиль безопасности в 238 пациентов, получавших озельтамивир, был сопоставимым с таким, который наблюдался в ходе клинических исследований применения препарата Тамифлю® для профилактики.
Дети с уже имеющейся бронхиальной астмой
В общем профиль побочных реакций у детей с бронхиальной астмой был качественно сравним с таковым у здоровых детей.
Срок годности Тамифлю
2 года.
Условия хранения Тамифлю
Хранить в недоступном для детей месте. Хранить при температуре не выше 30 ° С.
Приготовленную суспензию хранить при температуре от 2 до 8 ° С (в холодильнике) не более 17 дней или при температуре не выше 25 ° С - не более 10 дней.
Упаковка
По 13 г порошка для оральной суспензии в бутылке с коричневого стекла емкостью 100 мл (с полипропиленовой винтовой крышкой с функцией для защиты от открытия детьми).
По 1 бутылке вместе с пластиковым адаптером, пластиковым дозатором для орального применения вместимостью 10 мл, или пластиковыми дозаторами для орального применения вместимостью 3 мл и 10 мл, пластиковым мерным стаканчиком в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Ф.Хоффманн-Ля Рош Лтд, Швейцария
Местонахождение производителя
Вурмисвег, 4303 Кайсераугст, Швейцария
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Тамифлю только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Роттендорф Фарма ГмбХ
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Тамифлю |
| Производитель: | Роттендорф Фарма ГмбХ |
| Форма выпуска: | порошок для оральной суспензии, 6 мг/мл; по 13 г порошка в бутылке; по 1 бутылке вместе с пластиковым адаптером, пластиковым дозатором для орального применения вместимостью 10 мл, пластиковым мерным стаканчиком в картонной коробке по 13 г порошка в бутылке; по 1 бутылке вместе с пластиковым адаптером, пластиковыми дозаторами для орального применения вместимостью 3 мл и 10 мл, пластиковым мерным стаканчиком в картонной коробке |
| Регистрационное удостоверение: | UA/3189/01/02 |
| Дата начала: | 26.06.2020 |
| Дата окончания: | неограниченный |
| МНН: | Oseltamivir |
| Условия отпуска: | по рецепту |
| Состав: | 1 г порошка содержит осельтамивира 30 мг в виде осельтамивира фосфата 39,4 мг / 1 мл готовой суспензии содержит 6 мг осельтамивира в виде осельтамивира фосфата 7,88 мг |
| Фармакологическая группа: | Противовирусные средства для системного применения. Противовирусные средства прямого действия. Ингибиторы нейраминидазы. |
| Код АТХ: | J05AH02 |
| Заявитель: | Ф. Хоффманн-Ля Рош Лтд |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Грензахерштрассе 124, СН-4070 Базель, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
