
- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Тамовир инструкция по применению
Официальная инструкция лекарственного препарата Тамовир лиофилизат 500 мг. Описание и применение Tamovir, аналоги и отзывы. Инструкция Тамовир лиофилизат утвержденная компанией производителем.
Состав
действующее вещество: ganciclovir;
1 флакон содержит ганцикловира (в форме ганцикловира натрия) 500 мг.
вспомогательные вещества: раствор натрия гидроксида, кислота соляная.
Лекарственная форма
Лиофилизат для приготовления раствора для инфузий.
Основные физико-химические свойства:
лиофилизат: лиофилизированный порошок белого цвета
приготовленный раствор прозрачный бесцветный раствор.
Фармакологическая группа
Противовирусные средства для системного применения. Нуклеозиды и нуклеотиды, за исключением ингибиторов обратной транскриптазы. Ганцикловир.
Код АТХ J05A B06.
Фармакологические свойства
Фармакологические.
Ганцикловир - синтетический нуклеозидный аналог 2'-дезоксигуанозина, что подавляет репликацию вирусов герпеса как in vitro , так и in vivo . К ганцикловира чувствительны вирусы человека, как цитомегаловирус (ЦМВ), вирусы простого герпеса типов 1 и 2 (HSV-1 и HSV-2), вирус герпеса человека типа 6, 7 и 8 (HHV-6, HHV-7, HHV- 8), вирус Эпштейна-Барр (ВЭБ), вирус ветряной оспы ( Varicella zoster ), вирус гепатита В. Клинические исследования ограничивались оценкой эффективности препарата у больных цитомегаловирусная инфекция.
В инфицированных ЦМВ клетках ганцикловир вначале фосфорилируется вирусной протеинкиназой UL97 к ганцикловира монофосфата. Следующее фосфорилирования осуществляется с помощью нескольких клеточных киназ с образованием ганцикловира трифосфата, который в дальнейшем подлежит медленном внутриклеточного метаболизма. Показано, что этот метаболизм происходит в клетках, инфицированных цитомегаловирусом человека и вирусом простого герпеса, при этом после исчезновения ганцикловира из внеклеточной жидкости период внутриклеточного полувыведения ганцикловира составляет, соответственно 18 и 6-24 часа. Поскольку фосфорилирования ганцикловира в большей степени зависит от действия вирусной киназы, оно происходит преимущественно в инфицированных клетках.
Вирусостатична действие ганцикловира обусловлено подавлением синтеза вирусной ДНК путем: (1) конкурентного ингибирования встраивания дезоксигуанозина трифосфата в ДНК под действием ДНК-полимеразы; (2) включением трифосфата ганцикловира в вирусную ДНК, что приводит к прекращению удлинения вирусной ДНК или к очень ограниченного их удлинения.
Противовирусная активность.
Противовирусная IC 50 относительно цитомегаловируса, определенная in vitro , находится в диапазоне от 0,08 мкм (0,02 мкг / мл) до 14 мкм (3,5 мкг / мл).
Вирусная резистентность.
Возможность развития вирусной резистентности следует рассматривать у пациентов, повторно демонстрируют плохую клинический ответ или у которых сохраняется устойчивое выделение вирусов в течение терапии. Устойчивость цитомегаловируса к ганцикловира может развиться после длительного лечения или профилактики ганцикловиром при выборочной мутации гена вирусной киназы (UL97), отвечающий за монофосфорилювання ганцикловира, и / или, менее часто, гена вирусной полимеразы (UL54). Вирусы, содержащие мутации в гене UL97, резистентные только к ганцикловира, тогда как вирусы с мутацией в UL54 могут демонстрировать перекрестную устойчивость к другим потивирусних средств, действие которых направлено на вирусную полимеразу.
Дети.
В проспективном исследовании 36 пациентов детского возраста (от 6 месяцев до 16 лет) с тяжелым иммунодефицитом (больные ВИЧ и ЦМВ-инфекцию) получали ганцикловир внутривенно в дозе 5 мг / кг в сутки в течение 2 дней, после чего получали ганцикловир перорально в среднем в течение 32 недель. Ганцикловир был эффективным, при этом профиль токсичности был подобный таковому у взрослых. Снижение выявления ЦМВ методом посева или полимеразной цепной реакции было связано с применением ганцикловира. Нейтропения была единственной тяжелой побочной реакцией на ганцикловир, которая наблюдалась во время исследования; и хотя ни один ребенок не нуждалась прекращения лечения, 4 из них было необходимое лечение гранулоцитарным колониестимулирующий фактором (G-CSF) для сохранения абсолютного числа нейтрофилов на уровне> 400 клеток / мм 3.
В ретроспективном исследовании 122 детей (в возрасте от 16 дней до 18 лет, средний возраст - 2,5 года), перенесших трансплантацию печени, получали не менее 14 дней ганцикловир в дозе 5 мг / кг дважды в сутки, после чего проводился превентивный мониторинг ЦМВ с помощью полимеразной цепной реакции (ПЦР). В 43 пациентов риск развития ЦМВ считался высоким, а в 79 - обычным. Бессимптомная ЦМВ-инфекция была обнаружена с помощью ПЦР в 34,4% пациентов и чаще наблюдалась у тех, кто имел высокий риск, чем у реципиентов с обычным риском (58,1% по сравнению с 21,8%, р = 0,0001) . У 12 пациентов (9,8%) возникла ЦМВ-инфекция (в 8 из группы высокого риска по сравнению с 4 из группы обычного риска, р = 0,03). У 3 пациентов наблюдалось острое отторжение в течение 6 месяцев после выявления ЦМВ, но у 13 пациентов ЦМВ-инфекции предшествовало отторжения. Случаев смерти, вызванной ЦМВ-инфекцией, не было. В общем 38,5% пациентов не получали противовирусные препараты после проведения первоначальной послеоперационной профилактики.
В ретроспективном анализе безопасность и эффективность ганцикловира сравнивали с соответствующими характеристиками валганцикловира в 92 детей (в возрасте от 7 месяцев до 18 лет, средний возраст - 9 лет), перенесших трансплантацию почек и / или печени. Все дети получали ганцикловир по 5 мг / кг дважды в сутки в течение 2 недель после трансплантации. Дети, которых лечили до 2004 года, получали ганцикловир перорально от 30 мг / кг / дозу до 1 г / дозу три раза в сутки (n = 41), тогда как дети, которых лечили после 2004 года, получали валганцикловира в дозе до 900 мг раз в сутки (n = 51). Общая частота ЦМВ составила 16% (15 из 92 пациентов). Время до возникновения ЦМВ-инфекции был сопоставимым в обеих группах.
В рандомизированном контролируемом исследовании 100 новорожденных (в возрасте ≤ 1 месяца) с симптоматической врожденной ЦМВ-инфекцией с поражением ЦНС в течение 6 недель получали ганцикловир 6 мг / кг каждые 12:00 или не получавших лечения. Из 100 пациентов, включенных в исследование, 42 соответствовали всем критериям исследования и имели результаты аудиометрического обследование и на исходном уровне, и через 6 месяцев дальнейшего наблюдения. Из них 25 получали ганцикловир и 17 не получали лечения. В 21 из 25 пациентов, получавших ганцикловир, слух сравнению с исходным уровнем до 6 месяцев улучшилось или остался на нормальном уровне по сравнению с 10 из 17 пациентов из контрольной группы (84% и 59% соответственно, p = 0,06). Ни у одного из пациентов, получавших ганцикловир, слух сравнению с исходным уровнем до 6 месяцев не ухудшилось по сравнению с 7 пациентами в контрольной группе (р <0,01). Через год у 5 из 24 пациентов, получавших ганцикловир, и у 13 из 19 пациентов из контрольной группы слух сравнению с исходным уровнем ухудшилось (p <0,01). В ходе исследования у 29 из 46 пациентов, получавших ганцикловир, наблюдалась нейтропения по сравнению с 9 из 43 пациентов из контрольной группы (р <0,1). В ходе исследования было 9 случаев смерти, 3 - в группе применения ганцикловира и шестой контрольной группе. Ни одна смерть не была связана с ганцикловиром. получавших ганцикловир, наблюдалась нейтропения по сравнению с 9 из 43 пациентов из контрольной группы (р <0,1). В ходе исследования было 9 случаев смерти, 3 - в группе применения ганцикловира и шестой контрольной группе. Ни одна смерть не была связана с ганцикловиром. получавших ганцикловир, наблюдалась нейтропения по сравнению с 9 из 43 пациентов из контрольной группы (р <0,1). В ходе исследования было 9 случаев смерти, 3 - в группе применения ганцикловира и шестой контрольной группе. Ни одна смерть не была связана с ганцикловиром.
В рандомизированном контролируемом исследовании III фазы 100 новорожденных (в возрасте от 3 до 33 дней, средний возраст - 12 дней) с тяжелой симптоматической врожденной ЦМВ-инфекцией с поражением ЦНС получали ганцикловир по 6 мг / кг дважды в день в течение 6 недель (n = 48 ) или не получали противовирусное лечение (n = 52). У младенцев, которые получали ганцикловир, на 6 и 12 месяцам улучшились результаты развития нервной системы по сравнению с теми, кто не получал противовирусное лечение. Хотя пациенты, которые получали ганцикловир, имели меньшую задержку и более нормальных неврологических показателей, большинство из них все же отставали от показателей нормального развития в возрасте 6 недель, 6 месяцев или 12 месяцев. В этом исследовании безопасность ни оценивали.
В ретроспективном исследовании изучали эффект противовирусной терапии на отсроченную тугоухость у младенцев с врожденной ЦМВ-инфекцией (в возрасте 4-34 месяцев, средний возраст 10,3 ± 7,8 месяца, средний возраст - 8 месяцев). В исследовании с участием 21 новорожденных с нормальным слухом при рождении, у всех участников развивалась отсрочено тугоухость. Противовирусное лечение состояло из:
- внутривенного применения ганцикловира в дозе 5 мг / кг ежедневно в течение 6 недель с последующим пероральным применением валганцикловира в дозе 17 мг / кг дважды в сутки в течение 6 недель, а затем один раз в сутки до достижения возраста 1 год, или
- перорального применения валганцикловира в дозе 17 мг / кг дважды в сутки в течение 12 недель, а затем один раз в сутки в течение 9 месяцев.
В одного ребенка не было необходимости в установлении кохлеарного имплантата, а слух улучшился у 83% ушей, пораженных тугоухостью на исходном уровне. Нейтропения была единственным побочным эффектом, о котором сообщали, и ни у одного пациента не было необходимости в прекращении лечения.
Фармакокинетика.
Системная экспозиция.
Системная экспозиция (AUC0-∞), наблюдавшаяся у взрослых пациентов с пересаженной печенью после однократной инфузии ганцикловира в дозе 5 мг / кг в течение 1:00, составляла в среднем 50,6 мкг × ч / мл (CV% 40). У пациентов этой популяции максимальная концентрация в плазме (Cmax) составляла в среднем 12,2 мкг / мл (CV% 24).
Распределение.
Объем распределения ганцикловира после введения коррелирует с массой тела. Равновесный объем распределения находится в пределах 0,54-0,87 л / кг. Связь с белками плазмы крови составлял 1-2% при концентрации ганцикловира 0,5 и 51 мкг / мл. Ганцикловир проникает в спинномозговую жидкость, где может достигать концентрации 24-67% от плазменной.
Метаболизм.
Ганцикловир не метаболизируется в значительной степени.
Вывод.
Ганцикловир выводится преимущественно путем почечной экскреции через клубочковую фильтрацию и активную канальцевую секрецию в неизмененном виде. У больных с нормальной функцией почек более 90% от внутривенно введенной дозы ганцикловира выделяется с мочой в неизмененном виде в течение 24 часов.
Средний системный клиренс находится в диапазоне от 2,64 ± 0,38 мл / мин / кг (n = 15) до 4,52 ± 2,79 мл / мин / кг (n = 6), а почечный клиренс - от 2, 57 ± 0,69 мл / мин / кг (n = 15) до 3,48 ± 0,68 мл / мин / кг (n = 20), что соответствует 90-101% введенного ганцикловира. Период полувыведения у лиц без почечной недостаточности колеблется от 2,73 ± 1,29 (n = 6) до 3,98 ± 1,78 (n = 8) часов.
Линейность / нелинейность.
Ганцикловир, введенный внутривенно, демонстрирует линейную фармакокинетику в диапазоне доз 1,6-5,0 мг / кг.
Пациенты с почечной недостаточностью.
Общий клиренс ганцикловира линейно коррелирует с клиренсом креатинина. У пациентов с нарушением функции почек легкой, средней и тяжелой степени наблюдался средний системный клиренс 2,1, 1 и 0,3 мл / мин / кг. У пациентов с нарушением функции почек увеличен период полувыведения. У пациентов с нарушением функции почек тяжелой степени период полувыведения увеличивался до 10-ти раз (информацию о коррекции дозы, необходимой для пациентов с нарушением функции почек, см. В разделе «Способ применения и дозы»).
Пациенты на гемодиализе.
Гемодиализ продолжительностью 4:00 снижает концентрацию ганцикловира в плазме крови после парентерального и перорального введения примерно на 50%.
При применении прерывистой схемы гемодиализа показатели клиренса ганцикловира составляют от 42 до 92 мл / мин, период полувыведения препарата во время диализа - 3,3-4,5 часа. Фракция ганцикловира, которая удаляется за один сеанс гемодиализа, составляет от 50 до 63%. Показатели клиренса ганцикловира при постоянного диализа были ниже (4,0-29,6 мл / мин), но в период до следующего приема препарата из организма выводится больший процент принятой дозы.
Пациенты с печеночной недостаточностью.
Безопасность и эффективность применения ганцикловира не изучали у пациентов с нарушением функции печени. Не ожидается, что нарушение функции печени влиять на фармакокинетику ганцикловира, поскольку он выводится почками. Поэтому особые рекомендации по изменению дозы отсутствуют (см. Раздел «Способ применения и дозы»).
Дети.
Фармакокинетику ганцикловира, который вводили внутривенно в дозе 200 мг / м2, изучали в двух исследованиях с участием пациентов в возрасте от 3 месяцев до 16 лет после трансплантации печени (n = 18) и почки (n = 25) и оценивали с использованием популяционной фармакокинетического модели.
КК (КлКр) был идентифицирован как статистически значимое независимая переменная (ковариата) для клиренса ганцикловира, а рост пациента - как статистически значимое независимая переменная для клиренса ганцикловира, объема распределения в равновесном состоянии и периферийного объема распределения. Когда такие ковариаты как КлКр и рост были добавлены модели, были обнаружены очевидные различия фармакокинетики ганцикловира между различными возрастными группами, а возраст, пол и типы трансплантации органа не были значимыми ковариатамы в этих популяциях. В таблице 1 приведены расчетные фармакокинетические показатели по возрастным группам.
Таблица 1. Фармакокинетические показатели ганцикловира после введения с расчетом дозы по ППТ (200 мг / м2) у пациентов с пересаженной печенью или почкой, представлены как медианы (минимальное-максимальное значение).
показатели | возраст <6 лет | возраст от 6 до <12 лет | возраст от ≥ 12 до ≤ 16 лет |
n = 17 | п = 9 | n = 17 | |
Клиренс (л / ч) | 4,23 (2,11—7,92) | 4,03 (1,88—7,8) | 7,53 (2,89—16,8) |
Vcent (л) | 1,83 (0,45—5,05) | 6,48 (3,34—9,95) | 12,1 (3,6—18,4) |
Впериф (л) | 5,81 (2,9—11,5) | 16,4 (11,3—20,1) | 27 (10,6—39,3) |
Vss (л) | 8,06 (3,35—16,6) | 22,1 (14,6—30,1) | 37,9 (16,5—57,2) |
AUC0-24h (мкг × год/мл) | 24,3 (14,1—38,9) | 40,4 (17,7—48,6) | 37,6 (19,2—80,2) |
Cmax (мкг/мл) | 12,1 (9,17—15) | 13,3 (4,73—15) | 12,4 (4,57—30,8) |
Кроме того, фармакокинетические показатели ганцикловира при внутривенном применении в соответствии со схемой дозирования, одобренной для взрослых (5 мг / кг путем внутривенной инфузии в течение 1:00), изучались в небольшой группе новорожденных и детей в возрасте от 9 месяцев до 12 лет с нормальной функцией почек ( n = 10, средний возраст 3,1 года). Экспозиция, которая определялась как среднее значение AUC0-∞ в день 1 (n = 10) и AUC0-12 в день 14 (n = 7), составила 19,4 ± 7,1 и 24,1 ± 14,6 мкг × ч / мл с показателями Cmax 7,59 ± 3,21 мкг / мл (день 1) и 8,31 ± 4,9 мкг / мл (день 14) соответственно. С применением дозирования по массе тела в этом исследовании наблюдалась тенденция к более низкой экспозиции у детей младшего возраста. У детей в возрасте до 5 лет средние величины AUC0-∞ в день 1 (n = 7) и AUC0-12h в день 14 (n = 4) составили 17,7 ± 5,5 и 17,1 ± 7,
Режим дозирования ганцикловира для внутривенного применения, рассчитывается по показателю ППТ и функцией почек (3 × ППТ × КлКр), является производным от режима дозирования детям валганцикловира и обеспечивает подобные величины экспозиции ганцикловира у детей от рождения до 16 лет (см. Таблицу 2).
Таблица 2. Смоделированные * показатели AUC0-24h (мкг × ч. / Мл) ганцикловира для детей, получавших лечение ганцикловиром в дозе рассчитанной по формуле 3 × ППТ × КлКр, что применялась путем инфузии в течение 1:00.
показатели | возраст <4 мес. | возраст от ³ 4 мес. до £ 2 лет | возраст от> 2 до <6 лет | возраст от ³ 6 до <12 лет | возраст от ³ 12 до £ 16 лет | все пациенты |
Количество детей в модели | 781 | 384 | 86 | 96 | 126 | 1 473 |
медиана | 55,6 | 56,9 | 54,4 | 51,3 | 51,4 | 55,4 |
Средняя величина | 57,1 | 58,0 | 55,1 | 52,6 | 51,8 | 56,4 |
Мин. | 24,9 | 24,3 | 16,5 | 23,9 | 22,6 | 16,5 |
Макс. | 124,1 | 133,0 | 105,7 | 115,2 | 94,1 | 133,0 |
пациенты с AUC < 40 мкг × год/мл | 89 (11 %) | 38 (10 %) | 13 (15 %) | 23 (24 %) | 28 (22 %) | 191 (13 %) |
пациенты с AUC 40-60 мкг × год/мл | 398 (51 %) | 195 (51 %) | 44 (51 %) | 41 (43 %) | 63 (50 %) | 741 (50 %) |
пациенты с AUC > 60 мкг × год/мл | 294 (38 %) | 151 (39 %) | 29 (34 %) | 32 (33 %) | 35 (28 %) | 541 (37 %) |
AUC = площадь под кривой плазменная концентрация-время; ППТ = площадь поверхности тела КлКр = клиренс креатинина макс. = Максимум; мин. = Минимум.
* Моделирование было выполнено с использованием валидированного фармакокинетического модели для популяции детей и демографических данных детей, получавших лечение валганцикловира или ганцикловиром в клинических исследованиях (n = 1473 записей данных).
Пациенты пожилого возраста.
Исследования у лиц старше 65 лет не проводили.
Клинические характеристики
Тамовир Показания
Препарат показан взрослым и подросткам старше 12 лет для:
- лечения цитомегаловирусной инфекции у пациентов с иммунодефицитами;
- предупреждения цитомегаловирусной инфекции путем превентивной терапии у пациентов с медикаментозной иммуносупрессией (например, после трансплантации органа или химиотерапии рака).
Препарат также показан детям от рождения для:
- предупреждения цитомегаловирусной инфекции путем универсальной профилактики у пациентов с медикаментозной иммуносупрессией (например, после трансплантации органа или химиотерапии рака).
Следует руководствоваться официальными рекомендациями относительно надлежащего применения противовирусных средств.
Противопоказания
- Повышенная чувствительность к ганцикловира, валганцикловира или другим компонентам препарата.
- Период кормления грудью.
Особые меры безопасности.
Предостережение при приготовлении раствора ганцикловира
Поскольку ганцикловир считается потенциально тератогенным и канцерогенным для человека, обращаться с препаратом следует с осторожностью.
Следует избегать ингаляции или прямой контакт с порошком, содержится во флаконах или прямому контакту восстановленного раствора с кожей или слизистыми оболочками. Раствор препарата щелочной (рН примерно 11). Приготовление раствора рекомендуется осуществлять в полиэтиленовых перчатках и защитных очках.
При попадании ганцикловира на кожу или слизистые оболочки это место необходимо тщательно промыть водой с мылом; глаза необходимо промывать стерильной или проточной водой, если нет стерильной.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Фармакокинетические взаимодействия.
Пробенецид.
При одновременном применении пробенецида с пероральным ганцикловиром наблюдалось статистически значимое снижение почечного клиренса ганцикловира (20%), что, в свою очередь, приводило к статистически значимому рост экспозиции (40%). Эти изменения согласуются с механизмом взаимодействия, включая конкуренцию за почечную канальцевую секрецию. Таким образом, в случае применения такой комбинации пациентов следует тщательно наблюдать относительно проявлений токсичности ганцикловира.
Диданозин.
Установлено, что при одновременном применении диданозина и внутривенном или пероральном введении ганцикловира концентрация диданозина в плазме крови устойчиво повышается. При внутривенном введении ганцикловира в дозах 5-10 мг / кг в сутки AUC диданозина увеличивается на 38-67%. Клинически значимых изменений концентрации ганцикловира при этом не было. Однако с учетом повышения плазменной концентрации диданозина в присутствии ганцикловира в случае применения такой комбинации пациентов необходимо тщательно наблюдать относительно проявлений токсичности диданозина (см. Раздел «Особенности применения»).
Другие антиретровирусные средства: изоферменты цитохрома P450 не участвуют в метаболизме ганцикловира. Как следствие, фармакокинетические взаимодействия с ингибиторами протеазы и ненуклеозидными ингибиторами обратной транскриптазы не ожидается.
Фармакодинамические взаимодействия.
Имипенем / циластатин.
У больных, которые одновременно получают ганцикловир и имипенем / циластатин, наблюдались судороги. Эти средства необходимо применять в комбинации с ганцикловиром только в случае, когда ожидаемая польза превышает риск (см. Раздел «Особенности применения»).
Зидовудин.
Зидовудин и ганцикловир могут приводить к нейтропении и анемии. Фармакодинамическая взаимодействие может возникнуть во время одновременного применения этих средств. Некоторые пациенты могут плохо переносить сопутствующее лечение полными дозами этих средств (см. Раздел «Особенности применения»).
Другие возможные взаимодействия.
Возможно усиление токсичности при назначении ганцикловира одновременно с другими средствами, которые могут оказывать миелосупрессивную действие или приводить к возникновению почечной недостаточности. К ним относятся: антибактериальные средства (например дапсон, пентамидин, флуцитозина, амфотерицин В, триметоприм / сульфаметоксазол) иммунодепрессанты (циклоспорин, такролимус, микофенолата мофетила) антинеопластичес средства (например винкристин, винбластин, доксорубицин и гидроксисечовиною) нуклеозиды (в частности зидовудин, ставудин и диданозин), аналоги нуклеотидов (в частности тенофовир, адефовир). Поэтому указанные лекарственные средства следует применять одновременно с ганцикловиром только в случае, когда польза от лечения превышает этот риск (см. Раздел «Особенности применения»).
Особенности применения
Риск перекрестной гиперчувствительности.
В связи с подобием химической структуры ганцикловира, ацикловира и пенцикловира между этими средствами возможные реакции перекрестной гиперчувствительности. Препарат следует применять с осторожностью пациентам с повышенной чувствительностью к ацикловиру или пенцикловиру (или к их неактивных форм (пролекарства), валганцикловира или фамцикловиру соответственно).
Риск мутагенности, тератогенности, канцерогенности, фертильности и контрацепция.
Перед началом применения препарата пациентов следует предупредить о возможном риске для плода. В исследованиях на животных ганцикловир проявлял мутагенное, тератогенное, асперматогенну и канцерогенное действие, а также подавлял фертильность. Учитывая результаты клинических и доклинических исследований, считается вероятным, что ганцикловир может вызвать временное или постоянное ингибирования сперматогенеза (см. Разделы «Применение в период беременности или кормления грудью» и «Побочные реакции»).
Ганцикловир имеет потенциальную тератогенным и канцерогенным действием и может вызвать врожденные пороки развития и злокачественные новообразования.
Во время применения препарата и в течение 30 дней после лечения необходимо рекомендовать женщинам репродуктивного возраста использовать надежные методы контрацепции. Мужчинам рекомендуется использовать барьерный метод контрацепции во время лечения и не менее 90 дней после его завершения, если только не доказано, что женщина-партнер не имеет риска забеременеть (см. Разделы «Применение в период беременности или кормления грудью» и «Побочные реакции »).
Применение препарата детям и подросткам требует исключительно тщательного рассмотрения из-за возможности удаленной канцерогенности и токсического влияния на репродуктивную функцию. Следует тщательно рассматривать преимущества лечения в каждом отдельном случае и четко учитывать риски. Обращайтесь к руководств по лечению.
Риск миелосупрессии.
Препарат следует применять с осторожностью пациентам с существующей гематологической цитопении или гематологической цитопении в анамнезе, связанной с применением лекарственных средств, а также пациентам, которые получают лучевую.
У больных, получавших ганцикловир, наблюдались случаи тяжелой лейкопении, нейтропении, анемии, тромбоцитопении, панцитопении, миелосупрессии и апластической анемии. Препарат не следует применять, если абсолютное число нейтрофилов менее 500 клеток в 1 мкл или число тромбоцитов менее 25000 в 1 мкл или уровень гемоглобина менее 8 г / дл (см. Разделы «Способ применения и дозы. Особые рекомендации по дозировке» и «Побочные реакции »).
Во время применения препарата рекомендуется мониторировать развернутую формулу крови, включая число тромбоцитов. Усиленный гематологический мониторинг может потребоваться для пациентов с нарушением функции почек, а также для новорожденных и младенцев (см. Раздел «Побочные реакции»). В течение первых 14 дней применения рекомендуется проводить исследование количества лейкоцитов (желательно дифференцированный подсчет) через день у пациентов с низким исходным уровнем нейтрофилов (<1000 нейтрофилов / мкл), пациентов, у которых наблюдалась лейкопения во время предыдущей терапии другими миелотоксическими средствами, а также у пациентов с нарушениями функции почек этот мониторинг следует проводить ежедневно.
Пациентам, у которых развивается тяжелая лейкопения, нейтропения, анемия и / или тромбоцитопения, рекомендуется лечение гематопоэтических факторами роста и / или прерывание лечения ганцикловиром (см. Разделы «Способ применения и дозы. Особые рекомендации по дозировке» и «Побочные реакции»).
Применение пациентам с нарушением функции почек.
Пациенты с нарушением функции почек имеют повышенный риск развития токсичности (особенно гематологической токсичности).
Во время применения препарата таким пациентам рекомендуется проводить коррекцию его дозы (см. Разделы «Способ применения и дозы. Особые рекомендации по дозировке» и «Фармакокинетика в особых группах больных»).
Применение с другими лекарственными средствами.
У больных, получающих имипенем / циластатин и ганцикловир, описано развитие судорог, поэтому не следует применять одновременно с имипенемом / циластатином, если только потенциальные преимущества терапии не превышают возможного риска (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий» ).
Одновременное применение ганцикловира и диданозина или средств, которые поступают миелосупрессивную (например, зидовудин) или нефротоксическое действие, следует тщательно контролировать, поскольку одновременное применение может привести к развитию аддитивной токсичности (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Вспомогательные вещества.
Один флакон препарата 500 мг содержит 2 ммоль (43 мг) натрия. Это следует учитывать пациентам, которые контролируют уровень натрия.
дети
Исследование взаимодействия проводились исключительно у взрослых.
Применение в период беременности или кормления грудью
Фертильность.
В небольшом клиническом исследовании с участием пациентов после трансплантации почек, получавших валганцикловира для профилактики ЦМВ-инфекции в течение периода до 200 дней, продемонстрированный влияние валганцикловира / ганцикловира на сперматогенез со снижением плотности спермы и подвижности сперматозоидов, определялись после завершения лечения. Этот эффект был обратным и примерно через шесть месяцев после отмены валганцикловира средняя плотность спермы и подвижность восстановились до уровней, сопоставимых с такими, которые наблюдались в группах контроля, не получавших лечения.
В исследованиях на животных ганцикловир вызвал нарушения фертильности у самцов и самок мышей, а также подавлял сперматогенез и вызывал атрофию яичек у мышей, крыс и собак при применении в дозах, которые считались клинически значимыми.
Учитывая результаты клинических и доклинических исследований, считается вероятным, что ганцикловир может вызвать временное или постоянное угнетение сперматогенеза у человека (см. Раздел «Особенности применения»).
Беременность.
Нет данных по безопасности по применению ганцикловира беременным. Однако, ганцикловир быстро проникает через плацентарный барьер. В исследованиях на животных применение ганцикловира было связано с возникновением репродуктивной токсичности и тератогенностью. Препарат не следует применять в период беременности, кроме случаев, когда клиническая необходимость в лечении женщины превышает возможный тератогенный риск для плода.
Контрацепция для мужчин и женщин.
Женщинам репродуктивного возраста следует рекомендовать использовать эффективные методы контрацепции во время лечения и в течение не менее 30 дней после лечения, поскольку возможно возникновение репродуктивной токсичности и тератогенности. Пациентам-мужчинам необходимо рекомендовать использовать барьерные методы контрацепции в течение и по меньшей мере 90 дней после лечения ганцикловиром, если только не доказано, что женщина-партнер не имеет риска забеременеть.
Период кормления грудью.
Неизвестно, проникает ганцикловир в грудное молоко у людей, однако нельзя исключить, что ганцикловир может проникать в грудное молоко и вызвать серьезные нежелательные реакции у ребенка. Данные, полученные в ходе исследований на животных показывают, что ганцикловир выводится в молоко в период лактации у крыс. Во время применения препарата следует прекратить кормление грудью.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Применение ганцикловира может существенно влиять на управление автотранспортом или другими механизмами (см. Раздел «Побочные реакции»).
Способ применения Тамовир и дозы
Препарат предназначен только для внутривенного введения, преимущественно с использованием пластиковой канюли и в вену с адекватным потоком крови. Не следует применять быстрые или болюсные внутривенные инъекции! Токсичность ганцикловира может расти вследствие чрезмерных уровней в плазме крови. Внутримышечные и подкожные инъекции препарата могут привести к тяжелому раздражение тканей в связи с высоким рН (9-11) раствора ганцикловира.
Дозировки.
Лечение ЦМВ-инфекции.
Взрослые и подростки старше 12 лет с нормальной функцией почек
- индукционная лечения: препарат применять в дозе 5 мг / кг путем внутривенной инфузии в течение 1:00 каждые 12:00 (10 мг / кг / сут) в течение 14-21 дня.
- поддерживающее лечение: у больных, у которых не восстановилась иммунная система, и в связи с чем сохраняется риск рецидива, можно применить поддерживающее лечение - в дозе 5 мг / кг путем внутривенной инфузии в течение 1:00, однократно ежедневно в течение 7 дней или в дозе 6 мг / кг однократно ежедневно в течение 5 дней в неделю. Продолжительность поддерживающего лечения определяют индивидуально, следует обратиться в местные руководств по лечению.
- лечение заболевания, которое прогрессирует: любом пациенту с прогрессированием ЦМВ-инфекции как при проведении поддерживающего лечения, так и после отмены применения ганцикловира лечения можно восстановить по схеме индукционного лечения.
Дети от рождения до 12 лет.
Имеющуюся на сегодняшний день информацию по применению препарата детям изложены в разделе «Фармакологические свойства», однако никаких рекомендаций относительно дозирования нельзя предоставить.
Предупреждение ЦМВ-инфекции путем превентивной терапии.
Взрослые и подростки в возрасте ≥ 12 лет с нормальной функцией почек
- индукционная лечения: препарат применять в дозе 5 мг / кг путем внутривенной инфузии в течение 1:00 каждые 12:00, в течение 7-14 дней.
- поддерживающее лечение: препарат применять в дозе 5 мг / кг путем внутривенной инфузии в течение 1:00 однократно ежедневно в течение 7 дней или в дозе 6 мг / кг однократно ежедневно в течение 5 дней в неделю. Продолжительность профилактики определяется на основе риска ЦМВ-инфекции следует обратиться в местные руководств по лечению.
Дети от рождения и до 12 лет.
Имеющиеся на данный момент данные применения препарата у детей описываются в разделе «Фармакологические свойства», однако никакие рекомендации по дозированию не могут быть предоставлены.
Предупреждение ЦМВ-инфекции путем универсальной профилактики.
Взрослые и подростки в возрасте от 16 лет.
Препарат применять в 5 мг / кг путем внутривенной инфузии в течение 1:00 однократно ежедневно в течение 7 дней или в дозе 6 мг / кг однократно ежедневно в течение 5 дней в неделю. Продолжительность профилактики определяется на основе риска ЦМВ-инфекции следует обратиться в местные руководств по лечению.
Дети от рождения до ≤ 16 лет.
Имеющуюся на сегодняшний день информацию по применению препарата детям изложены в разделе «Фармакологические свойства», однако никаких рекомендаций относительно дозирования нельзя предоставить.
Рекомендованную разовую дозу ганцикловира, которую вводят путем инфузии в течение одного часа, рассчитывают на основе площади поверхности тела (ППТ), определенной по формуле ППТ Мостеллер (Mostellar) и клиренса креатинина (КлКр), определяемого по формуле Шварца (Schwartz). Формулы расчета приведены ниже. Продолжительность универсальной профилактики следует определять индивидуально, с учетом риска развития ЦМВ-инфекции.
Доза для детей (мг) = 3 × ППТ × КлКр (см. Ниже формулу ППТ Мостеллер и формулу КлКр Шварца).
Если рассчитанный по формуле Шварца КлКр превышает 150 мл / мин / 1,73 м2, тогда максимальная величина, которую следует применять в формуле, составляет 150 мл / мин / 1,73 м
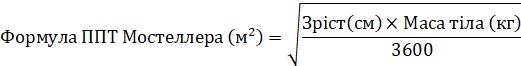
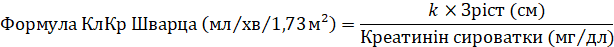
где k = 0,33 для пациентов в возрасте <1 года с низкой массой тела после рождения, 0,45 для пациентов в возрасте <2 лет, 0,55 для мальчиков в возрасте от 2 до <13 лет и девочек в возрасте от 2 до 16 лет и 0,7 для мальчиков в возрасте от 13 до 16 лет. Для пациентов старше 16 лет следует применять дозировки, рекомендуется для взрослых.
Приведенные величины k основываются на определении креатинина сыворотки по методу Яффе (Jaffe) и могут потребовать корректировки в случае использования ферментативных методов.
Рекомендуется регулярно просматривать сывороточные уровни креатинина, рост и массу тела пациента и при необходимости изменять дозу.
Пациенты с нарушением функции почек.
Дети (от рождения до 16 лет) с нарушением функции почек, получающих профилактическую дозу ганцикловира, рассчитанную по формуле 3 × ППТ × КлКр, не требуют дополнительной коррекции дозы, поскольку эта доза уже скорректирована с учетом клиренса креатинина.
Пациентам старше 12 лет с нарушением функции почек, получающих превентивную терапию и лечение ЦМВ-инфекции в дозе, рассчитанной на основе массы тела, дозу ганцикловира следует корректировать с учетом клиренса креатинина, как показано в таблице ниже.
Коррекция дозы для пациентов с нарушением функции почек
КК (мл / мин) | Индукционная доза | поддерживающая доза |
> 70 | 5 мг / кг каждые 12:00 | 5 мг / кг в сутки |
50-69 | 2,5 мг / кг каждые 12:00 | 2,5 мг / кг в сутки |
25-49 | 2,5 мг / кг в сутки | 1,25 мг / кг в сутки |
10-24 | 1,25 мг / кг в сутки | 0,625 мг / кг в сутки |
<10 | 1,25 мг / кг 3 раза / неделю после гемодиализа | 0,625 мг / кг 3 раза / неделю после гемодиализа |
КК (мл / мин) можно рассчитывать по креатинина сыворотки крови по следующей формуле:
(140 - возраст [ лет ] × масса тела [ кг ] )
Для мужчин = 72 × 0,011 × креатинин сыворотки крови [мкмоль / л]
Для женщин = 0,85 × показатель для мужчин.
Поскольку пациентам с нарушением функции почек рекомендуется проводить коррекцию дозы, следует контролировать уровень креатинина сыворотки крови или расчетный клиренс креатинина.
Пациенты с нарушением функции печени.
Безопасность и эффективность применения ганцикловира не изучали у пациентов с нарушением функции печени (см. Раздел «Фармакологические свойства»).
Пациенты с тяжелой лейкопенией, нейтропенией, анемией, тромбоцитопенией и панцитопенией (см. Раздел «Особенности применения» до начала терапии).
Если во время применения препарата наблюдается значительное уменьшение количества клеток крови, следует рассмотреть возможность лечения гематопоэтических факторами роста и / или прерывание лечения ганцикловиром (см. «Особенности применения» и «Побочные реакции»).
Пациенты пожилого возраста.
Эффективность и безопасность ганцикловира у лиц пожилого возраста не изучалась. Поскольку у пациентов пожилого возраста функция почек нередко снижена, препарат необходимо им застососвуваты с учетом функции почек (см. Раздел «Фармакологические свойства»).
Дети.
Существует ограниченный опыт лечения детей в возрасте до 12 лет (см. Разделы «Особенности применения» и «Фармакокинетика»). Уведомлены побочные реакции были подобны тем, которые наблюдались у взрослых. Однако применение ганцикловира детям требует чрезвычайной осторожности в результате возможной длительной канцерогенного действия и репродуктивной токсичности. Преимущество от лечения должна преобладать риски. Препарат показан для лечения врожденной и неонатальной ЦМВ-инфекции.
Способ применения.
Внимание!
Препарат следует вводить путем инфузии в течение 1:00 в концентрации, не превышающей 10 мг / мл. Нельзя вводить путем быстрой или болюсной инъекции, поскольку токсичность ганцикловира может зростатиты за его чрезмерные уровни в плазме крови.
Препарат нельзя вводить путем внутримышечной или подкожной инъекции, поскольку это может привести к тяжелому раздражение тканей из-за высокого рН (~ 11) раствора ганцикловира (см. Раздел «Побочные реакции»).
Нельзя превышать рекомендованные дозы препарата, частоту или скорость инфузии.
Препарат - это лиофилизат (порошок) для приготовления раствора для инфузий. После восстановления является прозрачным бесцветным раствором.
Инфузию следует проводить в вену с соответствующим потоком крови, желательно через пластиковую канюлю.
Приготовление концентрата следует проводить в асептических условиях.
Приготовление восстановленного концентрата
1. снять колпачок для того, чтобы иметь доступ к центральной части резиновой пробки;
2. набрать в шприц 10 мл воды для инъекций, и медленно перенести во флакон через центр резиновой пробки; нельзя использовать бактериостатическое воду для инъекций, содержащий парабены (парагидроксибензоаты), поскольку они несовместимы с препаратом;
3. мягко cтруситы флакон, чтобы обеспечить полное смачивание лиофилизат;
4. мягко обертатиты флакон круговыми движениями в течение нескольких минут, для того чтобы получить полностью восстановлен раствор
5. тщательно осмотреть восстановленный раствор для выявления механических примесей перед разведением совместимым растворителем.
Восстановленный концентрат является прозрачным бесцветным раствором.
Приготовление конечного разбавленного раствора для инфузий .
Из флакона отобрать нужный объем, рассчитанный по массе тела больного, и дальше развести в 100 мл соответствующего инфузионного растворителя.
Не рекомендуется применять инфузионные растворы с концентрацией выше 10 мг / мл.
С препаратом совместимы такие инфузионные растворы: 0,9% раствор натрия хлорида 5% раствор глюкозы; раствор Рингера и раствор Рингер-лактата.
Не следует смешивать препарат с другими средствами для внутривенного применения.
Разведенный раствор не следует вводить дольше 1:00, как указано в разделе «Способ применения и дозы».
Раствор, восстановленный водой для инъекций продемонстрировал химическую и физическую стабильность в течение 12:00 при хранении при температуре 25 ° C. Восстановленный раствор не следует хранить в холодильнике или замораживать.
С микробиологической точки зрения восстановлен раствор следует использовать немедленно. Иначе срок и условия хранения перед применением является ответственностью пользователя.
Разведенный раствор для инфузий демонстрировал химическую и физическую стабильность в течение 24 часов при температуре 2-8 ° C. Готовый раствор для инфузий не следует замораживать. С микробиологической точки зрения готовый раствор для инфузий препарата следует использовать немедленно. Иначе срок и условия хранения перед применением является ответственностью пользователя. При этом срок годности не должен превышать 24 ч при температуре 2-8 ° C, если восстановление и разведение происходило в контролируемых и валидизированных асептических условиях.
Любой неиспользованный препарат или отходы следует утилизировать согласно мицевих требований.
Дети
Существует ограниченный опыт лечения детей в возрасте до 12 лет (см. Разделы «Фармакологические свойства», «Показания», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Особенности применения», «Применение», «Передозировка», «Побочные реакции»).
Передозировка
Симптомы.
О случаях передозировки ганцикловиром, некоторые со смертельным исходом, сообщалось во время проведения клинических исследований и при послерегистрационного применения препарата. Большинство сообщений не были связаны с возникновением каких-либо побочных реакций или включали одну или более побочных реакций со перечню, приведенному ниже:
- гематологическая токсичность: миелосупрессия, в частности панцитопения, лейкопения, нейтропения, гранулоцитопения, аплазия костного мозга
- гепатотоксичность гепатит, нарушение функции печени
- почечная токсичность: усиление гематурии у больных с имеющимися к этому нарушениями функции почек, острая почечная недостаточность, повышение уровня креатинина
- желудочно-кишечное токсичность: боль в животе, диарея, рвота
- нейротоксичность: генерализованный тремор, судороги.
Лечение.
Ганцикловир выводится во время гемодиализа; таким образом, для снижения его уровня в плазме крови пациентов, которым введено избыточное количество препарата, можно применять гемодиализ (см. раздел «Фармакокинетика»).
Дополнительная информация по особых групп пациентов.
Пациенты с почечной недостаточностью.
Ожидается, что передозировка ганцикловиром может привести к повышению почечной токсичности у пациентов с почечной недостаточностью (см. Раздел «Особенности применения»).
Дети.
Конкретная информация отсутствует.
Побочные эффекты
Общий профиль безопасности.
Примечание: валганцикловира является неактивной форме (пролекарства) ганцикловира, и побочные реакции, связанные с применением валганцикловира, можно ожидать в случае применения ганцикловира. Ганцикловир для перорального применения больше не производится, но побочные реакции, о которых сообщали во время его применения, можно ожидать у пациентов, получающих ганцикловир внутривенно. Поэтому перечень включает побочные реакции, которые наблюдались при внутривенном или пероральном применении ганцикловира или валганцикловира.
У пациентов, которых лечили ганцикловиром / валганцикловира, наиболее серьезными и частыми побочными реакциями были нейтропения, анемия и тромбоцитопения. Другие побочные реакции приведены ниже.
Частота побочных реакций, приведенная ниже, полученная из объединенных данных группы ВИЧ-инфицированных пациентов (n = 1704), которые получали поддерживающую терапию ганцикловиром или валганцикловира. Исключением является агранулоцитоз, гранулоцитопения и анафилактические реакции; данные об их частоту, получены при постмаркетингового периода. Побочные реакции приведены в соответствии с классами систем органов MedDRA, их частота определена по следующим категориям: очень часто (≥ 1/10), часто (≥ 1/100, <1/10), нечасто (≥ 1/1000, <1/100 ), редко (≥ 1/10000, <1/1000).
Общий профиль безопасности ганцикловира / валганцикловира сопоставим в популяциях ВИЧ-инфицированных пациентов и пациентов, перенесших трансплантацию органов, за исключением того, что о отслойка сетчатки сообщалось только у ВИЧ-инфицированных пациентов с ЦМВ-ретинитом. Однако есть определенные различия в частоте некоторых реакций. Внутривенное применение ганцикловира связано с меньшим риском возникновения диареи по сравнению с пероральным применением валганцикловира. О повышении температуры тела, кандидозные инфекции, депрессию, тяжелую нейтропению (АКН <500 / мкл) и кожные реакции чаще сообщают в ВИЧ-инфицированных пациентов. Почечную и печеночную дисфункцию чаще наблюдали у пациентов, перенесших трансплантацию органов.
Инфекции и инвазии:
очень часто - кандидозные инфекции, в частности кандидоз ротовой полости, инфекции верхних отделов респираторного тракта часто - сепсис, грипп, воспаление подкожной клетчатки (целлюлит), инфекция мочевыводящих путей.
Со стороны крови и лимфатической системы: очень часто - нейтропения, анемия часто - тромбоцитопения, лейкопения, панцитопения нечасто - недостаточность костного мозга редко - агранулоцитоз *, апластическая анемия, гранулоцитопения *.
Со стороны иммунной системы:
часто - повышенная чувствительность; нечасто - анафилактические реакции *.
Со стороны обмена веществ, метаболизма :
очень часто - снижение аппетита часто - снижение массы тела.
Со стороны психики:
часто - депрессия, спутанность сознания, тревога; нечасто - возбуждение, психотические расстройства, нарушения мышления, галлюцинации.
Со стороны нервной системы:
очень часто - головная боль; часто - бессонница, дисгевзия (нарушение вкусовых ощущений), гипестезия, парестезии, периферическая нейропатия, судороги, головокружение нечасто - тремор.
Со стороны органов зрения:
часто - отек роговицы, отслойка сетчатки, плавающие помутнения стекловидного тела, боль в глазах, нарушение зрения, конъюнктивит.
Со стороны органов слуха и вестибулярного аппарата:
часто - боль в ушах нечасто - глухота.
Со стороны сердца:
нечасто - аритмия.
Со стороны сосудов :
часто - гипотензия.
Со стороны дыхательной системы, органов грудной клетки и средостения :
очень часто - одышка, кашель.
Со стороны пищеварительного тракта :
очень часто - диарея, тошнота, рвота, боль в животе; часто - боль в животе в верхней части живота, запор, метеоризм, дисфагия, диспепсия, ощущение растяжение живота, язвы в ротовой полости, панкреатит.
Со стороны пищеварительной системы:
часто - повышение уровня щелочной фосфатазы и АСТ плазмы крови, нарушение функции печени, повышение уровня АЛТ.
Со стороны кожи и подкожной клетчатки :
очень часто - дерматит часто - ночное потение, зуд, сыпь, алопеция нечасто - сухость кожи, крапивница.
Со стороны костно-м ' мышечной системы и соединительной ткани :
часто - боли в мышцах, боли в суставах, боль в спине, судороги в мышцах.
Со стороны почек и мочевыделительной системы : часто - снижение почечного клиренса креатинина, нарушение функции почек, повышение уровня креатинина плазмы крови нечасто - гематурия, почечная недостаточность.
Со стороны репродуктивной системы и молочных желез:
нечасто - мужское бесплодие.
Общие нарушения и реакции в месте введения:
очень часто - лихорадка, слабость, часто - боль, озноб, недомогание, астения, реакции в месте инъекции; нечасто - боль в грудной клетке.
* Информация о частоте возникновения побочных реакций получены при постмаркетингового применения, все остальные категории по частоте основываются на данных, полученных в ходе клинических исследований.
Описание отдельных побочных реакций.
Нейтропения.
Риск возникновения нейтропении невозможно предсказать на основе количества нейтрофилов перед лечением. Нейтропения обычно возникает в течение первого или второго недели индукционного лечения и после применения кумулятивной дозы ≤ 200 мг / кг. Количество клеток обычно нормализуется в течение 2-5 дней после отмены ганцикловира или снижение его дозы (см. Раздел «Особенности применения»).
Тяжелая нейтропения.
О тяжелой нейтропения чаще сообщали у ВИЧ-инфицированных пациентов (14%), которые получали поддерживающую терапию валганцикловира, ганцикловиром внутрь или внутривенно (n = 1704), чем у пациентов после трансплантации органов, получали валганцикловира или ганцикловир для перорального применения. У пациентов, получавших валганцикловира или ганцикловир для перорального применения ко дню 100 после трансплантации, частота тяжелой нейтропении составила 5% и 3% соответственно, тогда как у пациентов, получавших валганцикловира ко дню 200 после трансплантации, частота тяжелой нейтропении составила 10%.
Тромбоцитопения.
Пациенты с низкой исходной количеством тромбоцитов (<100 000 / мкл) имеют повышенный риск развития тромбоцитопении. Пациенты с ятрогенной иммуносупрессией вследствие лечения иммуносупрессивными лекарственными средствами имеют больший риск возникновения тромбоцитопении, чем пациенты со СПИДом (см. Раздел «Особенности применения»). Тяжелая тромбоцитопения может быть связана с потенциально угрожающей для жизни кровотечением.
Судороги.
У пациентов, которые одновременно принимали имипенем-циластатин и ганцикловир, наблюдались судороги (см. Раздел «Особенности применения» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Отслоение сетчатки .
Об этом побочную реакцию сообщалось только во время исследований с участием ВИЧ-инфицированных пациентов, получавших ганцикловира для лечения ЦМВ-ретинита.
Реакции в месте инъекции.
У пациентов, которым применяют ганцикловир, часто возникают реакции в месте инъекции. Препарат следует применять в соответствии с рекомендациями, изложенными в разделе «Способ применения и дозы», с целью снижения риска местного раздражения тканей.
Дети.
Официальные исследования безопасности применения ганцикловира детям ≤ 12 лет не проводились, однако на основе опыта применения валганцикловира, неактивной формы (пролекарства) ганцикловира, общий профиль безопасности активной формы у детей и взрослых пациентов подобный. Нейтропения возникает чаще у детей, но корреляции между возникновения нейтропении и инфекциями у детей нет. Более высокий риск развития цитопении у новорожденных и младенцев требует тщательного контроля числа клеток крови в этих возрастных группах.
Существуют лишь ограниченные данные по применению валганцикловира или ганцикловира новорожденным или младенцам с ВИЧ / СПИДом или симптоматической врожденной ЦМВ-инфекцией, однако профиль безопасности соответствует известному профилю безопасности валганцикловира / ганцикловира.
Сообщение о подозреваемых побочные реакции
Сообщение о подозреваемых побочные реакции, возникшие после регистрации лекарственного средства, очень важны. Это позволяет постоянно наблюдать за балансом польза / риск лекарственного средства. Работников системы здравоохранения просят сообщать о любых подозреваемые побочные реакции через национальную систему сообщений.
Срок годности Тамовир
3 года.
Условия хранения Тамовир
Хранить при температуре не выше 25 ° С в недоступном для детей месте.
Упаковка
По 500 мг во флаконе; 1 флакон в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Мефар Илач Сан. А.Ш., Турция /
Mefar Ilac San. A.S., Turkey.
Местонахождение производителя
Рамазаноглу Мах. Енсар Джад. № 20 34906 курткой - Бешикташ / Стамбул, Турция /
Ramazanoğlu Mah. Ensar Cad. №: 20, 34906 Курткой - Пендик / Стамбул, Турция.
Заявитель.
УОРЛД Медицина ИЛАЧ САН. ВЕ ТиДжей. A.Ш., Турция /
МИРОВАЯ МЕДИЦИНА ILAC SAN VE TIC. AS, Турция.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Тамовир только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Мефар Илач Сан. А.Ш.
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Тамовир |
| Производитель: | Мефар Илач Сан. А.Ш. |
| Форма выпуска: | лиофилизат для приготовления раствора для инфузий 500 мг во флаконе; по 1 флакону в картонной коробке |
| Регистрационное удостоверение: | UA/17832/01/01 |
| Дата начала: | 17.12.2019 |
| Дата окончания: | 17.12.2024 |
| МНН: | Ganciclovir |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон содержит ганцикловира (в форме ганцикловира натрия) 500 мг |
| Фармакологическая группа: | Противовирусные средства для системного применения. Нуклеозиды и нуклеотиды, за исключением ингибиторов обратной транскриптазы. Ганцикловир. |
| Код АТХ: | J05AB06 |
| Заявитель: | Уорлд Медицина Илач Сан. Ве Тидж. А.Ш. |
| Страна заявителя: | Турция |
| Адрес заявителя: | 15 Теммуз Мах. Джами Йолу Джад. №50 Гюнешли / Бешикташ, Стамбул, Турция |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| J | Противомикробные средства для системного применения |
| J05 | Противовирусные средства для системного применения |
| J05A | Противовирусные средства прямого действия |
| J05AB | Нуклеозиды и нуклеотиды, за исключением ингибиторов обратной транскриптазы |
| J05AB06 | Ганцикловир |
