- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/17140/01/01, UA/17140/01/02, UA/17140/01/03, UA/17140/01/04 закончился 01.02.2024
Нувик инструкция по применению
Официальная инструкция лекарственного препарата Нувик порошок 250 МО, 500 МО, 1000 МО, 2000 МО. Описание и применение Nuvik, аналоги и отзывы. Инструкция Нувик порошок утвержденная компанией производителем.
Состав
действующее вещество: симоктоког альфа (рекомбинантный фактор свертывания крови VIII).
1 флакон порошка для приготовления раствора для инъекций содержит симоктокогу альфа (рекомбинантный фактор свертывания крови VIII) 250 МЕ или 500 МЕ, или 1000 МЕ, или 2000 МЕ.
вспомогательные вещества : натрия хлорид; сахароза; L-аргинина гидрохлорид кальция хлорид, дигидрат; полоксамер 188; натрия, дигидрат.
Растворитель: вода для инъекций.
Лекарственная форма
Порошок и растворитель для приготовления раствора для инъекций.
Основные физико-химические свойства:
Порошок: белая смесь. Возможно небольшое количество белого порошка.
Растворитель: прозрачная, бесцветная жидкость, без частиц.
Фармакологическая группа
Антигеморрагические средства. Фактор свертывания крови VIII.
Код АТХ B02B D02.
Фармакологические свойства
Фармакологические.
Фактор свертывания крови VIII связывается с фактором Виллебранда в кровообращении пациента. Активированный фактор VIII действует как кофактор для активированного фактора IX, уменьшая время преобразования фактора X в активированный фактор X. активированный фактор X превращает протромбин в тромбин. После чего тромбин превращает фибриноген в фибрин и образуется сгусток.
Гемофилия А - наследственное заболевание крови, связанное с полом, вызванное врожденным дефицитом фактора свертывания VIII: C, что приводит к кровоизлияниям в суставы, мышцы, внутренние органы, возникают спонтанно или в результате случайной или хирургической травмы. При заместительной терапии уровне фактора VIII в плазме увеличиваются, благодаря чему временно корректируется дефицит фактора свертывания крови VIII и склонность к кровотечениям.
Иммуногенность препарата Нувик была оценена в клинических исследованиях с участием 190 пациентов с тяжелой гемофилией А (129 взрослых и 61 дитина). Ни у одного пациента не обнаружено формирование нейтрализующих антител.
Профилактика: В клиническом исследовании у 32 взрослых пациентов с тяжелой гемофилией А средняя профилактическая доза лекарственного средства Нувик составила 468,7 МЕ / кг / месяц. Лечение кровотечения Средняя доза для лечения кровотечения у пациентов, получавших профилактику, составляла 33,0 МЕ / кг. В другом клиническом исследовании 22 взрослых пациентов получили лечение по необходимости. Всего в 986 случаях кровотечений была применена среднюю дозу 30,9 МЕ / кг. В общем, незначительные кровотечения требовали меньших, а сильные кровотечения нуждались в три раза больших средних доз.
Индивидуализированная профилактика : индивидуализированная профилактика, основанная на ФК, оценивалась в 66 взрослых пациентов, ранее получавших лечение (PTPs), с тяжелой гемофилией А. После 1-3 месячного стандартного этапа профилактики (получение дозы через день или 3 раза в неделю), 44 (67%) пациенты перешли на режим дозирования, основанный на оценке их ФК, а 40 пациентов завершили 6-месячную профилактику в соответствии с предназначенных доз и схемы лечения. Из этих пациентов, 34 (85%) получали лечение два раза в неделю или меньше. 33 (82,5%) пациентов не имели никаких кровотечений, а 36 (90,0%) пациентов не имели спонтанных кровотечений. Средняя + SD аннуилизована (рассчитана на годовой основе) частота кровотечений составляла 1,2 + 3,9, а средняя +SD доза составляла 52,2 + 12,2 МЕ / кг на инъекцию и 99,7 + 25,6 МЕ / кг в неделю.
Следует отметить, что аннуализована частота кровотечений (ABR) не является сопоставимой между различными концентратами фактора и между различными клиническими исследованиями.
педиатрическая популяция
Данные получены в 29 ранее леченных детей от 2 до 5 лет, 31 ребенка в возрасте от 6 до 12 лет и одного подростка в возрасте 14 лет. Средняя профилактическая инъекционная доза составляла 37,8 МЕ / кг. Двадцать пациентов получили средние дозы более 45 МЕ / кг. Средняя профилактическая доза лекарственного средства Нувик в месяц составляла 521,9 МЕ / кг. Для лечения кровотечений детям назначали большую среднюю дозу лекарственного средства Нувик (43,9 МЕ / кг), чем взрослым (33,0 МЕ / кг), а также большую среднюю дозу для лечения как малых, так и больших кровотечений (78,2 МО / кг против 41,7 МЕ / кг). Детям младшего возраста в целом были необходимы большие средние дозы (6 - 12 лет - 43,9 МЕ / кг 2 - 5 лет - 52,6 МЕ / кг).
Эти данные подтверждались длительным последующим врачебным наблюдением 49 таких детей, которых лечили в течение дополнительного среднего периода примерно 30 месяцев (диапазон от 9,5 до 52 месяцев); в течение этого периода 45% детей не имели спонтанных кровотечений.
Проспективное открытое клиническое исследование у пациентов с тяжелой гемофилией А (˂ 1% FVIII: C), ранее не получавших лечения (PUPs), продолжается.
Европейское агентство по оценке лекарственных средств отложило обязательства предоставлять результаты исследований с препаратом Нувик в одной или более подгруппах пациентов детского возраста при лечении гемофилии А (врожденный дефицит фактора VIII).
Фармакокинетика.
взрослый популяция
Таблица 1.
Фармакокинетические параметры лекарственного средства Нувик (доза 50 МЕ / кг) у взрослых в возрасте от 18 до 65 лет с тяжелой гемофилией А, которые лечились ранее (n = 20).
фармакокинетические параметры | хромогенный анализ | |
Среднее ± SD | Медиана (границы) | |
AUC (год*МО/мл) | 22,6 ± 8,0 | 22,3 (8,4 — 38,1) |
T 1/2 (год) | 14,7 ± 10,4 | 12,5 (5,4 — 55,6) |
IVR (%/МО/кг) | 2,5 ± 0,4 | 2,5 (1,7 — 3,2) |
CL (мл/год/кг) | 3,0 ± 1,2 | 2,7 (1,5 — 6,4) |
AUC - площадь под кривой (FVIII: C), T ½ - период полувыведения
IVR - восстановление показателей in vivo , CL - клиренс, SD - стандартное отклонение
Таблица 2.
Фармакокинетические параметры лекарственного средства Нувик (доза 50 МЕ / кг) в возрасте от 6 до 12 лет с тяжелой гемофилией А, которые лечились ранее (n = 12).
фармакокинетические параметры | хромогенный анализ | |
Среднее ± SD | Медиана (границы) | |
AUC (год*МО/мл) | 13,2 ± 3,4 | 12,8 (7,8 — 19,1) |
T 1/2 (год) | 10,0 ± 1,9 | 9,9 (7,6 — 14,1) |
IVR (%/МО/кг) | 1,9 ± 0,4 | 1,9 (1,2 — 2,6) |
CL (мл/год/кг) | 4,3 ± 1,2 | 4,2 (2,8 — 6,9) |
AUC - площадь под кривой (FVIII: C), T ½ - период полувыведения
IVR - восстановление показателей in vivo , CL - клиренс, SD - стандартное отклонение
Таблица 3.
Фармакокинетические параметры лекарственного средства Нувик (доза 50 МЕ / кг) в возрасте от 2 до 5 лет с тяжелой гемофилией А, которые лечились ранее (n = 13).
фармакокинетические параметры | хромогенный анализ | |
Среднее ± SD | Медиана (границы) | |
AUC (год*МО/мл) | 11,7 ± 5,3 | 10,5 (4,9 — 23,8) |
T 1/2 (год) | 9,5 ± 3,3 | 8,2 (4,3 — 17,3) |
IVR (%/МО/кг) | 1,9 ± 0,3 | 1,8 (1,5 — 2,4) |
CL (мл/год/кг) | 5,4 ± 2,4 | 5,1 (2,3 — 10,9) |
AUC - площадь под кривой (FVIII: C), T ½ - период полувыведения
IVR - восстановление показателей in vivo , CL - клиренс, SD - стандартное отклонение
педиатрическая популяция
Согласно опубликованным данным, показатели восстановления и период полувыведения были ниже у детей младшего возраста, чем у взрослых, а показатель вывода - выше, что может быть частично объяснено большим объемом плазмы на килограмм массы тела у пациентов младшего возраста.
Подгруппы по массе тела
Таблица 4.
Фармакокинетические параметры лекарственного средства Нувик (доза 50 МЕ / кг) у взрослых в возрасте от 18 до 65 лет с тяжелой гемофилией А, ранее лечившихся (n = 20), по массе тела пациента
фармакокинетические параметры | все пациенты (n = 20) | С нормальной массой тела вес (n = 14) | Состояние перед ожирением (n = 4) | ожирение (n = 2) |
Хромогенный анализ, среднее ± SD | ||||
AUC (год*МО/мл) | 22,6 ± 8,0 | 20,4 ± 6,9 | 24,9 ± 8,9 | 33,5 ± 6,5 |
T 1/2 (год) | 14,7 ± 10,4 | 14,7 ± 12,1 | 13,4 ± 5,9 | 17,2 ± 4,8 |
IVR (%/МО/кг) | 2,5 ± 0,4 | 2,4 ± 0,4 | 2,7 ± 0,4 | 2,8 ± 0,3 |
CL (мл/год/кг) | 3,0 ± 1,2 | 3,2 ± 1,3 | 2,6 ± 1,0 | 1,8 ± 0,4 |
Хромогенный анализ, медиана (границы) | ||||
AUC (год*МО/мл) | 22,3 (8,4 — 38,1) | 21,2 (8,4— 32,6) | 23,3 (17,4 — 35,5) | 33,5 (28,9 — 38,1) |
T 1/2 (год) | 12,5 (5,4 — 55,6) | 12,3 (5,4— 55,6) | 11,2 (9,3 — 22,0) | 17,2 (13,8 — 20,6) |
IVR (%/МО/кг) | 2,5 (1,7 — 3,2) | 2,4 (1,7 — 3,1) | 2,8 (2,3 — 3,2) | 2,8 (2,6 — 3,0) |
CL (мл/год/кг) | 2,7 (1,5 — 6,4) | 2,8 (1,7 — 6,4) | 2,5 (1,6 — 3,7) | 1,8 (1,5 — 2,0) |
Нормальная масса тела BMI - 18.5 - 25 кг / м2, повышенная масса тела: BMI 25 - 30 кг / м2, Ожирение: BMI> 30 кг / м2, SD - стандартное отклонение
Клинические характеристики
Нувик Показания
Лечение и профилактика кровотечения у пациентов с гемофилией А (врожденный дефицит фактора VIII).
Препарат Нувик можно применять пациентам всех возрастов.
Противопоказания
Повышенная чувствительность к активному веществу или любой из вспомогательных веществ препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Не проводилось никаких исследований относительно взаимодействий лекарственного средства Нувик с другими лекарственными средствами.
Особенности применения
Специфическая активность лекарственного средства Нувик составляет примерно 9500 МЕ / мг протеина.
Симоктоког альфа (фактор свертывания крови VIII (рДНК)) - чистый протеин, который имеет 1440 аминокислот. Последовательность аминокислот подобная 90 + 80 кДа формы фактора
плазмы VIII (то есть с удаленным В-доменом). Нувик получают по технологии рекомбинантной ДНК из генетически модифицированных клеток почки эмбриона человека (НЭК) 293F. Во время производственного процесса и до готового лекарственного средства не входят материалы животного или человеческого происхождения.
повышенная чувствительность
Как и при применении любого внутривенного протеиновом препарата, вероятность развития аллергической реакции и повышенной чувствительности. Нувик содержит следовые количества белков человеческой клетки, которые отличаются от фактора VIII. В случае появления симптомов повышенной чувствительности нужно немедленно прекратить применение лекарственного средства и обратиться за медицинской помощью. Пациентов необходимо проинформировать о ранних признаках реакций гиперчувствительности, такие как крапивница, генерализованная крапивница, ощущение сжатия в грудной клетке, затрудненное дыхание, хрип, артериальная гипотензия и анафилактический шок.
В случае возникновения шока следует осуществлять стандартное медицинское лечение шокового состояния.
ингибиторы
Формирование нейтрализующих антител (ингибиторов) фактора VIII является известным осложнением, возникающим при лечении лиц с гемофилией А. Эти ингибиторы обычно представляют собой иммуноглобулины IgG, действие которых направлено против прокоагуляцийнои активности фактора VIII, и количественно определяются в единицах Бетезда (БО) на 1 мл плазмы, с использованием модификационного анализа. Риск образования ингибиторов коррелирует с тяжестью заболевания, а также зависит от влияния фактора VIII, причем он самый высокий в течение первых 20 дней применения препарата. В редких случаях ингибиторы могут формироваться после первых 100 дней лечения.
Случаи повторного образования ингибиторов (низкий титр) наблюдались при переходе с одного препарата рекомбинантного фактора VIII на другой у пациентов, ранее получавших лечение препаратом в течение более 100 дней и у которых в анамнезе имеется образования ингибиторов. В связи с этим рекомендуется тщательный мониторинг всех пациентов о создании ингибиторов после любого изменения лекарственного средства.
Клиническая значимость образования ингибиторов зависеть от титра ингибитора: ингибиторы с низким титром, которые временно находятся или постоянно сохраняют низкий титр, представляют собой меньший риск недостаточной клинического ответа, чем ингибиторы с высоким титром.
Необходим тщательный мониторинг всех пациентов, получающих лечение рекомбинантными факторами свертывания крови VIII, о создании ингибиторов путем надлежащего клинического наблюдения и лабораторных анализов. Если ожидаемые уровни активности фактора VIII в плазме крови не достигаются или если кровотечение не прекращается при применении соответствующей дозы препарата, следует провести анализы для определения наличия ингибиторов фактора VIII. Для пациентов с высокими титрами ингибиторов терапия фактором VIII может быть неэффективной, поэтому нужно рассмотреть другие терапевтические варианты, такие как индукция иммунной толерантности (ITI). Лечение таких пациентов должны проводить врачи с опытом лечения гемофилии и случаев образования ингибиторов фактора VIII.
Сердечно-сосудистые осложнения
У пациентов с существующими факторами риска сердечно-сосудистых заболеваний заместительная терапия FVIII может увеличить риск сердечно-сосудистых заболеваний.
Осложнения, связанные с применением катетера
В случае необходимости использования устройства для центрального венозного доступа (CVAD) следует рассмотреть риск развития осложнений, связанных с его использованием, в том числе местных инфекций, бактериемии и тромбоза на участке с катетером.
Настоятельно рекомендуется, чтобы при каждом введении лекарственного средства Нувик записывать название и номер партии (серии) лекарственного средства для определения связи между состоянием пациента и партией введенного препарата.
Все предостережения касаются как взрослых, так и детей.
Информация о вспомогательных веществ (содержание натрия)
1 мл разбавленного раствора содержит 7,35 мг (18,4 мг натрия на флакон).
Однако, в зависимости от массы тела и дозирования, пациент может получать более одного флакон. Данную информацию следует учитывать пациентам, которые придерживаются диеты с контролируемым содержанием натрия.
Применение в период беременности или кормления грудью
Исследование влияния лекарственного средства Нувик на репродуктивную функцию животных не проводились. Поскольку гемофилия А редко возникает у женщин, опыт применения фактора VIII в период беременности и кормления грудью отсутствует. Поэтому Нувик можно назначать во время беременности и кормления грудью по показаниям в случае необходимости. Данных о влиянии на фертильность нет.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Не выявлено никакого влияния на способность управлять автотранспортом и работать с механизмами.
Способ применения Нувик и дозы
Терапию следует проводить под наблюдением врача, имеющего опыт в лечении гемофилии.
мониторинг лечения
Во время курса лечения, рекомендуется соответствующее определение уровней фактора VIII, чтобы контролировать дозу, необходимую для введения и частоту повторных инъекций. Отдельные пациенты могут иметь разную ответ на применение фактора VIII, демонстрируя различные периоды полувыведения из организма и выздоровления (восстановления). Доза в зависимости от массы тела пациента может потребовать подбора (корректировка) при недостаточной или избыточной массы тела. В случае обширного хирургического вмешательства точный мониторинг заместительной терапии с помощью анализа на свертываемость крови (активность фактора VIII в плазме крови) является обязательным.
При использовании одностадийного анализа коагулирующей активности крови на основе тромбопластинового времени (aPTT) in vitro для определения активности фактора VIII в образцах крови пациентов на результаты активности фактора VIII в плазме крови могут существенно влиять как тип aPTT реагента, так и стандартный образец, используемых в анализе . Также могут наблюдаться значительные расхождения между результатами анализа, полученного с помощью одно- стадийного анализа коагулирующей активности крови на основе aPTT, и хромогенного анализа в соответствии с Европейской фармакопеи. Это очень важно, особенно при изменении лаборатории и / или реагентов, используемых в анализе.
способ применения
Дозировка и длительность заместительной терапии зависят от тяжести дефицита фактора VIII, местонахождение и степени кровотечения, а также от клинического состояния пациента.
Количество единиц фактора VIII, вводимого определяется в международных единицах (МЕ), что связано с действующим стандартом концентрата ВОЗ для лекарственных средств фактора VIII. Активность фактора VIII в плазме определяется или в процентах (относительно нормальной плазмы) или преимущественно в международных единицах (в соответствии с Международным стандартом для фактора VIII в плазме).
1 международная единица (МО) активности фактора VIII эквивалентна количеству фактора VIII в 1 мл нормальной плазмы.
Лечение в случае необходимости
Расчеты необходимой дозы фактора VIII базируются на эмпирических данных о том, что 1 международная единица (МО) фактора VIII на 1 кг массы тела увеличивает активность фактора VIII в плазме крови примерно на 2% от нормальной активности или на 2 МЕ / дл. Необходимая доза определяется с помощью следующей формулы:
И.
Необходимые единицы = масса тела (кг) × желаемый рост фактора VIII (%) (МЕ / дл) × 0.5 (МЕ / кг МЕ / дл)
ИИ.
Ожидаемый рост фактора VIII (% от нормального) = | 2 × ведомые МО |
массы тела (кг) |
II.
Доза, которую нужно вводить, и частота введения всегда должны быть ориентированы на клиническую эффективность в каждом отдельном случае.
В случае нижеуказанных геморрагических ситуаций активность фактора VIII не должна опускаться ниже данного уровня активности плазмы (в% от нормального или МЕ / дл) в соответствующий период. Таблицу 5 можно использовать для определения дозировки в периоды кровотечений и операций.
Таблица 5
Степень кровотечения / тип хирургической процедуры | необходимый уровень фактора VIII (%) (МЕ / дл) | Частота дозирования (часы) / продолжительность терапии (дни) |
кровотечение Ранний гемартроз, мышечная или оральная кровотечение | 20—40 | Повторяйте каждые 12 - 24 часа не менее 1 день пока кровотечение, сопровождающееся болью, не будет остановлена или к полному излечению |
Более экстенсивный гемартроз, мышечная кровотечение или гематома | 30—60 | Повторяйте каждые 12 - 24 часа в течение 3 - 4 дней или больше пока боль и острые нарушения не пройдут |
Жизненно опасна кровотечение | 60—100 | Повторяйте инъекции каждые 8 - 24 часов пока угроза не исчезнет |
операция Небольшая операция, включая удаление зубов Большая операция | 30—60 | Каждые 24 часа не менее 1 день до полного излечение |
80—100 (До и после хирургического вмешательства) | Повторяйте инъекции каждые 8 - 24 часов к существенному затягиванию раны, после терапия на менее 7 дней, чтобы поднять активность фактора VIII с 30% до 60% (МЕ / дл) |
профилактика
Для длительной профилактики кровотечения у пациентов с тяжелой формой гемофилии А обычно дозировка составляет от 20 до 40 МЕ фактора VIII на 1 кг массы тела каждые 2 - 3 дня. В некоторых случаях, особенно у пациентов молодого возраста, может возникнуть необходимость в увеличении дозы или частоты введения препарата.
Рекомендуется в течение курса лечения определять уровни фактора VIII для корректировки дозы и частоты повторных инъекций. В случае большой хирургической операции, в частности, необходим точный контроль заместительной терапии с помощью определения активности фактора VIII в плазме. В зависимости от фактора VIII отдельные пациенты могут демонстрировать различные периоды полувыведения и восстановления. Режим дозирования можно корректировать на основании отзыва пациента.
Способ применения одинаков как для взрослых, так и для детей и подростков, однако для детей и подростков, могут быть необходимы меньшие интервалы между применением или большие дозы. Нет данных по применению детям до 2 лет.
ввод
Препарат Нувик предназначен для внутривенного применения.
Рекомендуется вводить не более 4 мл в минуту.
Инструкции по восстановлению лекарственного средства перед введением.
Порошок нужно разводить только растворителем, который прилагается (2,5 мл воды для инъекций), с использованием набора для приготовления раствора для инъекций. Флакон нужно осторожно взбалтывать до полного растворения порошка. После разведения раствор нужно набрать в шприц, содержащий растворитель.
Приготовленный раствор нужно проверять визуально на наличие твердых частиц и признаков изменения цвета перед введением. Разбавленный раствор должен быть прозрачным и бесцветным, без посторонних частиц и иметь pH от 6,5 до 7,5. Не разрешается использование непрозрачных растворов или растворов с наличием осадка.
Инструкции по подготовке и введения препарата.
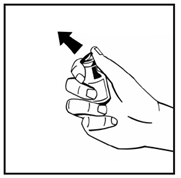
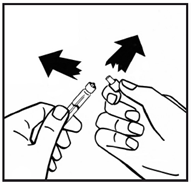
1. Докажите растворитель (вода для инъекций) в предварительно заполненном шприце и порошок в закрытом флаконе до комнатной температуры. Вы можете это сделать, держа их в своих руках, пока они не наберут такой же температуры, как ваши руки. Не используйте никаких других методов подогрева флакона и предварительно заполненного шприца. Эта температура должна быть при открытии флакона. 2. Снимите пластиковую верхнюю крышку с флакона с порошком, чтобы открыть центральную часть резиновой пробки. Не удаляйте серую пробку или металлическое кольцо вокруг верхней части флакона (рис.1). |
Рис 1 |
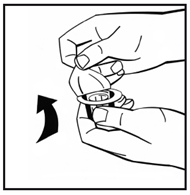
3. Протрите верхнюю часть флакона спиртовым тампоном. Дайте спирта высохнуть. 4. Снимите бумажную крышку с адаптера флакона (рис.2). Не извлекайте адаптер из упаковки. |
Рис. 2 |
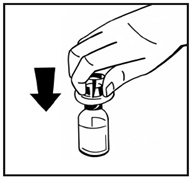
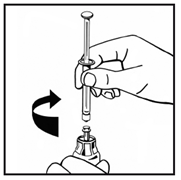
5. Поставьте флакон с порошком на ровную поверхность и удерживайте его. Возьмите упаковку с адаптером и поместите адаптер по центру резиновой пробки флакона с порошком. Придавите вниз на блок адаптера до тех пор, пока шип адаптера на проникнет в резиновую пробку (рис.3). Адаптер автоматически закроется, когда вы закончите надавливать. |
Рис. 3 |
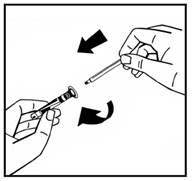
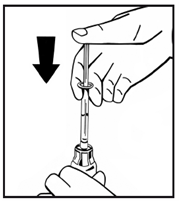
6. Снимите бумажную крышку с предварительно заполненного шприца. Удерживайте шток поршня на конце и не прикасайтесь стержня. Прикрепите резьбовой конец штока поршня к штока шприца с растворителем. Поворачивайте шток шприца с растворителем по часовой стрелке, пока не почувствуете небольшое сопротивление (рис.4). |
Рис. 4 |
7. Отделите защитный пластмассовый наконечник от шприца с растворителем, нажимая на перфорацию на колпачке (рис.5). Не дотрагивайтесь до внутренней части колпачка или наконечника шприца. Если раствор не используется, немедленно закройте заполнен шприц пластмассовым наконечником для хранения с защитой от несанкционированного доступа. |
Рис.5 |
8. Снимите упаковку адаптера и выбросьте ее. 9. Плотно соедините шприц с растворителем и адаптер флакона, поворачивая их по часовой стрелке пока не почувствуете незначительное сопротивление (рис.6). |
Рис.6 |
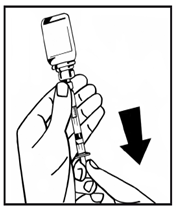
10. Медленно вливайте растворитель во флакон с порошком путем нажатия на плунжерный стержень (рис.7). |
Рис.7 |
11. Не вынимая шприца, осторожно перемешайте или взболтайте содержимое флакона несколько раз, чтобы растворить порошок. Не трясет флакон. Подождите, пока весь порошок не растворится. 12. Визуально осмотрите конечный раствор перед введением. Раствор должен быть прозрачным и бесцветным, практически без видимых частиц. Не используйте мутные растворы или растворы, содержащие видимые частицы. 13. Верните флакон, прикрепленный к шприцу, вверх дном и медленно введите конечный раствор в шприц (рис.8). Убедитесь, что все содержимое флакона набрано в шприц. |
Рис.8 |
14. Отключите заполнен шприц от адаптера флакона, поворачивая его против часовой стрелки, и выбросьте пустой флакон. 15. Раствор теперь готов к немедленному использованию. Не замораживает его. 16. Протрите место инъекции спиртовым тампоном. 17. Прикрепите набор для инъекций до шприца. Введите иглу инъекционного набора в выбранную вену. Если вы использовали жгут для облегчения обнаружения вен, этот жгут нужно снять до того, как вы начнете вводить раствор. Из-за риска формирования фибриновых сгустков кровь не должна попадать в шприц. 18. Вводите раствор в вену медленно, не более 4 мл в минуту. | |
Если используется более чем один флакон с порошком для одной процедуры, то можно использовать ту же инъекционную иглу снова. Адаптер флакона и шприц предназначены только для одноразового использования.
Неиспользованный препарат и отходы должны быть утилизированы в соответствии с местными требованиями.
Дети
Нувик можно применять детям любого возраста, но нет данных по применению детям до 2 лет.
Передозировка
Не сообщалось о случаях передозировки.
Побочные эффекты
Резюме профиля безопасности
Гиперчувствительность и аллергические реакции (которые могут включать ангионевротический отек, жжение и покалывание в месте инфузии, озноб, гиперемия, генерализованной крапивницы, головная боль, крапивница, артериальная гипотензия, сонливость, тошноту, сыпь, возбуждение, тахикардия, затрудненное дыхание, покалывание, крапивница, а также генерализованной крапивницы, рвота, хрип / сопение) редко наблюдаются после препаратов фактора FVIII, но могут в некоторых случаях прогрессировать до тяжелой анафилаксии (включая шок).
У пациентов с гемофилией А, которые лечатся препаратом фактора VIII, а также препаратом Нувик, могут развиваться нейтрализующие антитела (ингибиторы) к фактору VIII. В случае выявления ингибиторов, причиной их возникновения считается недостаточная клиническая соответствие в форме продолжающихся кровотечений или частых кровотечений, происходят, несмотря на соответствующую профилактику. В таких случаях рекомендуется связаться с специализированным центром гемофилии.
Список побочных реакций в таблицах
В течение клинических исследований лекарственного средства Нувик применяли для лечения детей (в возрасте от 2 до 11 лет, n = 129), подростков (от 12 до 17 лет, n = 3) и взрослых (n = 129) в которых была тяжелая стадия гемофилии А. при этом сообщалось о 12 побочных реакций (8 у взрослых, 4 у детей) у 8 пациентов 4 взрослых, 4 детей).
Частота оценивалась в соответствии со следующими критериев: очень часто (≥1 / 10); часто (≥1 / 100 до <1/10); нечасто (≥1 / 1000 до <1/100); редко (≥1 / 10000 до <1/1000); очень редко (<1/10000), неизвестно (не может быть оценено по имеющимся данным).
В каждой группе частот побочные реакции представлены в порядке убывания их степени тяжести.
Таблица 6.
Частота возникновения побочных реакций на препарат в клинических исследования с участием 135 пациентов с тяжелой гемофилией А.
Классы систем органов | побочные реакции | Частота* |
Со стороны крови и лимфатической системы | геморрагическая анемия Ингибирование фактора VIII | нечасто* нечасто (PTPs / пациенты, которые ранее получали лечение) # очень часто (PUPs / пациенты, которые не получали ранее лечения) # |
Со стороны иммунной системы | повышенная чувствительность | часто* |
Со стороны нервной системы | Парестезия Головная боль головокружение | нечасто* нечасто* нечасто* |
Со стороны органов слуха и лабиринта | головокружение | нечасто* |
Со стороны желудочно-кишечного тракта | Сухость во рту | нечасто* |
Со стороны костно-мышечной системы и соединительных тканей | Боль в спине | нечасто* |
Нарушения в месте инъекции | Воспаление в месте инъекции Боль в месте инъекции Дискомфорт (Плохое самочувствие) | часто* нечасто* нечасто* нечасто* |
лабораторные исследования | Положительные антитела к антигену фактора VIII, не имеет нейтрализующей активности (в PTPs) | нечасто* |
Со стороны дыхательной системы, органов грудной клетки и средостения | Затрудненное дыхание (одышка) | нечасто* |
* Подсчитано как количество пациентов с побочными реакциями на общее количество 280 исследуемых пациентов, из которых 190 пациентов, ранее получавших лечение ( PTPs ) и 90 пациентов, не получавших ранее лечение ( PUPs ).
# Частота базируется на исследованиях со всеми препаратами фактора VIII, которые включали пациентов с тяжелой гемофилией А.
PTPs = пациенты, которые ранее получали лечение, PUPs = пациенты, которые не получали ранее лечения.
Описание отдельных побочных реакций
Антитела к антигенам фактора VIII, не имеют нейтрализующей активности, было обнаружено у одного взрослого пациента (см. Таблицу 6) . Результат был положительным только при растворе фактора 1, а титр антител был очень низким. Активность ингибиторов, которую измеряли модифицированным тестом Бетезда, не была выявлена у этого пациента. Клиническая эффективность и in vivo восстановления лекарственного средства Нувик не повлияли на состояние этого пациента.
дети
Частота, тип и тяжесть побочных реакций у детей предусматриваются такие же, как и у взрослых.
Информирование о потенциальных побочных реакциях
Информирование о потенциальных побочных реакциях после регистрации медицинского препарата важно. Это позволяет продолжить мониторинг баланса польза / риск лекарственного средства. Специалисты здравоохранения должны докладывать о потенциальных побочных реакциях.
Срок годности Нувик
Порошок: 2 года.
Растворитель (вода для инъекций): 4 года.
В течение всего срока годности, возможно хранение лекарственного средства не более 1 месяца при комнатной температуре (до 25 ° C). Если лекарственное средство уже взято из холодильника, то его нельзя больше туда помещать.
Необходимо указывать дату начала срока хранения при комнатной температуре на упаковке лекарственного средства.
После приготовления раствора для инъекций химическая и физическая стабильность была продемонстрирована в течение 24 часов при хранении при комнатной температуре.
С точки зрения микробиологии, лекарственное средство необходимо использовать сразу после приготовления. Если его не использовали сразу, то пользователь лекарственного средства несет персональную ответственность за срок годности и условия применения лекарственного средства.
Условия хранения Нувик
Порошок
Хранить при температуре от 2 до 8 ° С. Не замораживать.
Хранить в картонной коробке для защиты от света.
Растворитель (вода для инъекций)
Хранить при температуре от 2 до 8 ° С.
Приготовленный раствор хранить при комнатной температуре.
Приготовленный раствор не замораживать.
Хранить в недоступном для детей месте.
Несовместимость.
Из-за отсутствия исследований совместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Нужно использовать только представлены инъекционные наборы, поскольку лечение может быть неудачным в результате адсорбции фактора свертывания крови VIII на внутренних поверхностях некоторых инъекционных устройств.
Упаковка
По 250 МЕ, 500 МЕ, 1000 МЕ или 2000 МЕ порошка во флаконе; 1 флакон с порошком, 1 предварительно заполненный шприц с растворителем по 2,5 мл (вода для инъекций) вместе с комплектом для растворения и введения (1 адаптер для открытия флакона, 1 игла-бабочка, 2 пропитанные спиртом тампоны) в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Octapharma AB.
Местонахождение производителя
Ларс Форсселлс гата 23, Стокгольм, 11275, Швеция.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Нувик только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Октафарма АБ
| Тип данных | Сведения из реестра |
| Торговое наименование: | Нувик |
| Производитель: | Октафарма АБ |
| Форма выпуска: | порошок и растворитель для приготовления раствора для инъекций, 250 МЕ или 500 МЕ, 1000 МЕ или 2000 МЕ во флаконе; 1 флакон с порошком, 1 предварительно заполненный шприц с растворителем по 2,5 мл (вода для инъекций) вместе с комплектом для растворения и введения (1 адаптер для открытия флакона 1 игла-бабочка, 2 пропитанные спиртом тампоны) в картонной коробке |
| Регистрационное удостоверение: | UA/17140/01/01, UA/17140/01/02, UA/17140/01/03, UA/17140/01/04 |
| Дата начала: | 02.01.2019 |
| Дата окончания: | 01.02.2024 |
| МНН: | Coagulation factor VIII |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон порошка для приготовления раствора для инъекций содержит симоктокогу альфа (рекомбинантный фактор свертывания крови VIII) 250 МЕ или 500 МЕ, 1000 МЕ или 2000 МЕ |
| Фармакологическая группа: | Антигеморрагические средства. Фактор свертывания крови VIII. |
| Код АТХ: | B02BD02 |
| Заявитель: | Октафарма Фармацевтика Продуктионсгес м.б.Х. |
| Страна заявителя: | Австрия |
| Адрес заявителя: | Оберлааер Штрассе 235, 1100 Вена, Австрия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| B | Средства, влияющие на систему крови и гемопоэз |
| B02 | Антигеморрагические средства |
| B02B | Витамин k и другие гемостатические средства |
| B02BD | Факторы свертывания крови |
| B02BD02 |
Фактор свертывания крови viii
|