- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Огиври инструкция по применению
Официальная инструкция лекарственного препарата Огиври порошок 150 мг, 420 мг. Описание и применение Ogivri, аналоги и отзывы. Инструкция Огиври порошок утвержденная компанией производителем.
Состав
действующее вещество: trastuzumab; 1 однократной флакон трастузумаба 150 мг
вспомогательные вещества: сорбит (D-сорбит), L-гистидин, L-гистидина гидрохлорида моногидрат, макрогол 3350 / полиэтиленгликоли 3350, натрия гидроксид, кислота соляная концентрированная.
1 многодозовых флакон трастузумаба 420 мг
вспомогательные вещества: сорбит (D-сорбит), L-гистидина гидрохлорида моногидрат, L-гистидин, макрогол 3350 / полиэтиленгликоли 3350, натрия гидроксид, кислота соляная концентрированная.
растворитель 1 флакон содержит бактериостатическое воду для инъекций 20 мл (спирт бензиловый вода для инъекций).
Лекарственная форма
Лиофилизированный порошок для внутривенной инфузии.
Основные физиио-химические свойства: от белого до светло-желтого цвета в неизмененном виде или в основном в неизмененном виде масса.
Фармакологическая группа
Другие антинеопластические средства. Моноклональные антитела.
Код ATH L01XC03.
Фармакологические свойства
Фармакологические.
Трастузумаб - рекомбинантное гуманизированное моноклональное антитело, класса IgGi к рецепторам 2 эпидермального фактора роста человека (HER2) Механизм действия Протоонкоген HER2 (или с-егЬВ2) кодирует трансмембранный белок рецептора с молекулярной массой 185 кДа. структурно подобен рецептора эпидермального фактора роста. В опытах in vitro и исследованиях на животных показано, что препараты трастузумаба подавляют пролиферацию опухолевых клеток человека с гиперэкспрессией HER2. Препараты трастузумаба являются медиаторами антителозависимую клеточно-опосредованной цитотоксичиости (ADCC). В опытах in vitro было показано, что опосредованная трастузумабом ADCC влияет преимущественно на раковые клетки с гиперэкспрессией HER2 сравнению с раковыми клетками без экспрессии HER2.
Электрофизиология сердца Влияние трастузумаба на результаты электрокардиографии (ЭКГ), включая продолжительность интервала QTc, оценивали с участием пациентов с HER2-положительными солидными опухолями. Не было выявлено клинически значимого влияния трастузумаба на продолжительность интервала QTc и явного взаимосвязи между концентрациями трастузумаба в сыворотке крови и изменением продолжительности интервала QT, скорректированного по формуле Федериция (QTcF), у пациентов с HER2-положительными солидными опухолями. Фармакокинетика. Фармакокинетику трастузумаба оценивали в ходе популяционного анализа модели фармакокинетики (ФК) с использованием обобщенных данных 1582 пациентов с первичным раком молочной железы и метастатическим раком желудка (МСД), которые получали трастузумаб в.
Несмотря на то. что средняя экспозиция трастузумаба после первого цикла лечения была больше у пациентов с раком молочной железы, получавших препарат в трехнедельном режиме по сравнению с еженедельным режимом введения трастузумаба, средняя экспозиция в равновесном состоянии была фактически одинаковой при применении обоих режимов. Средняя экспозиция трастузумаба после первого цикла лечения и в равновесном состоянии, а также время до достижения равновесного состояния были большими у пациентов с раком молочной железы по сравнению с пациентами с МСД при одинаковом режиме ввода; однако причина этой разницы экспозиции неизвестна. Дополнительная прогнозируемая экспозиция трастузумаба и фармакокинетические параметры после первого цикла трастузумаба и в равновесном состоянии представлены в таблицах 1 и 2 соответственно.
Популяционный анализ ФК-моделей свидетельствует, что после отмены трастузумаба концентрации в крови по крайней мере 95% пациентов с раком молочной железы и МСД в течение 7 месяцев уменьшается примерно до 3% от прогнозируемой в популяции минимальной концентрации в сыворотке крови в равновесном состоянии (примерно 97% вымывания ).
Таблица 1 Прогнозируемые в популяции значение ФК экспозиции в цикле 1 (медиана от 5-го до 95-го перцентиля) у пациентов с раком молочной железы и МСД
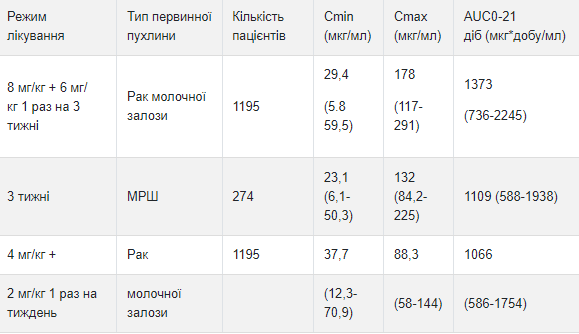
Таблица 2 Прогнозируемые в популяции значение ФК экспозиции в равновесном состоянии
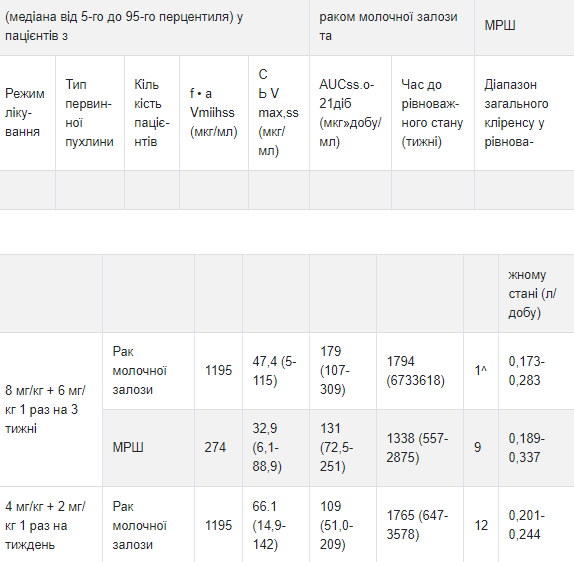
а Минимальная концентрация трастузумаба в сыворотке крови в равновесном состоянии.
Максимальная концентрация трастузумаба в сыворотке крови в равновесном состоянии. Особые группы пациентов: по результатам популяционного анализа фармакокинетики, отсутствуют клинически значимые различия фармакокинетики трастузумаба в зависимости от возраста (<65 лет (n = 1294) 65 лет (n = 288)), расы (азиатского происхождения (п = 264) неазиатского происхождения (п = 1324)) и нарушение функции почек (легкое (клиренс креатинина [CLcr] 60-90 мл / мин) (n = 636) или умеренное (CLcr 30-60 мл / мин) (n = 133)). Фармакокинетика препаратов трастузумаба у пациентов с тяжелым нарушением функции почек, с терминальной стадией поражения почек (включая применение гемодиализа) или с нарушением функции печени не исследована. Исследование взаимодействия лекарственных средств: исследований по взаимодействию препаратов трастузумаба с участием человека не проводилось.
В клинических исследованиях не наблюдалось клинически значимых взаимодействий между трастузумабом и другими лекарственными средствами, применяемыми одновременно. Паклитаксел и доксорубицин: концентрации паклитаксела и доксорубицина и их основных метаболитов (то есть ба-гидроксипаклитаксела [РОН] и доксорубицинола [DOL] соответственно) не менялись при наличии трастузумаба при применении комбинированно "! терапии в рамках клинических исследований. Концентрации трастузумаба как компонента этой комбинированной терапии не менялись. Доцетаксел и карбоплатин: при введении трастузумаба в комбинации с доцетакселом или карбоплатином не менялись ни концентрации в плазме крови доцетаксела или карбоплатина, ни концентрации в плазме крови трастузумаба. Цисплатин и капецитабин: в дополнительном исследовании по взаимодействий, проведенном в рамках исследования 7,
Клинические характеристики
Огиври Показания
Терапия рака молочной железы
Препарат Огиври показан для адъювантной терапии рака молочной железы с гиперэкспрессией HER2, положительным или отрицательным статусом лимфатических узлов (отрицательным статусом эстрогенных / прогестероновых рецепторов [ЕР / ПР] или с одним признаком высокого риска: • как компонент схемы лечения, содержащий доксорубицин, циклофосфамид в сочетании с паклитакселом или доцетакселом; • как компонент схемы лечения с доцетакселом и карбоплатином; • в качестве монотерапии после мультимодальных! »терапии на основе антрациклина. Метастатический рак молочной железы Препарат Огиври показан: с • в комбинации с паклитакселом для первой линии терапии метастатического рака молочной железы с гиперэкспрессией HER2; • в качестве монотерапии для лечения больных раком молочной железы с гиперэкспрессией HER2, которые получили один или более режимов химиотерапии по поводу метастатического заболевания.
Метастатическим раком желудка
Препарат Огиври показан в комбинации с цисплатином и капецнтабином или 5 фторурацилом для лечения пациентов с раком желудка с гиперэкспрессией HER2 или аденокарциномой гастроэзофагеального соединения, которые не получали ранее лечения метастатического заболевания.
Противопоказания
Гиперчувствительность к трастузумаба или любых других компонентов препарата или растворителя.
Особые меры безопасности.
Предостережение: кардиомиопатия, инфузионные реакции, эмбрио- фетальная токсичность и легочная токсичность кардиомиопатия. Применение препаратов трастузумаба может привести к субклинической и клинической сердечной недостаточности. Частота и тяжесть были самыми высокими у пациентов, получавших трастузумаб со схемами химиотерапии, содержащие антрациклин. Рекомендуется оценить функцию левого желудочка сердца у всех пациентов до и во время лечения Огиври.
Прервать лечение препаратом Огиври пациентов, получающих адъювантной терапии, и отменить применение препарата Огиври пациентам с метастазами в случае клинически значимого снижения функции левого желудочка сердца (см. Раздел «Способ применения и дозы»), Инфузионные реакции; легочная токсичность, Введение препаратов трастузумаба может привести к серьезным и летальных инфузионных реакций и легочной токсичности.
Обычно симптомы возникают во время или в течение 24 часов после введения. Инфузию препарата Огиври в случае одышки или клинически значимой артериальной гипотензии ". Наблюдать за пациентами до окончательного исчезновения симптомов. Прекратить применение препарата Огиври в случае анафилаксии ", ангионевротического отека, интерстициального пневмонита или острого респираторного дисирее-еиндрому (см. Раздел« Особенности применения »).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исходя из результатов популяционного анализа фармакокинетики (ФК), пациенты, получающие антрациклин после отмены препаратов трастузумаба, могут иметь повышенный риск сердечной дисфункции через длительный период вымывания трастузумаба. Рекомендуется избегать назначения терапии на основе антрациклина в течение 7 месяцев после отмены траетузумабу "В случае применения антрациклина следует тщательно контролировать у пациента функцию сердца.
Особенности применения
кардиомиопатия
Препараты трастузумаба могут вызвать дисфункцию левого желудочка сердца, аритмии, артериальная гипертензия, сердечная недостаточность, кардиомиопатия и внезапную остановку сердца. Также препараты трастузумаба могут вызвать бессимптомное снижение фракции выброса левого желудочка (ФВЛЖ). Частота сердечных нарушений больше в 4-6 раз среди пациентов, получавших препараты трастузумаба в качестве монотерапии или в комбинированной терапии по сравнению с теми, кто не получал препараты трастузумаба. Самая высокая абсолютная частота наблюдалась при применении препаратов трастузумаба с антрациклинами. Рекомендуется отменить препарат Огиври в случае снижения фракции выброса левого желудочка на> 16% от значений, наблюдавшихся до лечения, или при снижении фракции выброса левого желудочка ниже установленного предела нормы и абсолютном снижении фракции выброса левого желудочка на> 10 0% от значений,
Безопасность обновления или продления лечения препарата Огиври пациентам с дисфункцией левого желудочка сердца, вызванной трастузумабом, не исследовались. Пациенты, получающие антрациклины после прекращения лечения Огиври, имеют повышенный риск сердечной дисфункции (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Мониторинг сердечной функции ". Рекомендуется проводить тщательную оценку функции сердца, включая сбор анамнеза, физикальное обследование и определение фракции выброса левого желудочка с помощью эхокардиографии или радиоизотопной вентрикулографии (MUGA). Рекомендуется следующая схема контроля: • определение исходной фракции выброса левого желудочка непосредственно перед началом применения препарата Огиври; • определение фракции выброса левого желудочка каждые 3 месяца во время и после завершения применения препарата Огиври; • контроль фракции выброса левого желудочка с 4-недельными интервалами, если применение препарата Огиври прекращено из-за значительной дисфункции левого желудочка сердца (см. Раздел «Способ применения и дозы»). • определение фракции выброса левого желудочка каждые 6 месяцев в течение не менее 2 лет после завершения применения препарата Огиври как компонента адъювантной терапии ". Инфузионные реакции инфузионные реакции состоят из симптомокомплекса,
В период послерегистрационного применения сообщалось о серьезных и летальных инфузионные реакции. Тяжелые реакции, которые включали бропхоспазм, анафилаксии, ангионевротический отек, гипоксию и тяжелую гипотензию, обычно регистрировать во время или непосредственно после первой инфузии. Однако начало и клиническое течение были вариабельными, включая прогрессирующее ухудшение, первоначальное улучшение с последующим клиническим ухудшением или отсроченные писляинфузийни реакции с быстрым клиническим ухудшением. Если у пациента наблюдается одышка, клинически значимая артериальная гипотензия, следует прервать инфузию препарата Огиври и назначить медикаментозную терапию (например, эпинефрин, ГКС, дифенгидрамин, бронхолитики и кислород).
Пациентов следует наблюдать до полного исчезновения признаков и симптомов. С целью снижения риска возникновения инфузионных реакций можно применять премедикацию антигистаминными препаратами и / или кортикостероидами. Эмбрио- фетальная токсичность По данным послерегистрационных исследований при применении трастузумаба во время беременности сообщено о риске развития олигогидрамнион и его последствий, что проявлялось как гипоплазия легких плода, аномалии скелета и смерть новорожденных. Женщинам репродуктивного возраста следует исключить наличие беременности перед началом применения препарата Огиври. Следует предупредить беременных и жьинок репродуктивного возраста, влияние препарата Огиври во время беременности или в течение 7 месяцев до зачатия может нанести ущерб для развития плода.
Женщинам репродуктивного возраста следует применять эффективные методы контрацепции во время лечения и в течение 7 месяцев после последнего введения препарата Огиври. Легочная токсичность Применение препарата трастузумаба может вызвать серьезную и летальную легочной токсичности ,. Проявления легочной токсичности включают одышку, интерстициальный пневмонит, легочные инфильтраты, экссудат в плевральную полость, некардиогенный отек легких, дыхательную недостаточность и гипоксию, острый респираторный диетрес-синдром и фиброз легких. Такие осложнения могут возникнуть как следствие инфузионных реакций пациентов с врожденными заболеваниями легких или метастазами в легких, сопровождающихся одышкой в покое, имеют более тяжелые проявления токсичности. Усиление нейтропении. индуцированной химиотерапией
В рандомизированных контролируемых клинических исследованиях частота нейтропении и фебрильной нейтропении 3-4 степени была выше у пациентов, получавших трастузумаб в комбинации с миелосупрессивной химиотерапией по сравнению с теми, кто получал только химиотерапию, Частота смерти от сепсиса была подобной между группами: пациенты которой получали трастузумаб, и группой, где применяли его {см. раздел «Побочные реакции»). Содержание сорбита Лекарственное средство Огиври 150 мг содержит 115.2 мг сорбита в каждом флаконе. Лекарственное средство Огиври 420 мг содержит 332,6 мг сорбита в каждом флаконе. Пациенты с установленной непереносимостью некоторых сахаров, в частности фруктозы, должны проконсультироваться с врачом, прежде чем принимать этот препарат.
Применение в период беременности или кормления грудью
Беременность.
При применении беременной женщине препараты! трастузумаба могут нанести ущерб плода. По сообщениям в послерегистрационный период, применение трастузумаба во время беременности приводило к случаям олигогидрамнион и его последствий, которые проявлялись как гипоплазия легких, аномалии скелета и смерть новорожденного. Следует проинформировать женщину, которая забеременела, о потенциальных рисков для плода. Если беременная получает терапию Огиври или если пациентка забеременела во время лечения Огиври или в течение 7 месяцев после применения последней дозы препарата, следует проводить тщательное обследование плода в соответствии с гестационного возраста и согласно стандартам медицинской помощи.
Кормления грудью.
Отсутствует информация о проникновении трастузумаба в грудное молоко, влияния на младенца, которое кормят грудью, или влияния на образование молока. Известно, что IgG человека секретируется в грудное молоко, но не поступает в кровоток новорожденного и ребенка в значительных количествах. В исследовании на животных трастузумаб был обнаружен в молоке лактирующих яванских макак в концентрации, составляющей примерно 0,3% от концентрации в сыворотке крови матери после введения в дозе 25 мг / кг (что в 25 раз превышает рекомендуемую дозу трастузумаба для человека - 2 мг / кг), но не ассоциировался с токсическим воздействием на новорожденных обезьян. Рекомендуется прекратить кормление грудью во время лечения Огиври с учетом периода выведения препарата 7 месяцев после завершения терапии.
Фертильность.
Женщинам репродуктивного возраста следует исключить наличие беременности перед началом применения препарата Огиври. Контрацепция Женщинам репродуктивного возраста следует применять эффективные методы контрацепции во время лечения и в течение 7 месяцев после последнего введения препарата Огиври.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Неизвестно, влияет трастузумаб на способность управлять автотранспортом или работать с механизмами. Пациентам, у которых развились инфузионные реакции, следует посоветовать не садиться за руль и не работать с механизмами, пока симптомы окончательно не пройдут.
Способ применения Огиври и дозы
Лечение препаратом Огиври проводить под наблюдением врача с опытом лечения онкологических больных. Определение опухолевой экспрессии HER2 до начала лечения Огиври является обязательным. Не вводить внутривенно струйно или болюсно. Не смешивать препарат Огиври с другими препаратами. Не заменять препарат Огиври (трастузумаб) на а к-трастузумаб емтанзин.
Ад "ювантна терапия рака молочной железы Вводить в соответствии доз и схем указанных ниже в течение 52 недель: Во время и после применения паклитаксела, доцетаксела или доцетаксела и карбоплатина: • начальная доза 4 мг / кг в виде инфузии в течение 90 минут, затем 2 мг / кг в виде инфузии в течение ЗО минут еженедельно во время химиотерапии в течение первых 12 недель (паклитаксел или доцетаксел) или 18 недель (доцетаксел и карбоплатин) • через неделю после последнего еженедельного введения препарата Огиври вводить в дозе 6 мг / кг в виде инфузии в течение 30-90 минут каждые С недели. В качестве монотерапии в течение 3 недель после мультимодальных схем химиотерапии на основе антрациклина: • начальная доза 8 мг / кг в виде инфузии в течение 90 минут • последующие введения в дозе 6 мг / кг в виде инфузии в течение 3090 минут каждые 3 недели; • не рекомендуется продолжать адъювантной терапии более одного года. Лечение метастатического пачку молочной железы • Применять препарат Огиври отдельно или в комбинации с паклитакселом в начальной дозе 4 мг / кг в виде 90-минутной инфузии 'с последующим введением один раз в неделю 2 мг / кг в виде 30-минутной инфузии к прогрессированию заболевания. Лечение метастатического рака желудка • Применять препарат Огиври в начальной дозе 8 мг / кг в виде 90-минутной инфузии с последующим введением в дозе 6 мг / кг в виде инфузии в течение 30-90 минут кожьни 3 недели до прогрессирования заболевания. • не рекомендуется продолжать адъювантной терапии более одного года. Лечение метастатического пачку молочной железы • Применять препарат Огиври отдельно или в комбинации с паклитакселом в начальной дозе 4 мг / кг в виде 90-минутной инфузии 'с последующим введением один раз в неделю 2 мг / кг в виде 30-минутной инфузии к прогрессированию заболевания. Лечение метастатического рака желудка • Применять препарат Огиври в начальной дозе 8 мг / кг в виде 90-минутной инфузии с последующим введением в дозе 6 мг / кг в виде инфузии в течение 30-90 минут кожьни 3 недели до прогрессирования заболевания. • не рекомендуется продолжать адъювантной терапии более одного года. Лечение метастатического пачку молочной железы • Применять препарат Огиври отдельно или в комбинации с паклитакселом в начальной дозе 4 мг / кг в виде 90-минутной инфузии 'с последующим введением один раз в неделю 2 мг / кг в виде 30-минутной инфузии к прогрессированию заболевания. Лечение метастатического рака желудка • Применять препарат Огиври в начальной дозе 8 мг / кг в виде 90-минутной инфузии с последующим введением в дозе 6 мг / кг в виде инфузии в течение 30-90 минут кожьни 3 недели до прогрессирования заболевания. Лечение метастатического пачку молочной железы • Применять препарат Огиври отдельно или в комбинации с паклитакселом в начальной дозе 4 мг / кг в виде 90-минутной инфузии 'с последующим введением один раз в неделю 2 мг / кг в виде 30-минутной инфузии к прогрессированию заболевания. Лечение метастатического рака желудка • Применять препарат Огиври в начальной дозе 8 мг / кг в виде 90-минутной инфузии с последующим введением в дозе 6 мг / кг в виде инфузии в течение 30-90 минут кожьни 3 недели до прогрессирования заболевания. Лечение метастатического пачку молочной железы • Применять препарат Огиври отдельно или в комбинации с паклитакселом в начальной дозе 4 мг / кг в виде 90-минутной инфузии 'с последующим введением один раз в неделю 2 мг / кг в виде 30-минутной инфузии к прогрессированию заболевания. Лечение метастатического рака желудка • Применять препарат Огиври в начальной дозе 8 мг / кг в виде 90-минутной инфузии с последующим введением в дозе 6 мг / кг в виде инфузии в течение 30-90 минут кожьни 3 недели до прогрессирования заболевания.
Важные рекомендации по дозированию
Если пациент пропустил введения трастузумаба на одну неделю или менее, следует ввести как можно раньше обычную поддерживающую дозу (еженедельный режим: 2 мг / кг трехнедельный режим: 6 мг / кг). НЕ ожидать следующего планового цикла. Следующие поддерживающие дозы следует вводы через 7 дней или через 21 день в зависимости от еженедельного или трехнедельного режима соответственно. Если пациент пропустил введения трастузумаба более чем на одну неделю, следует как можно раньше ввести повторно нагрузочную дозу в течение примерно 90 минут (еженедельный режиме: 4 мг / кг трехнедельный режим: 8 мг / кг).
Следующие поддерживающие дозы трастузумаба (еженедельный режим: 2 мг / кг трехнедельный режим: 6 мг / кг соответственно) следует вводить через 7 дней или через 21 день в зависимости от еженедельного или трехнедельного режима соответственно. Инфузиити реакции (см. Раздел «Особенности применения») • Уменьшить скорость инфузии в случае легких или умеренных инфузионных реакций. • Прервать инфузию пациентам с одышкой или клинически значимой артериальной гипотензии. • Прекратить применение препарата Огиври в случае тяжелых или опасных для жизни инфузионных реакций.
Кардиомиопатия (см, раздел «Особенности применения») Оценить фракцию выброса левого желудочка (ФВЛЖ) до начала применения препарата "Огиври и через равные промежутки во время лечения. Отменить введение препарата Огиври по крайней мере на 4 недели в любом из следующих случаев: • абсолютное снижение фракции выброса левого желудочка на> 16% от значений, наблюдавшихся до лечения; • фракции выброса левого желудочка ниже установленных границ нормы и абсолютное снижение фракции выброса левого желудочка на> 10% от значений, наблюдавшихся до начала лечения. Применение препарата Огиври можно восстановить, если- в течение 4-8 недель фракции выброса левого желудочка возвращается к нормальным границ и абсолютное снижение исходного уровня составляет <15%.
Окончательно прекратить применение препарата Огиври в случае устойчивого (> 8 недель) снижение фракции выброса левого желудочка или когда введение препарата Огиври приостанавливается более трех раз за возникновения кардиомипатии. Особые группы пациентов Дети Безопасность и эффективность применения препаратов трастузумаба детям не установлены. Пациенты пожилого возраста Трастузумаб применяли 386 пациентам в возрасте от 65 лет (253 - в качестве адъювантной терапии и 133 - при лечении метастатического рака молочной железы). Риск сердечной дисфункции был повышенным у пациентов пожилого возраста по сравнению с молодыми пациентами как при лечении метастатического заболевания (исследование 5 и 6), так и при адъювантной терапии (исследование 1 и 2).
Ограничения набора данных и различия в дизайне 4 исследований адъювантной терапии рака молочной железы трастузумабом препятствуют определению того, отличается профиль токсичности трастузумаба пациентов пожилого возраста от такого молодых пациентов. Имеющегося клинического опыта недостаточно для определения того, отличается улучшение параметров эффективности (частоты общего ответа на лечение, времени до прогрессирования заболевания, общей выживаемости, выживаемости без заболевания) лечение трастузумабом пациентов пожилого возраста от того, что наблюдалось у пациентов в возрасте <65 лет при лечении метастатического заболевания и адъювантной терапии.
В исследовании 7 (метастатическим раком желудка) из 294 пациентов, леченных трастузумабом, 108 (37%) были в возрасте от 65 лет, а 13 (4,4%) - в возрасте от 75 лет. Не наблюдалось общих различий в безопасности и эффективности применения препарата. Пригото ния и введение лекарственного средства С целью предотвращения ошибочного применению лекарственного средства важно проверить этикет ки на флаконах, чтобы убедиться, что лекарственное средство, которое готовится и вводится, является Огиври (трастузумаб), а не а к-трастузумаб емтанзин. Многодозовых флакон 420 мг
Видновлення- содержимое одного флакона 420 мг Огиври растворить в 20 мл бактериостатической воды для инъекций (содержит 1,1% бензилового спирта в качестве консерванта), чтобы получить раствор для многократного введения, содержащий 21 мг / мл трастузумаба, распределяемой в 20 мл (420 мг трастузумаба). Для ввода пациентам с установленной гиперчувствительностью к бензилового спирта растворить в 20 мл воды для инъекций без консерванта, чтобы получить раствор для однократного применения. Соблюдать соответствующие правила асептики, выполняя следующие этапы восстановления. • Используя стерильный шприц, медленно ввести 20 мл растворителя во флакон, содержащий лиофилизированный порошок Огиври в виде плотной массы. Поток растворителя следует направлять в лиофилизированную массу.
Осторожно повернуть флакон, чтобы способствовать восстановлению. НЕ встряхивать !. • После восстановления может быть имеющимся незначительное ценообразования. Дать флакона постоять в течение 5 минут. • Парентеральные лекарственные средства перед введением следует проверять визуально на наличие твердых частиц и изменение цвета, если раствор и упаковка позволяют это сделать. Проверить визуально на наличие частиц и изменение цвета. Раствор должен быть без видимых частиц, прозрачным или слегка опалесцирующий, бесцветным или бледно-желтого цвета. • Хранить восстановлен препарат Огиври в холодильнике при температуре от 2 до 8 ° С; утилизировать неиспользованный препарат Огиври через 28 дней. Если препарат Огиври восстанавливается с помощью стерильной воды для инъекций без консерванта, применить немедленно и утилизировать любую неприменимы часть. Не замораживать. Разведение • Определить дозу (мг) Огиври. Вычислить необходимый объем восстановленного раствора препарата Огиври, содержащий 21 мг / мл. • Набрать это количество из флакона и добавить ее в инфузионный пакет, содержащий 250 мл 0,9% раствора натрия хлорида для инъекций.
НЕ ПРИМЕНЯТЬ раствор глюкозы (5%). • Осторожно перевернуть пакет, чтобы перемешать раствор. • Раствор препарата Огиври для инфузии, разведенный в пакетах из поливинилхлорида или полиэтилена, которые содержат 0,9% раствор натрия хлорида для инъекций, следует хранить при температуре от 2 до 8 ° С не более 24 часов к применению. Не замораживать. Однодозовиш флакон 150 мг Видновлення-, содержимое одного флакона, содержащего 150 мг Огиври растворить в 7,4 мл стерильной воды для инъекций, чтобы получить раствор для однократного введения, содержащий 21 мг / мл трастузумаба, распределяемой в 7, 15 мл (150 мг трастузумаба). Соблюдать соответствующие правила асептики, выполняя следующие этапы восстановления. • Используя стерильный шприц, медленно ввести 7,4 мл стерильной воды для инъекций во флакон, содержащий лиофилизированный порошок Огиври в виде плотной массы. Поток растворителя следует направлять в лиофилизированную массу. В результате восстановления во флаконе образуется раствор для однократного введения, содержащий 21 мг / мл трастузумаба. • Осторожно повернуть флакон, чтобы способствовать восстановлению.
НЕ встряхивать. • После восстановления может быть имеющимся незначительное пенообразование. Дать флакона постоять в течение 5 минут. • Парентеральные лекарственные средства перед введением следует проверять и визуально на наличие твердых частиц и изменение цвета, если раствор и упаковка позволяют это сделать. Проверить визуально на наличие частиц и изменение цвета. Раствор должен быть без видимых частиц, прозрачным или слегка опалесцирующий, бесцветным или бледно-желтого цвета. • Применить раствор препарата Огиври немедленно после восстановления стерильной водой для инъекций, поскольку он не содержит консервантов и предназначен только для однократного введения.
Если не применяют немедленно, хранить восстановлен раствор препарата Огиври не более 24 часов при температуре от 2 до 8 ° С: утилизировать любую неприменимы часть препарата Огиври после 24 часов. Не замораживать. Разведение • Определить необходимую дозу (мг) Огивр ^^. • Вычислить необходимый объем восстановленного раствора препарата Огиври. содержащего 21 мг / мл. • Отобрать это количество из флакона и добавить ее в инфузионный пакет, содержащий 250 мл 0,9% раствора натрия хлорида для инъекций. НЕ ПРИМЕНЯТЬ раствор глюкозы (5%). • Осторожно перевернуть пакет, чтобы перемешать раствор. • Раствор препарата Огиври для инфузий, разведенный в пакетах из поливинилхлорида или полиэтилена, которые содержат 0,9% раствор натрия хлорида для инъекций, следует хранить к применению при температуре от 2 до 8 ° С не более 24 часов. Утилизировать через 24 часа. Это время хранения дополняет времени, разрешенного для восстановленных растворов во флаконах. Не замораживать.
Дети
Безопасность и эффективность применения препаратов трастузумаба детям не установлены.
Передозировка
Опыт передоза ния в ходе клинических исследований с участием человека отсутствует. Однократные дозы выше 8 мг / кг, не изучались.
Побочные эффекты
У пациентов, получавших трастузумаб в адъювантном режиме и при лечении метастатического рака молочной железы, наиболее частыми побочными реакциями были лихорадка, тошнота, рвота, инфузионные реакции, диарея, инфекции, усиленный кашель, головная боль, утомляемость, одышка, сыпь, нейтропения, анемия и миалгия.
Побочные реакции, требующие прерывания или прекращения лечения препаратами трастузумаба, включали сердечную недостаточность, значительное снижение функции левого желудочка сердца, тяжелые инфузионные реакции и легочной токсичности. При лечении метастатического рака желудка наиболее частыми побочными реакциями (> 10%), были нейтропения, диарея, утомляемость, анемия, стоматит, потеря массы тела, инфекции верхних дыхательных путей, лихорадка, тромбоцитопения, воспаление слизистых оболочек, назофарингит и дисгевзия, частота которых была повышенной (разница 5%) в группе пациентов, получавших трастузумаб по сравнению с пациентами, получавшими только химиотерапию. Наиболее частыми побочными реакциями, которые привели к прекращению лечения трастузумабом при отсутствии прогрессирования заболевания, были инфекция, диарея и фебрильная нейтропения.
Исследование ад "ювантнои терапии рака молочной железы Приведенные ниже данные, полученные в трех рандомизированных открытых исследованиях (исследование 1,2 и 3) адъювантной терапии рака молочной железы с применением трастузумаба (n = 3678) или без него (n = 3363), отражают влияние терапии трастузумабом в течение 1 года. Данные исследования 3, обобщены ниже в таблице 3, отражают влияние применения трастузумаба 1678 пациентам; со средней продолжительностью лечения 51 неделю, со средним количеству инфузий - 18 Средний возраст 3386 пациентов, включенных в группы наблюдения и группы лечения трастузумабом в течение 1 года исследования 3 со средней продолжительностью наблюдения в группе трастузумаба 12,6 месяцев, составил 49 лет (диапазон: от 21 до 80 лет), среди них 83% пациентов были представителями европеоидной расы, а 13% - выходцами из Азии.
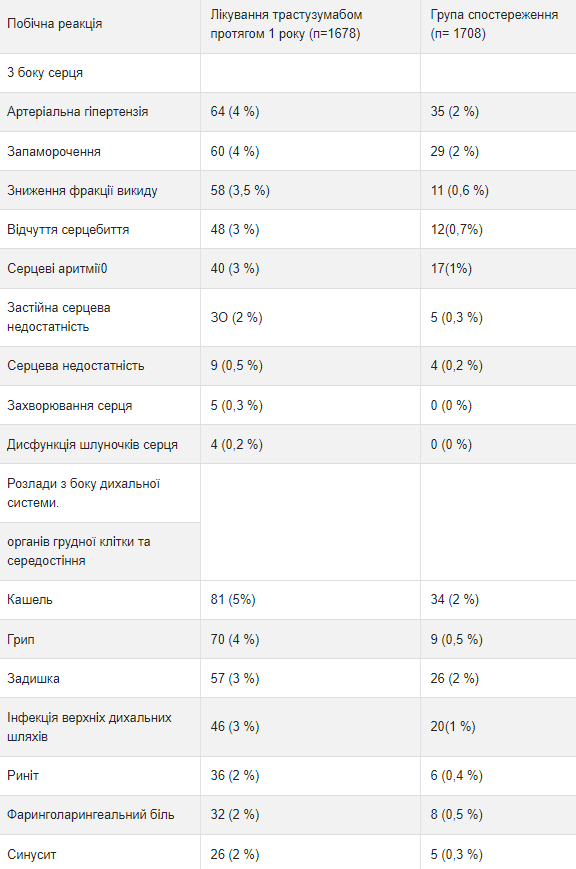
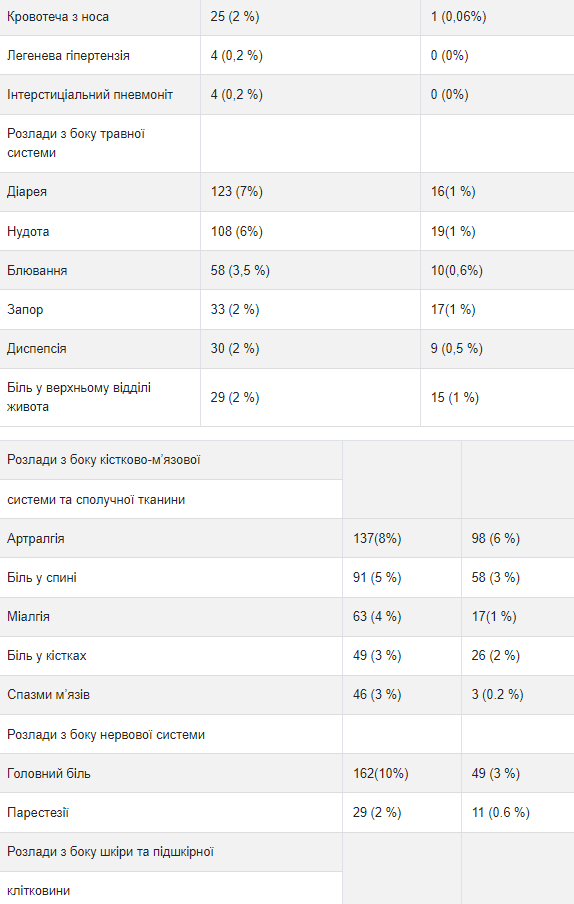
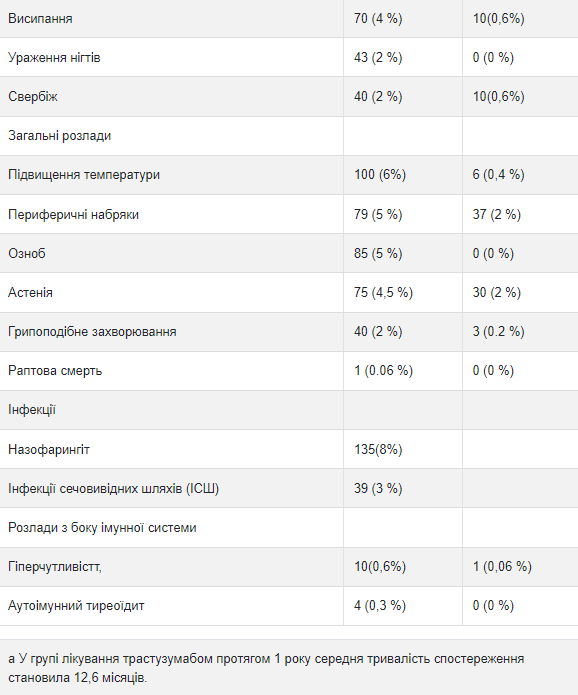
Частота побочных реакций 3-го или выше степени тяжести составляла <1% в обеих группах по каждому перечисленному термина. с Групповые сроки высшего уровня.
В исследовании 3 также было проведено сравнение 3-недельного режима лечения трастузумабом в течение 2 лет и в течение 1 года. Частота бессимптомной сердечной дисфункции была повышенной в группе лечения трастузумабом в течение 2 лет (8,1% против 4,6% в группе лечения трастузумабом в течение 1 года). У большинства пациентов наблюдалась минимум один побочная реакция 3-го или выше степени тяжести в группе лечения трастузумабом в течение 2 лет (20,4%) по сравнению с группой лечения трастузумабом в течение 1 года (16,3%). Данные исследований 1 и 2 по безопасности были получены от 3655 пациентов, из которых 2000 получали трастузумаб; средняя продолжительность лечения составила 51 неделю.
Средний возраст составил 49 лет (диапазон: от 24 до 80); 84% пациентов были представителями европеоидной расы, 7% - негроидной, 4% были латиноамериканского происхождения и 3% - выходцами из Азии. В исследовании 1 во время и в течение 3 месяцев лечения были зарегистрированы побочные эффекты 3-5-й степени, связанные с лечением эффекты 2-го степени и одышка 2-5-й степени тяжести. Следующие некардиальных побочные реакции 2-5-й степени тяжести возникали по крайней мере на 2% чаще среди пациентов, получавших трастузумаб вместе с химиотерапией, по сравнению с группой только химиотерапии утомляемость (29,5% против 22,4%), инфекция (24 0% против 12,8%), приливы (17.1% против 15,0%), анемия (12,3% против 6,7%), одышка (11,8% против 4.6%). высыпания / десквамация (10.9% против 7.6%), лейкопения (10,5% против 8,4%), нейтропения (6,4% против 4,3%), головная боль (6,2% против 3.8%). боль (5,5% против 3,0%), отек (4,7% против 2.7%) и бессонница (4,3% против 1,5%). Большинство из этих явлений были 2-й степени тяжести.
В исследовании 2 описаны следующие побочные реакции: гематологическая токсичность 4 и 5-й степени тяжести, негематологическая токсичность 3-5-й степени тяжести, отдельные связанные с действием таксанов токсические реакции 2-5-й степени тяжести (миалгия, артралгии, изменения ногтей, моторная нейропатия, сенсорная нейропатия) и кардиотоксичность 1-5-й степени тяжести, возникали во время химиотерапии и / или лечения трастузумабом. Следующие некардиальных побочные реакции 2-5-й степени тяжести, возникали по крайней мере на 2% чаще среди пациентов, получавших трастузумаб вместе с химиотерапией, по сравнению с группой пациентов только на химиотерапии: артралгия (12,2% против 9,1%), изменения ногтей (11,5% против 6,8%). одышка (2,4% против 0,2%) и диарея (2,2% против 0%). Большинство из этих явлений были 2-й степени тяжести. Данные по безопасности исследования 4 отражают влияние трастузумаба как части режима адъювантной терапии в 2124 пациентов, получивших хотя бы одну дозу исследуемого препарата (схема лечения АС-ТИИ: п = 1068; схема ТСН: п = 1056). В целом средняя продолжительность лечения составляла 54 недели в обеих группах (АС-ТН и ТСН).
Среднее количество инъекций составляла 26 в группе АС-ТН и 30 в группе ТСН, включая еженедельные инфузии во время фазы химиотерапии и введение каждые три недели в период монотерапии, средний возраст этих пациентов составил 49 лет (диапазон от 22 до 74 лет). В исследовании 4 профиль токсичности был подобен показателей, полученных в исследованиях 1, 2 и 3 за исключением низкой частоты застойной сердечной недостаточности в группе ТСН. Исследование метастатического года молочной железы Приведенные ниже данные отражают влияние трастузумаба в одном рандомизированном открытом исследовании (исследовании 5) химиотерапии с трастузумабом (n = 235) или без него (n = 234) с участием пациентов с метастатическим раком молочной железы и в одном несравнительном исследовании ( исследования 6, п = 222) с участием пациентов с метастатическим раком молочной железы. В таблице 4 представлены данные исследований 5 и 6. Средний возраст пациентов (n = 464), которых лечили в рамках исследования 5, составил 52 года (диапазон от 25 до 77 лет) .. Восемьдесят девять процентов были представителями европеоидной расы, 5% - негроидной, 1% - выходцами из Азии и 5% принадлежали к другим расовых / этнических групп. Все пациенты получали начальную дозу трастузумаба 4 мг / кг с последующим введением 2 мг / кг в неделю.
Доля пациентов, получавших лечение трастузумабом в течение 6 месяцев и 12 месяцев составила 58% и 9% соответственно ». Среди 352 пациентов, леченных в рамках исследований одного лекарственного средства (213 пациентов в дослиджьенни 6) средний возраст составлял 50 лет (диапазон от 28 до 86 лет), 86% были представителями европеоидной расы, 3% - негроидной, 3% были выходцами из Азии и 8% принадлежали к другим расовых / этнических групп. Большинство пациентов получали трастузумаб в начальной дозе 4 мг / кг с последующим введением 2 мг / кг в неделю. Доля пациентов, получавших лечение трастузумабом в течение 6 месяцев и 12 месяцев составила 31% и 16% соответственно.
Таблица 4 Частота побочных реакций, возникших у 5% пациентов в ходе неконтролируемых исследований, либо при повышении частоты в группе трастузумаба (исследования 5 и 6)


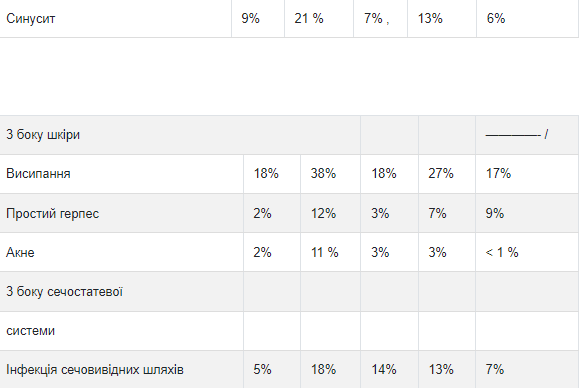
а Данные по трастузумаба как одного препарата полученные в 4 исследованиях, включая 213 пациентов исследования 6.
Антрациклин (доксорубицин или еиирубицин) и циклофосфамид. Метастатическим раком желудка Приведенные ниже данные основаны на применении трастузумаба в комбинации с фторпиримидинами (капецитабином или 5-фторурацилом) и цисплатином (исследование 7) 294 пациентам. В группе трастузумаба с химиотерапией (XT) начальную дозу трастузумаба 8 мг / кг вводили в 1-й день (до химиотерапии) с последующим введением 6 мг / кг каждый 21 день до прогрессирования заболевания.
Цисплатин вводили в дозе 80 мг / м2 в 1-й день, а фторпиримидин вводили или как капецитабин 1000 мг / м2 внутрь дважды в сутки с 1-го до 14-го дня. или как 5-фторурацил 800 мг / м2 / сутки в виде непрерывной инфузии с 1-го до 5-го дня. Химиотерапия проводилась в течение шести 21-дневных циклов. Средняя продолжительность лечения трастузумабом составляла 21 неделю; среднее количество инфузий трастузумаба составляла 8.
Таблица 5 Исследование 7: Частота побочных реакций всех степеней тяжести (разница частоты между группами 5%) или 3/4-й степени тяжести (разница частоты между группами 1%) и более высокая частота в группе трастузумаба
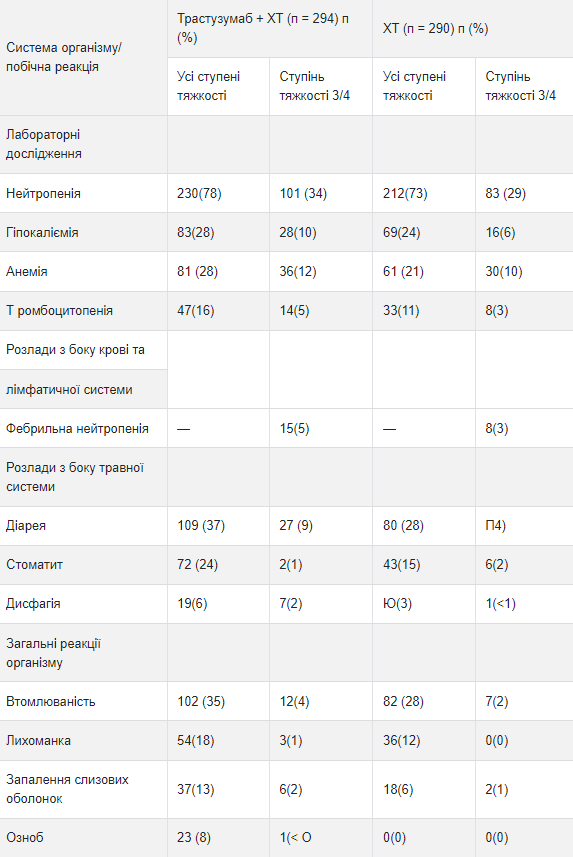
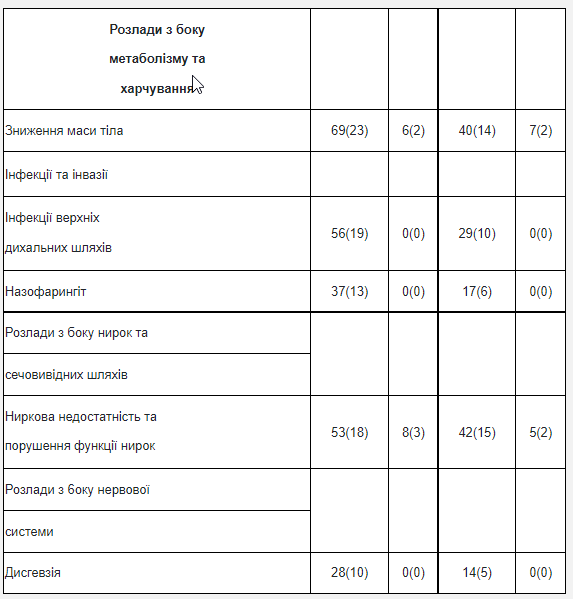
Ниже представлены дополнительные детали относительно побочных реакций, которые наблюдались в клинических исследованиях адъювантной терапии рака молочной железы, лечение метастатического рака молочной железы, метастатического рака желудка или в период послерегистрационного применения. Кардиомиопатия Периодическое определение функции сердца (фракции выброса левого желудочка) проводилось в ходе клинических исследований адъювантной терапии рака молочной железы.
В исследовании 3 средняя продолжительность наблюдения составила 12,6 месяцев (12,4 месяца в группе наблюдения; 12,6 месяцев в группе лечения трастузумабом в течение 1 года); и в исследованиях 1 и 2 - 7,9 лет в группе, получавшей терапию: доксорубицин, циклофосфамид с последующим применением паклитаксела (АС-Т), 8,3 лет в группе терапии: доксорубицин, циклофосфамид + паклитаксел с трастузумабом (АС-ТН ). В исследованиях 1и 2 6% всех рандомизированных пациентов, которым оценивали фракции выброса левого желудочка после применения режима АС (доксорубицин, циклофосфамид), не было разрешено начинать лечение трастузумабом после завершения химиотерапии в режиме АС-за сердечной дисфункции (фракции выброса левого желудочка <нижней границы нормы (НМН) или снижение фракции выброса левого желудочка на> 16 пунктов от исходного уровня на момент окончания применения АС).
После начала терапии трастузумабом частота впервые выявленной дисфункции миокарда, ограничивает дозу, была выше среди пациентов, получать трастузумаб и паклитаксел, по сравнению с пациентами, получавшими только паклитаксел (исследование 1 и 2), и у пациентов, получавших монотерапию трастузумабом в течение 1 года по сравнению с группой наблюдения (исследования 3) (см. таблицу 6). Частота впервые выявленной сердечной дисфункции, определенной по показателю фракции выброса левого желудочка, залишатася подобной данным наблюдения средней продолжительностью 2 года в группе АС-ТН. Этот анализ также обнаружил доказательства обратного развития дисфункции левого желудочка сердца; в 64,5% пациентов группы АС-ТН, в которых спостеригшийся симптомы застойной сердечной недостаточности, симптомы отсутствовали в конце периода наблюдения, а в 90,3% наблюдалось полное или частичное восстановление фракции выброса левого желудочка.
Таблица 6 Частота впервые выявленной дисфункции миокарда (по показателю фракции выброса левого желудочка) в исследованиях 1,2, 3 и 4
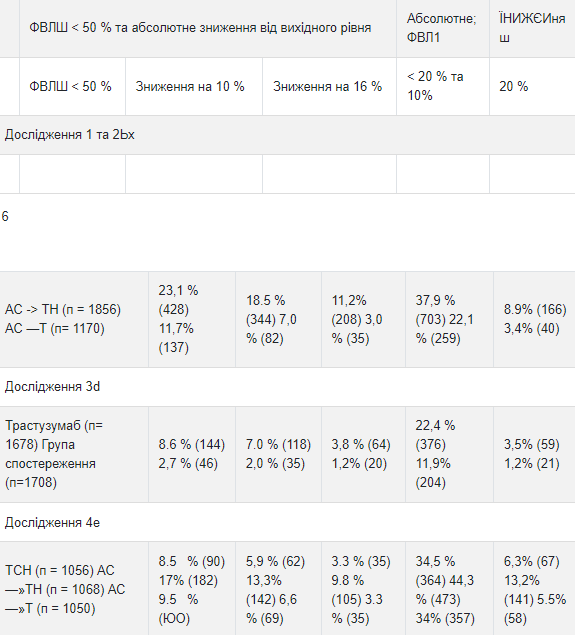
а События в исследованиях 1,2 и 3 подсчитаны от начала лечения трастузумабом.
События в исследовании 4 подсчитаны, начиная с даты рандомизации. ь Режимы лечения в исследованиях 1 и 2: доксорубицин и циклофосфамид с последующим применением паклитаксела (АС - "Т) или паклитаксела с трастузумабом (АС - ТН). с Средняя продолжительность наблюдения в исследованиях 1 и 2 в сочетании составляла 8.3 года в группе АС - ТН. d Средняя продолжительность наблюдения 12,6 месяцев в группе лечения трастузумабом в течение 1 года. е Режимы лечения в исследовании 4: доксорубицин и циклофосфамид с последующим применением доцетаксела (АС - Т) или доцетаксела с трастузумабом (АС - ТН) доцетаксел и карбоплатин с трастузумабом (ТСН). Частота застойной сердечной недостаточности, возникшей во время лечения пациентов в ходе исследований метастатического рака молочной железы, была распределена по степени тяжести согласно классификации Нью-Йоркской кардиологической ассоциации (классы 1-ИьV, где IV - уровень тяжелой сердечной недостаточности) В исследованиях метастатического рака молочной железы вероятность сердечной дисфункции была высокой у пациентов, получавших трастузумаб одновременно с антрациклинами. В исследовании 7 5,0% пациентов группы трастузумаба с химиотерапией по сравнению с 1.1% пациентов группы только химиотерапии имели значения фракции выброса левого желудочка ниже 50% с абсолютным снижением фракции выброса левого желудочка на> 10% от значения, которое наблюдалось до лечения.
Инфузионные реакции В ходе клинических исследований при первой инфузии трастузумаба чаще регистрировали такие симптомы как лихорадка и озноб, возникающие у 40% пациентов. Для лечения симптомов применяли ацетаминофен, дифенгидрамин и меперидин (с уменьшением скорости инфузии трастузумаба или без него); окончательного прекращения применения трастузумаба через инфузионные реакции требовали <1% пациентов. Другие признаки и / или симптомы включали тошноту, рвоту, боль (в некоторых случаях в области опухоли), ригидность мышц, головная боль, головокружение, одышку, артериальной гипотензии, повышенное артериальное давление, высыпания и анемию. Инфузионные реакции возникали у 21% и 35% пациентов и были тяжелыми в 1,4% и 9% случаев при второй и последующих инфузий трастузумаба,
В писляереестрацийному периоде сообщалось о тяжелых инфузионные реакции, включая гиперчувствительность, анафилаксии и ангионевротический отек.
анемия
В рандомизированных контролируемых клинических исследованиях частота анемии была повышенной в группе пациентов, получавших трастузумаб с химиотерапией по сравнению с теми, кто получал только химиотерапию: в целом (ЗО% против 21% [исследования 5]), анемии 2-5-й степени тяжести в соответствии с единых терминологических критериев побочных реакций Национального института рака (NationalCancerInstitute-CommonToxicityCriteria, NCI-CTC) (12,3% против 6,7% [исследования 1]) и анемии, требовала гемотрансфузии (0,1% против 0 пациентов [исследования 2] ). После применения трастузумаба в качестве монотерапии (исследование 6) частота анемии 3-й степени тяжести по NCI-CTCстановила <1%.
нейтропения
В рандомизированных контролируемых клинических исследованиях адъювантной терапии частота нейтропении была повышенной в группе пациентов, получавших трастузумаб с химиотерапией по сравнению с теми, кто получал только химиотерапию: 4-5-й степени тяжести по NCI-CTC (1,7% против 0, 8% [исследования 2]) и нейтропения 2-5-й степени тяжести (6,4% против 4,3% [исследования 1]). В рандомизированном контролируемом исследовании с участием пациентов с метастатическим раком молочной железы частота нейтропении также была повышенной у пациентов, рандомизированных в группу трастузумаба с миелосупрессивной химиотерапией по сравнению с группой только химиотерапии ": 3/4-й степени тяжести по NCI-CTC (32% против 22 %), фебрильная нейтропения (23% против 17%).
В исследовании 7 (метастатическим раком желудка) в группе трастузумаба по сравнению с группой только химиотерапии частота нейтропении 3/4-й степени тяжести по NCI-CTCстановила 36,8% по сравнению с 28.9%; фебрильной нейтропении - 5,1% по сравнению с 2.8%. Инфекция Частота инфекций в целом была выше в группе пациентов, получавших трастузумаб с химиотерапией по сравнению с теми, кто получал только химиотерапию (46% против ЗО% [исследования 5]), инфекции / фебрильная нейтропения 2-5-й степени тяжести по NCI-CTC - 24,3% против 13,4% [исследования 1] и инфекция / фебрильная нейтропения 3-5-й степени тяжести - 2,9% против 1.4% [исследования 2]. В условиях адъювантной терапии наиболее частой локализацией инфекций были верхние дыхательные пути, кожа и мочеиспускательный тракт-. В исследовании 4 общая частота инфекции была выше при добавлении трастузумаба схеме АС-Т, но не до ТСН [44% (АС-ТН), 37% (ТСН), 38% (АС-Т)]. Частота инфекции 34-й степени тяжести по NCI-CTCв всех трех группах была сходной [25% (АС-ТН), 21% (ТСН), 23% (АС-Т)]. В рандомизированном контролируемом исследовании лечения метастатического рака молочной железы зарегистрирована частота фебрильной нейтропении была выше (23% против 17%) в группе пациентов, получавших трастузумаб в комбинации с миелосупрессивной химиотерапией, чем в группе только химиотерапии ".
легочная токсичность
Адъювантной терапии рака молочной железы Среди женщин, получавших адъювантной терапии рака молочной железы, частота легочной токсичности была выше в группе пациентов, получавших трастузумаб с химиотерапией, чем в группе только химиотерапии: 2-5-й степени тяжести (14.3 % против 5,4% [исследования 1]), 3-5-й степени тяжести по NCI-CTCта одышки 2-й степени тяжести за спонтанными сообщениями (3,4% против 0,9% [исследования 2]). Чаще всего проявлением легочной / -7. ЖЛ токсичности была одышка: 2-5-й степени тяжести по NCI-CTC- 11,8% против 4,6% [исследования 1]; 2-5-й степени тяжести по NCI-CTC- 2,4% против 0,2% [исследования 2]. Пневмониьг / легочные инфильтраты возникли у 0,7% пациентов, получавших трастузумаб по сравнению с 0,3% тех, кто получал только химиотерапию. Летальная дыхательная недостаточность развилась у 3 пациентов, получавших трастузумаб (в друга как часть полиорганной недостаточности) по сравнению с 1 пациентом в группе только химиотерапии ". В исследовании 3 наблюдалось 4 случая интерстициального пневмонита в группе лечения трастузумабом в течение 1 года по сравнению с отсутствием такого в группе наблюдения при средней продолжительности наблюдения 12,6 месяцев.
Метастатическим раком молочной железы
Среди женщин, которые получаем валы лечения по поводу метастатического рака молочной железы, частота легочной токсичности также была повышенной. В период послерегистрационного применения сообщалось о побочных эффектах со стороны дыхательной системы как часть симптомокомплекса инфузионных реакций. Легочные осложнения включают бронхоспазм, гипоксию, одышку, легочные инфильтраты, экссудат в полость плевры, некардиогенный отек легких и острый респираторный дистресс-синдром. Детальное описание изложено в разделе «Особенности применения», Тромбоз / эмболия С 4 рандом изо ван х контролируемых клинических исследований в трех частота тромботических побочных явлений была выше в группе пациентов, получавших трастузумаб с химиотерапией по сравнению с группой только химиотерапии (2,6% против 1,5% [исследования 1], 2,5% и 3,7% против 2,2% [исследования 4] и 2, 1% против 0% [исследования 5]). Диарея Среди женщин, получавших адъювантной терапии рака молочной железы, частота диареи была выше в группе пациенток, получавших трастузумаб по сравнению с контрольной группой: диарея 2-5-й степени тяжести по NCI-CTC- 6,7% против 5 4% [исследования 1], диарея Из-5- й степени тяжести по NCI-CTC- 2,2% против 0% [исследования 2] и диареи l4-й степени тяжести - 7% против 1% [исследования 3]. В исследовании 4 частота диареи 3-4-й степени тяжести была выше среди женщин, получавших трастузумаб [5,7% в группе АС ТН, 5,5% в группе ТСН против 3,0% в группе АС-Т]; частота диареи 14-й степени тяжести также была выше [51% в группе АС-ТН, 63% в группе ТСН против 43% в группе АС Т]. Диарея наблюдалась у 25% пациентов, получавших трастузумаб в качестве монотерапии для лечения метастатического рака молочной железы.
Повышенная частота диареи наблюдалась в группе пациентов, для лечения метастатического рака молочной железы получали трастузумаб в сочетании с химиотерапией. Нефропюксичнисть В исследовании 7 (метастатическим раком желудка) в группе лечения с включением трастузумаба по сравнению с группой только химиотерапии частота нарушения функции почек составила 18% по сравнению с 14,5%. Тяжелая (3/4-й степени тяжести) почечная недостаточность наблюдалась у 2,7% случаев в группе лечения с включением трастузумаба по сравнению с 1,7% в группе только химиотерапии.
Лечение было прекращено вследствие нарушения функции / недостаточности почек в 2% случаев в группе лечения с включением трастузумаба и в 0,3% - в группе только химиотерапии. В период послерегистрационного применения сообщалось о редких случаях нефротического синдрома с патоморфологическими признаками гломерулопатии. Время до появления колебался от 4 месяцев до почти 18 месяцев от начала лечения трастузумабом. Морфологические признаки включали мембранозных гломерулонефрит, фокальный гломерулосклероз и фибриллярный гломерулонефрит.
Осложнения включали перегрузки объемом и застойную сердечную недостаточность. Иммуногенность как при применении всех терапевтических белков, существует потенциальная иммуногенность. Выявление антител в значительной степени зависит от чувствительности и специфичности метода исследования. Кроме того, на частоту положительного результата выявления антител (включая нейтрализующие антитела) могут влиять несколько факторов, в том числе методология анализа, обработка образцов, время сбора образцов, одновременное применение лекарственных средств и основное заболевание.
По этим причинам сравнение частоты выявления антител в описанных ниже исследованиях с частотой в других исследованиях или с выявлением антител к другим препаратам трастузумаба может привести к неправильным выводам. Среди 903 женщин с метастатическим раком молочной железы антитела человека к антителам человека (НАНА) было выявлено у 1 пациентки с помощью ферментного имуносорбентного анализа (ELISA). В этой пациентки не наблюдалось аллергической реакции. Материал для оценки НАНА в исследованиях адъювантной терапии рака молочной железы не собирали.
Опыт послерегистрационного применения Следующие побочные реакции выявлены во время послерегистрационного применения трастузумаба. Достоверных статистических данных об их частоту и причинную связь с действием препарата нет. • Инфузионная реакция (см. Раздел «Особенности применения»). • олигогидрамнион или следствие олигогидрамнион, включая гипоплазию легких, аномалии скелета и смерть новорожденного (см. Раздел «Особенности применения»), • Гломерулопатии. • Иммунная тромбоцитопения. • Синдром лизиса опухоли (СЛП): сообщалось о случаях СЛП при лечении пациентов трастузумабом. Более высокий риск могут иметь пациенты со значительным опухолевой нагрузкой (например обширными метастазами). У пациентов может наблюдаться гиперурикемия. гиперфосфатемия и острая почечная недостаточность, которые могут быть проявлениями потенциального СЛП.
Срок годности Огиври
4 года.
Условия хранения Огиври
Хранить в оригинальной упаковке при температуре 2-8 ° С. Хранить в недоступном для детей месте.
Несовместимость.
Не смешивать препарат Огиври с другими препаратами. Не применять для разведения раствор глюкозы (5%).
Упаковка
Для дозирования 150 мг 1 однократной флакон с лиофилизированным порошком для инфузии по 150 мг в картонной коробке.
Для дозирования 420 мг 1 многодозовых флакон с лиофилизированным порошком для инфузии по 420 мг вместе с 1 флаконом растворителя по 20 мл (спирт бензиловый, вода для инъекций) в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Биокон Биолоджикс Индия Лимитед.
Биокон Биологии Индия Лимитед.
Местонахождение производителя
Спешиал Экономик Зоун, Плот 2, 3, 4 и 5 Фейз IV, Боммасандра-Джиган Ссылка Роуд, Боммасандра Пост, Бенгалуру, 560099, Индия. Special Economic Zone, Plot 2, 3, 4 & 5, Phase IV, Bommasandra-Jigani Link Road, Bommasandra Post, Bengaluru, 560099, India.
Заявитель.
М.БИОТЕК ЛИМИТЕД M.BIOTECH LIMITED.
Местонахождение заявителя.
Глэдстоун Хауз, 77-79 Хай Стрит, Егам ТВ20 9ГЫ, Суррей, Великобритания Gladstone House, 77-79 High Street, Egham TW20 9HY, Surrey, United Kingdom.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Огиври только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Биокон Биолоджикс Индия Лимитед
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Огиври |
| Производитель: | Биокон Биолоджикс Индия Лимитед |
| Форма выпуска: | порошок лиофилизированный для инфузии по 150 мг или 420 мг 1 многодозовых флакон с лиофилизированным порошком для инфузии по 420 мг вместе с 1 флаконом растворителя по 20 мл (бензиловый спирт, вода для инъекций) в картонной коробке |
| Регистрационное удостоверение: | UA/18308/01/01, UA/18308/01/02 |
| Дата начала: | 02.12.2020 |
| Дата окончания: | 12.02.2025 |
| МНН: | Trastuzumab |
| Условия отпуска: | по рецепту |
| Состав: | 1 многодозовых флакон трастузумаба 420 мг |
| Фармакологическая группа: | Другие антинеопластичес средства. Моноклональные антитела. |
| Код АТХ: | L01XC03 |
| Заявитель: | М.БИОТЕК ЛИМИТЕД |
| Страна заявителя: | Великобритания |
| Адрес заявителя: | Глэдстоун Хауз, 77-79 Хай Стрит, Егам ТВ20 9ГЫ, Суррей, Британия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L01 | Противоопухолевые препараты |
| L01X | Другие антинеопластичес средства |
| L01XC | Моноклониальни антитела |
| L01XC03 | Трастузумаб |
