- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Емоклот инструкция по применению
Официальная инструкция лекарственного препарата Емоклот порошок 500 МО, 1000 МО. Описание и применение Emoklot, аналоги и отзывы. Инструкция Емоклот порошок утвержденная компанией производителем.
Состав
действующее вещество: фактор свертывания крови человека VIII;
1 флакон с порошком содержит фактора свертывания крови человека VIII 500 МЕ или 1000 МЕ.
Вспомогательные вещества: натрия хлорид, натрия цитрат, глицин, кальция хлорид,
флакон с растворителем содержит воды для инъекций 10 мл.
Восстановленный раствор содержит фактора свертывания крови человека VIII 50 МЕ / мл (500 МЕ / 10 мл) или 100 МЕ / мл (1000 МЕ / 10 мл).
Специфическая активность препарата ЕМОКЛОТ составляет примерно 80 МЕ / мг белка. Активность (МО) определяется с помощью хромогенного анализа в соответствии с Европейской фармакопеи.
Общее содержание белка не более 7,2 мг / флакон или 15 мг / флакон.
Препарат содержит фактор фон Виллебранда человека.
Лекарственная форма
Порошок и растворитель для приготовления раствора для инфузий.
Основные физико-химические свойства:
порошок белый или бледно-желтый гигроскопичный порошок или хрупкая твердое вещество;
растворитель: прозрачная бесцветная жидкость.
Фармакологическая группа
Антигеморрагические средства, фактор свертывания крови VIII.
Код ATХ B02B D02.
Фармакологические свойства
Фармакологические.
Комплекс фактор VIII / фактор фон Виллебранда состоит из двух молекул (фактор VIII и фактор фон Виллебранда) с различными физиологическими функциями.
При введении пациенту с гемофилией фактор VIII связывается с фактором фон Виллебранда, циркулирующей в крови пациента.
Активированный фактор VIII действует как кофактор для активированного фактора IX, ускоряя превращение фактора X в активную форму. Активированный фактор X превращает протромбин в тромбин, который, в свою очередь, превращает фибриноген в фибрин, после чего может формироваться сгусток. Гемофилия А - это связано с полом наследственное нарушение свертывания крови, обусловленное сниженным уровнем фактора VIII: C, что приводит к профузных кровотечений в суставах, мышцах или внутренних органах, которые происходят спонтанно или в результате случайных повреждений или хирургических вмешательств. Заместительная терапия повышает плазменные уровни фактора VIII и, таким образом, позволяет временно откорректировать дефицит фактора и снизить тенденцию к кровотечениям.
Фактор фон Виллебранда играет роль стабилизатора фактора VIII, опосредует адгезию тромбоцитов к участкам повреждения сосудов и участвует в агрегации тромбоцитов.
дети
Хотя специфические данные по применению детям отсутствуют, немногочисленные опубликованные данные исследований эффективности и безопасности не продемонстрировали существенных различий между взрослыми и детьми с одним и тем же заболеванием.
Фармакокинетика.
После введения препарата примерно 2 / 3-3 / 4 фактора VIII остается в циркулирующей крови.
Уровень активности фактора VIII, достигается в плазме составляет 80-120% от расчетной активности фактора VIII в плазме.
Активность фактора VIII в плазме снижается по двухфазной экспоненциальной кривой.
В начальной фазе распределение между внутрисосудистой и другими жидкостями организма происходит с периодом полувыведения 3-6 часов.
В следующей более медленной фазе (которая, вероятно, отражает поглощения фактора VIII) период полувыведения варьирует от 8 до 20 часов и в среднем составляет 12:00, отражающий истинный биологический период полувыведения.
Фармакокинетические свойства препарата ЕМОКЛОТ были изучены в клиническом исследовании, проводившемся с участием 15 пациентов с тяжелой гемофилией A (с уровнем фактора VIII <1). Фармакокинетические параметры определялись после двух отдельных инфузий (дозировка 25 МЕ / кг), проводившихся с интервалом 3-6 месяцев. В период между двумя инфузиями пациенты получали лечение препаратом ЕМОКЛОТ по их обычной терапевтической схеме применения (с лечебной или профилактической целью).
Средние величины фармакокинетических параметров препарата ЕМОКЛОТ, определенные в ходе исследования, представленные в таблице 1.
Таблица 1
показатель | первая инфузия | вторая инфузия | ||
Без вычета начальных показателей | С вычетом исходных показателей | Без вычета начальных показателей | С вычетом исходных показателей | |
AUC0-t (МО·мл-1·год) | 10,94 | 9,96 | 10,75 | 8,95 |
AUC0-¥ (МО·мл-1·год) | 13,08 | 11,22 | 12,07 | 9,89 |
Cltot (мл·год-1·кг-1) | 2,63 | 2,89 | 2,51 | 2,99 |
Постепенное восстановление (%) | 2,688 | 2,671 | ||
t1/2a (год) | 0,543 | 0,768 | ||
t1/2b (год) | 12,05 | 15,16 | ||
дети
Хотя специфические данные по применению детям отсутствуют, немногочисленные опубликованные данные исследований фармакокинетики не продемонстрировали существенных различий между взрослыми и детьми с одним и тем же заболеванием.
Клинические характеристики
Емоклот Показания
Лечение и профилактика кровотечений у пациентов с гемофилией А (врожденная недостаточность фактора свертывания крови человека VIII).
Лечение приобретенного дефицита фактора свертывания крови человека VIII.
Лечение больных гемофилией с антителами к фактору свертывания крови человека VIII (ингибиторы: см. Также «Особенности применения»).
Противопоказания
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
О взаимодействии препаратов фактора свертывания крови человека VIII с другими лекарственными средствами не сообщалось.
Особенности применения
повышенная чувствительность
При применении препарата ЕМОКЛОТ возможны аллергические реакции повышенной чувствительности.
Препарат содержит следы белков человека, отличных от фактора VIII. В случае возникновения симптомов повышенной чувствительности пациентам следует рекомендовать немедленно прекратить применение препарата и обратиться к врачу. Пациентов следует информировать о ранних признаках реакций гиперчувствительности, включая сыпь, ґенерализовану крапивницу, сжатие в груди, дыхание с присвистом, гипотонию и анафилаксии.
В случае возникновения шока следует придерживаться действующих медицинских стандартов лечения шока.
ингибиторы
Образование нейтрализующих антител (ингибиторов) к фактору свертывания крови человека VIII является известным осложнением лечения пациентов с гемофилией А. Эти ингибиторы обычно представляют собой иммуноглобулины IgG, направленные против прокоагулюючои активности фактора VIII, количество которых определяют в единицах Бетезда (ОБ) на 1 мл плазмы за помощью модифицированного анализа. Риск развития ингибиторов коррелирует со степенью тяжести заболевания, а также с экспозицией фактора VIII. Этот риск высокий в течение первых 20 дней применения. Редко ингибиторы могут образовываться после первых 100 дней применения.
Наблюдались случаи повторного появления ингибиторов (в низком титре) после перехода с одного препарата фактора VIII на другой у пациентов, ранее получавших лечение с экспозицией более 100 дней с образованием ингибиторов в анамнезе. Поэтому после любой смены препарата рекомендуется тщательный мониторинг всех пациентов относительно появления ингибиторов.
Клиническая значимость образования ингибиторов зависит от их титра. При низком титре ингибиторов, временном или постоянном, риск недостаточной клинической ответы ниже, чем при высоком титре ингибиторов.
В общем, следует проводить тщательный мониторинг всех пациентов, получающих лечение препаратами фактора коагуляции VIII, о создании ингибиторов путем надлежащего клинического наблюдения и лабораторных исследований. Если при применении соответствующей дозы не достигается ожидаемый уровень активности фактора VIII в плазме или, если кровотечение не контролируется, следует провести исследование на наличие ингибиторов фактора VIII. У пациентов с высоким уровнем ингибиторов терапия фактором VIII может оказаться неэффективной, и в таком случае следует рассмотреть другие способы лечения. Терапию таких пациентов следует проводить под контролем врача, имеющего опыт лечения пациентов с гемофилией и ингибиторами фактора VIII.
Осложнения, связанные с применением катетера
В случае необходимости в центральном венозном доступе следует учитывать риск связанных с применением устройства осложнений, включая локальные инфекции, бактериемию и тромбоз в месте введения катетера.
вирусная безопасность
Стандартные меры по предупреждению инфекций вследствие применения лекарственных средств, полученных из крови или плазмы человека, включают отбор доноров, проверку отдельных порций и пулов плазмы на специфические маркеры инфекций и принятия эффективных производственных мероприятий для инактивации / уничтожения вирусов.
Несмотря на это, при введении лекарственных средств, изготовленных из крови или плазмы человека, нельзя полностью исключить возможность передачи возбудителей инфекции, в том числе неизвестных или новых в настоящее время вирусов и других патогенов.
Меры, принимаемые, считаются эффективными по оболочечных вирусов, таких как вирус иммунодефицита человека (ВИЧ), вирус гепатита В (HBV) и вирус гепатита С (HCV), а также по необолонкових вирусов, таких как вирус гепатита А (HAV). Меры, принимаемые, могут иметь ограниченную эффективность по необолонкових вирусов, таких как парвовирус В19. Инфицирования парвовирусом В19 может быть серьезным для беременных (инфицирование плода) и пациентов с иммунодефицитом или усиленным эритропоэза (например, при гемолитической анемии).
Следует рассмотреть вопрос проведения соответствующей вакцинации (от гепатита A и B) пациентам, которым регулярно / повторно применяют препараты фактора коагуляции VIII из плазмы человека.
Для сохранения связи между пациентом и серией препарата настоятельно рекомендуется каждый раз при введении препарата ЕМОКЛОТ фиксировать номер серии препарата и данные пациента.
Применение в период беременности или кормления грудью
Исследование влияния фактора VIII на репродуктивную функцию животных не проводились. Частота заболевания гемофилией А среди женщин низкая, опыт применения фактора VIII беременным и кормящим грудью, отсутствует. Поэтому фактор VIII следует применять во время беременности и кормления грудью только при четких показаний.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
ЕМОКЛОТ не влияет на способность управлять транспортными средствами и работать с другими механизмами.
Способ применения Емоклот и дозы
Лечение следует начинать под контролем врача, имеющего опыт лечения гемофилии.
дозировка
Дозировка и длительность заместительной терапии зависят от степени тяжести дефицита фактора VIII, локализации и интенсивности кровотечения, а также от клинического состояния пациента.
Количество единиц фактора VIII, вводимого выражается в международных единицах (МЕ), что соответствует действующему стандарту ВОЗ для препаратов фактора VIII. Активность фактора VIII в плазме выражается в процентах (относительно нормальной плазмы) или в международных единицах (относительно международного стандарта для фактора VIII в плазме).
Активность одной международной единицы (МЕ) фактора VIII соответствует количеству фактора VIII в 1 мл нормальной плазмы.
Лечение в случае необходимости
Расчет необходимой дозы фактора VIII основывается на данных, полученных эмпирическим путем. 1 международная единица (МО) фактора VIII на 1 кг массы тела повышает активность фактора VIII в плазме на 1,5% -2% нормальной активности. Необходимая доза определяется по следующей формуле:
Необходимое количество единиц = масса тела (кг) х желаемое увеличение фактора VIII (%) (МЕ / дл) '0,4
Количество препарата, должна быть введена, и частота введения всегда должны быть ориентированы на клиническую эффективность в каждом конкретном случае.
В нижеследующих случаях кровотечений активность фактора VIII не должна быть ниже указанного уровня активности в плазме крови (в% от нормы) в соответствующий период. Таблицу 2 можно использовать как инструкцию по дозировке при кровотечениях и хирургических вмешательствах.
Таблица 2
Степень кровотечения / тип хирургической процедуры | Необходимый уровень фактора VIII (%) (МЕ / дл) | Частота введения (часы) / продолжительность лечения (дней) |
кровотечение | ||
Ранний гемартроз, кровотечение в мышцах или кровотечение в полости рта | 20—40 | Повторять каждые 12-24 часа в течение не менее 1 суток до прекращения кровотечения, о чем свидетельствует устранения боли или заживления. |
Более выраженный гемартроз, кровотечение в мышцах или гематома | 30—60 | Повторять введение каждые 12-24 часа в течение 3-4 суток или дольше, пока не будут устранены боль и острая недееспособность. |
Кровотечение, угрожающее жизни | 60—100 | Повторять введение каждые 8-24 часа до устранения угрозы жизни. |
оперативные вмешательства | ||
Малые оперативные вмешательства, в том числе удаление зуба | 30—60 | Каждые 24 часа минимум 1 сутки до заживления. |
Большие оперативные вмешательства | 80—100 (До и после оперативного вмешательства) | Повторять введение каждые 8-24 часа до адекватного заживления раны; затем продолжить терапию не менее 7 суток, поддерживая активность фактора VIII на уровне 30-60% (30-60 МЕ / дл). |
профилактика
Для длительной профилактики кровотечений у пациентов с тяжелой гемофилией А обычно назначают дозы от 20 до 40 МЕ фактора VIII на 1 кг массы тела с интервалом введения от 2 до 3 суток. В отдельных случаях, особенно у пациентов молодого возраста, могут быть необходимы более короткие интервалы между приемами или высокие дозы.
В течение курса лечения рекомендуется определять уровни фактора VIII для установления необходимой дозы и частоты повторных введений. В случае обширных оперативных вмешательств обязательным является тщательный контроль заместительной терапии с помощью анализа коагуляции (активность фактора VIII в плазме крови). Отдельные пациенты могут иметь разную ответ на фактор VIII, демонстрируя различные периоды полувыведения и восстановления.
способ применения
Применяется внутривенно путем инъекции или медленной инфузии.
При внутривенной инъекции препарат рекомендуется вводить в течение 3-5 минут и контролировать при этом частоту пульса у пациентов, прерывая ввода или снижая скорость введения при повышении частоты пульса.
Скорость инфузии для каждого пациента следует определять индивидуально.
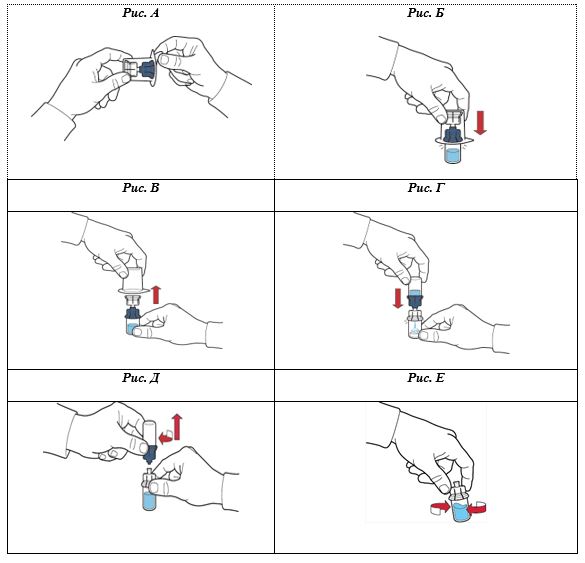
Восстановление порошка растворителем:
- Флакон с порошком и флакон с растворителем довести до комнатной температуры.
- Комнатную температуру следует поддерживать в течение всего процесса восстановления (максимум 10 минут).
- Снять защитные колпачки с флакона с порошком и флакона с растворителем.
- Обработать поверхности пробок на обоих флаконах этиловым спиртом.
- Открыть упаковку устройства, осторожно видшарувавшы верхнюю крышку, не касаясь внутренней части упаковки (рис. А).
- Не вынимать устройство из упаковки.
- Перевернуть упаковку с устройством и ввести пластиковый шип через пробку флакона с растворителем таким образом, чтобы синяя часть устройства соединилась с флаконом с растворителем (рис. Б).
- Удерживая за край упаковки устройства, удалить ее, не касаясь самого устройства (рис. В).
- Убедиться, что флакон с порошком находится на безопасном поверхности; перевернуть систему так, чтобы флакон с растворителем был над устройством; нажать на прозрачный адаптер на пробке флакона с порошком так, чтобы ввести пластиковый шип через пробку флакона с порошком; растворитель автоматически переместится во флакон с порошком (рис. Г).
- После перемещения растворителя открутить синюю часть системы, в которую подключен флакон растворителя, и удалить ее (рис. Д).
- Осторожно встряхивать флакон до полного растворения порошка (рис. Е).
- НЕ встряхивать флакон энергично, чтобы избежать пенообразования.
введение раствора
После восстановления раствор может содержать незначительное количество небольших хлопьев или частиц.
Перед введением восстановлен раствор следует визуально проверить на наличие частиц или изменение цвета. Раствор должен быть прозрачным или слегка опалесцирующий. Не использовать, если раствор мутный или содержит осадок.
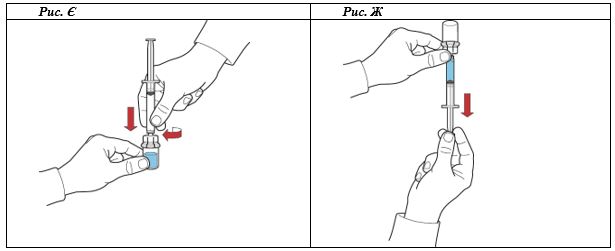
- Оттягивая поршень, заполнить шприц воздухом, подсоединить к устройству и ввести воздуха во флакон с восстановленным раствором (рис. Е).
- Сохраняя поршень в том же положении, перевернуть систему вверх дном так, чтобы флакон с восстановленным раствором находился над устройством, и медленно оттягивая поршень, набрать концентрат в шприц (рис. Ж).
- Отсоединить шприц, поворачивая его против часовой стрелки.
- Визуально проверить раствор в шприце, он должен быть прозрачным или слегка опалесцирующий и не содержать частиц.
- Подсоединить к шприцу иглу-бабочку и ввести препарат внутривенно путем инфузии или медленной инъекции.
Содержание открытых флаконов следует использовать немедленно.
Набранный в шприц восстановлен раствор следует использовать немедленно.
Содержимое флакона следует использовать только для одного ввода.
Запрещено применение препарата по истечении срока годности, указанного на упаковке.
Любой неиспользованный препарат или остатки следует уничтожить соответствии с местными требованиями.
Дети
Специфические данные в отношении детей отсутствуют. Безопасность и эффективность применения препарата ЕМОКЛОТ детям до 12 лет не установлены. Дозировка подросткам (12-18 лет) для каждого показания рассчитывается по массе тела.
Передозировка
О симптомах передозировки фактором свертывания крови человека VIII не сообщалось.
Побочные эффекты
Повышенная чувствительность или аллергические реакции (в том числе ангионевротический отек, жгучий и острый боль в месте инфузии, озноб, приливы, ґенерализована крапивница, головная боль, сыпь, гипотония, летаргия, тошнота, беспокойство, тахикардия, стеснение в груди, покалывание, рвота и дыхания с присвистом) наблюдаются редко и в некоторых случаях могут прогрессировать до тяжелой анафилаксии (включая шок).
Также наблюдалось повышение температуры.
У пациентов с гемофилией А, получающих лечение препаратами фактора VIII, включая ЕМОКЛОТ, могут развиться нейтрализующие антитела (ингибиторы). В случае появления ингибиторов это состояние проявляться как недостаточная клиническая ответ. В таких случаях рекомендуется обратиться в специализированный центр гемофилии.
Информацию по безопасности о передаче возбудителей инфекций см. в разделе «Особенности применения».
Побочные эффекты, которые могут возникать при применении фактора свертывания крови человека VIII, представлены в таблице 3 в соответствии с классификацией систем органов MedDRA (КСО) и сроков преимущественного использования.
Частота оценивалась по таким условным категориям: очень часто (≥1 / 10); часто (≥1 / 100 до <1/10); нечасто (≥1 / 1000 до <1/100); редко (≥1 / 10000 до <1/1 000) очень редко (<1/10 000), частота неизвестна (невозможно оценить по имеющимся данным).
Подтвержденные данные о частоте побочных реакций в клинических исследованиях отсутствуют.
Нижеприведенные данные основываются на профиле безопасности фактора свертывания крови человека VIII и частично наблюдались в постмаркетинговом периоде (постмаркетинговый опыт применения препарата); поскольку сообщение о постмаркетинговые побочные реакции осуществляются на добровольной основе и касаются популяции неизвестной численности, отсутствует возможность оценить частоту этих реакций.
Таблица 3
Системы органов MedDRA | побочная реакция | Частота |
Со стороны крови и лимфатической системы | Появление ингибиторов фактора VIII | Нечасто (PRL) ** Очень часто (ПРН) ** |
Со стороны иммунной системы | повышенная чувствительность | Неизвестная |
аллергические реакции (Повышенная чувствительность) * | Неизвестная | |
анафилактическая реакция | Неизвестная | |
анафилактический шок | Неизвестная | |
психические расстройства | беспокойство | Неизвестная |
Со стороны нервной системы | Головная боль | Неизвестная |
летаргия | Неизвестная | |
Парестезия | Неизвестная | |
Со стороны сердца | тахикардия | Неизвестная |
Со стороны сосудов | приливы | Неизвестная |
гипотония | Неизвестная | |
Респираторные, торакальные и медиастинальные расстройства | Дыхание с присвистом | Неизвестная |
Желудочно-кишечные расстройства | тошнота | Неизвестная |
рвота | Неизвестная | |
Со стороны кожи и подкожной клетчатки | ангионевротический отек | Неизвестная |
Ґенерализована крапивница (крапивница) * | Неизвестная | |
Сыпь (крапивница) * | Неизвестная | |
Системные нарушения и реакции в месте введения | Жгучая боль в месте инфузии (боль в месте инфузии) | Неизвестная |
Острая боль в месте инфузии (боль в месте инфузии) * | Неизвестная | |
Озноб | Неизвестная | |
Сжатия в груди (дискомфорт в груди) | Неизвестная | |
пирексия | Неизвестная |
* Сроки MedDRA низшего уровня, больше соответствуют описанию этих побочных реакций; в скобках приводится срок преимущественного использования MedDRA.
** Данные о частоте основываются на результатах исследований всех препаратов фактора VIII, которые включали пациентов с тяжелой гемофилией А. ПРЛ - пациенты, ранее леченные, ПРН - пациенты, ранее леченные.
дети
Специфические данные в отношении детей отсутствуют.
Сообщение о подозреваемых побочные реакции
После регистрации лекарственного средства сообщения о подозреваемых побочные реакции является важным, поскольку это дает возможность продолжить контролировать соотношение польза / риск применения лекарственного средства. О любых подозреваемые побочные реакции медицинским работникам следует сообщать через национальную систему сообщений.
Срок годности Емоклот
3 года.
Растворитель (вода для инъекций) - 5 лет.
Препарат должен быть использован сразу после растворения.
Условия хранения Емоклот
Хранить в холодильнике (при температуре от 2 до 8 ℃). Не замораживать . Хранить в оригинальной упаковке с мето ю защиты от света, в недоступном для детей месте.
Перед применением лекарственного средства и в течение его срока годности флакон с порошком можно хранить при комнатной температуре, не превышающей 25 ℃, в течение 6 месяцев подряд . После этого пер иоду флакон с порошком следует уничтожить.
После хранения флакона с порошком при комнатной температуре запрещается его дальнейшее хранение в холодильнике.
Данные о дате начала хранения лекарственного средства при комнатной температуре следует указывать на оригинальной упаковке лекарственного средства в специальном отведенном для этого месте.
Несовместимость.
Из-за отсутствия исследований совместимости этот препарат нельзя смешивать с другими лекарственными средствами.
Следует использовать только набор для инъекции / инфузии, входящий в комплект, так как лечение может быть неэффективным из-за адсорбции фактора свертывания крови человека VIII на внутренних поверхностях другого устройства ввода.
Упаковка
По 500 МЕ или 1000 МЕ во флаконе № 1 в комплекте с растворителем (вода для инъекций) по 10 мл во флаконе №1 и набором для растворения и введения в картонной коробке.
Категория отпуска
По рецепту.
Производитель
КЕДРИОН С.П.А.
Местонахождение производителя
ВИА ПРОВИНСИАЛЕ (лок. БОЛОГНАНА) - 55027 Галликано (ЛУ), Италия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Емоклот только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- КЕДРИОН С.П.А.
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Емоклот |
| Производитель: | КЕДРИОН С.П.А. |
| Форма выпуска: | порошок и растворитель для приготовления раствора для инфузий, 500 МЕ / 10 мл или 1000 МЕ / 10 мл по 1000 МЕ во флаконе № 1 в комплекте с растворителем (вода для инъекций) по 10 мл во флаконе № 1 и набором для растворения и введения в картонной коробке |
| Регистрационное удостоверение: | UA/17394/01/01, UA/17394/01/02 |
| Дата начала: | 08.05.2019 |
| Дата окончания: | 05.08.2024 |
| МНН: | Coagulation factor VIII |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон с порошком содержит фактора свертывания крови человека VIII 1000 МЕ |
| Фармакологическая группа: | Антигеморрагические средства, фактор свертывания крови VIII. |
| Код АТХ: | B02BD02 |
| Заявитель: | КЕДРИОН С.П.А. |
| Страна заявителя: | Италия |
| Адрес заявителя: | ЛОКАЛИТА АЙ КОНТИ, КАСТЕЛЬВЕККИО Пасколо, 55051 Барг, Лукка (ЛУ), ИТАЛIЯ |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| B | Средства, влияющие на систему крови и гемопоэз |
| B02 | Антигеморрагические средства |
| B02B | Витамин k и другие гемостатические средства |
| B02BD | Факторы свертывания крови |
| B02BD02 |
Фактор свертывания крови viii
|