- Общая характеристика
- МНН
- Описание
- Состав
- Форма выпуска
- Фармакотерапевтическая группа
- Фармакологические свойства
- Показания к применению
- Способ применения и дозировка
- Побочные действия
- Противопоказания
- Передозировка
- Меры предосторожности
- Дети
- Период беременности
- Управление автомобилем
- Взаимодействие
- Условия и срок хранения
- Упаковка
- Правила отпуска
- Информация о производителе
Валган инструкция по применению
Официальная инструкция лекарственного препарата Валган таблетки 450мг. Описание и применение Valgan, аналоги и отзывы. Инструкция Валган таблетки утвержденная компанией производителем.
Общая характеристика
Международное непатентованное наименование
Valganciclovir.
Описание
Таблетки розового цвета, овальные, двояковыпуклые, покрытые плёночной оболочкой, с гравировкой «J» с одной стороны и «156» с другой стороны.
Состав лекарственного средства
Одна таблетка содержит:
активное вещество: валганцикловир (в виде валганцикловира гидрохлорида) 450 мг;
вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, повидон, стеариновая кислота;
оболочка: гипромеллоза, титана диоксид (Е 171), макрогол/ПЭГ 400, железа оксид красный (Е 172), полисорбат 80.
Форма выпуска
Таблетки, покрытые оболочкой.
Фармакотерапевтическая группа
Противовирусные средства прямого действия. Нуклеозиды и нуклеотиды, исключая ингибиторы обратной транскриптазы.
Код АТС: J05AB14.
Фармакологические свойства
Валган Показания к применению
Индукционная и поддерживающая терапия ЦМВ-ретинита у взрослых пациентов со СПИДом.
Профилактика ЦМВ-инфекции после трансплантации солидных органов от ЦМВ-позитивных доноров у ЦМВ-негативных взрослых и детей (возраст: от рождения до 18 лет).
Способ применения Валган и дозировка
Во избежание передозировки следует строго соблюдать рекомендации по дозированию. Валганцикловир быстро и интенсивно метаболизируется до ганцикловира после перорального приема. Доза принятого перорально валганцикловира 900 мг 2 раза в сутки терапевтически эквивалентна дозе введенного внутривенно ганцикловира 5 мг/кг два раза в сутки.
Способ применения
Валганцикловир следует принимать внутрь, по возможности, после еды.
Детям, которые не способны проглотить таблетку, назначают валганцикловир в виде порошка для приготовления раствора для приема внутрь.
Таблетки нельзя разламывать или размельчать. Поскольку валганцикловир потенциально тератогенен и канцерогенен для человека, необходимо соблюдать осторожность, если таблетка разломилась. Следует избегать прямого контакта разломившейся или размельченной таблетки с кожей и слизистыми оболочками. В случаях такого контакта нужно тщательно промыть это место водой с мылом; при попадании в глаза их следует тщательно промыть стерильной водой или обычной водой, если стерильная вода не доступна.
Терапия ЦМФ-ретинита
Взрослые
Индукционная терапия ЦМВ-ретинита
У пациентов с активным ЦМВ-ретинитом рекомендованная доза валганцикловира составляет 900 мг (2 таблетки по 450 мг) 2 раза в сутки в течение 21 дня. Длительная индукционная терапия повышает риск миелотоксичности.
Поддерживающая терапия ЦМВ-ретинита
После проведения курса индукционной терапии или у пациентов с неактивным ЦМВ-ретинитом рекомендованная доза составляет 900 мг (2 таблетки по 450 мг) 1 раз в сутки. Если течение ретинита ухудшается, курс индукционной терапии можно повторить. Однако при рассмотрении этого вопроса следует учитывать возможность возникновения резистентности к противовирусным лекарственным средствам.
Профилактика ЦМВ-инфекции после трансплантации солидных органов
Взрослые
Пациентам, перенесшим трансплантацию почки, необходимо начать терапию валганцикловиром в течение первых 10 дней после операции в дозе 900 мг (2 таблетки по 450 мг) 1 раз в сутки и продолжать терапию по 200-е сутки посттрансплантационного периода. Пациентам, перенесшим трансплантацию других солидных органов, необходимо начать терапию валганцикловиром в течение первых 10 дней после операции в дозе 900 мг (2 таблетки по 450 мг) 1 раз в сутки и продолжать терапию по 100-е сутки посттрансплантационного периода.
Дети
Для детей, перенесших трансплантацию солидных органов, имеющих риск развития ЦМВ-инфекции, рассчитывают дозу валганцикловира для приема один раз в сутки по следующей формуле:
Доза (мг) = 7 × ППТ × КК
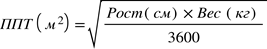 по формуле Мостеллера
по формуле Мостеллера
Если вычисленный по формуле Шварца клиренс креатинина (КК) превышает 150 мл/мин/1,73м2, в формуле для расчета дозы у детей должно быть использовано максимальное значение 150 мл/мин/1,73м2.
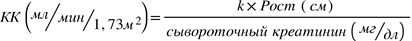
k = 0,45* для детей < 2 лет,
k = 0,55 для мальчиков от 2 до < 13 лет и девочек от 2 до < 16 лет,
k = 0,7 для мальчиков от 13 до 16 лет.
Для пациентов старше 16 лет применяют схему лечения как для взрослых.
* для некоторых пациентов может быть использовано более низкое значение к (например, дети с низким весом при рождении).
Для детей, перенесших трансплантацию почки, прием валганцикловира в рекомендуемой дозе (7 × ППТ × КК) один раз в сутки начинают в пределах 10 дней после трансплантации и продолжают до 200 дней после трансплантации.
Для детей, перенесших трансплантацию других солидных органов, прием валганцикловира в рекомендуемой дозе (7 × ППТ × КК) один раз в сутки начинают в пределах 10 дней после трансплантации и продолжают до 100 дней после трансплантации. С учетом того, что минимальная доза составляет 25 мг (0,5 мл), рассчитанная по формуле доза округляется в сторону увеличения до ближайшего значения, кратного 25. Если рассчитанная доза превышает 900 мг, то максимальная доза при назначении составляет 900 мг. Валганцикловир в форме раствора для прием внутрь более предпочтителен, поскольку представляется возможность применения дозы, вычисленной по приведенной выше формуле. Однако, для таблетированной формы валганцикловира данная формула может быть использована, если вычисленные дозы находятся в пределах 10% от дозы, содержащейся в таблетке 450 мг. Например, если вычисленная доза валганцикловира находится в пределах 405-495 мг, то может быть принята таблетка 450 мг.
Рекомендуется контролировать концентрацию креатинина в сыворотке и учитывать изменение роста и веса тела и по мере необходимости адаптировать дозу в течение периода профилактики.
Особые указания по дозированию
Пациенты детского возраста
Дозирование у детей, перенесших трансплантацию солидных органов, определяется индивидуально, исходя из функции почек, роста и веса пациента.
Пациенты пожилого возраста
Эффективность и безопасность у пожилых пациентов не установлены. Не проводилось исследований на пациентах старше 65 лет. Принимая во внимание снижение клиренса креатинина с возрастом, при назначении валганцикловира пожилым пациентам необходимо принимать во внимание функцию почек (см. раздел «Пациенты с почечной недостаточностью»).
Пациенты с почечной недостаточностью
Необходимо контролировать уровень креатинина в сыворотке крови или клиренса креатинина (КК). Коррекцию дозы у взрослых пациентов проводят в зависимости от КК, как это показано в таблице ниже.
КК (мл/мин) рассчитывается в зависимости от концентрации креатинина в сыворотке крови по следующей формуле:

Таблица 1
| Клиренс креатинина (мл/мин) | Доза для индукционной терапии | Доза для поддерживающей терапии/профилактики |
| ≥ 60 | 900 мг 2 раза в сутки | 900 мг 1 раз в сутки |
| 40-59 | 450 мг 2 раза в сутки | 450 мг 1 раз в сутки |
| 25-39 | 450 мг 1 раз в сутки | 450 мг каждые 2 дня |
| 10-24 | 450 мг каждые 2 дня | 450 мг 2 раза в неделю |
| < 10 | противопоказано | противопоказано |
Пациенты, находящиеся на гемодиализе
Для пациентов на гемодиализе (КК менее 10 мл/мин) невозможно дать рекомендации по дозированию, поэтому не рекомендуется назначать валганцикловир таким пациентам.
Пациенты с печеночной недостаточностью
Эффективность и безопасность не установлены у пациентов с печеночной недостаточностью.
Пациенты с тяжелой лейкопенией, нейтропенией, анемией, тромбоцитопенией или панцитопенией
Рекомендации по применению см. в разделе «Меры предосторожности».
Пациентам с тяжелой лейкопенией, нейтропенией, анемией и/или тромбоцитопенией рекомендуется назначать гемопоэтические факторы роста и/или прерывать прием лекарственного средства (см. раздел «Меры предосторожности»).
Побочные действия
Данные клинических исследований
Валганцикловир представляет собой пролекарство ганцикловира, которое после приема внутрь быстро превращается в ганцикловир, поэтому все известные нежелательные эффекты, связанные с приемом ганцикловира, являются ожидаемыми для валганцикловира. Все нежелательные явления, зарегистрированные в клинических исследованиях валганцикловира, раньше наблюдались при приеме ганцикловира.
Наиболее частыми и серьезными нежелательными реакциями при приеме валганцикловира/ганцикловира были такие гематологические реакции как нейтропения, анемия и тромбоцитопения.
Частота реакций указана в соответствии со следующей классификацией: очень часто (≥ 1/10), часто (≥ 1/100 до < 1/10), нечасто (≥ 1/1000 до <1/100), редко (≥ 1/10000 до < 1/1000) и очень редко (< 1/10000).
Общий профиль безопасности для ганцикловира/валганцикловира согласуется с популяциями ВИЧ и трансплантатов, за исключением того, что отслойка сетчатки наблюдается только у пациентов с ЦМВ-ретинитом. Однако есть некоторые различия в частоте побочных реакций. Прием валганцикловира ассоциирован с более высоким риском диареи по сравнению с внутривенным введением ганцикловира. Пирексия, кандидоз, депрессия, тяжелая нейтропения (< 500/ мкл) и кожные реакции чаще встречаются у пациентов с ВИЧ. Почечная и печеночная дисфункция чаще встречается у реципиентов трансплантата органов.
Инфекционные и паразитарные заболевания
Очень часто: кандидоз, включая кандидоз слизистой оболочки полости рта, инфекция верхних дыхательных путей.
Часто: сепсис, инфекции мочевыводящих путей, грипп, целлюлит.
Со стороны крови и лимфатической системы
Очень часто: нейтропения, анемия.
Часто: тромбоцитопения, лейкопения, панцитопения.
Нечасто: угнетение костного мозга.
Редко: апластическая анемия, агранулоцитоз*, гранулоцитопения*.
Со стороны иммунной системы:
Часто: гиперчувствительность.
Редко: анафилактические реакции*.
Со стороны обмена веществ и питания
Часто: снижение аппетита.
Редко: снижение веса.
Нарушения психики
Часто: депрессия, спутанность сознания, тревожность.
Нечасто: возбуждение, психотическое расстройство, патологическое мышление, галлюцинации.
Со стороны нервной системы:
Очень часто: головная боль.
Часто: бессонница, периферическая нейропатия, головокружение, парестезии, гипестезия, судороги, дисгевзия (нарушение вкусового восприятия).
Нечасто: тремор.
Со стороны органа зрения
Часто: нарушение зрения, отслойка сетчатки, помутнение стекловидного тела, боль в глазах, конъюнктивит, макулярный отек.
Со стороны органа слуха и лабиринтные нарушения
Часто: боль в ухе.
Нечасто: глухота.
Со стороны сердца
Нечасто: аритмия.
Со стороны сосудов
Часто: гипотензия.
Со стороны дыхательной системы, органов грудной клетки и средостения
Очень часто: одышка, кашель.
Со стороны желудочно-кишечного тракта
очень часто: диарея, тошнота, рвота, абдоминальные боли.
Часто: диспепсия, метеоризм, боли в верхней части живота, запор, язвенный стоматит, дисфагия, вздутие живота, панкреатит.
Со стороны печени и желчевыводящих путей
Часто: повышение уровня щелочной фосфатазы, нарушение функции печени, повышение уровня ACT (аспартатаминотрансферазы), повышение уровня ААТ (аланинаминотрансферазы).
Со стороны кожи и подкожных тканей
очень часто: дерматит.
Часто: ночная потливость, зуд, сыпь, алопеция.
Нечасто: сухость кожи, крапивница.
Со стороны скелетно-мышечной и соединительной ткани
Часто: боль в спине, миалгия, артралгия, спазм мускулатуры.
Со стороны почек и мочевыводящих путей
Часто: нарушение функции почек, снижение почечного клиренса креатинина, повышение уровня креатинина в крови.
Нечасто: почечная недостаточность, гематурия.
Со стороны половых органов и молочной железы
Нечасто: мужское бесплодие.
Общие расстройства и нарушения в месте введения
очень часто: лихорадка (пирексия), усталость.
Часто: боль, озноб, недомогание, слабость.
Нечасто: боль в груди.
* - частота побочных реакций была установлена в постмаркетинговом периоде
** - отслоение сетчатки наблюдалось только у пациентов с ВИЧ при терапии ЦМВ-ретинита.
Описание отдельных побочных реакций
Нейтропения
Риск нейтропении невозможно прогнозировать на основе количества нейтрофилов до начала терапии. Нейтропения обычно возникает в течение первой или второй недели индукционной терапии. Количество клеток обычно нормализуется в течение 2-5 дней после прекращения приема или снижения дозы (см. раздел «Меры предосторожности»).
Тромбоцитопения
Пациенты с низким исходным количеством тромбоцитов (<100 000/мкл) имеют повышенный риск развития тромбоцитопении. Пациенты с ятрогенной иммуносупрессией из-за терапии иммуносупрессивными препаратами подвергаются большему риску тромбоцитопении, чем пациенты со СПИДом (см. раздел «Меры предосторожности»). Тяжелая тромбоцитопения может быть связана с потенциально угрожающим жизни кровотечением.
Влияние продолжительности лечения или показаний на побочные реакции
Тяжелая нейтропения (АЧН <500/мкл) наблюдается чаще у пациентов с ЦМВ-ретинитом (14%) при приеме валганцикловира или ганцикловира (внутрь или внутривенно), чем у пациентов после трансплантации солидных органов, которые получали валганцикловир или ганцикловир перорально до 100 дней после трансплантации. Случаи тяжелой нейтропении составили 5% и 3% соответственно, тогда как у пациентов, получавших валганцикловир до 200 дней после трансплантации, случаи тяжелой нейтропении составили 10%.
Наблюдалось более значимое повышение уровня креатинина в крови у пациентов после трансплантации солидных органов, принимавших до 100 или 200 дней после трансплантации валганцикловир и ганцикловир перорально, по сравнению в с пациентами с ЦМВ-ретинитом. Однако нарушение функции почек является характерной особенностью для пациентов, перенесших трансплантацию органов.
Общий профиль безопасности валганцикловира не меняется при увеличении периода профилактического применения до 200 дней у пациентов после пересадки почки из группы высокого риска. У пациентов, получающих валганцикловир до 200-го дня посттрансплантационного периода, по сравнению с пациентами, получающих валганцикловир до 100-го дня посттрансплантационного периода, наблюдается некоторое увеличение частоты лейкопении. Частота развития нейтропении, анемии и тромбоцитопении сходна у пациентов, получающих лечение до 100-го дня и 200-го дня посттрансплантационного периода.
Дети
Применение валганцикловира было исследовано на 179 пациентах детского возраста, перенесших трансплантацию солидных органов и имеющих риск развития ЦМВ-расстройств (в возрасте от 3 недель до 16 лет), и на 133 новорожденных с симптоматической врожденной ЦМВ-инфекцией (в возрасте от 2 дней до 31 дня) при продолжительности терапии ганцикловиром от 2 до 200 дней.
Наиболее частыми побочными реакциями в клинических исследованиях у педиатрических пациентов были диарея, тошнота, нейтропения, лейкопения и анемия. Общий профиль безопасности валганцикловира у детей после трансплантации органов не отличается от профиля безопасности у взрослых. Незначительное увеличение случаев нейтропении у детей после трансплантации по сравнению со взрослыми было описано в двух исследованиях, однако при этом отсутствовала корреляция между нейтропенией и инфекционными проявлениями у детей и (см. раздел «Меры предосторожности»).
У детей после трансплантации почек продолжение экспозиции валганцикловира до 200 дней не было связано с общим увеличением частоты побочных эффектов. Частота тяжелой нейтропении (АЧН <500/мкм) была выше у детей с заболеваниями почек, получавших лечение до 200 дней, по сравнению с детьми, которые принимали валганцикловир до 100 дней, и по сравнению со взрослыми пациентами после трансплантации почек, получавших лечение до 100 или 200 дней (см. раздел «Меры предосторожности»).
Имеются ограниченные данные о новорожденных или младенцах с симптоматической или врожденной ЦМВ-инфекцией, получавших лечение валганцикловиром, однако, профиль безопасности соответствует известному профилю безопасности валганцикловира/ ганцикловира.
Сообщение о нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного средства с целью обеспечения непрерывного мониторинга соотношения «польза - риск» лекарственного средства.
В случае возникновения нежелательных реакций, в том числе, не указанных в инструкции по медицинскому применению, пациентам следует обратиться к врачу.
Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного средства через национальную систему сообщения о нежелательных реакциях ().
Противопоказания Валган
Повышенная чувствительность к валганцикловиру, ганцикловиру или любому компоненту лекарственного средства. Из-за сходного химического строения ацикловира, валацикловира и валганцикловира возможны реакции перекрестной чувствительности к этим веществам. Поэтому валганцикловир противопоказан пациентам с гиперчувствительностью к ацикловиру или валацикловиру.
Противопоказан при беременности, во время кормления грудью, а также мужчинам, желающим зачать ребенка.
Передозировка
У одного взрослого пациента при применении валганцикловира в течение нескольких дней в дозах не менее чем 10-кратно превышающих рекомендованные с учетом нарушения функции почек (снижение клиренса креатинина) развилось угнетение костного мозга (медуллярная аплазия) с летальным исходом.
Возможно, что передозировка валганцикловира может привести к увеличению нефротоксичности. Снизить концентрации валганцикловира в плазме у пациентов с передозировкой можно путем гемодиализа и гидратации.
Передозировка ганцикловира при внутривенном введении
Поскольку валганцикловир быстро и в значительной степени преобразуется в ганцикловир, нежелательные явления, наблюдаемые при передозировке ганцикловира, могут быть ожидаемыми и при передозировке валганцикловиром.
В ходе клинических исследований и постмаркетингового применения препарата были описаны случаи передозировки ганцикловира при внутривенном введении. Некоторые из них не сопровождались нежелательными явлениями. У большинства же пациентов отмечалось одно или несколько из следующих нежелательных явлений:
гематотоксичность: панцитопения, угнетение функции костного мозга, медуллярная аплазия, лейкопения, нейтропения, гранулоцитопения;
гепатотоксичность: гепатит, нарушение функции печени;
нефротоксичность: усиление гематурии у больных с уже имеющимся нарушением функции почек, острая почечная недостаточность, повышение концентрации креатинина в сыворотке крови;
желудочно-кишечная токсичность: боли в животе, диарея, рвота;
нейротоксичность: генерализованный тремор, судороги.
Меры предосторожности
Перекрестная чувствительность
Из-за сходства химической структуры ганцикловира с такими веществами, как ацикловир и пенцикловир, возможны реакции перекрестной чувствительности при приеме этих веществ (или их пролекарств, валацикловира или фамцикловира соответственно).
Мутагенность, тератогенность, канцерогенность, фертильность и контрацепция
Перед началом терапии валганцикловиром пациенты должны быть предупреждены о потенциальном риске для плода.
В экспериментах на животных было выявлено мутагенное, тератогенное, асперматогенное и канцерогенное действие ганцикловира. Валганцикловир следует считать потенциальным тератогеном и канцерогеном для человека, применение которого может вызывать врожденные пороки развития и рак. На основании данных клинических и доклинических исследований предполагают, что валганцикловир может временно или необратимо подавлять сперматогенез. Женщинам детородного возраста в процессе лечения необходимо применять эффективные методы контрацепции. Мужчинам при приеме валганцикловира и не менее 90 дней после приема рекомендуется применять барьерные контрацептивы (см. раздел «Применение в период беременности и лактации, влияние на фертильность»). В долгосрочной перспективе валганцикловир потенциально может демонстрировать канцерогенность и репродуктивную токсичность.
Миелосупрессия
У пациентов, получающих валганцикловир (и ганцикловир), отмечались случаи тяжелой лейкопении, нейтропении, анемии, тромбоцитопении, панцитопении, угнетения функции костного мозга и апластической анемии. Лечение не следует начинать, если абсолютное число нейтрофилов меньше 500 клеток в 1 мкл или число тромбоцитов меньше 25000 клеток в 1 мкл, а также в случае, если гемоглобин ниже 8 г/дл (см. раздел «Способ применения и дозировка» и «Побочное действие»). При увеличении сроков профилактики свыше 100 дней следует учитывать возможный риск развития лейкопении и нейтропении. Валганцикловир применяют с осторожностью у пациентов с уже существующей гематологической цитопенией или лекарственной гематологической цитопенией в анамнезе, а также у пациентов, получавших лучевую терапию.
В ходе лечения рекомендуется регулярно проводить контроль развернутой формулы крови и тромбоцитов. Усиленный гематологический контроль, по крайней мере, каждый раз при посещении трансплантационного центра может быть оправдан у пациентов с почечной недостаточностью и детей. Пациентам с тяжелой лейкопенией, нейтропенией, анемией и/или тромбоцитопенией рекомендуется назначать гемопоэтические факторы роста и/или прерывать прием лекарственного средства.
Различия в биодоступности с ганцикловиром при приеме внутрь
Биодоступность ганцикловира после однократной дозы 900 мг валганцикловира составляет около 60% по сравнению с 6% после перорального приема 1000 мг ганцикловира (в форме капсул). Передозировка ганцикловира может быть связана с угрожающими жизни побочными реакциями. Следует соблюдать рекомендации по режиму дозирования в начале лечения, при переходе от индукционной терапии к поддерживающей, а также при переходе с перорального приема ганцикловира на валганцикловир, поскольку таблетки валганцикловира нельзя заменить на капсулы ганцикловира в соотношении 1:1. Пациентов при переводе с капсул ганцикловира необходимо информировать о риске передозировки, если они будут принимать большее число таблеток валганцикловира, чем рекомендовано (см. «Способы применения и дозировка» и «Передозировка»).
Нарушение функции почек
У пациентов с нарушением функции почек необходимо рассчитывать дозу в зависимости от клиренса креатинина (см. раздел «Способы применения и дозировка»). Таблетки валганцикловира не следует применять у пациентов на гемодиализе.
Применение с другими лекарственными средствами
У пациентов, применявших имипенем/циластатин и ганцикловир, наблюдались судороги. Поэтому совместное применение валганцикловира с имипенем/циластатином следует избегать кроме тех случаев, когда потенциальная польза превышает возможный риск (см. «Взаимодействие с другими лекарственными средствами»).
Следует тщательно отслеживать симптомы токсического воздействия у пациентов, принимающих вал ганцикловир и диданозин, лекарственные средства, оказывающие миелосупрессивное действие (например, зидовудин) или нарушающие функцию почек (см. «Взаимодействие с другими лекарственными средствами»).
В контролируемых клинических исследованиях с применением валганцикловира для профилактики ЦМВ-инфекции после трансплантации органов не были включены пациенты после пересадки легкого и кишечника, поэтому опыт применения в данной группе пациентов ограничен.
Правила обращения с лекарственным средством
Попадание лекарственных средств в окружающую среду должно быть сведено к минимуму. Не следует утилизировать лекарственное средство с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных средств.
Дети
Безопасность и эффективность лечения ЦМВ-ретинита у детей не изучалась.
Применение в период беременности и кормления грудью
Фертильность
Небольшое клиническое исследование на пациентах, перенесших трансплантацию почки и получавших валганцикловир для профилактики ЦМВ до 200 дней, продемонстрировало влияние валганцикловира на сперматогенез: после завершения лечения было зафиксировано обратимое уменьшение плотности и подвижности сперматозоидов. Через шесть месяцев после отмены валганцикловира средняя плотность и подвижность восстанавливается до уровней, сравнимых с контрольными.
В исследованиях на животных ганцикловир в клинически значимых дозах нарушал фертильность у мышей мужского и женского пола, ингибировал сперматогенез и индуцировал атрофию яичек у мышей, крыс и собак.
Исходя из данных клинических и доклинических исследований, считается, что ганцикловир (и валганцикловир) может вызвать временное или постоянное ингибирование сперматогенеза человека.
Контрацепция у мужчин и женщин
Во время лечения валганцикловиром и, как минимум, 30 дней после окончания курса лечения женщинам детородного возраста следует использовать надежные методы контрацепции. Мужчинам рекомендуется использовать барьерный метод контрацепции во время лечения и не менее 90 дней после его окончания, за исключение случаев, когда вероятность беременности у партнерши исключена.
Беременность
Безопасность применения валганцикловира при беременности у человека не установлена. Активный метаболит ганцикловир легко проникает через плаценту. На основании фармакологического механизма действия и репродуктивной токсичности, наблюдавшейся в исследовании на животных с применением ганцикловира, существует риск тератогенного действия у человека. При беременности назначения валганцикловира следует избегать, за исключением случаев, когда потенциальный положительный эффект лечения для матери оправдывает возможный риск для плода.
Кормление грудью
Исследований влияния валганцикловира и ганцикловира на пери- и постнатальное развитие не проводилось, при этом нельзя исключить возможность выделения ганцикловира с грудным молоком и развития серьезных побочных реакций у грудного ребенка. Результаты исследований на животных подтвердили, что ганцикловир выделяется в грудное молоко у крыс. В случае необходимости применения валганцикловира в период лактации необходимо прекратить грудное вскармливание.
Способность влиять на скорость реакции при управлении транспортом
Влияние валганцикловира на способность управлять автомобилем и потенциально опасными механизмами не изучалась.
При лечении валганцикловиром и/или ганцикловиром возможно возникновение судорог, седации, головокружения, атаксии и/или спутанности сознания, что может отрицательно повлиять на деятельность, требующую повышенной концентрации внимания, включая управление транспортными средствами и работу с машинами и механизмами. В связи с этим в период лечения валганцикловиром следует соблюдать осторожность при управлении транспортными средствами и работе с машинами и механизмами. При появлении описанных нежелательных явлений следует воздержаться от выполнения указанных видов деятельности.
Взаимодействие с другими лекарственными средствами
Лекарственные взаимодействия валганцикловира
Исследований in vitro взаимодействия лекарственных средств с валганцикловиром не проводилось. Валганцикловир быстро метаболизируется в ганцикловир, поэтому взаимодействия, характерные для ганцикловира, ожидаются и для валганцикловира.
Лекарственные взаимодействия ганцикловира
Степень связывания ганцикловира с белками плазмы составляет лишь 1-2%, поэтому реакций, связанных с замещением белкового связывания, не ожидается.
Имипенем/циластатин: при одновременном применении ганцикловира и имипенема/ циластатина у пациентов отмечались судороги. Следует избегать одновременного применения валганцикловира и имипенема/циластатина в случаях, если потенциальные преимущества лечения не превышают возможный риск.
Пробенецид: одновременный пероральный прием пробенецида приводил к статистически значимому снижению почечного клиренса ганцикловира (20%) и к увеличению продолжительности его действия (40%). Это объясняется механизмом взаимодействия - конкуренцией за канальцевую почечную экскрецию. Пациенты, принимающие одновременно пробенецид и валганцикловир, должны находиться под тщательным наблюдением из-за возможного токсического действия ганцикловира.
Зидовудин: при одновременном применении с пероральным ганцикловиром отмечалось небольшое, но статистически значимое увеличение AUC зидовудина (17%); кроме того, отмечалась статистически незначимая тенденция к снижению концентрации ганцикловира. Поскольку как зидовудин, так и ганцикловир могут вызывать нейтропению и анемию, у некоторых пациентов может отмечаться непереносимость при одновременном приеме валганцикловира и зидовудина в полных дозах.
Диданозин: было выявлено стойкое увеличение концентрации диданозина в плазме при одновременном применении с ганцикловиром (как при внутривенном, так и при пероральном способе применения). В случае перорального приема ганцикловира в дозе 3 г и 6 г в сутки отмечалось увеличение AUC диданозина на 84-124%, при внутривенном введении ганцикловира в дозах 5-10 мг/кг/сутки AUC диданозина увеличивалась на 38-67%. Это повышение нельзя объяснить конкурентным взаимодействием за почечную канальцевую экскрецию, поскольку процент выведения диданозина при этом увеличивался. Причинами данного увеличения могут быть повышение биодоступности или замедление метаболизма. Клинически значимого влияния на концентрации ганцикловира не отмечалось. Однако, учитывая повышение плазменных концентраций диданозина в присутствии ганцикловира, следует тщательно наблюдать пациентов на предмет возникновения симптомов токсического действия диданозина при применении валганцикловира.
Другие антиретровирусные препараты: изоферменты цитохрома Р450 не оказывают влияния на фармакокинетику ганцикловира. Следовательно, не ожидается взаимодействия с ингибиторами протеазы и ненуклеозидными ингибиторами обратной транскриптазы.
Микофенолата мофетил: на основании результатов исследования по однократному внутривенному введению рекомендованной дозы ганцикловира и пероральному приему микофенолата мофетила, а также известного влияния нарушения функции почек на фармакокинетику микофенолата мофетила и ганцикловира, можно ожидать, что одновременное применение валганцикловира и микофенолата мофетила, оказывающих конкурентное взаимодействие в процессе канальцевой секреции, приведет к повышению концентрации ганцикловира и фенольного глюкуронида микофеноловой кислоты. Существенного изменения фармакокинетики микофеноловой кислоты не ожидается, поэтому корректировать дозу микофенолата мофетила не требуется. У пациентов с нарушением функции почек, которые одновременно получают микофенолата мофетил и валганцикловир, необходимо соблюдать рекомендации по коррекции дозы валганцикловира и проводить тщательное наблюдение.
Залцитабин:залцитабин повышал AUC0-8 перорально принимаемого ганцикловира на 13%. Статистически значимых изменений других фармакокинетических параметров не отмечалось. Клинически значимые изменения фармакокинетики залцитабина при одновременном пероральном приеме ганцикловира также выявлены не были, несмотря на незначительное увеличение константы скорости элиминации.
Ставудин: при одновременном пероральном приеме ганцикловира и ставудина статистически значимого фармакокинетического взаимодействия не отмечалось.
Триметоприм: триметоприм статистически значимо на 16,3% уменьшал почечный клиренс ганцикловира, принимаемого перорально, что сопровождалось также статистически значимым снижением скорости терминальной элиминации и соответствующим возрастанием периода полувыведения на 15%. Тем не менее, клиническая значимость этих изменений маловероятна, поскольку AUC0-8 и Сmах при этом не изменялись. Единственным статистически значимым изменением фармакокинетических параметров триметоприма при одновременном приеме ганцикловира было увеличение минимальной концентрации (Cmin) на 12%. Однако вряд ли это имеет клиническое значение, поэтому коррекции дозы валганцикловира не требуется.
Циклоспорин: при сравнении концентраций циклоспорина перед приемом следующей дозы данных о том, что ганцикловир изменял фармакокинетику циклоспорина, получено не было. Тем не менее, после начала применения ганцикловира отмечалось некоторое повышение максимальной концентрации креатинина в сыворотке крови.
Другие возможные лекарственные взаимодействия: поскольку основным путем выведения ганцикловира является клубочковая фильтрация и активная канальцевая секреция, применение валганцикловира одновременно с антиретровирусными лекарственными средствами, которые также выводятся посредством активной канальцевой секреции (например, нуклеоз(т)идными ингибиторами обратной транскриптазы), может повлиять на концентрацию валганцикловира и/или совместно применяемых средств. Применение ганцикловира одновременно с другими средствами, оказывающими миелосупрессивный или нефротоксический эффект (например, дапсоном, пентамидином, флуцитозином, винкристином, винбластином, адриамицином, амфотерицином В, аналогами нуклеозидов, гидроксикарбамидом и пегилированными интерферонами/рибавирином), может усиливать их токсическое действие. Поэтому эти средства можно применять одновременно с валганцикловиром только в случае, если ожидаемая польза от проводимого лечения превышает возможный риск.
Условия и срок хранения Валган
Хранить в оригинальной упаковке для защиты от света и влаги при температуре не выше 25°С.
Хранить в недоступном для детей месте.
3 года. Препарат не должен применяться по истечении срока годности.
Упаковка
По 10 таблеток в контурную ячейковую упаковку из фольги алюминиевой и комбинированного материала (пленки ПВХ, фольги алюминиевой, пленки полиамидной).
По 60 таблеток с уплотнителем (ватой медицинской) во флакон из полиэтилена высокой плотности, запаянный алюминиевой фольгой и укупоренный пластиковой крышкой с защитой от детей.
По 3, 6 контурные ячейковые упаковки или по 1 флакону вместе с листком-вкладышем помещают в пачку из картона.
Правила отпуска
По рецепту врача.
Информация о производителе
Hetero Labs Limited, Unit-V.
Polepally village, Jadcherla Mandal, Mahaboobnagar District - Telangana, Индия.
Упаковано
ООО «БЕЛАЛЕК», Республика Беларусь.
222163 г. Жодино, ул. Советская, 9,
тел.: +375447777701.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Валган только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание! Эта инструкция по применению лекарственного средства является официальной инструкцией производителя Hetero Labs Ltd., Индия упаковано Белалек ООО.
Авторское право:
- Hetero Labs Ltd., Индия упаковано Белалек ООО
- https://www.rceth.by - Государственный реестр ЛС Республики Беларусь
| Тип данных | Сведения из реестра |
| Торговое наименование: | Валган |
| Форма выпуска: | таблетки, покрытые оболочкой, 450мг в контурной ячейковой упаковке №10х3, №10х6, во флаконах №60 в упаковке №1 |
| Международное наименование: | Valganciclovir |
| Производитель: | Hetero Labs Ltd., Индия упаковано Белалек ООО, Республика Беларусь |
| Заявитель: | Белалек ООО, Республика Беларусь |
| Номер регистрации: | 19/06/2941 |
| Дата регистрации: | 27.06.2019 |
| Срок действия: | 27.06.2024 |
| Дата переоформления: | 01.01.2100 |
| Тип: | Лекарственное средство |
| Оригинальное: | генерик |
| Состав лекарственного средства: | Valganciclovir |
| Код АТХ: | J05AB14 |
| Производитель готовой лекарственной формы: | Hetero Labs Ltd., Индия |
| Производитель, осуществляющий фасовку/упаковку: | Hetero Labs Ltd., Индия (фасовка), Белалек ООО, Республика Беларусь (упаковка) |
| Контроль качества: | |
| Выдача разрешения на выпуск лекарственного средства: | Белалек ООО, Республика Беларусь |
| Другие участники производства: | |
| Заявленная цена: | №10х3 - 375, №10х6 -700USD |
| Порядок отпуска: | по рецепту |
| Список хранения: | |
| Срок годности лекарства: | 3 года |
| Нормативная документация: | ФСП РБ 2722-19 |
| Дата утверждения нормативной документации: | 27 июня 2019 г. 0:00 |
| Срок действия нормативной документации: | 27 июня 2024 г. 0:00 |
| Изменение в нормативной документации: | |
| Номер разрешения НД: |
| Код АТХ | Название группы |
| J | Противомикробные препараты для системного применения |
| J05 | Противовирусные препараты для системного применения |
| J05A | Противовирусные препараты прямого действия |
| J05AB | Нуклеозиды и нуклеотиды |
| J05AB14 | Valganciclovir |
