- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/15926/01/01, UA/15926/01/02, UA/15926/01/03 закончился 27.04.2022
Сигнифор Лар инструкция по применению
Официальная инструкция лекарственного препарата Сигнифор Лар порошок 20 мг, 40 мг, 60 мг. Описание и применение Signifor Lar, аналоги и отзывы. Инструкция Сигнифор Лар порошок утвержденная компанией производителем.
Состав
действующее вещество: pasireotide;
1 флакон с порошком для суспензии для инъекций содержит 20 мг, 40 мг или 60 мг пасиреотида (в форме пасиреотиду памоат).
вспомогательные вещества :
порошок: поле (D, L-лактид-ко-гликолид) (50-60: 40-50), поли (D, L-лактид-ко-гликолид) (50:50).
растворитель: 1 предварительно заполненный шприц с растворителем по 2 мл содержит кармеллоза натрия, маннит (E421), полоксамер 188, воду для инъекций.
Лекарственная форма
Порошок для суспензии для инъекций.
Основные физико-химические свойства:
порошок: порошок от слегка желтоватого до желтого цвета.
растворитель: прозрачный раствор от бесцветного до желтоватого или светло-коричневого цвета.
Фармакологическая группа
Гипофизарные, гипоталамические гормоны и их аналоги.
Код АТХ H01C B05.
Фармакологические свойства
Фармакологические.
Механизм действия. Пасиреотид - циклогексапептид, инъекционный аналог соматостатина. Подобно природных пептидных гормонов соматостатина-14 и соматостатина-28 (также известных как фактор, тормозящий выделение соматотропина [SRIF]) и других аналогов соматостатина, пасиреотид реализует свою фармакологическое действие путем связывания с рецепторами соматостатина. Известны пять подтипов человеческих рецепторов соматостатина: hsst1, 2, 3, 4 и 5. При нормальных физиологических условиях эти подтипы рецепторов экспрессируются в различных тканях. Аналоги соматостатина с разной мощностью связываются с рецепторами hsst (см. Таблицу 1). Пасиреотид с высокой аффинностью связывается с четырьмя из пяти рецепторов hsst.
Таблица 1. Аффинность связывания соматостатина (SRIF-14), пасиреотиду, октреотида и ланреотида с пятью человеческими подтипами рецепторов sst (hsst1-5).
Препарат | hsst1 | hsst2 | hsst3 | hsst4 | hsst5 |
Соматостатин (SRIF-14) | 0,93 ± 0,12 | 0,15 ± 0,02 | 0,56 ± 0,17 | 1,5 ± 0,4 | 0,29 ± 0,04 |
Пасиреотид | 9,3 ± 0,1 | 1,0 ± 0,1 | 1,5 ± 0,3 | > 100 | 0,16 ± 0,01 |
Октреотид | 280 ± 80 | 0,38 ± 0,08 | 7,1 ± 1,4 | > 1000 | 6,3 ± 1,0 |
Лантреотид | 180 ± 20 | 0,54 ± 0,08 | 14 ± 9 | 230 ± 40 | 17 ± 5 |
Результаты представлены в виде среднего значения ± среднее значение стандартной ошибки (ССП) IC50, выраженного в нмоль / л.
Фармакодинамические эффекты. Рецепторы соматостатина экспрессируются во многих тканях, особенно в нейроэндокринных опухолях, при которых наблюдается избыточная секреция гормонов, в том числе гормона роста (ГР) при акромегалии и АКТГ при болезни Кушинга.
Результаты исследований in vitro показали, что кортикотропного опухолевые клетки, взятые у пациентов с болезнью Кушинга, демонстрируют выраженную экспрессию hsst5, тогда как рецепторы других подтипов либо не экспрессируются или экспрессируются незначительно. Пасиреотид связывает и активирует четыре из пяти hsst, особенно hsst5, в кортикотропного АКТГ-продуцирующих аденомах, приводя к ингибированию секреции АКТГ.
Благодаря широкому профиля связывания с рецепторами соматостатина пасиреотид способен стимулировать рецепторы подтипа hsst2 и hsst5, необходимые для ингибирования секреции ГР и инсулиноподобного фактора роста (ИФР-1), поэтому он может быть эффективным для лечения акромегалии.
Метаболизм глюкозы. В ходе рандомизированного двойного слепого исследования с участием здоровых добровольцев развитие гипергликемии при подкожном применении пасиреотиду в дозах 0,6 мг и 0,9 мг дважды в сутки был связан со значительным уменьшением секреции гормонов инсулина, а также инкретинов (в частности, глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептида (ГИП)). Пасиреотид не влиял на чувствительность к инсулину.
Педиатрическая популяция. Европейское агентство по лекарственным средствам отказалось от обязанности представления результатов исследований препарата Сигнифор у детей всех подкатегорий при акромегалии и гипофизарному гигантизме, а также при гипофизозалежний болезни Кушинга, гиперсекреции гипофизарного АКТГ и гипофиззалежному гиперадренокортицизм (информацию о применении у детей см. В разделе «Способ применение »).
Фармакокинетика.
Пасиреотид для внутримышечного применения выпускается в виде микросфер пролонгированного действия. После разовой инъекции концентрация пасиреотиду в плазме крови свидетельствует о начальном «взрывной» высвобождения в первый день инъекции с последующим снижением концентрации на 2 - 7 день. Впоследствии наблюдалось постепенное достижение максимальной концентрации примерно на 21-й день и фаза постепенного уменьшения в течение следующих недель вместе с конечной фазой распада полимерной матрицы лекарственной формы.
Поглощения. Относительная биодоступность пасиреотиду при в применении по сравнению с подкожным применения является полной. Исследований с целью оценки биодоступности пасиреотиду у людей не проводилось.
Распределение. У здоровых добровольцев пасиреотид при в применении широко распределялся с большим объемом распределения (Vz / F> 100 литров). Распределение между клетками крови и плазмой не зависит от концентрации и показывает, что пасиреотид локализуется преимущественно в плазме крови (91%). Связывание с белками плазмы является умеренным (88%) и не зависит от концентрации.
На основе данных исследований in vitro пасиреотид является субстратом ефлюксного транспортера Р-гликопротеина. На основе данных исследований in vitro пасиреотид не является субстратом ефлюксного транспортера BCRP (протеин резистентности рака молочной железы) и инфлюксних транспортеров ОСТ1 (транспортер органических катионов 1), ОАТР (полипептид, транспортирующий органические анионы) 1B1, 1B3 или 2B1. В терапевтических дозах пасиреотид также не является ингибитором UGT1A1, OATP1B1 или 1B3, OAT1 или OAT3, OCT1 или OCT2, P-gp, BCRP, MRP2 и BSEP.
Метаболизм. Пасиреотид является высокостабильным в метаболическом отношении. Данные исследований in vitro свидетельствуют, что пасиреотид не является субстратом, ингибитором или индуктором любых основных ферментов CYP450. У здоровых добровольцев пасиреотид преимущественно проявляется в неизмененном виде в плазме крови, моче и кале.
Вывод. Пасиреотид выводится преимущественно путем печеночного клиренса (билиарная экскреция) по незначительным участием почечного пути выведения. В исследовании ADME (всасывание, распределение, метаболизм, выведение) у людей 55,9 ± 6,63% радиоактивной дозы возобновлялось в течение первых 10 дней после введения, включая 48,3 ± 8,16% радиоактивности в кале и 7,63 ± 2 , 03% в моче.
Клиренс (CL / F) внутримышечного пасиреотиду у здоровых добровольцев составляет в среднем 4,5-8,5 л / час. На основании результатов популяционного фармакокинетического анализа измеренный CL / F составлял примерно от 4,8 до 6,5 л / ч, для пациентов с типичной болезнью Кушинга и примерно от 5,6 до 8,2 л / ч, для пациентов с типичной акромегалией.
Линейность и зависимость от времени. Фармакокинетический состояние покоя при в применении пасиреотиду достигается через 3 месяца. После нескольких ежемесячных доз пасиреотид при в применении демонстрирует примерно дозопропорцийний фармакокинетический влияние в диапазоне доз от 10 мг до 60 мг каждые 4 недели у пациентов.
Особые категории пациентов. Педиатрическая популяция. Исследования у детей не проводились.
Пациенты с нарушением функции почек. Почечный клиренс играет минимальную роль в выведении пасиреотиду у людей. В клиническом исследовании одноразовая подкожная доза пасиреотиду 900 мкг у пациентов с почечной дисфункцией, легким, умеренным и тяжелым нарушением функции почек или болезнью почек в терминальной стадии (ESRD) не оказывала значимого влияния на общую плазменную экспозицию пасиреотиду. Плазменная экспозиция несвязанного пасиреотиду (AUCinf, u) увеличилась у пациентов с нарушением функции почек (легкий: 33%; умеренный: 25%, тяжелый: 99%, ESRD 143%) по сравнению с пациентами в контрольной группе.
Пациенты с нарушением функции печени. Клинические исследования внутримышечного применения пасиреотиду у пациентов с нарушенной функцией печени не проводились. В клиническом исследовании одноразовой подкожной дозы пасиреотиду с участием пациентов с нарушением функции печени статистически значимую разницу было обнаружено у пациентов с умеренным и тяжелым нарушением функции печени (класс В и С по Чайлд-Пью). У пациентов с умеренным и тяжелым нарушением функции печени AUC inf росла на 60% и 79%, Cmax - на 67% и 69%, а CL / F снижался на 37% и 44% соответственно.
Пациенты пожилого возраста (≥ 65 лет). Возраст не является существенным параметром при популяционном фармакокинетическом анализе пациентов.
Демографические характеристики. Популяционный фармакокинетический анализ внутримышечного применения пасиреотиду свидетельствует, что расовая принадлежность и пол не влияют на фармакокинетические показатели препарата. Масса тела незначительно влияла на фармакокинетику в исследовании с участием пациентов, ранее не получавших лечения, но не влияла в исследовании с участием пациентов, которым не обеспечивался достаточный контроль заболевания. Женщины с акромегалией подвергались большему влиянию (32% и 51%) по сравнению с мужчинами в исследованиях пациентов, не получавших лечения, и пациентов, которым не обеспечивался достаточный контроль, соответственно; эти различия не были клинически релевантными на основе данных об эффективности и безопасности.
Клинические характеристики
Сигнифор Лар Показания
Лечение взрослых пациентов с акромегалией, в которых хирургическое вмешательство не является оптимальным или было неудачным и которым не обеспечивается надлежащий контроль с помощью другого аналога соматостатина.
Лечение взрослых пациентов с болезнью Кушинга, в которых хирургическое вмешательство не является оптимальным или было неудачным.
Доза 60 мг применяется только для лечения акромегалии.
Противопоказания
Повышенная чувствительность к активному веществу или к любому компоненту препарата. Тяжелое нарушение функции печени (класс C по шкале Чайлд-Пью).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Ожидаемые фармакокинетические взаимодействия, которые обусловливают влияние на пасиреотид. Влияние ингибитора Р-гликопротеина верапамила на фармакокинетику пасиреотиду в случае подкожного применения был опробован в исследовании взаимодействия лекарственных средств с участием здоровых добровольцев. Никаких изменений фармакокинетики (скорости или степени влияния) пасиреотиду не наблюдалось.
Ожидаемые фармакокинетические взаимодействия, обусловливающие влияние на другие лекарственные средства. Пасиреотид может снижать относительную биодоступность циклоспорина. При одновременном применении пасиреотиду и циклоспорина может потребоваться коррекция дозы циклоспорина с целью поддержания терапевтической концентрации.
Ожидаемые фармакодинамические взаимодействия. Лекарственные средства, пролонгируют интервал QT.
Пасиреотид следует применять с осторожностью пациентам, которые одновременно принимают лекарственные средства, пролонгируют интервал QT, такими как антиаритмические средства класса Iа (например хинидин, прокаинамид, дизопирамид), антиаритмические средства класса III (например амиодарон, дронедарон, соталол, дофетилида, ибутилид), некоторые антибактериальные средства (эритромицин, инъекции пентамидина, кларитромицин, моксифлоксацин), некоторые антипсихотические средства (например хлорпромазин, тиоридазин, флуфеназин, пимозид, галоперидол, тиаприд, амисульприд, сертиндол, метадон), некоторые антигистаминные средства (например терфенадин, астемизол, мизоластин), антималярийные средства (например хлорохин, галофантрин, люмефантрин), некоторые противогрибковые средства (кетоконазол, кроме шампуня).
Лекарственные средства, вызывающие брадикардию. Клинический мониторинг сердечного ритма, особенно в начале лечения, рекомендуется пациентам, которые получают пасиреотид одновременно с лекарственными средствами, вызывающими брадикардию, такими как бета-блокаторы (например метопролол, картеолол, пропранолол, соталол), ингибиторы ацетилхолинэстеразы (например, ривастигмин, физостигмин) , некоторые блокаторы кальциевых каналов (например верапамил, дилтиазем, бепридил), некоторые антиаритмические средства.
Инсулин и противодиабетические лекарственные средства. Коррекция дозы (снижение или повышение) инсулина и противодиабетических лекарственных средств (например метформина, лираглутид, вилдаглиптину, натеглинид) может потребоваться в случае одновременного применения с пасиреотидом.
Особенности применения
Расстройства обмена глюкозы. Изменения в уровнях глюкозы в крови часто отмечались у здоровых добровольцев и пациентов после лечения пасиреотидом. Гипергликемия и (реже) гипогликемия наблюдались у пациентов, участвовавших в клинических исследованиях пасиреотиду.
Пациенты, у которых развивалась гипергликемия, в целом реагировали на противодиабетическим терапию. Снижение дозы или прекращения лечения пасиреотидом через гипергликемии были нечастыми во время клинических исследований пасиреотиду.
Развитие гипергликемии связан с уменьшением секреции инсулина (особенно в период после приема дозы) и инкретинових гормонов (в частности, глюкагоноподобного пептида-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептида (ГИП)).
Состояние гликемии (глюкоза плазмы крови натощак / гемоглобин А1с (ГПН / НА1с)) следует оценить до начала лечения пасиреотидом. Мониторинг ГПН / А1с время лечения следует проводить согласно имеющихся рекомендаций. Самомониторинг глюкозы крови и / или оценку ГПН следует выполнять каждую неделю в течение первых 2-3 месяцев и затем периодически, в соответствии с клинической практики. Кроме того, следует выполнить мониторинг ГПН через 4 недели и гемоглобина А1с через 3 месяца после окончания лечения.
Если у пациента на фоне приема препарата Сигнифор ЛАР развивается гипергликемия, рекомендуется начать или откорректировать противодиабетических лечения согласно имеющимся рекомендациям для контроля гипергликемии. Если неконтролируемая гипергликемия продолжается, несмотря на соответствующее медикаментозное лечение, следует уменьшить дозу препарата Сигнифор ЛАР или прекратить лечение.
Пациенты с плохим гликемическим контролем (определенным по значению HbA1c> 8% на фоне противодиабетической терапии) могут иметь повышенный риск развития тяжелой гипергликемии и сопутствующих осложнений. У пациентов с плохим гликемическим контролем контроль диабета и мониторинг следует усилить до начала и во время терапии пасиреотидом.
Печеночные тесты. У пациентов, принимавших пасиреотид, обычно наблюдалось незначительное транзиторное повышение уровня аминотрансфераз. Также наблюдались редкие случаи одновременного повышения АЛТ выше 3 х ВМН (верхняя граница нормы) и билирубина выше 2 х ВМН (верхняя граница нормы). Рекомендуется контролировать функцию печени до начала лечения пасиреотидом и после одного, двух, четырех и двенадцати недель лечения, не сопровождалось повышением уровня общего билирубина в сыворотке крови. В дальнейшем мониторинг функции печени следует выполнять по клиническим показаниям.
Пациентам, у которых развилось повышение уровня трансаминаз, следует провести повторное определение функции печени для подтверждения полученных результатов. Если результаты подтверждены, то такие пациенты подлежат частом мониторинга функции печени до возвращения значений к уровням, которые были до лечения. Терапию пасиреотидом следует прекратить, если у пациента развилась желтуха или другие признаки клинически значимого дисфункции печени, в случае устойчивого повышения АСТ или АЛТ 5 х ВГН или выше, или АЛТ или АСТ выше АЛТ 3 х ВМН одновременно с повышением билирубина выше АЛТ 2 х ВМН. После прекращения терапии пасиреотидом следует проводить мониторинг пациентов до исчезновения симптомов. Лечение не следует возобновлять, если есть подозрение на то, что нарушения функции печени связаны с пасиреотидом.
Явления, связанные с сердечно-сосудистой системой. Сообщалось о случаях брадикардии при применении пасиреотиду. Тщательный мониторинг рекомендуется у пациентов с сердечными заболеваниями и / или факторами риска брадикардии, такими как клинически значимая брадикардия или острый инфаркт миокарда в анамнезе, сердечные блокады высокой степени, застойная сердечная недостаточность (класс III или IV по классификации Нью-Йоркской кардиологической ассоциации - NYHA) , нестабильная стенокардия, устойчивая желудочковая тахикардия, фибрилляция желудочков. Может возникнуть необходимость в коррекции дозы лекарственных средств, например, бета-блокаторов, блокаторов кальциевых каналов или лекарственных средств, предназначенных для контроля электролитного баланса.
В двух исследованиях с участием здоровых добровольцев было показано, что пасиреотид продлевал интервал QT на ЭКГ. Клиническое значение такого продления неизвестно. В клинических исследованиях III фазы у пациентов с акромегалией не было обнаружено никаких клинически значимых различий в случаях удлинение интервала QT между внутримышечно применением пасиреотиду и аналогов соматостатина, которые применялись в качестве активного препарата сравнения. Все явления, связанные с удлинение интервала QT, были временными и проходили без терапевтического вмешательства.
Эпизодов тахикардии типа «пируэт» не наблюдалось ни в одном клиническом исследовании пасиреотиду.
Пасиреотид следует с осторожностью и с учетом польза / риск применять пациентам, которые имеют значительный риск развития удлинения интервала QT, а именно:
- с врожденным синдромом длительного интервала QT.
- с неконтролируемыми или значимыми сердечными заболеваниями, в частности с недавно перенесенным инфарктом миокарда, застойной сердечной недостаточностью, нестабильной стенокардией или клинически значимой брадикардией.
- тем, кто принимает антиаритмические лекарственные средства или другие препараты с известной способностью вызывать удлинение интервала QT.
- с гипокалиемией и / или гипомагниемией.
До начала терапии препаратом Сигнифор ЛАР рекомендуется провести начальную ЭКГ. Желательно осуществить мониторинг влияния на интервал QTс через 21 день после начала лечения и впоследствии при наличии клинических показаний. Гипокалиемии и / или гипомагниемии необходимо откорректировать до приема препарата Сигнифор ЛАР и в дальнейшем проводить соответствующий периодический мониторинг во время лечения.
Гипокортизолизм. Подавление секреции АКТГ (АКТГ) может привести к гипокортизолизму у пациентов, получавших препарат Сигнифор ЛАР.
Таким образом, необходимо проводить мониторинг и инструктировать пациентов относительно проявлений и симптомов, ассоциированных с гипокортизолизмом (например, слабость, утомляемость, анорексия, тошнота, рвота, артериальная гипотензия, гиперкалиемия, гипонатриемия, гипогликемия). В случаях подтвержденного гипокортизолизму может потребоваться временной заместительной терапии с применением экзогенных стероидов (глюкокортикоидов) и / или уменьшении дозы или перерыве в терапии препаратом Сигнифор ЛАР. Быстрое снижение уровней кортизола может быть связано со снижением количества лейкоцитов.
Желчный пузырь и связанные явления. Холелитиаз является установленной нежелательной реакцией, ассоциируется с применением аналогов соматостатина, и о которой часто сообщалось в клинических исследованиях пасиреотиду. Поэтому рекомендуется ультразвуковое обследование желчного пузыря к и с 6 и 12-месячным интервалом во время терапии препаратом Сигнифор ЛАР. Наличие желчных камней у пациентов, принимающих Сигнифор, протекает преимущественно асимптомно; наличие желчных камней с клиническими проявлениями следует лечить в соответствии со стандартами медицинской практики.
Гормоны гипофиза. Поскольку фармакологическое действие пасиреотиду имитирует действие соматостатина, нельзя исключать вероятность ингибирования гипофизарных гормонов, кроме ГР и / или ИПФР-1 у пациентов с акромегалией и АКТГ / кортизола у пациентов с болезнью Кушинга. Таким образом, необходимо осуществлять мониторинг функции гипофиза (например, уровня ТТГ / свободного Т4, гормона роста) до и периодически во время терапии препаратом Сигнифор ЛАР в соответствии с клиническими стандартами.
Влияние на репродуктивную функцию у женщин. Терапевтический эффект уменьшения уровней гормона роста и нормализации концентрации инсулиноподобного фактора роста 1 (ИФР-1) у женщин с акромегалией и снижение или нормализация уровней кортизола в сыворотке крови у женщин с болезнью Кушинга может потенциально восстанавливать репродуктивную функцию. Пациенткам детородного возраста следует рекомендовать использовать соответствующие средства контрацепции, если необходимо, во время лечения Сигнифор ЛАР.
Расстройства системы свертывания крови. Пациенты со значительно увеличенными значениями ПВ (PT) и частичного тромбопластинового времени (РТТ) или пациенты, которые получают производные кумарина или антикоагулянты на основе производных гепарина, исключались из клинических исследований пасиреотиду, поскольку безопасность сочетание с такими антикоагулянтами не установлена. Если одновременное применение производных кумарина или антикоагулянтов на основе производных гепарина при в применении Сигнифор ЛАР нельзя избежать, пациентам должен быть обеспечен регулярный контроль изменений их параметров коагуляции (РТ и РТТ), и дозы антикоагулянта должны быть скорректированы соответствующим образом.
Нарушение функции почек. Из-за повышения экспозиции несвязанного лекарственного средства Сигнифор ЛАР следует применять с осторожностью пациентам с тяжелыми нарушениями функции почек или болезнью почек в терминальной стадии.
Содержание натрия. Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) в одну рекомендованную дозу, то есть фактически он «не содержит натрия».
Применение в период беременности или кормления грудью
беременность
Данные по использованию пасиреотиду у беременных женщин ограничены. Исследование подкожного применения пасиреотиду у животных показали репродуктивной токсичности. Пасиреотид не рекомендуется для применения во время беременности и у женщин детородного потенциала, которые не используют средства контрацепции.
кормление грудью
Данных о выведение пасиреотиду в грудное молоко у людей нет. Имеющиеся данные исследования подкожного применения пасиреотиду у крыс показали, что пасиреотид проникает в молоко. Сигнифор ЛАР не следует использовать во время кормления грудью.
фертильность
Исследование подкожного применения пасиреотиду у крыс показали влияние на репродуктивные параметры у самок. Клиническая значимость этих эффектов у людей неизвестна.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Пасиреотид не влияет или незначительно влияет на способность управлять транспортными средствами и работать с механизмами. Пациентам следует посоветовать соблюдать осторожность при управлении транспортными средствами или работе с механизмами, если они чувствуют усталость или головную боль во время лечения Сигнифор ЛАР.
Способ применения Сигнифор Лар и дозы
Дозировки.
акромегалия
Для лечения акромегалии рекомендуемая доза 40 мг пасиреотиду каждые 4 недели.
Доза может быть увеличена максимум до 60 мг для пациентов, у которых уровни гормона роста (ГР) и / или инсулиноподобного фактора роста 1 (ИФР-1) недостаточно контролируются через 3 месяца лечения в дозе 40 мг.
Для контроля подозреваемых побочных реакций или чрезмерной реакции на лечение (ИФР-1 <нижней границы нормы) может потребоваться временное снижение дозы. Доза может уменьшаться временно или постоянно.
болезнь Кушинга
Рекомендованная начальная доза для лечения болезни Кушинга составляет 10 мг пасиреотиду в виде глубокой внутримышечной инъекции каждые 4 недели.
После первого месяца лечения и периодически в дальнейшем пациентов необходимо обследовать, чтобы оценить клиническую пользу. Титрования дозы следует проводить каждые 2 - 4 месяца в зависимости от эффекта лечения и переносимости. Максимальная доза Сигнифор ЛАР при болезни Кушинга составляет 40 мг каждые 4 недели. Если клиническая пользу не наблюдается, следует рассмотреть возможность отмены препарата.
Лечение подозреваемых побочных реакций или чрезвычайного эффекта от лечения (уровни кортизола <нижней границы нормы) может потребовать снижения дозы, отмены или прекращения лечения Сигнифор ЛАР.
Переход из подкожного на внутримышечное введение при болезни Кушинга
Данные клинических исследований при переходе с подкожного на внутримышечное введение пасиреотиду отсутствуют. Если такой переход необходим, рекомендуемая начальная доза для лечения болезни Кушинга составляет 10 мг пасиреотиду в виде глубокой внутримышечной инъекции каждые 4 недели. Следует наблюдать за состоянием пациента для оценки эффекта от лечения и переносимости; также может потребоваться дополнительная коррекция дозы.
пропуск дозы
Если прием дозы Сигнифор ЛАР пропущено, пропущенную инъекцию следует сделать как можно скорее. Следующую дозу следует принять через 4 недели после введения инъекции для восстановления графику дозирования один раз в 4 недели.
Особые категории пациентов.
Пациенты пожилого возраста (≥ 65 лет). Данные по применению препарата Сигнифор ЛАР пациентами в возрасте от 65 лет ограничены, но доказательств, которые свидетельствовали бы о необходимости коррекции дозы у таких пациентов нет.
Нарушение функции почек. Коррекция дозы у пациентов с нарушением функции почек не требуется.
Нарушение функции печени. Коррекция дозы у пациентов с легким нарушением функции печени не требуется (класс А по Чайлд - Пью).
Рекомендованная начальная доза при акромегалии для пациентов с умеренным нарушением функции печени (класс В по Чайлд - Пью) составляет 20 мг каждые 4 недели. Максимальная рекомендованная доза для таких пациентов составляет 40 мг каждые 4 недели.
Болезнь Кушинга рекомендуемая начальная доза при болезни Кушинга с умеренным нарушением функции печени (класс В по шкале Чайлд - Пью) составляет 10 мг каждые 4 недели, а максимальная рекомендуемая доза для этих пациентов составляет 20 мг каждые 4 недели.
Препарат Сигнифор ЛАР не следует применять пациентам с тяжелыми нарушениями функции печени (класс С по Чайлд - Пью).
Способ применения.
Препарат Сигнифор ЛАР имеет вводиться в форме глубокой внутримышечной инъекции специально подготовленным медицинским работником. Суспензию препарата следует готовить только непосредственно перед введением .
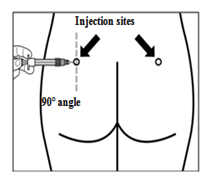
Место повторных инъекций следует чередовать между левым и правым ягодичные мышцы.
Компоненты набора для инъекций
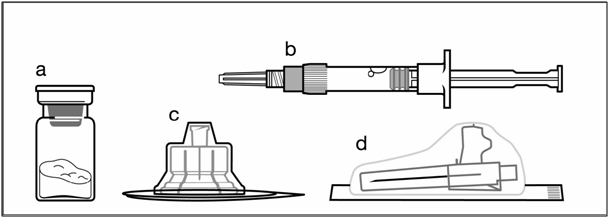
a один флакон, содержащий порошок
b один предварительно заполненный шприц с растворителем;
c один адаптер для флакона для приготовления суспензии;
d одна безопасная игла для инъекций (20G x 1,5")
Для того чтобы должным образом приготовить суспензию препарата Сигнифор ЛАР следует тщательно следовать указаниям приведенным ниже.
шаг 1 Достаньте препарат Сигнифор ЛАР из холодильника. Внимание Набор для инъекции должен достичь комнатной температуры. Следует оставить набор для инъекции при комнатной температуре минимум на 30 минут (но не более чем на 24 часа). Примечание: не использован в течение 24 часов набор для инъекции можно возвращать снова в холодильник. |  |
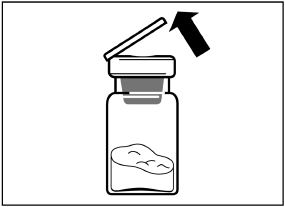
шаг 2 Снимите с флакона пластиковую крышку и протрите резиновую пробку флакона спиртовой салфеткой. |
|
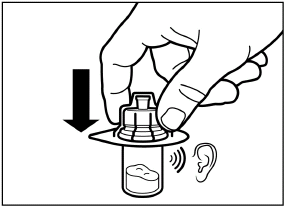
Удалите пленку из упаковки, в которой находится адаптер для флакона, но НЕ вынимайте его из этой упаковки. Держа адаптер для флакона за упаковку, поместите его на верхушку флакона и нажмите на адаптер до конца вниз, к фиксации (характерный звук щелчка). |
|
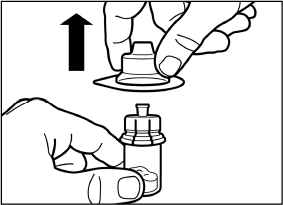
Вертикальным движением вверх снимите пластиковый контейнер с адаптера для флакона. |
|
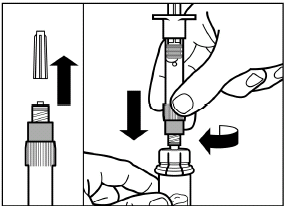
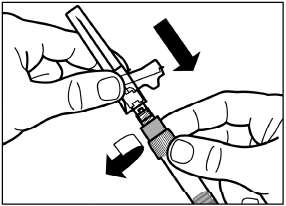
шаг 3 Снимите колпачок с предварительно заполненного шприца с растворителем, и вкрутите шприц в адаптер для флакона |
|
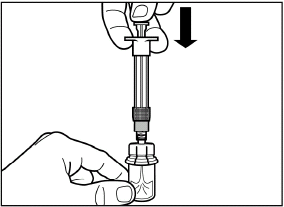
Медленно нажмите на поршень вниз до конечного положения, чтобы переместить весь растворитель во флакон. |
|
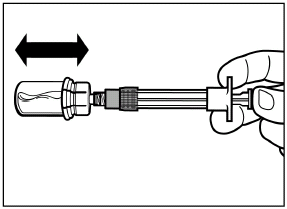
шаг 4 Внимание: держа поршень нажатым, аккуратно перемещайте флакон в горизонтальной плоскости в течение, по меньшей мере, 30 секунд пока не сформируется однородная суспензия. Если порошок не полностью суспендувався, снова аккуратно перемешайте содержимое путем перемещения флакона в горизонтальной плоскости в течение 30 секунд. |
|
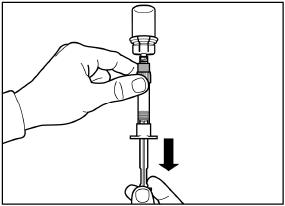
шаг 5 Переверните флакон с присоединенным к нему шприцем вверх дном, медленно потяните поршень вниз для перемещения содержимого из флакона до шприца. |
|
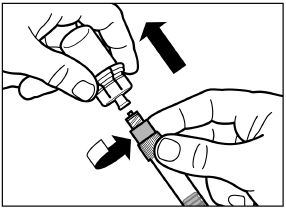
Открутите шприц от адаптера флакона. |
|
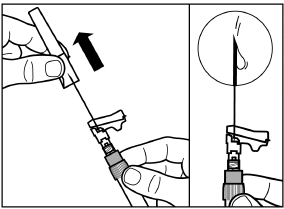
шаг 6 Накрутите на шприц безопасную иглу для инъекции. |
|
Снимите с иглы защитный колпачок, потянув его вверх по линии иглы. Во избежание осаждения, вы можете поддерживать однородность суспензии путем легкого покачивания шприца. Легко постучите по шприцу, чтобы видимые пузырьки воздуха поднялись вверх, после чего удалите их осторожно нажимая на поршень. Теперь суспензия препарата готова для немедленного применения. |
|
шаг 7 Сигнифор ЛАР можно вводить только глубоко в. Подготовьте место для инъекции протерев его спиртовым тампоном. Введите иглу до конца в правый или левый ягодичную мышцу под углом 90 ° к поверхности кожи. Немного потяните поршень назад, чтобы убедиться, что игла не попала в кровеносный сосуд (если игла попала в кровеносный сосуд, введите ее в другое место). Медленно надавливайте на поршень пока шприц не станет пустым. Извлеките иглу с места инъекции и активируйте защитный механизм (как показано на рисунке ниже). |
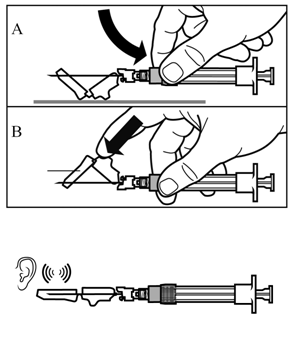
|
шаг 8 Включите защитный механизм иглы одним из следующих способов: - прижать откидную часть защитного устройства к твердой поверхности (рисунок A) - или нажать указательным пальцем на откидную часть защитного устройства (рисунок B). Звук щелчка подтверждает правильную активацию защитного механизма. Немедленно утилизировать флакон и шприц с иглой в контейнер для острых вещей. |
|
Дети
Безопасность и эффективность препарата Сигнифор ЛАР у детей и подростков в возрасте от 0 до 18 лет не изучалась. Данные отсутствуют.
Передозировка
В случае передозировки рекомендуется начать соответствующее поддерживающее лечение, определяется клиническим состоянием пациента и проводится до исчезновения симптомов.
Побочные эффекты
Резюме профиля безопасности.
Профиль безопасности после внутримышечного применения пасиреотиду совпадает с таковым после приема препаратов класса аналогов соматостатина, за исключением повышенной частоты и степени гипергликемии, которые наблюдались при введении пасиреотиду. Профиль безопасности после внутримышечного применения пасиреотиду во многом подобный при применении по разным показаниям - акромегалия и болезнь Кушинга.
акромегалия
При акромегалии оценку безопасности проводили в 491 пациента, которые получали пасиреотид (419 пациентов получали пасиреотид внутримышечно и 72 получали пасиреотид подкожно) в ходе исследований фазы I, II и III.
Наиболее частыми побочными реакциями (частота ≥ 1/10) на основе сводных данных о безопасности в ходе исследований фазы ИИИ C2305 и C2402 были (в порядке убывания): диарея (чаще наблюдалась в исследовании C2305), желчнокаменная болезнь, гипергликемия (чаще наблюдалась в исследовании C2402) и сахарный диабет. Побочные реакции в соответствии с общим критериям токсичности (СКТ) степени 3 и 4 были, в основном, связаны с гипергликемией.
болезнь Кушинга
При болезни Кушинга оценка безопасности средств для внутримышечного применения была проведена на основании данных, собранных в 150 пациентов, получавших пасиреотид, в ходе исследования фазы III G2304 (средняя продолжительность экспозиции: 57 недель). Пациенты были рандомизированы в соотношении 1: 1 для получения начальных доз 10 мг или 30 мг пасиреотиду с возможностью повышения дозы до достижения максимальной дозы 40 мг каждые 28 дней. Наиболее частыми побочными реакциями (частота ≥1 / 10) во время исследования фазы III G2304 были гипергликемия, диарея, холелитиаз и сахарный диабет. Частота и тяжесть побочных реакций увеличивались с повышением начальной дозы до 30 мг, но они не были одинаковыми для всех побочных реакций.
Побочные реакции включают события, о которых сообщалось при базовых исследований при введении средств для внутримышечного применения пациентам с акромегалией и болезнью Кушинга. Побочные реакции приведены в соответствии с основными классов систем органов по медицинским словарем для нормативно-правовой деятельности (MedDRA). В рамках каждого класса систем органов нежелательные реакции распределены по частоте. В пределах каждой группы по частоте побочные реакции представлены в порядке уменьшения серьезности. Частоту определены следующим образом: очень часто (≥ 1/10); часто (от ≥ 1/100 до <1/10); нечасто (от ≥ 1/1000 до <1/100).
Нежелательные реакции (согласно предпочтительными сроками) при в применении пасиреотиду.
Со стороны крови и лимфатической системы:
часто - анемия.
Со стороны эндокринной системы:
часто - недостаточность надпочечников *.
Расстройства обмена веществ и питания:
очень часто - гипергликемия, сахарный диабет
часто - сахарный диабет II типа, нарушение переносимости глюкозы, снижение аппетита.
Со стороны нервной системы:
часто - головная боль, головокружение.
Со стороны сердца:
часто - синусовая брадикардия **, пролонгация интервала QT.
Со стороны пищеварительного тракта:
очень часто - диарея, тошнота, боль в животе ***;
часто - вздутие живота, рвота.
Со стороны печени и желчевыводящих путей:
очень часто - холелитиаз;
часто - холецистит ***, холестаз.
Со стороны кожи и подкожных тканей:
часто - алопеция, зуд.
Общие нарушения и реакции в месте введения препарата:
Очень часто - усталость ***;
часто - реакции в месте инъекции ***.
Исследования:
часто - повышение уровня гликозилированного гемоглобина, повышение уровня аланинаминотрансферазы, повышение уровня аспартатаминотрансферазы, повышение уровня гамма-глутамилтранспептидазы, повышение уровня глюкозы крови, повышение уровня глюкозы крови и КФК крови, повышение уровня липазы;
нечасто - повышение уровня амилазы, увеличение протромбинового времени.
* Недостаточность надпочечников включает: адреналовую недостаточность и снижение уровня кортизола в крови.
** Синусовая брадикардия включает: брадикардия и синусовая брадикардия.
*** Боль в животе включает боль в животе и боли в верхних отделах живота. Реакции в месте инъекции включают: боль в месте инъекции, узелок в месте инъекции, дискомфорт в месте инъекции, синяк в месте инъекции, зуд в месте инъекции, реакции в месте инъекции, повышенная чувствительность в месте инъекции и отек в месте инъекции. Холецистит включая острый холецистит и хронический холецистит. Усталость включая усталость и астению.
Описание отдельных побочных реакций.
Расстройства обмена глюкозы.
акромегалия
У пациентов с акромегалией повышение уровня глюкозы натощак было частым отклонением лабораторных показателей степени 3/4 при двух исследований фазы ИИИ. В исследовании C2305 повышение уровня глюкозы натощак степени 3 сообщались в 9,7% и 0,6%, а степени четвёртого 0,6% и 0% пациентов с акромегалией, получавших пасиреотид внутримышечно и октреотид внутримышечно, соответственно . В исследовании C2402, повышение уровня глюкозы натощак степени 3 сообщались в 14,3% и 17,7% пациентов с акромегалией, получавших пасиреотид 40 мг и 60 мг внутримышечно, соответственно, и в 0% пациентов в группе активного контроля. Два неотложных случаях, связанных с гипергликемией (диабетический кетоацидоз, и диабетическая гипергликемическая кома) были зарегистрированы после увеличения дозы пасиреотиду до 60 мг у пациентов, ранее не получавших лечения, один у пациента с нелеченной гипергликемии и HbA1c> 8% до начала применения пасиреотиду и один у пациента с нелеченной гипергликемии и плазменным уровнем глюкозы натощак 359 мг / дл, соответственно. В обоих исследованиях уровне FPG и HbA1c повысились в течение первых трех месяцев внутримышечного применения пасиреотиду. У пациентов, ранее не получавших лечения (исследование C2305) среднее абсолютное повышение FPG и HbA1c было, в основном, подобным у всех пациентов, получавших пасиреотид внутримышечно, независимо от исходных значений. В обоих исследованиях уровне FPG и HbA1c повысились в течение первых трех месяцев внутримышечного применения пасиреотиду. У пациентов, ранее не получавших лечения (исследование C2305) среднее абсолютное повышение FPG и HbA1c было, в основном, подобным у всех пациентов, получавших пасиреотид внутримышечно, независимо от исходных значений. В обоих исследованиях уровне FPG и HbA1c повысились в течение первых трех месяцев внутримышечного применения пасиреотиду. У пациентов, ранее не получавших лечения (исследование C2305) среднее абсолютное повышение FPG и HbA1c было, в основном, подобным у всех пациентов, получавших пасиреотид внутримышечно, независимо от исходных значений.
Степень и частота гипергликемии, которая наблюдалась в двух основных исследованиях с участием пациентов с акромегалией, была выше в группе внутримышечного применения препарата Сигнифор ЛАР, чем в группе активного контроля (октреотида для внутримышечного применения или ланреотида в виде глубокой подкожной инъекции ). В общем анализе двух основных исследований общая частота неблагоприятных побочных реакций, связанных с гипергликемией, была 58,6% (все степени) и 9,9% (критерии общей токсичности степени 3 и 4) в группе внутримышечного применения препарата Сигнифор ЛАР по сравнению с 18,0% (все степени) и 1,1% (КОТ степени 3 и 4) в группе активного контроля. В опорном исследовании с участием пациентов, у которых не обеспечивается достаточный контроль с помощью другого аналога соматостатина, доля пациентов, ранее не получавших противодиабетических средств и требовали антидиабетической терапии в ходе исследования, составила 17,5% и 16,1% в группах препарата Сигнифор ЛАР 40 мг и 60 мг по сравнению с 1,5% в группе активного контроля; в опорном исследовании с участием пациентов, не получавших предварительного лечения, доля пациентов, нуждающихся антидиабетической терапии в ходе исследования, составила 36% в группе препарата Сигнифор ЛАР по сравнению с 4,4% в группе активного контроля.
болезнь Кушинга
У пациентов с болезнью Кушинга повышенный уровень ГПН был частым отклонением лабораторных показателей степени 3 по СКТ (14,7% пациентов) во время исследования фазы III G2304; случаи отклонения лабораторных показателей степени 4 не наблюдалось. Среднее повышение HbA1c было менее выраженным у пациентов с нормальным уровнем гликемии на момент включения в исследование по сравнению с пациентами с предиабетом или диабетом. Средние уровни ГПН часто росли в течение первого месяца лечения, а в последующие месяцы снижались и стабилизировались. Повышение уровня ГПН и HbA1c зависело от дозы, а значение обычно снижались после прекращения введения пасиреотиду, но оставалось выше исходных значений. Общая частота побочных реакций, связанных с гипергликемией, составила 75,3% (все степени) и 22,7% (степень 3 по СКТ).
Повышение уровня глюкозы и HbA1c в плазме натощак, которые наблюдались после внутримышечного применения пасиреотиду, были обратимыми после отмены препарата.
Рекомендуется мониторинг уровня глюкозы в крови у пациентов, принимающих препарат Сигнифор ЛАР.
Со стороны пищеварительного тракта . Во время лечения Сигнифор ЛАР часто сообщалось о расстройствах со стороны пищеварительного тракта. Эти явления были обычно низкой степени тяжести, не требовали вмешательства и проходили при продолжении лечения. У пациентов с акромегалией желудочно-кишечные расстройства были менее частыми у пациентов, которым не обеспечивался достаточный контроль, по сравнению с пациентами, ранее не получавших лечения.
Реакции в месте инъекции. Во время исследований фазы III реакции в месте инъекции (например боль в месте инъекции, дискомфорт в месте инъекции) имели степень тяжести преимущественно 1 или 2. Частота таких явлений была самой высокой в первые 3 месяца лечения. Во время исследований с участием пациентов с акромегалией рекции в месте инъекции были подобными при в применении пасиреотиду и внутримышечном применении октреотида и реже наблюдались у пациентов, у которых не обеспечивается достаточный контроль, по сравнению с пациентами, ранее не получавших лечения.
Удлинение интервала QT.В исследовании C2305 с участием пациентов с акромегалией доля пациентов с вновь открывшимися заметными интервалами QT / QTc была сопоставимой между группами, получавшими пасиреотид внутримышечно и октреотид внутримышечно в перекрестной фазы, с несколькими заметными аномальными значениями. Значение QTcF> 480 мс наблюдались у 3 пациентов по сравнению с 2 пациентами в группе внутримышечного применения пасиреотиду и внутримышечного применения октреотида, соответственно, и удлинение QTcF> 60 мс по сравнению с исходным значением сообщалось у 2 пациентов по сравнению с 1 пациентом в соответствующих группах . В исследовании C2402 единственным заметным отклонением от нормы было значение QTcF> 480 мс у 1 пациента в группе внутримышечного применения пасиреотиду 40 мг. Во время исследования G2304 с участием пациентов с болезнью Кушинга значение QTcF> 480 мс наблюдалось у 2 пациентов. Значение QTcF> 500 мс не наблюдалось ни в одном из основных исследований.
Печеночные ферменты. Сообщалось о транзиторное повышение уровня печеночных ферментов на фоне применения аналогов соматостатина, также наблюдалось у пациентов, принимавших пасиреотид в ходе клинических исследований. Повышение в основном было асимптомно, с низкой степенью и оборотным при продолжении лечения. Несколько случаев одновременного повышения АЛТ более 3 x ВМН и билирубина более 2 x ВМН наблюдались при подкожном применении, однако не у пациентов, получавших пасиреотид внутримышечно. Все случаи одновременных повышений наблюдались в течение 10 дней с момента начала лечения. Пациенты выздоровели без клинических последствий, а результаты тестов функции печени вернулись к исходным значениям после отмены лечения.
Рекомендуется мониторинг уровня печеночных ферментов до и во время лечения Сигнифор ЛАР в соответствии с клиническими стандартами.
Ферменты поджелудочной железы. У пациентов, принимавших пасиреотид в ходе клинических исследований, наблюдалось асимптоматическое повышение уровня липазы и амилазы. Повышение было преимущественно низкой степени и мало обратимый характер при продолжении лечения. Панкреатит является потенциальной неблагоприятной реакцией, связанной с применением аналогов соматостатина в результате связи между желчнокаменной болезнью и острым панкреатитом.
Несовместимость.
Из-за отсутствия исследований совместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Срок годности Сигнифор Лар
3 года.
Условия хранения Сигнифор Лар
Хранить в оригинальной упаковке при температуре 2-8 ° C. Не замораживать. Хранить в недоступном для детей месте.
Упаковка
Порошок во флаконе из коричневого стекла емкостью 6 мл, закупоренный резиновой пробкой серого цвета под алюминиевым колпачком системы flip-off серого (для дозировки 20 мг), красного (для дозировки 40 мг) или оранжевого (для дозировки 60 мг) цвета в комплекте с: растворителем в предварительно заполненном шприце вместимостью 3 мл с бесцветного стекла с 2 резиновыми пробками серого цвета, упором для пальцев, поршнем и колпачком; другой иглой и одним адаптером в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Новартис Фарма Штейн АГ.
Местонахождение производителя
Шаффхаусерштрассе, 4332 Штейн, Швейцария / Schaffhauserstrasse, 4332 Stein, Switzerland.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Сигнифор Лар только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- https://www.novartis.com/ - Новартис Фарма Штейн АГ
| Тип данных | Сведения из реестра |
| Торговое наименование: | Сигнифор Лар |
| Производитель: | Новартис Фарма Штейн АГ |
| Форма выпуска: | порошок для суспензии для инъекций 20 мг, 40 мг или 60 мг 1 флакон с порошком в комплекте с растворителем по 2 мл в предварительно заполненном шприце (кармеллоза натрия, маннит (E421), полоксамер 188, вода для инъекций) , 1 иглой и 1 адаптером в картонной коробке |
| Регистрационное удостоверение: | UA/15926/01/01, UA/15926/01/02, UA/15926/01/03 |
| Дата начала: | 27.04.2017 |
| Дата окончания: | 27.04.2022 |
| МНН: | Pasireotide |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон с порошком для суспензии для инъекций содержит 20 мг, 40 мг или 60 мг пасиреотиду (в форме пасиреотиду памоат) |
| Фармакологическая группа: | Гипофизарные, гипоталамические гормоны и их аналоги. |
| Код АТХ: | H01CB05 |
| Заявитель: | Новартис Фарма АГ |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Лихтштрассе, 35, 4056 Базель, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| H | Препараты гормонов для системного применения (кроме половых гормонов и инсулинов) |
| H01 | Гипофизарные, гипоталамические гормоны и их аналоги |
| H01C | Гипоталамические гормоны |
| H01CB | Гормоны, задерживающие рост |
| H01CB05 | Пасиреотид |