- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/16775/01/01 закончился 21.06.2023
Соликва инструкция по применению
Официальная инструкция лекарственного препарата Соликва раствор 100 Од./мл+33 мкг/мл. Описание и применение Solikva, аналоги и отзывы. Инструкция Соликва раствор утвержденная компанией производителем.
Состав
действующая вещество: инсулин глapгин, ликсисенатид;
1 мл раствора для инъекций содержит 100 единиц инсулина глapгина и 33 мкг ликсисенатида;
1 шприц-ручка содержит 3 мл раствора для инъекций, что эквивалентно 300 Ед. инсулина глapгина и 100 мкг ликсисенатида;
1 шприц соответствует 1 Ед. инсулина глapгина и 0,33 мкг ликсисенатида.
Вспомогательная вещества: глицерин (85%); метiонiн; метакрезол; цинка хлорид: соляная кислота, концентрированная; натрия гидроксид; вода для инъекций.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: бесцветный или почти бесцветный раствор.
Фармакологическая группа
Лекарственные средства, применяемые при сахарном диабете, инсулин и иx аналоги длительного действия для инъекционного введения.
Код ATH: A10AE54.
Фармакологические свойства
Фармакодинамика.
Механизм действия. Препарат Соликва это комбинация двух действующих веществ с взасмодоповнюючимы механизмами действия для улучшения контроля гликемии, а именно инсулина глapгинy (аналог базального инсулина, главной целью якоrо является контроль уровней глюкозы в плазме крови натощак) и ликсисенатиду (агонист рецепторов к ГПП-1, главной целью которого с контроль постпрандиальных уровней rлюкозы).
Инсулин глapгин. Важнейшим действием инсулина, в том числе инсулина глapгiнy, является регуляции метаболизма глюкозы. Инсулин и его аналоги снижают уровень глюкозы в крови за счет стимуляции ее захвата периферическими тканями, в частности скелетными мышцами и жировой тканью, а также угнетения образования rлюкозы в печени. Инсулин подавляет липолиз и протеолиз, а также стимулирует синтез белков.
Ликсисенатид. Лiксисенатид с агонистом рецепторов к глюкаrоноподобного пептиду- 1 (ГПП-1). Рецепторы к ГПП-1 является мишенью природного ГПП-1 - эндогенного гормона инкретину, который глюкозозависимый секрецию инсулина β-клетками и угнетает секрецию глюкагона α-клетками поджелудочной железы.
Ликсисенатид стимулюс секрецию инсулина при повышении уровня глюкозы в крови, не влияя при этом на секрецию инсулина при нормогликемии, что ограничивает риск виникенення гипогликемии. Параллельно угнетается секреция глюкагона. В случае гипогликемии рятуваьний механизм в виде секреции глюкагона сохраняется. Постпрандиальный введение ликсисенатиду также замедляет опорожнение желудка, снижая таким образом скорость абсорбции и поступления в систему кровообращения глюкозы, содержащейся в пище.
Фармакологические.
Комбинация инсулина гларгину и ликсисенатиду не влияет на Фармакодинамика инсулина гларгину. Влияние комбинации инсулина гларгину и ликсисенатиду на Фармакодинамика ликсисенатиду не изучали в рамках исследований I фазы.
Учитывая относительно постоянный Профиль "концентрация / время» инсулина гларгина в течение 24 часов без выраженных пиков при применении его отдельно, Профиль «скорость утилизации глюкозы / час» был подобным при применении комбинации инсулина гларгiну и ликсисенатиду.
Период действия инсулинов, в том числе препарата Солiква, может отличаться в разных лиц i даже быть различным в одной той же лица.
Инсулин гларгiн. По результатам клинических исследований с применением инсулина гларгiну (100 ед / мл) гипогликемизирующий эффект на молярнiй основе (то есть при применении одинаковых доз) инсулина гларгiну при его внутривенном введении приблизительно таким же, как человеческого инсулина.
Ликсисенатид. По результатам 28-дневного плацебо-контролируемого исследования среди пациентов с сахарным диабетом 2 типа применения лiксисенатиду в дозе 5-20 мкг приводило к статистически значимому снижению постпрандиальних уровней глюкозы после завтрака, обеда и ужина.
Опорожнение желудка . После употребления стандартной мiченои исследуемой пищи в рамках указанного выше исследования было подтверждено, что ликсисенатид замедляет опорожнение желудка, снижая таким образом скорость постпрандиальнои абсорбции глюкозы. Эффект сповiльнення опорожнение желудка поддерживалось до завершения дослщження.
Клиническая эффективность и безопасность. Безопасность и эффективность препарата Соликва по контролю гликемии оценивались в трех рандомизованих клинических исследованиях среди пациентов с сахарным диабетом 2 типа:
- Добавление к метформiну (у пациентов, не получавших инсулин). Переход от базального инсулина.
- Переход от агонисту рецепторов ГПП-1
В каждом из исследований с активным контролем лечения лекарственным средством Соликва приводило к клинически и статистически значимого улучшения уровней гликированного гемоглобина (НЬА1с).
Достижения низших уровней НЬА1с и достижения более значительного снижения уровней НЬА1с не приводил к увеличению частоты возникновения гипогликемии при комбинированном лечении по сравнению с монотерапии инсулин гларгином (см. Раздел «Побочные реакции»).
В рамках клинического исследования с добавлением препарата до метформину лечения начиналось с 10 доз дозирования (10 единиц инсулина гларгiну и 5 мкг ликсисенатиду). В рамках клинического исследования с переходом от базального инсулина начальная доза составляла 20 доз дозирования или 30 доз дозирования (30 единиц инсулина гларгину и 10 мкг ликсисенатиду) (см. Раздел «Способ применения и дозы») , в зависимости от предварительного дозирования инсулина. В обоих исследованиях титрования дозы осуществлялось один раз в неделю, учитывая уровне глюкозы в плазме крови натощак, которые определялись самостоятельно.
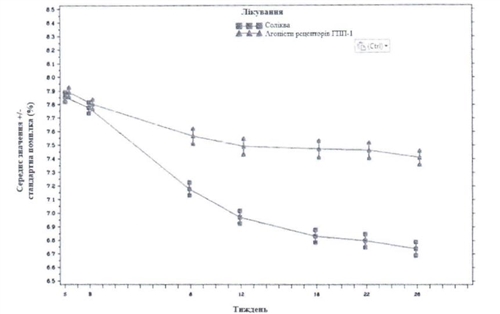
Добавление к метформину (у пациентов, не получавших инсулин).
Клинические исследования среди пациснтов с сахарным диабетом 2 типа, в которых на фоне лечения пероральным протидiабетичним препаратом отмечалось надлежащего контроля заболевания . Всего в рамках открытого, 30-недельного исследования с активным контролем было рандомiзовано 1170 пациентов с сахарным диабетом 2 типа для оценки эффективности и безопасности препарата Соликва сравнению с отдельными компонентами инсулином гларгин (10 ед / мл) и ликсисенатидом (20 мкг).
Пациенты с сахарным диабетом 2 типа, получавших лечение метформином в виде монотерапии или метформином в сочетании с другим пероральных противодиабетических препаратом, которым мог быть препарат сульфонилмочевины, глинид, ингибиторы натрiйзалежного котранспортера глюкозы-2 (НЗКГ-2) или ингибиторы дипептидилпептидазы-4 (ДПП -4), и в которых не отмечалось должного контроля заболевания фоне данного лечения (уровне НЬА1с колебались в пределах от 7,5% до 10,0% у пациентов, которые ранее получали метформин в виде монотерапии, и в пределах от 7,0 % до 9,0% у пациентов, которые ранее получали лечение метформином в комбинации с другим пероральным протидиабетичним препарату), были включены в вступительный пepиoд в течение 4 недель. В течение этой вступительной фазы осуществлялась оптимизация лечения метформiном, а прием других пероральных протидиабетичних препаратов прекращался. В конце вступительного периода пациенты, в которых продолжался отмечаться ненадлежащий контроль заболевания (уровни HbAlc колебались в пределах от 7% до l U%), были рандомизованые в группы, которые получали препарат Соликва, инсулин глapгин или ликсисенатид. С 1479 пациентов, которые были включены в вводную фазу исследования, 1170 были рандомизированны. Главными причинами, которые не позволяли включить пациентов в фазу исследования, были уровне глюкозы в плазме крови натощак> 13,9 ммоль / л и уровне НЬА1с <7% или> 10% в конце вступительной фазы исследования. инсулин глapгiн или лiксисенатид. С 1479 пацiснтiв, которые были включены в вводную фазу исследования, 1170 были рандомизированы. Главными причинами, которые не позволяли включить пациентов, были уровне глюкозы в плазме крови натощак> 13,9 ммоль / л и уровне НЬА1с <7% или> 10% в конце вступительной фазы исследования. инсулин глapгин или ликсисенатид. С 1479 пацiснтiв, которые были включены в вводную фазу исследования, 1170 были рандомизованные. Главными причинами, которые не позволяли включить пациентов в рандомизациоонуюу фазу исследования, были уровне глюкозы в плазме крови натощак> 13,9 ммоль / л и уровне НЬА1с <7% или> 10% в конце вступительной фазы исследования.
Характеристики популяций рандомiзованих пациентов с сахарным диабетом 2 типа были следующими: Средний возраст составил 58,4 лет, при этом возраст большинства пацiснтiв (57,1%) составлял от 50 до 64 лет, 50,6% пацiснтiв были мужчинами. Средний индекс массы тела (IМТ) на исходном уровне составил 31,7 Кr / м2, при этом в 63,4% пациентов IMT составлял более 30 кг / м2. Середия продолжительность цукровоrо диабета составляла примерно 9 лет. Метформiн было обязательным фоновой терапiсю, а 58% пациентов получали на скринiнrу также другой пероральный протидiабетичний препарат, которым в 54% пацiентiв был препарат сульфонiлсечовины.
На неделе 30 лечения препаратом Солiква приводило к статистически значущоrо улучшение уровней НЬА1с (р-значение <0,0001) по сравнению с отдельными компонентами. По результатам предварительно визначеноrо анализа этой первичной конечной точки отмечены различия узrоджувались относительно исходных уровней HbA1c (<8% или> 8%) или перорального протидiабетичноrо лечения на исходном уровне (метформiн в виде монотерапiьi или метформiн в комбинации с другим пероральным протидiабетичним препаратом).
lнформацiя относительно других конечных точек исследования приведена ниже в таблице и на изображении.
Результаты клинического исследования с добавлением препарата до метформiну на недели 30 (попvляцiя пациентов, которые получили лечение)
| препарат Соликва | инсулин гларгин | Ликсисенатид | |
| Количество пациентов, которые получили лечение | 468 | 466 | 233 |
| Уровень НЬАlс (%) | |||
| Выходной уровень (среднее значение, после вступительной фазы) | 8,1 | 8,1 | 8,1 |
| Завершение исследования (среднее значение) | 6,5 | 6,8 | 7,3 |
| Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -1,6 | -1,3 | -0,9 |
| Отличие по сравнению с инсулином гларгин [95% доверительного интервал] (о значения) | -0,3 [-0,4; -0,2] (<0,0001) | ||
| Отличие сравнению с ликсисенатидом [95% доверительного интервал] (р-значения) | -0,8 [-0,9; -0,7] (<0,0001) | ||
| Количество пацiснтiв (%), в которых были досяrнути уровне HbA1c <7% на Неделе 30 * | 345 (74%) | 277 (59%) | 77 (33%) |
| Уровень глюкозы в плазме крови натощак (ммоль / л) | |||
| Выходной уровень (среднее значение) | 9,88 | 9,75 | 9,79 |
| Завершения исследования (среднее значения) | 6,32 | 6,53 | 8,27 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) [95% доверительного интервал] | -0,19 -0,420; 0,038] (0,1017) | ||
| Изменение по сравнению с ликсисенатидом, определенная методом наименьших квадратов (среднее значение)
[95% доверительного интервал] | -1,96 [-2,246; -1,682] (<0,0001) | ||
| Постпрандiальний уровень глюкозы через 2:00 после приема пищи (ммоль / л) ** | |||
| Выходной уровень (среднее значение) | 15,19 | 14,61 | 14,72 |
| Завершение исследования (середие значения) | 9,15 | 11,35 | 9,99 |
| Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов | -5,68 | -3,31 | -4,58 |
| Изменение по сравнению с инсулином гларгин, определенная методом наименьших квадратов (среднее значение)
[95% доверительного интервал] | -2,38 [-2,79; -1,96] | ||
| Изменение по сравнению с ликсисенатидом, определенная методом наименьших квадратов (среднее значение)
[95% доверительного интервал] | -1,10 [-1,63; -0,57] | ||
| Средняя масса тела (кг) | |||
| Выходной уровень (среднее значение) | 89,4 | 89,8 | 90,8 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов | -0,3 | 1,1 | -2,3 |
| Сравнение с инсулином гларгин
[95% доверительного интервал] | -1,4 [-1,9; -0,9] (<0,0001) | ||
| По сравнению с ликсисенатидом
[95% доверительного интервал] | 2,01 [1,4; 2,5] | ||
| Количество пациента (%), в которых были достигнуты уровни HbA1c <7,0% без прироста массы тела на недели 30 | 202 (43,2%) | 117 (25,1%) | 65 (27,9%) |
Пропорциональна различие по сравнению с инсулина гларгiном [95% доверительного интервал] | 18,1 [12,2; 24.01] (<0,0001) | ||
Пропорциональна отличие по сравнению с лiксисенатидом [95% довiрчий iнтервал]* | 15,2 [8,1; 22,4] | ||
| Суточная доза инсулина гларгина | |||
| Доза инсулина на недели 30, определенная методом наименьших квадратов (среднее значение) | 39,8 | 40,5 | не применены |
* Не включено в предварительно определенной процедуре исследования постепенного снижения уровней
** Постпрандiальниы уровень глюкозы через 2:00 после приема пищи минус уровень глюкозы перед приемом пищи
Изображения - средний уровне НЬАlс (%) на визит в течение 30 недель лечения
В пациентов группы препарата Солiква отмечено статистически значимое больше снижение среднего профиля уровней глюкозы в плазме крови, которые определялись самостоятельно на 7 временных точках, от исходного уровня до Недели 30 (-3,35 ммоль / л) по сравнению с пациентами группы инсулина гларгiну (-2 , 66 ммоль / л различие -0,69 ммоль / л) и с пациентами rрупы лiксисенатиду (-1,95 ммоль / л различие -1,40 ммоль / л) (р <0,0001 для обеих сравнению). На всех временных точках на недели 30 средние уровни rлюкозы в плазме крови были ниже в группе препарата Солiква сравнению как с группой инсулина гларгiну, так i с группой лiксисенатиду, за исключением только уровней глюкозы перед завтраком, которые были подобными в группе лекарственного средства Солiква и в группе инсулина глapriнy.
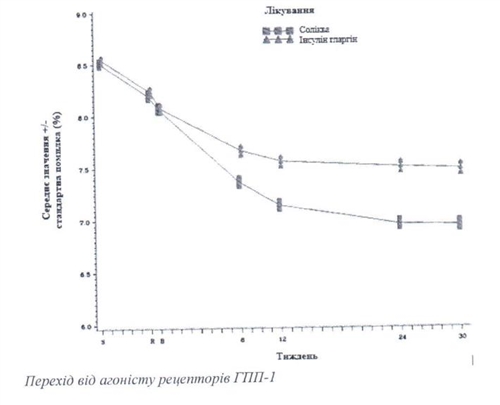
Переход от базального инсулина
Клиническое исследование среди пациентов с сахарным диабетом 2 типа, в которых на фоне лiкувания базальным инсулина НЕ отмечалось надлежащего контроля заболевания
общем 736 пациентов с сахарным диабетом 2 типа приняли участие в рандомiзованому, 30-недельном, с активным контролем, открытом, с 2 группами лечения, в параллельных группах, многоцентровом исследовании с оценкой эффективности и безопасности препарата Соликва сравнению с инсулином гларгин (100 ед / мл).
Скриновани пациенты с сахарным диабетом 2 типа получали лечение базальным инсулином впрдовж не менее 6 месяцев в стабильной дозе от 15 до 40 МЕ в виде монотерапии или в комбинации с одним или двумя пероральными гипогликемическими препаратами (метформин, препарат сульфонилмочевины, глиниды, ингибитор НЗКТГ-2 или ингибитор ДПП-4), при этом уровне HbA1c в них составляли вщ 7,5% до 10% (средний уровень HbA1c на скрининга составлял 8,5%), а уровни глюкозы в плазме крови натощак составляли <10,0 ммоль / л или <11,1 ммоль / л в зависимости от предыдущего противодиабетического лечения.
После скринiнгу пациенты, которые были определены пригодными для участия в исследовании (n = 1018), включались в 6-недельный вступительную фазу, влродовж которой пациенты продолжали получать инсулин гларгин или были переведены на лечение инсулина гларгiном в случае, если они получали другой базальный инсулин; при этом осуществлялось титрование / стабилизация дозы инсулина на фоне продолжения терапии метформiном (если он принимался до этого). Лечение любыми другими пероральными протидiабетичнимы препаратами было прекращено.
После завершения вводного периода пациенты, у которых равны HbA1c составляли от 7 до 10%, уровне глюкозы в плазме крови натощак составляли менее 7,77 ммоль / л, а суточная доза инсулина гларгiну составляла от 20 до 50 единиц, были рандомiзованi в группу препарата Солiква (n = 367) или в группу инсулина гларгiну (n = 369).
Характеристики популяций данных пациентов с сахарным диабетом 2 типа были следующими: Средний возраст составил 60,0 лет, при этом возраст большинства пациентов (56,3%) составлял от 50 до 64 лет, 53,3% пациентов были женского пола. Средний индекс массы тела (IMT) на исходном уровне составил 31,1 кг / м2, при этом в 57,3% пациентов IMT составил более 30 Кr / м2. Средняя продолжительность сахарного диабета составляла лриблизно 12 лет, а средняя продолжительность предварительного лечения базальным инсулина - примерно 3 года. На скринiнгу 64,4% пациентов в качестве базального инсулина получали инсулин гларгiн, а 95,0% получали по крайней мере один пероральный протидiабетичний препарат.
На неделе 30 лечения препаратом Солiква приводило к статистически значимому улучшению уровней НЬА 1 с (р-значение <0,0001) по сравнению с инсулина гларriном.
Информация относительно других конечных точек исследования приведена ниже в таблице и на изображении.
Результаты клинического исследования среди пацiснтiв с сахарным диабетом 2 типа, в которых не отличался надлежащий контроль заболевания фоне лечения базальным инсулина, на неделе 30 (попvляцiя пацiснтiв, которые получили лечение)
препарат Соликва | инсулин гларгин | |
|---|---|---|
Количество пациентов, получивших лечение | 366 | 365 |
| Уровень HbA1c (%) | ||
Выходной уровень (среднее значение, после вступительной фазы) | 8,1 | 8,1 |
Завершение лечения (среднее значение) | 6,9 | 7,5 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -1,1 | -0,6 |
Отличие по сравнению с инсулином гларгин [95% доверительный интервал] (Р-значения) | -0,5 [-0.6; -0.4] (<0,0001) | |
Количество пациентов [п (%)], в которых были достигнуты уровне НЬАИс <7% на Неделе 30 | 201 (54,9%) | 108 (29,6%) |
Уровень глюкозы в плазме крови натощак (ммоль / л) | ||
Выходной уровень (среднее значение) | 7,33 | 7,32 |
Завершение исследования (среднее значение) | 6,78 | 6,69 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -0,35 | -0,46 |
Отличие по сравнению с инсулином гларгин [95% доверительный интервал] | 0,11 (-0,21; 0,43) | |
Постпрандиальный уровень глюкозы через 2:00 после приема пищи (ммоль / л) ** | ||
| Выходной уровень (среднее значение) | 14,85 | 14,97 |
Завершение исследования (среднее значение) | 9,91 | 13,41 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадраиив (среднее значение) | -4,72 | -1,39 |
Изменение по сравнению с инсулином гларгин, определенная методом наименьших квадратов (среднее значение) 95% доверительный интервал | -3,33 [-3,89: -2.77] | |
| Средняя масса тела (кг) | ||
Выходной уровень (среднее значение) | 87,8 | 87,1 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -0,7 | 0,7 |
Сравнение с инсулином гларгин [95% доверительный интервал] (р-значения) | -1,4 [-1,8; -0,9] (<0,0001) | |
Количество пациентов (%), в которых были достигнуты уровне НЬАИс <7,0% без прироста массы тела на Неделе 30 | 125 (34,2%) | 49 (13,4%) |
Пропорциональна отличие по сравнению с инсулином гларгин [95% доверительный интервал] (Р-значения) | 20,8 [15,0; 26,7] (<0,0001) | |
Суточная доза инсулина гларгина | ||
Выходной уровень (среднее значение) | 35,0 | 35,2 |
Конечная точка (среднее значение) | 46,7 | 46,7 |
Изменение дозы инсулина на недели, определенная методом наименьших квадратов (среднее значение) | 10,6 | 10,9 |
* Не включено в предварительно определенной процедуре исследования постепенного снижения уровней
** постпрандиальный уровень глюкозы через 2:00 после приема пищи минус уровень глюкозы перед приемом пищи
Изображения - Средние уровни НЬАИс (%) на визитах в течение 30 недель лечения
.
.
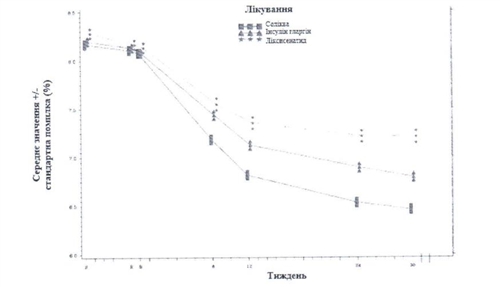
Клиническое исследование среди пациентов с сахарным диабетом 2 типа, в которых на фоне лечения агонiстом рецепторов ГПП-1 не отмечалось надлежащего контроля заболевания
Эффективность и безопасность препарата Солiква в сравнении с неизменным предыдущим лечением агонiстом рецепторов ГПП-1 были изучены в 26-недельном рандомiзованому открытом дослiджсннi. В исследовании принимало участие 514 пациентов с сахарным диабетом 2 типа, в которых отмечалось надлежащего контроля (уровень НЬАИс от 7% до 9% включительно) заболевания, и получавших лечение лираглутид или эксенатид течение не менее 4 месяцев или дулаглутидом, албиглутидом или эксенатид с пролонгированным высвобождением в течение не менее 6 месяцев (все препараты вводились в максимально переносимой дозе), и метформином в виде монотерапии или в сочетании с пиоглитазоном, ингибитором натрий-глюкозного котранспортеру-2 или с обоими. Отобранные пациенты были рандомизированы или для приема препарата Соликва,
На скрининга 59,7% субъектов получали агонист рецепторов ГПП-1 один или два раза в день, а 40,3% получали агонист рецепторов ГПП-1 раз в неделю. Во время скрининга 6,6% субъектов получали пиоглитазон, а 10,1% - ингибитор натрий-глюкозного котранспортеру 2-го типа в комбинации с метформином. Характеристики популяции исследования были следующие: средний возраст составлял 59,6 лет. 52,5% субъектов были мужчины. Средняя продолжительность диабета составляла 11 лет, средняя продолжительность предварительного лечения агонистами рецепторов ГПП-1 составила 1,9 года, средний ИМТ составлял примерно 32,9 кг / м2, средняя рШКФ составила 87,3 мл / мин / 1,73 м2 и 90, 7% пациентов имели рШКФ> 60 мл / мин.
На Неделе 26 лечения Соликва приводило к статистически значимому улучшению уровней НЬАИс (р <0,0001). Предустановленный анализ подтипа агониста рецепторов ГПП-1 (один / два раза в день или неделю), использованного во время скрининга, показал, что изменение НЬАИс на неделе 26 было аналогичной для каждой подгруппы и согласуется с первичным анализом для всей популяции. Средняя суточная доза Соликва на Неделе 26 составляла 43,5 делений дозирования.
Информация о других конечных точек исследования приведена ниже в таблице и на картинке.
Результаты клинического исследования среди пациентов с сахарным диабетом 2 типа, в которых отмечался надлежащий контроль заболевания на фоне лечения агонистами рецепторов ГПП -1 на Неделе 26 (популяция пациентов, получивших лечение)
| Соликва | Агонист рецепторов ГПП-1 | |
|---|---|---|
Количество пациентов, получивших лечение | 252 | 253 |
Уровень НЬАИс (%) | ||
Выходной уровень (среднее значение, после вступительной фазы) | 7,8 | 7,8 |
Завершение лечения (среднее значение) | 6,7 | 7,8 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -1,0 | -0,4 |
Отличие по сравнению с агонистом рецепторов ГПП-1 [95% ДИ] (р-значения) | -0.6 (< [-0.8: -0,5] 0.0001) | |
Количество пациентов [п (%)], в которых были достигнуты уровне НЬАИс <7% на Неделе 26 | 156(61,9%) | 65 (25,7%) |
Пропорциональна отличие по сравнению с агонистом рецепторов ГПП-1 (95% ДИ) | 36.1 % (28,1 %: 44.0%) | |
| р-значение | <0,0001 | |
Уровень глюкозы в плазме крови натощак (ммоль / л) | ||
Выходной уровень (среднее значение) | 9,06 | 9,45 |
Завершение исследования (среднее значение) | 6,86 | 8,66 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -2,28 | -0,60 |
Отличие по сравнению с агонистом рецепторов ГПП-1 [95% ДИ] (Р-значения) | -1,67 [-2.00;-1,34] (<0,0001) | |
Постпрандиальный уровень глюкозы через 2:00 после приема пищи (ммоль / л) * | ||
Выходной уровень (среднее значение) | 13,60 | 13,78 |
Завершение исследования (среднее значение) | 9,68 | 12,59 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | -4,0 | -1,11 |
Изменение по сравнению с агонистом рецепторов ГПП-1, определенная методом наименьших квадратов (среднее значение) [95% ДИ] (р-значения) | -2,9 [-3,42; -2,28] (<0,0001) | |
| Средняя масса тела (кг) | ||
| Выходной уровень (среднее значение) | 93,01 | 95,49 |
Изменение по сравнению с исходным уровнем, определенная методом наименьших квадратов (среднее значение) | 1,89 | -1,14 |
Сравнение с агонистом рецепторов ГПП-1 [95% ДИ] (р-значения) | -3,03 [2,417; 3,643] (<0,0001) | |
* Постпрандиальный уровень глюкозы через 2:00 после приема пищи минус уровень глюкозы перед приемом пищи
Изображения - Средние уровни НЬАИс (%) на визитах в течение 26 недель лечения
Одновременное применение препарата Соликва с ингибиторами натрий-глюкозного котранспортеру 2-го типа (ингибиторы НЗКТГ-2)
Одновременное применение препарата Соликва с ингибиторами НЗКТГ-2 подтверждается анализом подгрупп из трех рандомизированных клинических исследований фазы 3 (119 пациентов, получавших комбинацию инсулина гларгина / ликсисенатиду с фиксированным соотношением, которые также получали ингибиторы НЗКТГ-2).
Одно исследование, проведенное в Европе и Северной Америке, включало в себя данные 26 пациентов (10,1%), одновременно получали комбинацию инсулина гларгина и ликсисенатиду с фиксированным соотношением, метформин и ингибиторы НЗКТГ-2. Еще два исследования фазы 3 из специализированной японской программы клинического развития, выполненные на пациентах, не достигших достаточного контроля гликемии на пероральных противодиабетических препаратах, предоставили данные по 59 пациентов (22,7%) и 34 пациентов (21,1%), соответственно, одновременно получали ингибиторы НЗКТГ-2 и комбинацию инсулина гларгина и ликсисенатиду с фиксированным соотношением.
Данные этих 3 исследований показывают, что начало применения препарата Соликва у пациентов с недостаточным контролем лечением, которые получали ингибиторы НЗКТГ-2, приводит к более значительному улучшению уровней НЬАИс по сравнению с препаратами сравнения. У пациентов, получавших ингибиторы НЗКТГ-2, не было повышенного риска гипогликемии и значимых различий в общем профиле безопасности по сравнению с теми, кто не получал ингибиторы НЗКТГ-2.
Исследования с изучением влияния на сердечно-сосудистые события
Безопасность инсулина гларгина и ликсисенатиду отношении сердечно-сосудистых событий изучалась в рамках клинических исследований ORIGIN и ELIXA соответственно. Отдельного исследования с изучением влияния препарата Соликва сердечно-сосудистые события не проводилось.
Инсулин гларгин. Исследование снижения частоты сердечно-сосудистых осложнений при инициальном применении инсулина гларгина (исследования ORIGIN) было открытым рандомизированное исследование, в которое были включены 12 537 пациентов и в рамках которого сравнивалось лечения Лантус со стандартным лечением> йа момент первого возникновения серьезного нежелательного явления со стороны сердечно -судиЦпоьГ системы, в Серьезное нежелательное явление со стороны сердечно-сосудистой системы включало смерть внаьслидок- сердечно-сосудистой события, нефатальный инфаркт миокарда и нефатальный инсульт. Медиана продолжительности контрольного наблюдения в рамках исследования составила 6,2 лет. Частота серьезных нежелательных явлений со стороны сердечно-сосудистой системы в рамках исследования ORIGIN была подобной между группой, получавшей препарат Лантус, и группой,
Ликсисенатид. Исследование EL1XA было рандомизированное, вдвойне-слепым, плацебо контролируемым, многонациональным исследованием, в рамках которого осуществлялась оценка сердечно-сосудистых осложнений при лечении ликсисенатидом у пациентов с сахарным диабетом 2 типа (n = 6068) после недавно перенесенного острого коронарного синдрома. Первичной комбинированной конечной точкой по эффективности было время до первого возникновения любого из следующих нежелательных явлений: смерть вследствие сердечно-сосудистой события, нефатальный инфаркт миокарда, нефатальный инсульт или госпитализация по поводу нестабильной стенокардии. Медиана продолжительности контрольного наблюдения в рамках исследования составила 25.8 и 25,7 месяцев в группе ликсисенатиду и в группе плацебо соответственно.
Частота первичной конечной точки была подобной между группой ликсисенатиду (13,4%) и группой плацебо (13,2%): отношение рисков для ликсисенатиду сравнению с плацебо составило 1,017 с ассоциированным 2-сторонней 95% доверительным интервалом (ДИ) от 0,886 до 1,168 .
Фармакокинетика.
Абсорбция. Соотношение инсулин гларгин / ликсисенатид существенно не влияет на фармакокинетику инсулина гларгина и ликсисенатиду в препарате Соликва.
После подкожного введения комбинации инсулин гларгин / ликсисенатид у пациентов с сахарным диабетом 1 типа инсулин гларгин не демонстрировало выраженного пика. Экспозиция инсулина гларгина после введения комбинации инсулин гларгин И ликсисенатид составляла 86- 88% от экспозиции, которая отмечалась при отдельных одновременных инъекциях инсулина гларгина и ликсисенатиду. Такое различие нельзя считать клинически значимой.
После подкожного введения комбинации инсулин гларгин / ликсисенатид у пациентов с сахарным диабетом 1 типа медиана tmax ликсисенатиду находилась в диапазоне от 2,5 до 3,0 часов. AUC была сопоставимой, в то время как отмечалось незначительное снижение Стах ликсисенатиду на 22-34% по сравнению с максимальной концентрации, которая отмечалась при отдельных одновременных инъекциях инсулина гларгина и ликсисенатиду; однако, такое снижение маловероятно может быть клинически значимым.
Клинически значимые различия в скорости абсорбции ликсисенатиду при его применении в виде монотерапии после подкожного введения в область живота, дельтовидной мышцы или бедра отсутствуют.
Распределение. Ликсисенатид характеризуется низким (55%) уровнем связывания с белками плазмы. Предполагаемый объем распределения ликсисенатиду после подкожного введения комбинации инсулин гларгин / ликсисенатид (несвязанный объем распределения, Vz / F) составляет примерно 100 л. Предполагаемый объем распределения инсулин} 'гларгина после подкожного введения комбинации инсулин гларгин / ликсисенатид (объем распределения в равновесном состоянии, Vss / F) составляет примерно 1700 л.
Метаболизм и элиминация. Результаты исследования с изучением метаболизма у пациентов с сахарным диабетом, получавших инсулин гларгин в виде монотерапии, свидетельствуют о том, что инсулин гларгин быстро метаболизируется на уровне карбоксильного конца В-цепи с образованием двух активных метаболитов - МИ (21 А-глицин-инсулин) и М2 (21 А-глицин-дез-ЗОВ-треонин-инсулин). В плазме крови главной циркулирующей соединением является метаболит МИ. Фармакокинетические и фармакодинамические данные свидетельствуют о том, что эффект подкожной инъекции инсулина гларгина главным образом зависит от экспозиции метаболита МИ.
Как и все пептиды, ликсисенатид выводится путем клубочковой фильтрации с последующей. канальцевой реабсорбции и последующим метаболическим расщеплением меньшим пептидов и аминокислот, которые опять включаются в белковый метаболизм. После многократного введения у пациентов с сахарным диабетом 2 типа средней терминальный период полувыведения составлял примерно 3:00, а средний воображаемый клиренс (CL / F) составлял примерно 35 л / ч.
Особые популяции пациентов.
Пациенты с нарушением функции почек. У пациентов с легким (клиренс креатинина, рассчитанный по формуле Кокрофта-Голта. 60-90 мл / мин), умеренным (КК 30-60 мл / мин) и тяжелым (клиренс креатинина 15-30 мл / мин) нарушением функции почек AUC ликсисенатиду росла на 46%, 5Г% и 87% соответственно.
Применение инсулина гларгина у пациентов с нарушением функции почек не исследовалось. Тем не менее, у пациентов с нарушением функции почек потребность в инсулине может быть уменьшена вследствие снижения метаболизма инсулина.
Пациенты с нарушением функции печени. Поскольку ликсисенатид выводится почками, у пациентов с острой или хронической печеночной недостаточностью никаких фармакокинетических исследований не проводилось. Влияние нарушения функции печени на фармакокинетику ликсисенатиду не предвидится.
Применение инсулина гларгина у пациентов с сахарным диабетом и с нарушением функции печени не исследовалось. У пациентов с нарушением функции печени потребность в инсулине может быть уменьшена в связи со снижением способности к глюконеогенеза и снижением метаболизма инсулина.
Возраст, расовая принадлежность, пол и масса тела.
Инсулин гларгин. Влияние возраста, расовой принадлежности и пола на фармакокинетику инсулина гларгина не изучали. По результатам анализа подгрупп, сформированных по возрасту, расовой принадлежностью и статью, в рамках контролируемых клинических исследований среди взрослых пациентов, получавших инсулин гларгин (100 ед / мл), никаких различий в отношении безопасности и эффективности обнаружено не было.
Ликсисенатид. Возраст не имеет клинически значимого влияния на фармакокинетику ликсисенатиду. В рамках исследования фармакокинетики среди пожилых людей без сахарного диабета введение ликсисенатиду в дозе 20 мкг приводило к среднему повышение AUC ликсисенатиду в этих лиц на 29% (11 участников исследования были в возрасте от 65 до 74 лет и 7 участников исследования - в возрасте> 75 лет) по сравнению с 18 лицами в возрасте от 18 до 45 лет, что, вероятно, связано со снижением функции почек в группе пожилых людей.
Этническая принадлежность не вызывает клинически значимого влияния на фармакокинетику ликсисенатиду, о чем свидетельствуют результаты фармакокинетических исследований, проведенных с участием пациентов европейской, японской и китайской национальности.
Пол не имеет клинически значимого влияния на фармакокинетику ликсисенатиду.
Масса тела не имеет клинически значимого влияния на AUC ликсисенатиду.
Иммуногенность. При наличии антител к ликсисенатиду его экспозиция и вариабельность его экспозиции существенно повышаются, независимо от уровня дозировки.
Доклинические данные по безопасности.
Никаких исследований на животных с применением комбинации инсулина гларгина и ликсисенатиду для оценки токсичности при многократном введении, канцерогенеза, генотоксичности или токсического воздействия на репродуктивную систему не проводилось.
Инсулин гларгин. Доклинические данные, полученные в стандартных исследованиях фармакологической безопасности, токсичности при многократном введении, генотоксичности. канцерогенного потенциала и токсического влияния на репродуктивную систему, свидетельствуют об отсутствии каких-либо специфических рисков для человека при применении инсулина гларгина.
Ликсисенатид. В рамках 2-летних исследований канцерогенности при подкожном введении препарата у крыс и мышей наблюдались нелегальные С-клеточные опухоли щитовидной железы, которые были расценены как такие, которые обусловлены Негенотоксичные механизмом, опосредованным рецепторами к GLP-1, к которому грызуны особенно чувствительны. С-клеточная гиперплазия и аденома наблюдались у крыс на фоне применения всех исследуемых доз, а максимальную дозу, при которой не отличались нежелательные эффекты, определить не удалось. У мышей эти эффекты возникали при уровне экспозиции, в 9,3 раза перевищувар-экспозицию у людей при применении терапевтических доз препарата. У мышей не наблюдалось С-клеточных карцином, а у крыс они возникали при уровне экспозиции, примерно в 900 раз превышал экспозицию у людей при применении терапевтических доз.
В рамках 2-летнего исследования канцерогенности при подкожном введении препарата у мышей отмечено С случаи аденокарциномы ендомстрию со статистически значимым повышением частоты этого заболевания в группе применения средних доз, которые обусловили уровень экспозиции, превышал экспозицию у людей в 97 раз. Никаких эффектов, связанных с применением препарата, отмечено не было.
Результаты исследований на животных не свидетельствуют о каком-либо непосредственной вредное воздействие препарата на фертильность самцов и самок крыс. У собак, которым вводился ликсисенатид, наблюдались обратные нарушения в яечках и придатках яечок. У здоровых мужчин не отмечено никакого влияния препарата на сперматогенез, связанного с применением препарата.
В исследованиях с изучением влияния препарата на внутриутробное развитие у крыс на фоне всех исследуемых доз ликсисенатиду (при уровнях экспозиции, в 5 раз превышали экспозицию в людей) и у кроликов при введении высоких доз препарата (при уровнях экспозиции, в 32 раза превышали экспозицию у людей) наблюдались пороки развития, замедление роста плода, задержка оссификации и побочные эффекты со стороны скелета. В обеих моделях исследуемых животных отмечалась незначительная токсическое действие на материнский организм, проявлялась в виде уменьшения потребления пищи и снижение массы тела. Рост новорожденных крысят был замедлен среди самцов, которые подвергались воздействию высоких доз ликсисенатиду в течение позднего гестационного периода и лактации, с небольшим увеличением смертности крысят.
Клинические характеристики
Соликва Показания
Для лечения взрослых пациентов с недостаточно контролируемым сахарным диабетом 2 типа с целью улучшения контроля гликемии как дополнение к диете и упражнениям в дополнение к метформина с ингибиторами натрий-глюкозного котранспортеру 2-го типа или без них. (Результаты исследований влияния на контроль гликемии и исследованы группы пациентов см. Разделы «Особенности применения» и «Фармакологические»).
Противопоказания
Гиперчувствительность к действующим веществам или к любому вспомогательному веществу, входящему в состав препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Никаких исследований с изучением взаимодействия лекарственного средства Соликва с другими лекарственными средствами не проводилось. Информация, приведенная ниже, основывается на результатах исследований, проведенных с отдельными компонентами препарата.
Фармакодинамические взаимодействия. Существует ряд веществ, которые влияют на метаболизм глюкозы, в связи с чем их применение может приводить к необходимости коррекции дозы лекарственного средства Соликва.
К веществам, которые могут усиливать гипогликемизирующий эффект и увеличивать склонность к гипогликемии, относятся противодиабетические лекарственные средства, ингибиторы АПФ (АПФ), дизопирамид, фибраты, флуоксетин, ингибиторы моноаминоксидазы (МАО), пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные лекарства.
К веществам, которые могут ослаблять гипогликемизирующий эффект, относятся кортикостероиды, даназол, диазоксид, диуретики, глюкагон, изониазид, эстрогены и прогестины, производные фенотиазина, соматропин. симпатомиметики (например, эпинефрин (адреналин), сальбутамол, тербуталин), гормоны щитовидной железы, атипичные антипсихотические лекарственные средства (например, клозапин и оланзапин) и ингибиторы протеаз.
Бета-адреноблокаторы, клонидин, соли лития или алкоголь могут как усиливать, так и ослаблять гипогликемизирующий эффект инсулина. Пентамидин может вызывать гипогликемию, после которой иногда может развиться гипергликемия.
Кроме того, под действием симпатолитических средств, таких как бета-адреноблокаторы. клонидин, гуанетидин и резерпин, признаки адренергической коитррегуляции могут ослабляться или совсем исчезать.
Фармакокинстични взаимодействия. Ликсисенатид является пептид но не мстаболизуеться с участием цитохрома Р450. По результатам исследований в условиях in vitro ликсисенатид не влиял на активность исследуемых изоферментов цитохрома Р450 и транспортеров человека.
Ни о каких фармакокинетични взаимодействия инсулина гларгина неизвестно.
Влияние опорожнение желудка на пероральные лекарственные средства. Замедление опорожнения желудка, обусловленное применением ликсисенатиду. может уменьшать скорость абсорбции лекарственных средств, принимаемых перорально. Пациенты, получающие лекарственные средства, которые имеют узкий терапевтический индекс или которые требуют тщательного клинического мониторинга, должен осуществляться тщательный надзор, особенно в начале лечения ликсисенатидом. Эти лекарственные средства должны приниматься в стандартизированном порядке относительно приема ликсисенатиду. Если такие лекарственные средства должны приниматься с пищей, то пациентам нужно рекомендовать по возможности принимать их с тем приемом пищи, если не выполняется ввод ликсисенатиду.
Что касается пероральных лекарственных средств, эффективность которых особенно зависит от пороговых концентраций, например, антибиотиков, то пациентам нужно рекомендовать принимать такие лекарственные средства менее чем за 1:00 до или через 4:00 после инъекции ликсисенатиду.
Кишечно лекарственные формы, содержащие вещества, чувствительные к расщеплению в желудке, должны приниматься по 1:00 до или через 4:00 после инъекции ликсисенатиду.
Парацетамол. Парацетамол использовался в качестве модели лекарственного средства для оценки влияния ликсисенатиду на опорожнение желудка. После однократного приема парацетамола в дозе 1000 мг AUC и ti / д парацетамола оставались неизменными, независимо от времени приема препарата (до или после инъекции ликсисенатиду). При применении препарата через 1:00 или через 4:00 после введения 10 мкг ликсисенатиду В. а х парацетамола уменьшалась на 29% и 31% соответственно, а медиана tmax увеличивалась на 2,0 и 1,75 ч соответственно. Прогнозируется, что при введении ликсисенатиду в поддерживающей дозе 20 мкг будет наблюдаться еще больший рост tmax и снижение Стах парацетамола. При приеме парацетамола за 1:00 до введения ликсисенатиду Стах и tmax парацетамола не изменялись.
Учитывая приведенные результаты необходимость в коррекции дозы парацетамола отсутствует, но удлинение tmax, которое наблюдалось, когда парацетамол принимался через 1-4 часа после введения ликсисенатиду, нужно учитывать, когда для эффективности необходимо быстрое начало действия.
Пероральные контрацептивы. Однократный прием перорального контрацептива (этинилэстрадиола 0.03 мг / левоноргестрела 0,15 мг) за 1:00 до или через 11:00 после ввод 10 мкг ликсисенатиду не влиял на максимальной концентрации, AUC, tl / 2 и tmax этинилэстрадиола и левоноргестрела.
Прием перорального контрацептива через 1:00 или через 4:00 после введения ликсисенатиду не влиял на AUC и ti / 2 этинилэстрадиола и левоноргестрела, хотя максимальная концентрация этинилэстрадиола снижалась на 52% и 39% соответственно, максимальная концентрация левоноргестрела снижалась на 46% и 20% соответственно, а медиана tmax увеличивалось на 1-3 часа. Такое снижение С max имеет ограниченную клиническую значимость и необходимость в коррекции дозы пероральных контрацептивов отсутствует.
Аторвастатин. При одновременном применении ликсисенатиду в дозе 20 мкг и аторвастатина в дозе 40 мг, которые принимались утром в течение 6 дней, экспозиция аторвастатина не менялась, в то время как максимальная концентрация снижалась на 31%, a tmax продлевался на 3,25 часа.
Такого увеличения tmax не наблюдалось в случае, когда аторвастатин принимался вечером; а ликсисенатид вводился утром, но AUC и максимальная концентрация аторвастатина при этом увеличивались на 27% и 66% соответственно.
Эти изменения не с клинически значимыми, поэтому необходимости в коррекции дозы аторвастатина при его одновременном применении с ликсисенатидом нет.
Варфирин и другие производные кумарина. При одновременном применении варфарина в дозе 25 мг и многократном введении ликсисснатиду в дозе 20 мкг не отмечалось никакого влияния на AUC или МНО (международное нормализованное отношение), в то время как Стах снижалась на 19%, a tmax продлевался на 7:00.
Учитывая эти данные необходимости в коррекции дозы варфарина при его одновременном применении с ликсисенатидом не существует; тем не менее, в начале и при завершении лечения ликсисенатидом у пациентов, принимающих варфарин и / или другие производные кумарина, рекомендуется осуществлять частый мониторинг МНО.
Дигоксин. При одновременном применении ликсисснатиду в дозе 20 мкг и дигоксина в дозе 0,25 мг в равновесном состоянии AUC дигоксина без изменений. При этом tmax дигоксина увеличился на 1,5 часа, а максимальная концентрация уменьшилась на 26%.
Учитывая эти данные необходимости в коррекции дозы дигоксина при его одновременном применении с ликсисенатидом нет.
Рамиприл. При одновременном применении ликсисснатиду в дозе 20 мкг и рамиприла в дозе 5 мг в течение 6 дней AUC рамиприла увеличилась на 21%, в то время как максимальная концентрация уменьшилась на 63%. При этом AUC и Стах активного метаболита (рамиприлата) не изменялись. Значение tmax рамиприла и рамиприлата увеличилось примерно на 2,5 часа.
Учитывая эти данные необходимости в коррекции дозы рамиприла при его одновременном применении с ликсисенатидом нет.
Особенности применения
Препарат Соликва не должен применяться у пациентов с сахарным диабетом 1 типа или для лечения диабетического кетоацидоза.
Гипогликемия.
Гипогликемия была нежелательной реакцией, о которой сообщалось чаще всего при лечении препаратом Соликва (см. Раздел «Побочные реакции»). Гипогликемия может возникать, если доза Соликва выше, чем необходимо.
Факторы, которые повышают склонность к гипогликемии, требуют особенно тщательного мониторинга и могут приводить к необходимости в коррекции дозы препарата. К таким факторам относятся следующие:
- изменение места инъекции
- увеличение чувствительности к инсулину (например, при устранении стрессовых факторов) необычное, чрезмерное или длительная физическая нагрузка
- сопутствующее заболевание (например, такое, что сопровождается рвотой, диареей) недостаточно прием пищи пропуск приема пищи
- употребление алкоголя
- некоторые некомпенсированные эндокринные расстройства (например, гипотиреоз и недостаточность передней доли гипофиза или коры надпочечников)
- одновременное применение других лекарственных средств (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»)
- при применении ликсисенатиду и / или инсулина в комбинации с препаратами сульфонилмочевины может повышаться риск возникновения гипогликемии, в связи с чем препарат Соликва не должен применяться в комбинации с препаратами сульфонилмочевины.
Дозировка препарата Соликва должно подбираться индивидуально с учетом клинического ответа, а его титрования осуществляется в соответствии с потребностью пациента в инсулине (см. Раздел «Способ применения и дозы»).
Острый панкреатит.
Применение агонистов рецепторов глюкагоноподобного пептида-1 (GLP-1) ассоциируется с риском развития острого панкреатита. Сообщалось о небольшом количестве случаев острого панкреатита на фоне применения ликсисенатиду, хотя наличие причинно-следственной связи с приемом препарата не. Пациенты должны быть проинформированы о характерные симптомы острого панкреатита, такие как постоянный сильную боль в животе. В случае подозрения на панкреатит применение препарата Соликва необходимо прекратить; если острый панкреатит подтверждается, ликсисснатид назначать больше нельзя. У пациентов с наличием панкреатита в анамнезе нужно соблюдать осторожность при назначении препарата.
Тяжелое заболевание желудочно-кишечного тракта.
Применение агонистов рецепторов GLP-1 может быть ассоциировано с нежелательными реакциями со стороны желудочно-кишечного тракта. Применение препарата Соликва не исследовался у пациентов с тяжелыми желудочно-кишечными заболеваниями, включая тяжелый Гастропарез, в связи с чем применение лекарственного средства Соликва у таких пациентов не рекомендуется.
Тяжелое нарушение функции почек.
Терапевтический опыт применения препарата у пациентов с тяжелым нарушением функции почек (клиренс креатинина менее ЗО мл / мин) и при терминальной стадии болезни почек отсутствует. Применение препарата у пациентов с тяжелым нарушением функции почек и при терминальной стадии болезни почек не рекомендуется (см. Разделы «Способ применения и дозы» и «Фармакологические свойства. Фармакокинетика»).
Одновременное применение других лекарственных средств.
Замедление опорожнения желудка, обусловленное применением ликсисенатиду, может уменьшать скорость абсорбции лекарственных средств, принимаемых перорально. Препарат Соликва должен применяться с осторожностью у пациентов, получающих лекарственные средства, для которых необходима быстрая абсорбция в желудочно-кишечном тракте, которые требуют тщательного клинического мониторинга или которые имеют узкий терапевтический индекс. Конкретные рекомендации по приему таких лекарственных средств приведены в разделе «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий».
Дегидратация.
Пациентам, получающим препарат Соликва, необходимо сообщать о потенциальном риске дегидратации, связанный с побочными эффектами со стороны желудочно-кишечного тракта, и в таких пациентов должны приниматься меры для предотвращения гиповолемии.
Образование антител.
Применение препарата Соликва может приводить к образованию антител к инсулину гларгина и / или ликсисенатиду. В редких случаях наличие таких антител может вызывать необходимость в коррекции дозы препарата Соликва с целью устранения склонности к развитию гипер- или гипогликемии.
Во избежание ошибок в применении лекарственного средства.
Пациенты должны быть проинструктированы о необходимости обязательной проверки маркировки шприц-ручки перед каждой инъекцией во избежание случайной путаницы между двумя различными дозировками препарата Соликва и путаницы с другими инъекционными гипогликемическими лекарственными средствами.
Во избежание ошибок в дозировке и потенциального передозировки ни пациенты, ни медицинские работники никогда не должны использовать шприц для забора лекарственного средства из картриджа шприц-ручки.
Ситуации, в которых применение лекарственного средства не исследовался.
Применение препарата Соликва не исследовался в комбинации с ингибиторами дипептидилпептидазы-4 (ДПП-4), препаратами сульфонилмочевины. глиниды и пиоглитазоном.
Вспомогательные вещества.
Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на одну дозу, то есть можно считать, что он практически не содержит натрия.
Это лекарственное средство содержит метакрезол, который может вызвать аллергические реакции.
Применение в период беременности или кормления грудью
Препарат Соликва не рекомендуется применять женщинам репродуктйвногр.вику, которые не используют средства контрацепции.
Беременность. Не существует клинического опыта применения препарата Соликва беременными женщинами. Не существует клинических данных, полученных в ходе контролируемых клинических исследованиях, по применению препарата Соликва. инсулина гларгина или ликсисенатиду в период беременности. Большой объем данных по применению инсулина гларгина беременными женщинами (более 1000 случаев беременности) указывает на то, что инсулин гларгин не имеет специфических нежелательных воздействий на течение беременности, а также не вызывает ни пороков развития у плодаТновонароджсного. ни токсического воздействия на него. Исследования на лабораторных животных не выявили признаков влияния инсулина гларгина на репродуктивную систему.
Не существует надлежащих данных по применению ликсисенатиду у беременных женщин. Результаты исследований на животных свидетельствуют о наличии токсического воздействия ликсисенатиду на репродуктивную систему (см. Раздел «Фармакологические свойства. Доклинические данные по безопасности»).
Препарат Соликва не должен применяться во время беременности. Если пациентка планирует беременность или беременность уже наступила, препарат Соликва следует прекратить.
Кормления грудью. Неизвестно, инсулин гларгин или ликсисенатид выводится в грудное молоко у человека. Препарат Соликва не должен применяться во время кормления грудью.
Репродуктивная функция. Исследования на лабораторных животных не выявили непосредственного вредного влияния ликсисенатиду или инсулина гларгина на репродуктивную функцию.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Препарат Соликва не свойственен или присущ незначительное влияние на способность управлять транспортными средствами или другими механизмами. Способность пациента к концентрации внимания и скорость его реакции могут нарушаться вследствие возникновения гипогликемии или гипергликемии или, например, вследствие зрительных расстройств. Это может быть опасным в ситуациях, когда эти качества особенно важны (например, во время управления транспортным средством или работы с механизмами).
Пациентам необходимо посоветовать принимать необходимые меры предосторожности во избежание гипогликемии во время управления транспортным средством или работе с механизмами. Это особенно важно для тех пациентов, у которых первые признаки развития гипогликемии слабо выраженными или вообще отсутствуют, а также для тех больных, у которых часто возникает гипогликемия. Необходимо тщательно взвешивать, стоит ли садиться за руль или работать с другими механизмами в таком состоянии.
Способ применения Соликва и дозы
Препарат Соликва доступен в двух типах шприц-ручек с различными опциями дозирования, а именно шприц-ручка Соликва (10-40) и шприц-ручка Соликва (30-60) соответственно. Отличие между дозировками шприц-ручек связана с их диапазонами дозирования.
• Соликва 100 Ед. / Мл + 50 мкг / мл в предварительно заполненной шприц-ручке - диапазон дозирования составляет 10-40 единиц инсулина гларгина в комбинации с 5-20 мкг ликсисенатиду (шприц-ручка Соликва (10-40))
• Соликва 100 Ед. / Мл + 33 мкг / мл в предварительно заполненной шприц-ручке - диапазон дозирования составляет 30-60 единиц инсулина гларгина в комбинации с 10-20 мкг ликсисенатиду (шприц-ручка Соликва (30-60))
Во избежание ошибок в применении врач, его назначает, должен убедиться, что в рецепте указано правильную дозировку и диапазон делений дозирования шприц-ручки.
Дозировки.
Дозировка должна подбираться индивидуально с учетом индивидуального ответа больного, а его титрования осуществляется в соответствии с потребностью пациента в инсулине. Дозировка ликсисенатиду повышается или снижается вместе с дозировкой инсулина гларгина и также зависит от того, какая шприц-ручка используется.
Начальная доза. Терапию базальным инсулином или агонистом рецепторов глюкагоноподобного пептида-1 (ГПП-1) или пероральных сахароснижающих лекарственным средством, за исключением метформина и ингибиторов натрий-глюкозного котранспортеру 2-го типа, перед началом применения препарата Соликва следует прекратить.
Начальная доза Соликва определяется па основании предварительного противодиабетического лечения, при этом рекомендуемая начальная доза ликсисенатиду не должна превышать 10 мкг:
* Единиц инсулина гларгина (100 Ед. / Мл) И микрограмм ликсисенатиду
* * Если применялся другой базальный инсулин:
- При применении базального инсулина два раза в сутки или инсулина гларгина (300 Ед. / Мл) предыдущая общая суточная доза должна быть снижена на 20% при выборе начальной дозы препарата Соликва.
- При применении любого другого базального инсулина должно применяться такое же правило, как для инсулина гларгина (100 Ед. / Мл).
Максимальная суточная доза составляет 60 единиц инсулина гларгина и 20 мкг ликсисенатиду, что соответствует 60 делениям дозирования.
Инъекция препарата Соликва должна осуществляться один раз в сутки в пределах одного часа перед едой. Желательно, чтобы прандиального инъекция выполнялась перед одним и тем же приемом пищи ежедневно, после того, как пациент выберет наиболее удобный для себя прием пищи.
Титрования дозы. Препарат Соликва должен вводиться в соответствии с индивидуальными потребностями пациента в инсулине. Контроль гликемии рекомендуется оптимизировать путем коррекции дозы на основании уровня глюкозы в плазме крови натощак (см. Раздел «Фармакологические»). При переводе на этот препарат и в течение первых недель после этого рекомендуется осуществлять тщательный мониторинг уровня глюкозы.
• Если пациент начинает применять шприц-ручку Соликва (10-40), тогда дозировка может быть Титруемая до 40 делений дозирования.
• Для дозирования> 40 делений дозирования в сутки титрования нужно продолжать с использованием шприц-ручки Соликва (30-60).
• Если пациент начинает применять шприц-ручку Соликва (30-60), тогда дозировка может быть Титруемая до 60 делений дозирования.
• Для общего суточного дозирования> 60 делений дозирования препарат Соликва не должен применяться.
Пациенты, которые корректируют количество или время введения препарата, должны осуществлять это только под контролем с соответствующим мониторингом уровня глюкозы (см. Раздел «Особенности применения»).
Особые категории пациентов.
Пациенты пожилого возраста (> 65 лет).
Препарат Соликва может применяться у пациентов пожилого возраста. Дозировка должна быть подобрано в индивидуальном порядке с учетом результатов мониторинга уровня глюкозы. У пациентов пожилого возраста прогрессирующее ухудшение функции почек может стать причиной постоянного уменьшения потребности в инсулине. Коррекция дозы ликсисенатиду в зависимости от возраста не требуется. Опыт терапевтического применения препарата Соликва у пациентов в возрасте> 75 лет ограничен.
Пациенты с нарушением функции почек.
Препарат Соликва не рекомендуется применять у пациентов с тяжелым нарушением функции почек и при терминальной стадии болезни почек, поскольку опыт терапевтического применения ликсисенатиду в таких случаях недостаточно.
У пациентов с легким или умеренным нарушением функции почек коррекция дозы ликсисенатиду не требуется.
У пациентов с нарушением функции почек потребность в инсулине может быть уменьшена в связи со снижением метаболизма инсулина.
У пациентов с легким или умеренным нарушением функции почек, применяют препарат Соликва, может возникать необходимость в частом мониторинга уровня глюкозы и в соответствующей коррекции дозы.
Пациенты с нарушением функции печени.
У пациентов с нарушением функции печени коррекция дозы ликсисенатиду не требуется (см. Раздел «Фармакокинетика»), у пациентов с нарушением функции печени потребность в инсулине может быть уменьшена в связи со снижением способности к глюконеогенеза и снижением метаболизма инсулина. У пациентов с нарушением функции печени может возникать необходимость в частом мониторинга уровня глюкозы и в соответствующей коррекции дозы препарата Соликва.
Дети и подростки.
Препарат Соликва не предусмотрен для применения у детей.
Способ введения. Препарат Соликва следует вводить путем подкожной инъекции в области живота, дельтовидной мышцы или бедра.
Места для инъекций должны варьироваться в пределах одной анатомической области (живота, дельтовидной мышцы или бедра) от одной инъекции к другой с целью уменьшения риска возникновения липодистрофии и / или кожного амилоидоза (см. Раздел «Побочные реакции»).
Пациенты должны быть проинструктированы о постоянной необходимости использования новой иглы. Повторное использование иглы инсулиновой шприц-ручки увеличивает риск ее блокировки, что может приводить к введению недостаточной или чрезмерной дозы препарата. Препарат Соликва не допускается отбирать из картриджа предварительно наполненной шприц- ручки в шприц, поскольку это может привести к тяжелой передозировки (см. Раздел «Особенности предосторожности при использовании препарата»).
Особенности предосторожности при использовании препарата.
Перед первым применением шприц-ручку нужно вытащить из холодильника и подержать при температуре не выше 25 ° С в течение 1-2 часов.
Перед использованием проверяют картридж шприц-ручки. Его можно использовать только тогда, когда в нем содержится прозрачный бесцветный раствор, который по консистенции напоминает воду, без видимых твердых частиц.
Препарат Соликва нельзя смешивать с любым другим инсулином или разводить. При смешивании или разведении может измениться профиль действия препарата во времени; кроме этого, смешивания с другими препаратами может привести к образованию осадка.
Перед каждой инъекцией всегда необходимо подключать новую иглу. Повторно использовать иглы нельзя. Пациент должен утилизировать иглу после каждой инъекции.
В случае блокировки иглы пациентам необходимо придерживаться инструкций, описанных в шага 3 Инструкции по использованию (см. Ниже).
Пустые шприц-ручки в коем случае нельзя использовать повторно, они должны быть надлежащим образом утилизированы.
Если Вам кажется, что шприц-ручка повреждена, не используйте ее. Возьмите новую. Не пытайтесь самостоятельно починить шприц-ручку.
Для предотвращения возможной передачи заболеваний каждый шприц-ручка должна использоваться только одним пациентом.
Перед каждой инфекцией нужно всегда проверять этикетку, чтобы избежать путаницы между препаратом Соликва и другими инъекционными гипогликемическими лекарственными средствами, включая два различных типа шприц-ручек с препаратом Соликва (см. Раздел «Особенности применения»).
Перед применением препарата Соликва следует внимательно прочитать раздел «Инструкция по использованию шприц-ручки Соликва».
Важная информация по использованию шприц-ручки Соликва.
• Шприц-ручка предназначена лично Вам и не следует передавать его другим лицам.
• Нельзя использовать шприц-ручку в случае ее повреждения или при наличии сомнений в правильности ее функционирования.
• Всегда следует проводить тест на безопасность.
• Всегда необходимо иметь запасную шприц-ручку и запасные иглы на случай потери или повреждения основного набора.
Что нужно знать для проведения инъекции.
• Перед использованием шприц-ручки следует спросить своего врача или медсестру, как делается инъекция.
• Если у Вас есть какие-либо сложности с использованием шприц-ручки. например, из-за проблем со стороны зрения, обратитесь за помощью.
• Перед использованием шприц-ручки следует перечитать эту Инструкцию. В случае несоблюдения этих установок Вы можете получить слишком высокую или низкую дозу препарата.
Принадлежности, которые потребуются при введении этого препарата:
• новая стерильная игла (смотрите ШАГ 2)
• смоченный спиртом тампон;
• устойчивый для прокалывания контейнер для использованных игл и шприц-ручек.
Перед первым использованием шприц-ручки хранить в холодильнике при температуре + 2 ° С - 8 ° С в защищенном от света месте. Не замораживать.
После первого использования шприц-ручку следует хранить не более 28 дней при комнатной температуре ниже 25 ° С в защищенном от света месте.
Не ставьте Вашу шприц-ручку обратно в холодильник.
После каждой инъекции в шприц-ручку следует снова одевать колпачок для защиты от света. Нельзя хранить шприц-ручку с прикрепленной к ней иглой.
Эксплуатация.
Со шприц-ручкой следует обращаться с осторожностью. Если Вам кажется, что шприц-ручку повреждено, не пытайтесь ее починить, возьмите новую.
Защитить шприц-ручку от пыли и грязи: внешнюю поверхность шприц-ручки можно очищать, протирая ее влажной тканью (смоченной только водой). Погружать в жидкость, Не промывайте и не смазывайте шприц-ручку - это может ее повредить.
Утилизация шприц-ручки: перед утилизацией шприц-ручки снимите с нее иглу. Выбрасывайте шприц-ручку так, как рекомендовано местными регуляторными органами.
Дети
Безопасность и эффективность препарата Соликва для лечения детей в возрасте до 18 лет не установлены. Данные по этому поводу отсутствуют.
Передозировка
В случае введения большей дозы Соликва, чем требовалось, могут возникнуть нежелательные реакции в виде гипогликемии и расстройств со стороны желудочно-кишечного тракта. Эпизоды гипогликемии легкой степени, как правило, могут быть устранены пероральным приемом углеводов. Может возникнуть необходимость в коррекции дозы лекарственного средства и внесения изменений в режим питания или физической активности.
Более тяжелые эпизоды гипогликемии, сопровождающиеся комой, судорогами или неврологическими нарушениями, требуют внутримышечного / подкожного введения глюкагона или введения концентрированного раствора глюкозы. Поскольку гипогликемия может возникнуть повторно даже после очевидного улучшения клинического состояния пациента, необходимыми мерами могут быть длительный прием углеводов и наблюдение за пациентом.
В случае нежелательных реакций со стороны желудочно-кишечного тракта должна быть начата соответствующая поддерживающая терапия в соответствии с клинических признаков и симптомов, отмечаются у пациента.
Побочные эффекты
Побочными реакциями, о которых чаще всего сообщалось во время лечения Соликва, были гипогликемия и расстройства со стороны желудочно-кишечного тракта (см. Ниже раздел «Описание отдельных нежелательных реакций»).
Побочные реакции, связанные с применением препарата, наблюдались во время клинических исследований, приводятся ниже по категориям «Система-Орган-класс» в порядке уменьшения частоты возникновения (очень часто> 1/10: часто от> 1/100 до <1/10 нечасто от> 1/1000 до <1/100, редко от> 1/10 000 до <1/1000, очень редко <1/10 000, частота неизвестна: невозможно оценить по имеющимся данным) .
категории «Система-Орган- Клас» MedDRA | очень часто | Часто | Нечасто | частота неизвестна |
|---|---|---|---|---|
Инфекционные и паразитарные заболевания | Назофарингит Инфекция верхних дыхательных путей | |||
Со стороны иммунной системы | крапивница | |||
Метаболические и алиментарные расстройства | гипогликемия | |||
Со стороны нервной системы | головокружение | Головная боль | ||
Со стороны желудочно-кишечного тракта | тошнота диарея Рвота | диспепсия Боль в животе | ||
Со стороны кожи и подкожных тканей | Кожный амилоидоз Липодистрофия | |||
Общие нарушения и реакции в месте введения препарата | Повышенная утомляемость Реакции в месте инъекции |
Описание отдельных побочных реакций.
Гипогликемия. В следующей таблице приведены данные о частоте документированной симптоматической гипогликемии (<3.9 ммоль / л) и тяжелой гипогликемии при применении препарата Соликва и препарата сравнения.
Побочные реакции в виде документированной симптоматической гипогликемии или тяжелой гипогликемии
Пациенты, которые ранее не получали инсулин | Переход от базального инсулина | Переход от агониста рецепторов ГПП- 1 | |||||
|---|---|---|---|---|---|---|---|
| препарат Соликва | инсулин гларгин | Ликсисе -натид | препарат Соликва | инсулин гларгин | препарат Соликва | Агонист рецепторов ГПП-1 | |
| N | 469 | 467 | 233 | 365 | 365 | 255 | 256 |
Задокументирована симптоматич -на гипогликемия * | |||||||
Пациенты, у которых возникла побочная реакция, n | 120 (25,6%) | 110 (23,6%) | 15 (6,4%) | 146 (40,0%) | 155 (42,5%) | 71 (27,8%) | 6 (2,3%) |
| (%) | |||||||
Количество побочных реакций па ииациенго- год, n | 1,44 | 1,22 | 0,34 | 3,03 | 4,22 | 1,54 | 0,08 |
тяжелая гипогликемия * * | |||||||
Количество побочных реакций на пациенто- год, n | 0 | <0,01 | 0 | 0,02 | <0,01 | <0,01 | 0 |
* Задокументированная симптоматическая гипогликемия определялась как событие, во время которой типичные симптомы гипогликемии сопровождались определенной концентрацией глюкозы в плазме крови <3,9 ммоль / л.
** Тяжелая симптоматическая гипогликемия определялась как явление, требовало помощи другого лица для активного введения углеводов, глюкагона или проведения других реанимационных мероприятий.
Со стороны желудочно-кишечного тракта. Со стороны желудочно-кишечного тракта (тошнота, рвота и диарея) были побочными реакциями, о которых часто сообщалось в течение периода лечения. У пациентов, получавших лечение препаратом Соликва, частота связанной тошноты, диареи и рвоты составляла 8,4%, 2,2% и 2,2% соответственно. Побочные реакции в виде расстройств со стороны желудочно-кишечного тракта преимущественно были легкой степени и имели преходящий характер.
Со стороны иммунной системы. Аллергические реакции (крапивница), возможно связанные с применением препарата Соликва, было сообщено в 0,3% пациентов. О случаях генерализованных аллергических реакций, включая анафилактические реакции и ангионевротический отек, сообщалось при пострегистрационный применении инсулина гларгина и ликсисенатиду.
Иммуногенность. Применение препарата Соликва может приводить к образованию антител к инсулину гларгина и / или ликсисенатиду.
частота случаев образование антител к инсулину гларгина составила 21,0% и 26,2%. Примерно у 93% пациентов отмечалась перекрестная реактивность антител к инсулину гларгина относительно человеческого инсулина. Частота образования антител к ликсисенатиду составляла примерно 43%. Ни статус антител к инсулину гларгина, ни статус антител к ликсисенатиду не имели клинически значимого влияния на безопасность или эффективность препарата.
Со стороны кожи и подкожных тканей. Липодистрофия и кожный амилоидоз могут возникать в месте инъекции инсулина и приводить к задержке абсорбции инсулина из него. Постоянное изменение места инъекции в пределах одного участка тела может помочь уменьшить или предотвратить эти реакции.
Реакции в месте др инъекции. У некоторых пациентов (1,7%), получавших терапию, которая включала введение инсулина, в том числе препарата Соликва, отмечались покраснение, местное набухание и зуд в месте инъекции.
Частота сердечных сокращений. При применении агонистов рецепторов GLP-1 сообщалось об увеличении частоты сердечных сокращений транзиторное увеличение частоты сердечных сокращений наблюдалось также и в рамках некоторых исследований применения ликсисенатиду. По результатам всех исследований препарата Соликва не приводил к увеличению средней частоты сердечных сокращений.
Сообщение о подозреваемых побочные реакции.
Сообщение о подозреваемых побочные реакции после утверждения лекарственного средства является важной процедурой. Это позволяет продолжать мониторинг соотношения «польза / риск» для данного лекарственного средства. Медицинских работников просят сообщать обо всех подозреваемых побочные реакции в Государственный экспертный центр МЗ Украины.
Срок годности Соликва
24 месяца
Срок годности после первого использования шприц-ручки : 28 дней.
Хранить при температуре ниже 25 ° С. Не замораживать. Не охлаждайте. Не хранить с прикрепленной иглой. Хранить шприц-ручку в месте, защищенном от источников прямого тепла и света. После каждой инъекции в шприц-ручку следует снова надевать колпачок для защиты от света.
Условия хранения Соликва
Хранить в недоступном для детей месте.
Шприц-ручки. не состоящим в использовании:
Хранить в холодильнике (при температуре + 2 ° С - 8 ° С).
Не замораживать и не допускать контакта с морозильным отделением или накопителями холода.
Хранить шприц-ручку во внешней картонной упаковке для защиты от света.
Шприц-ручки, после первого использования:
Условия хранения смотрите в разделе «Срок годности».
несовместимость
Это лекарственное средство нельзя смешивать с любым другим инсулином или разводить.
Упаковка
№ 3 или №5: по 3 мл в картриджи, встроенном в одноразовую шприц-ручку; по 3 или по 5 шприц-ручек в картонной коробке. Иглы в упаковку не включенные.
Категория отпуска
По рецепту.
Производитель
Санофи-Авентис Дойчланд ГмбХ.
Местонахождение производителя
Iндустрiпарк Хьохст-Брюнiнrштрассе 50, HS00, Н590, НбОО, Н785, Н790. Франкфурт-на-Майнi, Гессен, 65926, Нiмеччина.
Заявитель.
ООО «Санофi-Авентiс Украина», Украина.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Соликва только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Санофи-Авентис Дойчланд ГмбХ
| Тип данных | Сведения из реестра |
| Торговое наименование: | Соликва |
| Производитель: | Санофи-Авентис Дойчланд ГмбХ |
| Форма выпуска: | раствор для инъекций, 100 Ед. / мл + 33 мкг / мл, № 3 или № 5: 3 мл в картридже, встроенном в одноразовую шприц-ручку; по 3 или по 5 шприц-ручек в картонной коробке. Иглы в упаковку не включены. |
| Регистрационное удостоверение: | UA/16775/01/01 |
| Дата начала: | 21.06.2018 |
| Дата окончания: | 21.06.2023 |
| МНН: | Insulin glargine and lixisenatide |
| Условия отпуска: | по рецепту |
| Состав: | 1 мл раствора содержит 100 единиц инсулина гларгина и 33 мкг ликсисенатиду; / 1 шприц-ручка содержит 3 мл раствора для инъекций, что эквивалентно 300 Ед. инсулина гларгина и 100 мкг ликсисенатиду; / 1 деление дозирования соответствует 1 Ед. инсулина гларгина и 0,33 мкг ликсисенатиду |
| Фармакологическая группа: | Лекарственные средства, застовсовуються при сахарном диабете, инсулины и их аналоги длительного действия для инъекционных введения. |
| Код АТХ: | A10AE54 |
| Заявитель: | ООО «Санофи-Авентис Украина» |
| Страна заявителя: | Украина |
| Адрес заявителя: | Украина, 01033, г.. Киев, ул. Жилянская, 48-50 |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Комбинированный |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| A | Средства, влияющие на пищеварительную систему и метаболизм |
| A10 | Противодиабетические препараты |
| A10A | Инсулин и его аналоги |
| A10AE | Инсулины и аналоги для инъекций, длительного действия |
| A10AE54 | Инсулин гларгин и ликсисенатид |
