- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Скайризи инструкция по применению
Официальная инструкция лекарственного препарата Скайризи раствор 75 мг. Описание и применение Skajrizi, аналоги и отзывы. Инструкция Скайризи раствор утвержденная компанией производителем.
Состав
действующее вещество: рисанкизумаб;
1 предварительно наполненный шприц, содержащий 75 мг рисанкизумаба в 0,83 мл;
Вспомогательные вещества: сорбитол, натрия сукцината гексагидрат, янтарная кислота, полисорбат 20, вода для инъекций.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: бесцветный или слегка желтоватый раствор от прозрачного до слегка опалесцирующий.
Фармакологическая группа
Иммунодепрессанты. Ингибиторы интерлейкина. Рисанкизумаб.
Код АТХ L04A C18.
Фармакологические свойства
Фармакологические.
Рисанкизумаб - это гуманизированное моноклональное антитело, иммуноглобулин G1 (IgG1), с селективным действием в отношении белка интерлейкина 23 (IL-23), произведенное из клеток яичника китайского хомячка с использованием технологии рекомбинантной ДНК.
механизм действия
Рисанкизумаб - это гуманизированное моноклональное антитело, иммуноглобулин G1 (IgG1), которое с высоким сродством связывается с субъединицей Р19 цитокина интерлейкина 23 (IL-23) человека без связывания с IL-12 и ингибирует его взаимодействие с рецепторным комплексом IL-23 . IL-23 - это цитокин, участвующий в воспалительных и иммунных ответах. Блокируя IL-23 от связывания с его рецептором, рисанкизумаб ингибирует IL-23-зависимую клеточную сигнализацию и высвобождение провоспалительных цитокинов.
фармакодинамические эффекты
В исследовании с участием пациентов с псориазом экспрессия генов, связанных с осью IL-23 / IL-17 снижалась в коже после одноразовых доз рисанкизумабу. Также при псориатических поражениях наблюдали снижение толщины эпидермиса, инфильтрации воспалительных клеток и экспрессии маркеров псориатического заболевания.
Клиническая эффективность и безопасность
Эффективность и безопасность рисанкизумабу оценивали по данным 2109 пациентов с умеренным или тяжелым бляшечная псориазом при четырех многоцентровых рандомизированных двойных слепых исследований (ULTIMMA-1, ULTIMMA-2, IMMHANCE и IMMVENT). Включены в эти исследования пациенты были старше 18 лет, имели бляшечная псориаз на ≥10% площади поверхности тела (ППТ), статическую Глобальную оценку врачом (sPGA) ≥ 3 баллов при общей оценке псориаза (толщина бляшек / индурация, эритема и шелушение) по шкале тяжести от 0 до 4, оценку по Индексу площади псориаза и тяжести состояния (PASI) ≥ 12 баллов и были кандидатами на системную терапию или фототерапия.
Всего на момент оценки исходного состояния пациентов медиана оценки PASI составила 17,8 балла, медиана пораженной ППТ - 20,0%, а медиана DLQI - 13,0. При оценке исходного состояния по sPGA состояние классифицированы как тяжелое в 19,3% пациентов и как умеренный в 80,7% пациентов. В целом 9,8% субъектов исследования в анамнезе диагностирован псориатический артрит.
По данным всех исследований 30,9% пациентов не получали ранее системной терапии (в т.ч. небиологическими и биологическими лекарственными средствами), 38,1% получали предварительную фототерапию или Фотохимиотерапия, 48,3% получали ранее системную терапию небиологическими лекарственными средствами, 42 , 1% получали предшествующую терапию биологическими лекарственными средствами, а 23,7% уже проходили лечение по меньшей мере одним ингибитором ФНО-альфа для лечения псориаза.
Фармакокинетика.
абсорбция
Рисанкизумаб демонстрировал линейную фармакокинетику с дозозависимым увеличением экспозиции в пределах доз от 18 до 300 мг и от 0,25 до 1 мг / кг при подкожном введении, а также от 200 до 1200 мг и от 0,01 до 5 мг / кг при внутривенном введении .
После подкожного применения рисанкизумабу пиковые концентрации в плазме были достигнуты через 3-14 дней после введения дозы, при этом расчетная биодоступность составляла 89%. При применении рисанкизумабу в дозе 150 мг на неделе 0, недели 4, а затем каждые 12 недель расчетные концентрации рисанкизумабу в плазме при достижении равновесного состояния и остаточные концентрации рисанкизумабу в плазме составляли 12 и 2 мкг / мл соответственно.
распределение
Средний (± стандартное отклонение) объем распределения (Vss) рисанкизумабу при достижении равновесного состояния составлял 11,4 (± 2,7) л в исследованиях фазы 3 с участием пациентов с псориазом, что свидетельствует о том, что распределение рисанкизумабу основном ограничивается сосудистыми и интерстициальными пространствами.
Метаболизм
Терапевтические моноклональные антитела IgG обычно разлагаются на малые пептиды и аминокислоты катаболическими путями так же, как и эндогенные IgG. Не ожидается, что рисанкизумаб метаболизуватиметься ферментами цитохрома Р450.
вывод
Средний (± стандартное отклонение) системный клиренс (CL) рисанкизумабу составил 0,3 (± 0,1) л / сутки в исследованиях фазы 3 с участием пациентов с псориазом. Период полувыведения рисанкизумабу варьировал от 28 до 29 дней в исследованиях фазы 3 с участием пациентов с псориазом.
Не ожидается, что рисанкизумаб как моноклональное антитело IgG1 фильтроваться путем клубочковой фильтрации в почках или выводиться в виде неизмененной молекулы с мочой.
Линейность / нелинейность
Рисанкизумаб демонстрировал линейную фармакокинетику с примерно дозопропорцийним увеличением системной экспозиции (Cmax и AUC) в оцениваемых диапазонах доз от 18 до 300 мг или от 0,25 до 1 мг / кг при подкожном введении здоровым добровольцам или пациентам с псориазом.
Взаимодействия с лекарственными средствами
Исследование взаимодействия с лекарственными средствами проводили с участием пациентов с бляшечная псориазом с целью оценки влияния повторного введения рисанкизумабу на фармакокинетику субстратов, чувствительных к цитохрома Р450 (CYP). Влияние кофеина (субстрат CYP1A2), варфарина (субстрат CYP2C9), омепразола (субстрат CYP2C19), метопролола (субстрат CYP2D6) и мидазолама (субстрат CYP3A) после лечения рисанкизумабом был сопоставим с их экспозицией к лечению рисанкизумабом, что указывает на отсутствие клинически значимого лекарственного взаимодействия через эти ферменты.
Популяционные фармакокинетические анализы показали, что на экспозицию рисанкизумабу не влияли сопутствующие лекарственные средства (метформин, аторвастатин, лизиноприл, амлодипин, ибупрофен, ацетилсалицилат и левотироксин), которые применяли некоторые пациенты с бляшечная псориазом во время клинических исследований.
Особые популяции пациентов
дети
Фармакокинетика рисанкизумабу у детей не установлена.
Пациенты пожилого возраста
С 2234 субъектов с бляшечная псориазом, получавших лечение рисанкизумабом, 243 имели возраст от 65 лет, а 24 - возраст от 75 лет. Общих различий в экспозиции рисанкизумабу у пациентов старшего и младшего возраста, получавших рисанкизумаб, а не отмечали.
Пациенты с почечной или печеночной недостаточностью
Не было проведено никаких специальных исследований для определения влияния почечной или печеночной недостаточности на фармакокинетику рисанкизумабу. По данным популяционных фармакокинетических анализов, уровень креатинина в сыворотке, клиренс креатинина или маркеры функции печени (АЛТ / АСТ / билирубин) не влияли на клиренс рисанкизумабу у пациентов с псориазом.
Как моноклональное антитело IgG1 рисанкизумаб преимущественно выводится внутриклеточным катаболизмом, а потому не ожидается метаболизма через печеночные ферменты цитохрома Р450 или элиминации почками.
масса тела
Клиренс рисанкизумабу и объем распределения повышаются с увеличением массы тела, что может привести к снижению эффективности у пациентов с большой массой тела (> 130 кг). Однако это наблюдение базируется на данных по ограниченному числу пациентов. В настоящее время не рекомендуется корректировать дозу учитывая массу тела.
Стать або раса
У пациентов с бляшечная псориазом пол или раса существенно не влияли на клиренс рисанкизумабу. В клиническом фармакокинетические исследования не выявлено клинически значимых различий в экспозиции рисанкизумабу у китайцев или японцев по сравнению с представителями европеоидной расы.
Доклинические данные по безопасности
На доклиническом этапе не выявлено особой опасности для человека по данным исследований токсичности при повторном применении рисанкизумабу, в частности при изучении фармакологии безопасности, а также репродуктивной токсичности в яванских макак, в дозах до 50 мг / кг в неделю (что обеспечивает экспозицию, которая в 70 раз превышает экспозицию у человека при максимальной рекомендуемой дозе для человека [МРДЛ]).
Исследования мутагенности и канцерогенности рисанкизумабу не проводили. В 26-недельном исследовании токсикологичности при длительном применении рисанкизумабу в дозах до 50 мг / кг / неделю (примерно в 70 раз больше экспозиции у человека при МРДЛ) не наблюдалось ни одного предракового или неопластического поражения, неблагоприятных проявлений иммунотоксичности или влияния на сердечно-сосудистую систему.
Клинические характеристики
Скайризи Показания
Лечение умеренной или тяжелой бляшечного псориаза у взрослых, которым показана системная терапия.
Противопоказания
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ.
Клинически значимые инфекции в активной форме (например активная форма туберкулеза).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Не ожидается, что рисанкизумаб метаболизуватиметься печеночными ферментами или выводиться почками. Не ожидается взаимодействия рисанкизумабу с ингибиторами, индукторами или субстратами ферментов, которые метаболизируются лекарственные средства, а потому корректировки дозы не требуется.
Сопутствующая иммуносупрессивная терапия или фототерапия
Безопасность и эффективность рисанкизумабу при его применении с иммунодепрессантами, в частности биологическими лекарственными средствами или фототерапия, ни оценивались.
Особенности применения
прослеживаемость
Для улучшения видстежуваности биологических лекарственных средств следует четко документировать название и номер серии введенного препарата.
инфекции
Рисанкизумаб может повысить риск инфекции.
Рисанкизумаб следует с осторожностью применять пациентам с хронической инфекцией, рецидивирующей инфекцией в анамнезе или известными факторами риска инфекции. Лечение рисанкизумабом не следует начинать у пациентов с любой клинически важной инфекцией в активной форме, пока она не прошла либо не была адекватно пролеченная.
Пациентов, получающих рисанкизумаб, следует проинструктировать о необходимости обращения к врачу в случае появления симптомов клинически важной хронической или острой инфекции. В случае развития такой инфекции или при отсутствии ответа на стандартное лечение инфекции состояние пациента необходимо тщательно контролировать, при этом рисанкизумаб не назначают, пока инфекция не прошла.
туберкулез
Перед началом лечения рисанкизумабом состояние пациентов следует оценить на наличие инфекции туберкулеза. Состояние пациентов, получающих рисанкизумаб, следует контролировать по появлению симптомов активной формы туберкулеза. До начала лечения рисанкизумабом следует рассмотреть необходимость применения противотуберкулезной терапии пациентам с латентной или активной формой туберкулеза в анамнезе, в отношении которых прохождения адекватного курса лечения не подтверждено.
иммунизация
До начала терапии рисанкизумабом необходимо завершить все соответствующие иммунизации согласно текущим рекомендациям по проведению иммунизации. Если пациент получил вакцинацию живой вакциной (вирусной или бактериальной), рекомендуется подождать не менее 4 недели до начала лечения рисанкизумабом. Пациентам, проходивших лечение рисанкизумабом, не следует применять живые вакцины во время лечения, а также в течение по меньшей мере 21 недели после лечения рисанкизумабом (см. Раздел «Фармакокинетика»).
повышенная чувствительность
В случае развития серьезной реакции повышенной чувствительности рисанкизумаб немедленно отменяют и начинают соответствующую терапию.
Вспомогательные вещества с известным эффектом
Это лекарственное средство содержит 68,0 мг сорбита на дозу 150 мг.
Необходимо учитывать аддитивный эффект одновременно применяемых лекарственных средств, содержащих сорбит (или фруктозу), и поступления сорбита (или фруктозы) в организм пациента вместе с пищей.
Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) в дозе 150 мг, то есть по сути является лекарственным средством, которое не содержит натрия.
Применение в период беременности или кормления грудью
Женщины репродуктивного возраста
Женщинам репродуктивного возраста следует применять эффективный способ контрацепции во время лечения, а также в течение по меньшей мере 21 недели после лечения.
беременность
Данных по применению рисанкизумабу беременным женщинам нет или эти данные ограничены (менее 300 результатов беременности). Исследования на животных не показали прямого или косвенного вредного воздействия с точки зрения репродуктивной токсичности. В качестве меры пресечения желательно избегать применения рисанкизумабу во время беременности.
кормление грудью
Неизвестно, попадает рисанкизумаб в грудное молоко. Известно, что человеческие IgG попадают в грудное молоко в течение первых нескольких дней после рождения ребенка и вскоре постепенно уменьшаются до низких концентраций. Итак, в этот короткий период нельзя исключить риск для младенца, находящегося на грудном вскармливании. Необходимо принять решение относительно отмены / отказа от терапии рисанкизумабом, учитывая пользу от грудного вскармливания для ребенка и пользу терапии рисанкизумабом для матери.
фертильность
Влияние рисанкизумабу на фертильность человека не оценивался. Исследования на животных не показали прямых или опосредованных вредных последствий с точки зрения фертильности.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Рисанкизумаб не влияет или оказывает незначительное влияние на способность управлять транспортными средствами или работать с другими автоматизированными системами.
Способ применения Скайризи и дозы
Лекарственное средство Скайризи следует применять под руководством и наблюдением врача с опытом диагностики и лечения бляшечного псориаза.
дозы
Рекомендуемая доза составляет 150 мг (две инъекции по 75 мг), вводимых путем подкожной инъекции в неделю 0, неделю 4, а затем каждые 12 недель.
Для пациентов, не отвечающих на лечение после 16 недель терапии, следует рассмотреть целесообразность отмены этого лекарственного средства. У некоторых пациентов с начальной частичным ответом может впоследствии наблюдаться улучшение при лечении более 16 недель.
пропуск дозы
В случае пропуска дозы этот препарат применяют как можно быстрее. После этого препарат применяют регулярно по обычной схеме.
Особые группы пациентов
Пациенты пожилого возраста (старше 65 лет)
Корректировка дозы не требуется.
Информация о применении этого лекарственного средства пациентами в возрасте ≥ 65 лет ограничено.
Пациенты с почечной или печеночной недостаточностью
Никаких конкретных исследований для оценки влияния печеночной или почечной недостаточности на фармакокинетику лекарственного средства Скайризи проведено не было. В общем не ожидается, что эти состояния будут любой значительное влияние на фармакокинетику моноклональных антител, поэтому коррекция дозы нельзя считать необходимым.
дети
Безопасность и эффективность применения лекарственного средства Скайризи детям и подросткам в возрасте от 6 до 18 лет еще не установлены. Данные отсутствуют.
Данных о соответствующем применения лекарственного средства Скайризи детям до 6 лет по показаниям умеренный или тяжелый бляшечная псориаз нет.
Пациенты с избыточной массой тела
Корректировка дозы не требуется.
способ применения
Лекарственное средство Скайризи вводят путем подкожной инъекции. При применении каждой дозы следует менять анатомическое место инъекций (например, бедра или живот) и избегать участков болезненной кожи, синяка, эритематозной, уплотненной или пораженной псориазом кожи. Введение лекарственного средства Скайризи в верхнюю внешнюю часть руки может проводить только медицинский работник или лицо, ухаживающее пациента.
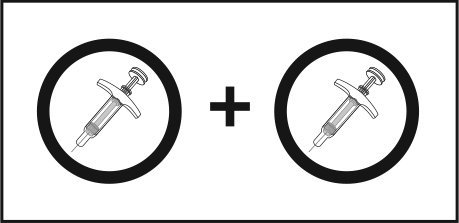
Пациенты могут самостоятельно вводить себе препарат Скайризи после прохождения ими обучения технике подкожной инъекции. Пациентов следует проинструктировать о необходимости инъекционного введения содержания 2-х предварительно наполненных шприцев для получения полной дозы 150 мг, а также о необходимости прочитать Инструкцию по самостоятельного ввода , приведенную ниже, перед проведением инъекций.
Инструкция по самостоятельному введение
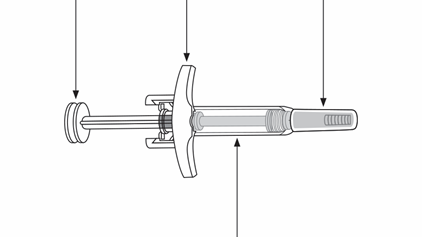
Шток поршня шприца Упор для пальцев Защитный колпачок иглы
Важная информация, которую необходимо знать до введения лекарственного средства Скайризи
- Перед инъекцией Вы должны пройти обучение о том, как правильно делать инъекцию лекарственного средства Скайризи. Поговорите со своим врачом, фармацевтом или медсестрой, если Вам нужна помощь.
- Отметьте даты в своем календаре, чтобы знать, когда нужно ввести лекарственное средство Скайризи.
- Держите лекарственное средство Скайризи в оригинальной картонной коробке для защиты этого лекарственного средства от света до момента его использования.
- Не удаляйте колпачок иглы до момента проведения инъекции.
- Не струшуйте шприц.
Не используйте этот препарат:
- если жидкость мутная или содержит хлопья или крупные частицы. Жидкость должна выглядеть прозрачной или слегка желтоватой и может содержать мелкие белые или прозрачные частицы;
- если просроченный срок годности;
- если жидкость замораживали (даже если она растаяла)
- если шприц упал или поврежден;
- если нарушена целостность ячеистой упаковки шприца.
Обеспечение более комфортной инъекции. Перед проведением инъекции выньте картонную коробку из холодильника и оставьте ее при комнатной температуре на 15-30 минут , избегая при этом прямых солнечных лучей.
- Лекарственное средство Скайризи нельзя нагревать в никакой другой способ (например, в микроволновой печи или в горячей воде).
- Держите шприцы в картонной коробке к проведению инъекции.
Следуйте пошаговой инструкции каждый раз, когда применяете препарат Скайризи.
ШАГ 1 Поместите на чистую ровную поверхность:
Вымойте и высушите руки. Начните с одной шприца для проведения первой инъекции. Для получения полной дозы нужно сделать 2 инъекции одна за другой. | |
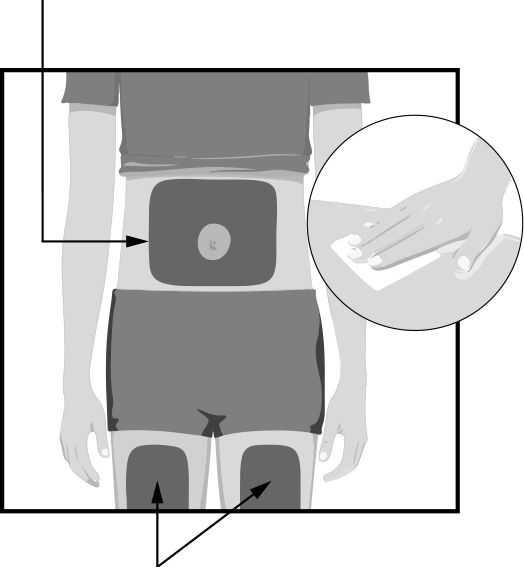
ШАГ 2 Участки для инъекций
Участки для инъекций | Для инъекционного применения лекарственного средства выберите одну из этих 3 участков:
При применении содержания второго шприца инъекцию проводят по крайней мере на расстоянии 3 см от первой инъекции. Не вводите препарат в одно и то же место. Перед каждой инъекцией протрите спиртовой салфеткой круговыми движениями участок, где Вы будете вводить лекарственное средство.
|
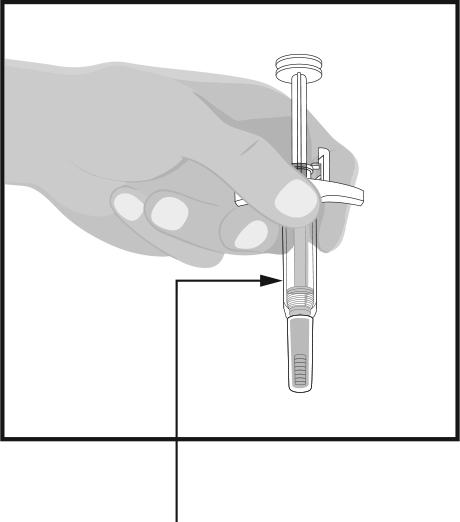
ШАГ 3
проверьте жидкость | Держите шприц вниз иглой, которая закрыта защитным колпачком, как показано на рисунке. Проверьте жидкость в шприце.
|
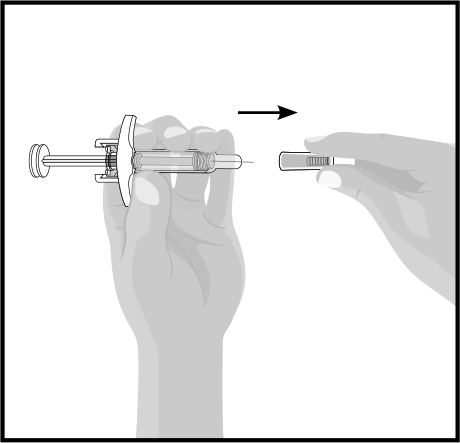
ШАГ 4
| Снятие защитного колпачка иглы:
|
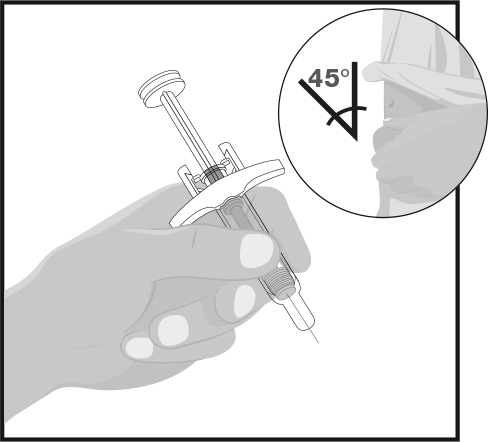
ШАГ 5
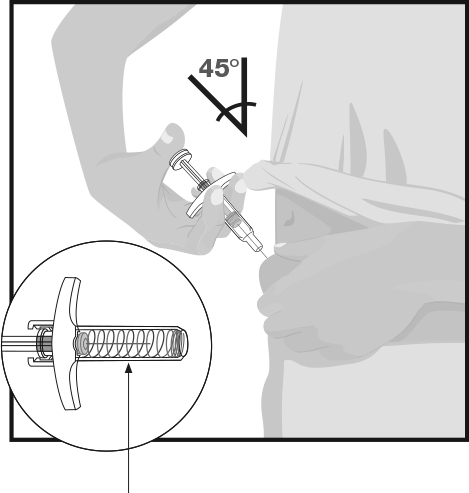
| Держите корпус шприца одной рукой между большим и указательным пальцами так, будто держите карандаш. Другой рукой осторожно возьмите участок очищенной кожи в складку и крепко удерживайте ее. Быстрым коротким движением вставьте иглу в кожу примерно под углом 45 градусов на всю ее длину. Держите шприц под одним углом. |
ШАГ 6
Предохранитель системы защиты иглы | Медленно нажимайте на шток поршня шприца до конца, пока вся жидкость не будет введена. Извлеките иглу из кожи, держа шприц под одним углом. Медленно снимите большой палец с штока поршня. После этого игла закроется предохранителем системы защиты иглы.
Прижмите ватным шариком или марлевым тампоном место инъекции на 10 секунд. Не трите кожу в месте инъекции. В месте инъекции может возникать небольшое кровотечение. Это нормально. |
ШАГ 7
Необходимо сделать 2 инъекции. | Для получения полной дозы необходимо сделать две инъекции, одна за другой.
|
ШАГ 8
| |
Дети
Безопасность и эффективность применения лекарственного средства Скайризи детям и подросткам в возрасте от 6 до 18 лет еще не установлены. Данные отсутствуют.
Данных о соответствующем применения лекарственного средства Скайризи детям до 6 лет по показаниям умеренный или тяжелый бляшечная псориаз нет.
Передозировка
В случае передозировки рекомендуется контролировать состояние пациента относительно возникновения каких-либо симптомов побочных реакций и немедленно назначить соответствующее симптоматическое лечение.
Побочные эффекты
Краткое описание профиля безопасности
Наиболее частыми побочными реакциями были инфекции верхних дыхательных путей, наблюдали у 13% пациентов.
Перечень побочных реакций в форме таблицы
Побочные реакции на рисанкизумаб в клинических исследованиях (таблица) представлены по классам систем органов согласно терминологии MedDRA и по частоте: очень часто (≥ 1/10), часто (≥ 1/100 и <1/10), нечасто (≥ 1 / 1000 и <1/100), редко (≥ 1/10 000 и <1/1 000), очень редко (<1/10 000).
Перечень побочных реакций в клинических исследованиях
Класс систем органов | Частота | побочные реакции |
Инфекции и инвазии | очень часто | Инфекции верхних дыхательных путей a |
Часто | Лишайные инфекции b | |
Нечасто | фолликулит | |
Со стороны нервной системы | Часто | Головная боль c |
Со стороны кожи и подкожной клетчатки | Часто | зуд |
Общие нарушения и осложнения в месте введения | Часто | утомляемость d Реакции в месте введения e |
a Включает: инфекцию дыхательных путей (вирусной, бактериальной или неуточненную), синусит (в частности острый), ринит, назофарингит, фарингит (в т.ч. вирусный), тонзиллит.
b Включает: дерматомикоз стопы, паховый дерматомикоз, дерматофитию туловища, разноцветный лишай, микоз кистей, онихомикоз.
c Включает: головная боль, головная боль напряжения, синусный головную боль.
d Включает: утомляемость, астению.
e Включает: кровоизлияния в месте инъекции, эритема, гематому, кровотечение, раздражение, боль, зуд, реакцию, отек.
Описание отдельных побочных реакций
инфекции
В период реализации всей программы исследования рисанкизумабу при лечении псориаза, в том числе при длительном применении рисанкизумабу, частота инфекций составила 75,5 случаев на 100 пациенто-лет. Большинство случаев были несерьезными, имели легкий или умеренный степень тяжести и не требовали прекращения лечения рисанкизумабом. Частота серьезных инфекций составила 1,7 случая на 100 пациенто-лет.
иммуногенность
Как и в случае применения всех терапевтических белков, существует потенциальная возможность развития иммуногенности при применении рисанкизумабу. Возможность выявления образованных антител в значительной степени зависит от чувствительности и специфичности количественного анализа.
У пациентов, получавших рисанкизумаб в рекомендованной клинической дозе в период до 52-х недель при клинических испытаний с участием пациентов с псориазом, антитела к лекарственному средству и нейтрализующие антитела наблюдали в 24% (263/1079) и в 14% (150 / 1079) оцененных субъектов соответственно.
У большинства пациентов антитела к рисанкизумабу, включая нейтрализующие антитела не были связаны с изменениями клинического ответа или параметров безопасности. В немногих пациентов (примерно 1%; 7/1000 на неделе 16 и 6/598 на неделе 52) с высокими титрами антител (> 128), клинический ответ оказалась пониженной. Частота реакций в месте инъекции была количественно выше у пациентов с антителами к рисанкизумабу по сравнению с пациентами, у которых не обнаружили антител к рисанкизумабу течение непродолжительного (16 недель 2,7% по сравнению с 1,3%) и длительной терапии (> 52 недели: 5,0% по сравнению с 3,3%). Реакции в месте инъекции были легкими и умеренными по степени тяжести. Ни одна из них не была серьезной и не привела к отмене терапии рисанкизумабом.
Пациенты пожилого возраста
Информация о безопасности применения пациентам в возрасте ≥ 65 лет ограничено.
Срок годности Скайризи
2 года.
Не следует применять препарат после окончания срока годности, указанного на упаковке.
Условия хранения Скайризи
Хранить в недоступном для детей и защищенном от света месте при температуре от 2 до 8 ° С (в холодильнике) в оригинальной картонной коробке. Не замораживать.
Несовместимость.
При отсутствии исследований совместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Упаковка
По 2 предварительно наполненные шприцы (в контурной ячейковой упаковке каждый) и 2 салфетки, помещенные в картонную коробку.
Категория отпуска
По рецепту.
Производитель
Еббви С.р.л., Италия.
Местонахождение производителя
С.Р. 148 Понтина Км 52, СНС - Камповерди ди Априлия (лок. Априлия) - 04011 Априлия (ЛТ), Италия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Скайризи только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Берингер Ингельхайм Фарма ГмбХ и Ко. КГ
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Скайризи |
| Производитель: | Берингер Ингельхайм Фарма ГмбХ и Ко. КГ |
| Форма выпуска: | раствор для инъекций по 75 мг по 0,83 мл раствора в предварительно наполненном шприце; по 2 предварительного наполненные шприцы (в контурной ячейковой упаковке каждый) и 2 салфетки помещены в картонную коробку |
| Регистрационное удостоверение: | UA/17970/01/01 |
| Дата начала: | 06.03.2020 |
| Дата окончания: | 03.06.2025 |
| МНН: | Risankizumab |
| Условия отпуска: | по рецепту |
| Состав: | 1 предварительно наполненный шприц, содержащий 75 мг рисанкизумабу в 0,83 мл |
| Фармакологическая группа: | Иммунодепрессанты. Ингибиторы интерлейкина. Рисанкизумаб. |
| Код АТХ: | L04AC18 |
| Заявитель: | ЕббВи Биофармасьютикалз ГмбХ |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Нейхофштрассе 23 6341 Баар, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L04 | Иммунодепрессанты |
| L04A | Иммунодепрессанты |
| L04AC | Ингибиторы интерлейкина |
| L04AC18 | Рисанкизумаб |