- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/17010/01/01 закончился 31.10.2023
Репата инструкция по применению
Официальная инструкция лекарственного препарата Репата раствор 140 мг/мл. Описание и применение Repata, аналоги и отзывы. Инструкция Репата раствор утвержденная компанией производителем.
Состав
действующее вещество: еволокумаб;
Репата, 140 мг, раствор для инъекций в предварительно наполненном шприце-ручке.
1 предварительно наполненный шприц-ручка содержит 140 мг еволокумабу в 1 мл раствора.
Репата - это моноклональное антитело человека IgG2 товары с использованием технологии рекомбинантной ДНК в клетках яичника китайского хомячка (ЯКХ).
Вспомогательные вещества: пролин, уксусная кислота ледяная, полисорбат 80, натрия гидроксид (для регулирования pH), вода для инъекций.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: прозрачная или опалесцирующая жидкость, бесцветная или желтоватого цвета, практически без частиц.
Фармакологическая группа
Липидомодификувальные средства, простые. Другие липидомодификувальни средства.
Код АТХ C10AX13.
Фармакологические свойства
Фармакологические.
механизм действия
Еволокумаб селективно связывается с пропротеинконвертазою 9-го субтилизин-кексинового типа (PCSK9) и ингибирует связывание циркулирующей PCSK9 с рецептором липопротеина низкой плотности (Р-ЛПНП) на поверхности клеток печени, таким образом предотвращая PCSK9-опосредованном распада Р-ЛПНП. Повышение уровня Р-ЛПНП в печени приводит к снижению сывороточной концентрации холестерина липопротеинов низкой плотности (ХС ЛПНП).
Фармакодинамические свойства.
В клинических испытаниях препарат Репата снижал концентрации несвязанной PCSK9, ХС-ЛПНП, общего холестерина (ОХ), аполипопротеина В (АпоВ), холестерина липопротеинов невысокой плотности (ХС-ЛПВП), ХС / ХС-ЛПВП, АпоВ / АпоА1, холестерина липопротеинов очень низкой плотности (ХС ЛПОНП), триглицеридов (ТГ) и липопротеина (а) [Лп (а)] и повышал холестерин липопротеидов высокой плотности (ХС ЛПНП) и АпоА1 у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией.
Однократное подкожное применение лекарственного средства Репата 140 мг или 420 мг приводил к максимальной супрессии циркулирующей несвязанной PCSK9 через 4:00, что сопровождалось снижением ХС-ЛПНП, достигал средней низшего предела в 14 и 21 дня соответственно. Изменения концентрации несвязанной PCSK9 и сывороточных липопротеинов были обратимыми после отмены препарата Репата. Никакого увеличения концентрации несвязанной PCSK9 и ХС ЛПНП по сравнению с исходным уровнем при выводе еволокумабу не наблюдалось, что свидетельствует о том, что компенсаторные механизмы для повышения выработки PCSK9 и ХС ЛПНП во время лечения появляются.
Режимы подкожного применения 140 мг каждые 2 недели и 420 мг один раз в месяц были эквивалентными по среднему снижением ХС ЛПНП (среднее значение на неделях 10 и 12), что приводило к снижению от - 72 до - 57% от исходного уровня по сравнению с плацебо . Лечение с помощью лекарственного средства Репата привело к подобному снижению ХС-ЛПНП при применении в виде монотерапии или в комбинации с другой гиполипидемической терапией.
Клиническая эффективность при первичной гиперхолестеринемии и смешанной дислипидемии
Снижение уровня ХС ЛПНП примерно от 55% до 75% с помощью лекарственного средства Репата достигалось уже на недели 1 и поддерживалось в течение длительной терапии. В общем максимальная ответ достигалась в течение 1-2 недель после введения дозы 140 мг каждые 2 недели и 420 мг 1 раз в месяц. Лекарственное средство Репата был эффективным во всех подгруппах по сравнению с плацебо и эзетимиба, при этом между подгруппами существенных различий, связанных, например, с возрастом, расой, полом, регионом, индексом массы тела, риском по Национальной образовательной программой по холестерину, курением, фактором риска ишемической болезни сердца (ИБС) на начальном этапе, семейным анамнезом ранней ИБС, статусом толерантности к глюкозе (например, сахарный диабет 2 типа, метаболический синдром или ни то, ни другое), артериальной гипертензией, дозой статина и интенсивностью, начальной незв " связанной PCSK9, начальным уровнем ХС ЛПНП и начальным уровнем ТГ, а не постеригалося.
В 80-85% всех пациентов с первичной гиперхолестеринемией, принимавших одну из доз, лекарственное средство Репата демонстрировал снижение на ≥ 50% уровня ХС ЛПНП в среднем на неделях 10 и 12. До 99% пациентов, принимавших одну из доз лекарственного средства Репата, достигали концентрации ХС ЛПНП <2,6 ммоль / л, а в 95% - достигали уровня ХС ЛПНП <1,8 ммоль / л в среднем на неделях 10 и 12.
Комбинация с статинами и статинами с другими гиполипидемическими препаратами
LAPLACE-2 - международное многоцентровое двойное слепое рандомизированное 12-недельное исследование с участием 1896 пациентов с первичной гиперхолестеринемией или смешанной дислипидемией, которых в произвольном порядке были распределены между группами приема лекарственного средства Репата в комбинации со статинами (розувастатин, симвастатин или аторвaстатин). Лекарственное средство Репата сравнивали с плацебо в группах приема розувастатина и симвастатина и плацебо и эзетимиба в группе приема аторвaстатину.
Лекарственное средство Репата существенно снижал уровень ХС ЛПНП от начального уровня до среднего значения на неделях 10 и 12 по сравнению с плацебо в группах приема розувастатина и симвастатина и плацебо и эзетимиба в группе аторвaстатину (p <0,001). Лекарственное средство Репата существенно снижал уровне ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП, АпоВ / АпоА1, ХС-ЛПОНП, уровне ТГ и Лп (а), повышал уровень ХС ЛПВП от начального уровня до среднего значения на неделях 10 и 12 по сравнению с плацебо в группах приема розувастатина и симвастатина (p <0,05) и существенно снижал уровне ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП, АпоВ / АпоА1 и Лп (а) по сравнению с плацебо и эзетимиба в группе аторвaстатину (p <0,001) (см. таблицы 1 и 2).
RUTHERFORD-2 - международное многоцентровое двойное слепое рандомизированное плацебо-контролируемое 12-недельное исследование с участием 329 пациентов с гетерозиготной семейной гиперхолестеринемией, проходивших гиполипидемическое терапию. Лекарственное средство Репата существенно снижал уровни ХС ЛПНП от начального уровня до среднего значения на неделях 10 и 12 по сравнению с плацебо (p <0,001). Лекарственное средство Репата существенно снижал уровне ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП, АпоВ / АпоА1, ХС-ЛПОНП, ТГ и Лп (а) и повышал уровни ХС-ЛПВП и АпоА1 от начального уровня до среднего значения на неделях 10 и 12 по сравнению с плацебо (p <0,05) (см. таблицу 1).
Таблица 1. Эффекты от лечения лекарственным средством Репата сравнению с плацебо у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией - среднее значение процентного изменения от начального уровня до среднего значения на неделях 10 и 12 (%, 95% доверительный интервал (ДИ))
исследование | Режим ис-вания | HS- LPNŜ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ZH (%) | Лп(а) (%) | HS- LPDNŜ (%) | HS- LPVŜ (%) | ТГ (%) | ApoA1 (%) | Спиввид- ношение З / ХС ЛПВП % | Спиввид- ношение АпоВ / АпоА1 % |
ЛАПЛАС-2 (HMD) (Комбинированные группы приема розувастатина, симвастатина и аторвастатина) | 140 мг Q2W (N = 555) | - 72b (-75, -69) | - 60b (-63, -58) | - 56b (-58, -53) | - 41b (-43, -39) | - 30b (-35, -25) | - 18b (-23, -14) | 6b (4, 8) | - 17б (-22, -13) | 3b (1, 5) | - 45b (-47, -42) | - 56b (-59, -53) |
420 мг QM (N = 562) | - 69b (-73, -65) | - 60b (-63, -57) | - 56b (-58, -53) | - 40b (-42, -37) | - 27b (-31, -24) | - 22б (-28, -17) | 8b (6, 10) | - 23б (-28, -17) | 5b (3, 7) | - 46b (-48, -43) | - 58b (-60, -55) | |
РЕЗЕРФОРД-2 (HeFH) | 140 мг Q2W (N = 110) | - 61b (-67, -55) | - 56b (-61, -51) | - 49b (-54, -44) | - 42b (-46, -38) | - 31b (-38, -24) | - 22б (-29, -16) | 8b (4, 12) | - 22б (-29, -15) | 7a (3, 12) | - 47b (-51, -42) | -53 (-58, -48) |
420 мг QM (N = 110) | - 66b (-72, -61) | - 60b (-65, -55) | - 55b (-60, -50) | - 44b (-48, -40) | - 31b (-38, -24) | - 16б (-23, -8) | 9b (5, 14) | - 17б (-24, -9) | 5а (1, 9) | - 49b (-54, -44) | - 56b (-61, -50) |
Условные обозначения:
Q2W = 1 раз каждые 2 недели
QM = 1 раз в месяц
HMD = первичная гиперхолестеринемия и смешанная дислипидемия
HeFH = гетерозиготная семейная гиперхолестеринемия
а значение р <0,05 по сравнению с плацебо
b значение р <0,001 по сравнению с плацебо
Пациенты с непереносимостью статинов
GAUSS-2 - международное многоцентровое двойное слепое рандомизированное эзетимиб-контролируемое 12-недельное исследование с участием 307 пациентов, имевших непереносимость статинов или не могли переносить эффективную дозу статина. Лекарственное средство Репата существенно снижал уровень ХС ЛПНП по сравнению с эзетимиба (p <0,001). Лекарственное средство Репата существенно снижал уровне ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП, АпоВ / АпоА1 и Лп (а) от начального уровня до среднего значения на неделях 10 и 12 по сравнению с эзетимиба (p <0,001) (см . таблицу 2).
Лечение при отсутствии статина
MENDEL-2 - международное многоцентровое двойное слепое рандомизированное плацебо и эзетимиб-контролируемое 12-недельное исследование лекарственного средства Репата с участием 614 пациентов с первичной гиперхолестеринемией и смешанной дислипидемией. Лекарственное средство Репата существенно снижал уровень ХС ЛПНП от начального уровня до среднего значения на неделях 10 и 12 по сравнению с плацебо и эзетимиба (p <0,001). Лекарственное средство Репата существенно снижал уровне ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП, АпоВ / АпоА1 и Лп (а) от начального уровня до среднего значения на неделях 10 и 12 по сравнению с плацебо и эзетимиба (p <0,001) (см. таблицу 2).
Таблица 2. Эффекты от лечения лекарственным средством Репата сравнению с эзетимиба у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией - среднее значение процентного изменения от начального уровня до среднего значения на неделях 10 и 12 (%, 95% ДИ)
исследование | Режим ис-вания | HS- LPNŜ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ZH (%) | Лп(а) (%) | HS- LPDNŜ (%) | HS- LPVŜ (%) | ТГ (%) | ApoA1 (%) | Спиввид- ношение З / ХС ЛПВП % | Спиввид- ношение АпоВ / АпоА1 % |
ЛАПЛАС-2 (HMD) (Комбинированные группы приема аторвастатина) | 140 мг Q2W (N = 219) | - 43с (-50, -37) | - 34с (-39, -30) | - 34с (-38, -30) | - 23с (-26, -19) | - 30 часов (-35, -25) | -1 (-7, 5) | 7 с (4, 10) | -2 (-9, 5) | 7 с (4, 9) | - 27 с (-30, -23) | - 38 с (-42, -34) |
420 мг QM (N = 220) | - 46с (-51, -40) | - 39с (-43, -34) | - 40-е годы (-44, -36) | - 25 часов (-29, -22) | - 33с (-41, -26) | -7 (-20, 6) | 8с (5, 12) | -8 (-21, 5) | 7 с (2, 11) | - 30 часов (-34, -26) | - 42с (-47, -38) | |
ГАУСС-2 (Непереносимость статинов) | 140 мг Q2W (N = 103) | - 38b (-44, -33) | - 32b (-36, -27) | - 32b (-37, -27) | - 24b (-28, -20) | - 24b (-31, -17) | -2 (-10, 7) | 5 (1, 10) | -3 (-11, 6) | 5а (2, 9) | - 27b (-32, -23) | - 35b (-40, -30) |
420 мг QM (N = 102) | - 39b (-44, -35) | - 35b (-39, -31) | - 35b (-40, -30) | - 26б (-30, -23) | - 25b (-34, -17) | -4 (-13, 6) | 6 (1, 10) | -6 (-17, 4) | 3 (-1, 7) | - 30b (-35, -25) | - 36b (-42, -31) | |
МЕНДЕЛЬ-2 (Лечение при отсутствии статина) | 140 мг Q2W (N = 153) | - 40b (-44, -37) | - 36b (-39, -32) | - 34b (-37, -30) | - 25b (-28, -22) | - 22б (-29, -16) | -7 (-14, 1) | 6а (3, 9) | -9 (-16, -1) | 3 (0, 6) | - 29b (-32, -26) | - 35b (-39, -31) |
420 мг QM (N = 153) | - 41b (-44, -37) | - 35b (-38, -33) | - 35b (-38, -31) | - 25b (-28, -23) | - 20b (-27, -13) | -10 (-19, -1) | 4 (1, 7) | -9 (-18, 0) | 4a (1, 7) | - 28b (-31, -24) | - 37b (-41, -32) |
Условные обозначения:
Q2W = 1 раз каждые 2 недели
QM = 1 раз в месяц
HMD = первичная гиперхолестеринемия и смешанная дислипидемия
а значение р <0,05 по сравнению с эзетимиба
b значение р <0,001 по сравнению с эзетимиба
с номинальное значение р <0,001 по сравнению с эзетимиба
Длительная эффективность при первичной гиперхолестеринемии и смешанной дислипидемии
DESCARTES - международное многоцентровое двойное слепое рандомизированное плацебо-контролируемое 52-недельное исследование с участием 901 пациента с гиперлипидемией, получавших только диету, аторвaстатин или комбинацию аторвaстатину и эзетимиба. Лекарственное средство Репата в дозе 420 мг 1 раз в месяц существенно снижал уровень ХС ЛПНП от исходного значения на неделе 52 по сравнению с плацебо (p <0,001). Эффекты от лечения поддерживались в течение 1 года, демонстрировалось снижением уровня ХС ЛПНП с недели 12 до недели 52. Снижение уровня ХС ЛПНП от исходного значения на неделе 52 по сравнению с плацебо согласовывалось в течение фоновой гиполипидемической терапии, оптимизированной по ХС ЛПНП и сердечно сосудистого риска.
Лекарственное средство Репата существенно снижал уровне ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП, АпоВ / АпоА1, ХС-ЛПОНП, ТГ и Лп (а) и повышал уровни ХС-ЛПВП и АпоА1 на неделе 52 по сравнению с плацебо ( p <0,001) (см. таблицу 3).
Таблица 3. Эффекты от лечения лекарственным средством Репата сравнению с плацебо у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией - среднее значение процентного изменения от начального уровня до недели 52 (%, 95% ДИ)
исследование | Режим засто- вания | HS- LPNŜ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ZH (%) | Лп(а) (%) | HS- LPDNŜ (%) | HS- LPVŜ (%) | ТГ (%) | ApoA1 (%) | Спиввид ношение З / ХС ЛПВП % | спиввид ношение АпоВ / АпоА1 % |
ДЕСКАРТ | 420 мг QM (N = 599) | - 59b (-64, -55) | - 50b (-54, -46) | - 44b (-48, -41) | - 33b (-36, -31) | - 22б (-26, -19) | - 29b (-40, -18) | 5b (3, 8) | - 12b (-17, -6) | 3a (1, 5) | - 37b (-40, -34) | - 46b (-50, -43) |
Условные обозначения:
QM = 1 раз в месяц
а номинальное значение р <0,001 по сравнению с плацебо
b значение р <0,001 по сравнению с плацебо
OSLER и OSLER-2 были два рандомизированных контролируемых открытых расширенных исследования по оценке безопасности и эффективности лекарственного средства Репата с участием пациентов, завершивших лечение в начальном исследовании. В каждом расширенном исследовании пациентов было в произвольном порядке распределены в соотношении 2: 1 в группы приема лекарственного средства Репата + стандартное лечение (группа приема еволокумабу) или только стандартного лечения (контрольная группа) в течение первого года исследования. В конце первого года (неделя 52 в исследовании OSLER и неделю 48 в исследовании OSLER-2) пациенты продолжили участие в лечении лекарственным средством Репата, когда все пациенты получали незамаскированное лекарственное средство Репата течение еще 4 лет (OSLER) или 2 лет (OSLER-2) .
Всего в исследование OSLER были включены 1324 пациентов. Лекарственное средство Репата в дозе 420 мг 1 раз в месяц существенно снижал уровень ХС ЛПНП от исходного значения на неделе 12 и недели 52 по сравнению с контролем (номинальное значение p <0,001). Эффекты от лечения поддерживались в течение 272 недель, что демонстрировалось снижением уровня ХС ЛПНП с недели 12 в начальном исследовании до недели 260 в открытом расширенном исследовании. Всего в исследование OSLER-2 были включены 3681 пациент. Лекарственное средство Репата существенно снижал уровень ХС ЛПНП от исходного уровня на неделе 12 и недели 48 по сравнению с контролем (номинальное значение p <0,001). Эффекты от лечения поддерживались, что демонстрировалось снижением уровня ХС ЛПНП с недели 12 до недели 104 в открытом расширенном исследовании. Лекарственное средство Репата существенно снижал уровне ОХ, АпоВ, 48 в исследовании OSLER-2 по сравнению с контролем (номинальное значение p <0,001). Уровень ХС ЛПНП и другие параметры липидов возвращались к исходным значениям в течение 12 недель после прекращения приема препарата Репата в начале исследования OSLER или OSLER-2 без проявления синдрома «рикошета».
TAUSSIG было текущим многоцентровым открытым 5-летним расширенным исследованием по оценке длительной безопасности и эффективности лекарственного средства Репата как дополнительной терапии к другим гиполипидемических препаратов с участием пациентов с тяжелой семейной гиперхолестеринемией (СГ), включая гомозиготной семейной гиперхолестеринемией. Всего в исследование TAUSSIG были включены 194 пациентов с тяжелой семейной гиперхолестеринемией (никак ГоСГ) и 106 пациентов с гомозиготной семейной гиперхолестеринемией. Всех пациентов в исследовании сначала лечили лекарственным средством Репата в дозе 420 мг 1 раз в месяц, за исключением пациентов, получавших аферез на момент включения и начали лечение лекарственным средством Репата в дозе 420 мг 1 раз каждые 2 недели. Частоту приема лекарственного средства у пациентов, не получавших липидный аферез, можно было увеличить до 420 мг 1 раз каждые 2 недели на основании ответа уровней ХС ЛПНП и PCSK9. Длительное применение лекарственного средства Репата демонстрировало стабильный эффект от лечения, что подтверждалось снижением уровня ХС ЛПНП у пациентов с тяжелой семейной гиперхолестеринемией (никак ГоСГ) (см. Таблицу 4).
Изменения в других параметрах липидов (ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП и АпоВ / АпоА1) также демонстрировали стабильный эффект от длительного приема лекарственного средства Репата у пациентов с тяжелой семейной гиперхолестеринемией (никак ГоСГ).
Таблица 4. Эффект лекарственного средства Репата на ХС ЛПНП у пациентов с тяжелой семейной гиперхолестеринемией (никак ГоСГ) - медианное значение процентного изменения от начального уровня до недели 216 ВРД (и ассоциированные 95% ДИ)
популяция пациентов (N) | Неделя 12 ВРД (n = 191) | Неделя 24 ВРД (n = 191) | Неделя 36 ВРД (n = 187) | Неделя 48 ВРД (n = 187) | Неделя 96 ВРД (n = 180) | Неделя 144 ВРД (n = 180) | Неделя 192 ВРД (n = 147) | Неделя 216 ВРД (n = 96) |
Тяжелая СГ ( НЕ - ГоСГ ) ( N = 194) | -54.9 (-57.4, -52.4) | -54.1 (-57.0, -51.3) | -54.7 (-57.4, -52.0) | -56.9 (-59.7, -54.1) | -53.3 (-56.9, -49.7) | -53.5 (-56.7, -50.2) | -48.3 (-52.9, -43.7) | -47.2 (-52.8, -41.5) |
Условные обозначения:
ВРД = открытое расширенное исследование
СГ = семейная гиперхолестеринемия
N (n) = количество пациентов, подвергающихся оценке (N), и пациентов со значениями ЛПНП, которые наблюдались во время специального запланированного визита (n) в промежуточной анализируемой выборке пациентов с тяжелой семейной гиперхолестеринемией (никак ГоСГ).
Длительная безопасность стабильных очень низких уровней ХС ЛПНП (а именно: <0,65 ммоль / л [<25 мг / дл]) еще не было установлено. Имеющиеся данные показывают, что нет клинически значимой разницы между профилями безопасности у пациентов с уровнями ХС ЛПНП <0,65 ммоль / л и пациентов с высокими уровнями ХС ЛПНП (см. Раздел «Побочные реакции»).
Лечение гомозиготной семейной гиперхолестеринемии
TESLA было международным многоцентровым двойное слепое рандомизированное плацебо-контролируемым 12-недельным исследованием с участием 49 пациентов с гомозиготной семейной гиперхолестеринемией в возрасте от 12 до 65 лет. Лекарственное средство Репата в дозе 420 мг 1 раз в месяц, как вспомогательная терапия в других гиполипидемических терапий (например, статины, секвестранты желчных кислот), существенно снижал уровни ХС ЛПНП и АпоВ на неделе 12 по сравнению с плацебо (p <0,001) (см . таблицу 5). Изменения в других параметрах липидов (ОХ, ХС-ЛПВП, ХС / ХС-ЛПВП и АпоВ / АпоА1) также демонстрировали эффект от лечения лекарственным средством Репата у пациентов с гомозиготной семейной гиперхолестеринемией.
Таблица 5. Эффекты от лечения лекарственным средством Репата сравнению с плацебо у пациентов с гомозиготной семейной гиперхолестеринемией - среднее значение процентного изменения от начального уровня до недели 12 (%, 95% ДИ)
исследование | Режим при- менение | HS- LPNŜ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ZH (%) | Лп(а) (%) | HS- LPDNŜ (%) | HS- LPVŜ (%) | ТГ (%) | Спиввид ношение З / ХС ЛПВП % | спиввид ношение АпоВ / АпоА1 % |
ТЕСЛА (GoSG) | 420 мг QM (N = 33) | - 32b (-45, -19) | - 30 а (-42, -18) | - 23б (-35, -11) | - 27 а (-38, -16) | -12 (-25, 2) | -44 (-128, 40) | -0,1 (-9, 9) | 0,3 (-15, 16) | - 26а (-38, -14) | - 28а (-39, -17) |
Условные обозначения:
ГоСГ = гомозиготная семейная гиперхолестеринемия
QM = 1 раз в месяц
а номинальное значение р <0,001 по сравнению с плацебо
b значение р <0,001 по сравнению с плацебо.
Длительная эффективность при гомозиготной семейной гиперхолестеринемии
В исследовании TAUSSIG длительное применение лекарственного средства Репата продемонстрировало стабильный эффект лечения, подтверждался снижением уровня ХС ЛПНП примерно от 20% до 30% у пациентов с гомозиготной семейной гиперхолестеринемией, не получавших аферез, и примерно от 10% до 30% у пациентов с гомозиготной семейной гиперхолестеринемией, получавших аферез (см. таблицу 6). Изменения в других параметрах липидов (ОХ, АпоВ, ХС ЛПВП, ХС / ХС-ЛПВП и АпоВ / АпоА1) также демонстрировали стабильный эффект длительного приема лекарственного средства Репата у пациентов с гомозиготной семейной гиперхолестеринемией. Снижение в уровне ХС ЛПНП и изменения в других параметрах липидов в 14 пациентов-подростков (в возрасте ≥ 12 и <18 лет) с гомозиготной семейной гиперхолестеринемией были сопоставимы со значениями в общей популяции пациентов с гомозиготной семейной гиперхолестеринемией.
Таблица 6. Эффект лекарственного средства Репата на ХС ЛПНП у пациентов с гомозиготной семейной гиперхолестеринемией - среднее значение процентного изменения от начального уровня до недели 216 ВРД (и ассоциированные 95% ДИ)
популяция пациентов (N) | Неделя 12 ВРД | Неделя 24 ВРД | Неделя 36 ВРД | Неделя 48 ВРД | Неделя 96 ВРД | Неделя 144 ВРД | Неделя 192 ВРД | Неделя 216 ВРД |
GoSG (N = 106) | -21.2 (-26.0, -16.3) (n = 104) | -21.4 (-27.8, -15.0) (n = 99) | -27.0 (-32.1, -21.9) (n = 94) | -24.8 (-31.4, -18.3) (n = 93) | -25.0 (-31.2, -18.8) (n = 82) | -27.7 (-34.9, -20.5) (n = 79) | -27.4 (-36.9, -17.8) (n = 74) | -24.0 (-34.0, -14.0) (n = 68) |
Не получали аферез (N = 72) | -22.7 (-28.1, -17.2) (n = 70) | -25.8 (-33.1, -18.5) (n = 69) | -30.5 (-36.4, -24.7) (n = 65) | -27.6 (-35.8, -19.4) (n = 64) | -23.5 (-31.0, -16.0) (n = 62) | -27.1 (-35.9, -18.3) (n = 60) | -30.1 (-37.9, -22.2) (n = 55) | -23.4 (-32.5, -14.2) (n = 50) |
получали аферез (N = 34) | -18.1 (-28.1, -8.1) (n = 34) | -11.2 (-24.0, 1.7) (n = 30) | -19.1 (-28.9, -9.3) (n = 29) | -18.7 (-29.5, -7.9) (n = 29) | -29.7 (-40.6, -18.8) (n = 20) | -29.6 (-42.1, -17.1) (n = 19) | -19.6 (-51.2, 12.1) (n = 19) | -25.9 (-56.4, 4.6) (n = 18) |
Условные обозначения:
ВРД = открытое расширенное исследование
N (n) = количество пациентов, подвергающихся оценке (N), и пациентов со значениями ЛПНП, которые наблюдались во время специального запланированного визита (n) в финальной анализируемой выборке пациентов с гомозиготной семейной гиперхолестеринемией (ГоСГ).
Влияние атеросклерозом
Влияние лекарственного средства Репата в дозе 420 мг 1 раз в месяц на течение атеросклероза, что измеряется внутрисосудистым ультразвуковым исследованием (ВСУЗД (IVUS)), оценивали в пределах 78-недельного двойного слепого рандомизированного плацебо-контролируемого исследования с участием 968 пациентов с ишемической болезнью сердца на фоне оптимальной терапии статинами в стабильной дозе. Лекарственное средство Репата уменьшил как относительный объем атеромы (ВОА (PAV) 1,01% [95% ДИ 0,64, 1,38], p <0,0001), так и общий объем атеромы (ЗОА ( TAV) 4,89 мм 3 [95% ДИ 2,53, 7,25], p <0,0001) по сравнению с плацебо. При измерении ВОА атеросклеротическая регрессия наблюдалась в 64,3% (95% ДИ 59,6, 68,7) и 47,3% (95% ДИ 42,6, 52,0) пациентов, получавших препарат Репата или плацебо соответственно при измерении ЗОА атеросклеротическая регрессия наблюдалась в 61, 5% (95% ДИ 56,7, 66,0) и 48,9% (95% ДИ 44,2, 53,7) пациентов, получавших препарат Репата или плацебо соответственно. В исследовании не изучали взаимосвязь между регрессией атеросклеротических бляшек и явлениями со стороны сердечно-сосудистой системы.
Снижение сердечно-сосудистого риска у взрослых с установленным атеросклерозом сердечно-сосудистой системы
Исследование результатов применения лекарственного средства Репата «Repatha Outcomes Study (FOURIER)» было рандомизированное двойное слепое исследование типа «случай-контроль» с участием 27 564 субъектов в возрасте от 40 до 86 лет (средний возраст 62,5 лет) с установленным атеросклерозом сердечно-сосудистой системы; 81% имели предыдущий эпизод инфаркта миокарда (ИМ), 19% - эпизод инсульта, 13% - эпизод заболевания периферических артерий. Более 99% пациентов получали средне- и высокоинтенсивные терапию статинами и по крайней мере один другой сердечно-сосудистый препарат, например, антитромбоцитарные средства, бета-блокаторы, ингибиторы АПФ или блокаторы рецепторов ангиотензина; медиана уровня холестерина ЛПНП (1-й квартал, 3-й квартал) на исходном уровне составляла 2,4 ммоль / л (2,1, 2,8). Абсолютный сердечно-сосудистый (СС) риск был сбалансирован между группами лечения, в дополнение к индексной события все пациенты имели менее 1 значимый или 2 незначимых факторы СС риска; 80% имели гипертоническую болезнь, 36% имели сахарный диабет, 28% курили ежедневно. Пациенты были рандомизированы в соотношении 1: 1 к группе терапии лекарственным средством Репата (140 мг каждые 2 недели или 420 мг 1 раз в месяц) или в группу соответствующего плацебо; средняя продолжительность последующего наблюдения за пациентом составляла 26 месяцев. 1 к группе терапии лекарственным средством Репата (140 мг каждые 2 недели или 420 мг 1 раз в месяц) или в группу соответствующего плацебо; средняя продолжительность последующего наблюдения за пациентом составляла 26 месяцев. 1 к группе терапии лекарственным средством Репата (140 мг каждые 2 недели или 420 мг 1 раз в месяц) или в группу соответствующего плацебо; средняя продолжительность последующего наблюдения за пациентом составляла 26 месяцев.
Значительное снижение уровня холестерина ЛПНП наблюдалось в течение всего исследования, при этом достигался медианный диапазон уровня холестерина ЛПНП от 0,8 до 0,9 ммоль / л при каждой оценке; 25% пациентов достигли концентрации холестерина ЛПНП менее 0,5 ммоль / л. Несмотря на достижение очень низкого уровня холестерина ЛПНП, новых проблем безопасности не наблюдалось (см. Раздел «Побочные реакции»); частота случаев впервые выявленного сахарного диабета и когнитивных событий была сопоставима у пациентов, достигших уровней холестерина ЛПНП <0,65 ммоль / л и у пациентов с более высоким уровнем холестерина ЛПНП.
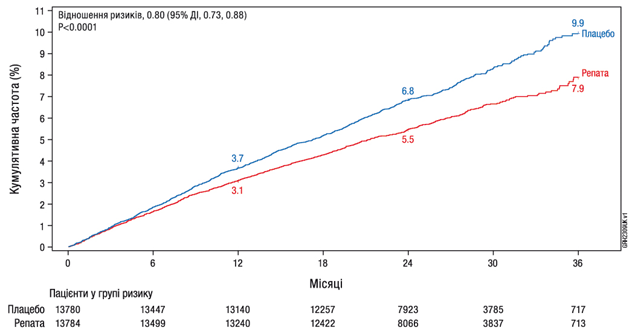
Лекарственное средство Репата значительно снизил риск явлений со стороны сердечно-сосудистой системы, определенных как композитная конечная точка, включая время до первой смерти через СС патологию, ИМ, инсульт, коронарную реваскуляризацию или госпитализации по поводу нестабильной стенокардии (см. Таблицу 7); кривые Каплана-Мейера для первичной и ключевой вторичной композитных конечных точек, между которыми было около 5 месяцев (трехлетнюю кривую Каплана-Мейера для значительного нежелательного сердечно-сосудистого явления (ЗНССЯ (MACE)) приведен на рисунке 1). Относительный риск композитной конечной точки ЗНССЯ (смерть через СС патологию, ИМ или инсульт) был значительно снижен на 20%. Эффект лечения был последовательным во всех подгруппах (включая возраст, тип заболевания, исходный уровень холестерина ЛПНП, уровень интенсивности терапии статинами, применение эзетимиба и наличие сахарного диабета) и был обусловлен уменьшением риска инфаркта миокарда, инсульта и коронарной реваскуляризации; не наблюдалось значимой разницы по смертности из СС патологию и по всем причинам, однако дизайн исследования не предусматривал выявление такой разницы.
Таблица 7. Эффект лекарственного средства Репата на значимые явления со стороны сердечно-сосудистой системы
значимые явления | Плацебо (N = 13 780) п (%) | Репы (N = 13 784) п (%) | Отношение рисков a (95% ДИ) | p-значение b | |||||
ЗНССЯ + (композитная ЗНССЯ, коронарной реваскуляризации или госпитализации по поводу нестабильной стенокардии) | 1 563 (11,34) | 1 344 (9,75) | 0,85 (0,79, 0,92) | <0,0001 | |||||
ЗНССЯ (композитная смерти через СС патологию, ИМ или инсульт) | 1 013 (7,35) | 816 (5,92) | 0,80 (0,73, 0,88) | <0,0001 | |||||
Смерть из-за сердечно-сосудистую патологию | 240 (1,74) | 251 (1,82) | 1,05 (0,88, 1,25) | 0,62 | |||||
Смертность по всем причинам | 426 (3,09) | 444 (3,22) | 1,04 (0,91, 1,19) | 0,54 | |||||
Инфаркт миокарда (смертельный / Несмертельный) | 639 (4,64) | 468 (3,40) | 0,73 (0,65, 0,82) | <0,0001c | |||||
Инсульт (смертельный / Несмертельный) d | 262 (1,90) | 207 (1,50) | 0,79 (0,66, 0,95) | 0,0101c | |||||
Коронарная реваскуляризация | 965 (7,00) | 759 (5,51) | 0,78 (0,71, 0,86) | <0,0001c | |||||
Госпитализация по поводу нестабильной стенокардии e | 239 (1,7) | 236 (1,7) | 0,99 (0,82, 1,18) | 0,89 | |||||
a На основе модели Кокса, стратифицированной по факторам стратификации рандомизации, собранными с помощью Системы интерактивного голосового ответа (IVRS).
b Двусторонний лог-ранговый критерий стратифицированный по факторам стратификации рандомизации, собранными с помощью Системы интерактивного голосового ответа (IVRS).
c Номинальная значимость.
d Влияние лечения на инсульт был обусловлен уменьшением риска ишемического инсульта; не было отмечено влияния на геморрагический или неопределенный инсульт.
e Оценка времени до госпитализации при нестабильной стенокардии была ситуативной.
Рис. 1. Время до явления ЗНССЯ (композитная смерти через СС патологию, ИМ или инсульт) 3-летний расчет по методу Каплана-Мейера
дети
Европейское агентство лекарственных средств отказалось от права требовать исполнения обязательства подавать результаты исследований по лекарственным средством Репата во всех субпопуляциях детей для лечения смешанной дислипидемии.
Европейское агентство лекарственных средств отсрочило обязательства подавать результаты исследований по лекарственным средством Репата в одной или более субпопуляции детей для лечения повышенного уровня холестерина.
Имеющиеся данные по применению лекарственного средства Репата детям ограничены. 14 пациентов-подростков в возрасте ≥ 12 и <18 лет с гомозиготной семейной гиперхолестеринемией были включены в клинические исследования. Никакой общей разницы в безопасности или эффективности между пациентами-детьми и взрослыми с гомозиготной семейной гиперхолестеринемией не наблюдалось.
Информация о применении детям приведена в разделе «Способ применения и дозы».
Фармакокинетика.
Абсорбция и распределение
После однократного подкожного введения 140 мг или 420 мг лекарственного средства Репата здоровым взрослым медианные пиковые концентрации в сыворотке достигается через 3-4 дня. Применение однократной подкожной дозы 140 мг вызывало среднее значение (СКО) Cmax 13,0 (10,4) мкг / мл и среднее значение (СКО) AUClast 96,5 (78,7) сутки • мкг / мл. Применение однократной подкожной дозы 420 мг вызывало среднее значение (СКО) Cmax 46,0 (17,2) мкг / мл и среднее значение (СКО) AUClast 842 (333) сутки • мкг / мл. 3 подкожные дозы 140 мг были биоэквивалентными 1 подкожной дозе 420 мг. Биодоступность после подкожного введения дозы составляла 72% от фармакокинетических (ФК) моделей.
После однократной внутривенной дозы 420 мг лекарственного средства Репата средний (СКВ) объем распределения в равновесном состоянии составлял 3,3 (0,5) л, что свидетельствовало о том, что еволокумаб имеет ограниченный распределение в тканях.
Метаболизм
Лекарственное средство Репата состоит только из аминокислот и углеводов, как природный иммуноглобулин, и вряд ли будет выводиться через метаболические механизмы печени. Ожидается, что его метаболизм и вывод будут осуществляться путем разложения на небольшие пептиды и отдельные аминокислоты.
вывод
Считается, что еволокумаб имеет эффективный период полувыведения от 11 до 17 дней.
У пациентов с первичной гиперхолестеринемией или смешанной дислипидемией, принимающих высокую дозу статина, системное воздействие еволокумабу был немного ниже, чем у пациентов, принимавших низкую или среднюю дозу статина (соотношение AUClast 0,74 [90% ДИ 0,29; 1,9 ]). Повышение примерно на 20% клиренса частично опосредованное статинами, что увеличивало концентрацию PCSK9, но не влияло негативно на фармакодинамический еволокумабу на липиды. Фармакокинетический анализ популяции не указывал на существенную разницу в сывороточных концентрациях еволокумабу у пациентов с гиперхолестеринемией (несемейной гиперхолестеринемией или семейной гиперхолестеринемией), одновременно принимали статины.
Линейность / нелинейность
После однократной внутривенной дозы 420 мг средний (СКВ) системный клиренс составлял 12 (2) мл / час. В клинических исследованиях с многократным подкожным введением дозы в течение 12 недель дозопропорцийне увеличение экспозиции наблюдались при применении дозы 140 мг и более. Примерно 2-3-кратная кумуляция наблюдалась при минимальных сывороточных концентрациях [Cmin (СКО) 7,21 (6,6)] после введения дозы 140 мг каждые 2 недели или после введения дозы 420 мг 1 раз в месяц [Cmin (СКО) 11 2 (10,8)], сывороточные минимальные концентрации приближались к равновесному состоянию через 12 недель после введения дозы.
Часозалежни изменения не наблюдались в сывороточных концентрациях в течение периода 124 недели.
Нарушение функции почек
Для пациентов с нарушением функции почек коррекции дозы не требуется. Данные по клиническим исследованиям лекарственного средства Репата не выявил разницы в фармакокинетике еволокумабу у пациентов с нарушением функции почек легкой или средней степени по сравнению с пациентами, которые не имеют нарушения функции почек.
В клиническом исследовании с участием 18 пациентов с нормальной функцией почек (расчетная скорость клубочковой фильтрации [eGFR] ≥ 90 мл / мин / 1,73 м2, n = 6), или тяжелым нарушением функции почек (eGFR от 15 до 29 мл / мин / 1,73 м2, n= 6), или заболеванием почечной болезни конечной стадии (ЗНХ), получавших гемодиализ (n = 6), влияние несвязанного еволокумабу по оценке Cmax после однократного подкожной дозы 140 мг уменьшился на 30% у пациентов с тяжелым нарушением функции почек и на 45% у пациентов с ЗНХ, получавших гемодиализ. Экспозиция, по оценке AUClast, уменьшилась примерно на 24% у пациентов с выраженным нарушением функции почек и примерно на 45% у пациентов с ЗНХ, получавших гемодиализ. Точный механизм различий ЖК неизвестен; однако разницы в весе тела не смогли предоставить объяснения этим различиям. При интерпретации результатов следует учитывать некоторые факторы, включая небольшой размер выборки и большую изменчивость между субъектами. Фармакологические и безопасность еволокумабу у пациентов с выраженным нарушением функции почек и ЗНХ были похожи на те, которые были у пациентов с нормальной функцией почек, и клинически значимых различий в снижении уровня ХС ЛПНП не было. Поэтому корректировки дозы не требуется пациентам с тяжелым нарушением функции почек или ЗНХ, которые получают гемодиализ.
Нарушение функции печени
У пациентов с нарушением функции печени легкой степени (класс А по шкале Чайлд - Пью) коррекции дозы не требуется. Однократные подкожные дозы 140 мг лекарственного средства Репата изучали у 8 пациентов с нарушением функции печени легкой степени, 8 пациентов с нарушением функции печени средней степени и 8 здоровых участников. Экспозиция еволокумабу у пациентов с нарушением функции печени была примерно на 40-50% меньше по сравнению со здоровыми участниками. Однако начальные уровни PCSK9 и степень и динамика нейтрализации PCSK9 были подобными среди пациентов с нарушением функции печени легкой или средней степени и у здоровых добровольцев. Это обусловило подобную динамику и степень абсолютного снижения уровня ХС ЛПНП. Лекарственное средство Репата не изучали у пациентов с нарушением функции печени тяжелой степени (класс С по шкале Чайлд - Пью) (см.
масса тела
Масса тела была существенной ковариатою в ФК анализе популяции, влияла на минимальные концентрации еволокумабу, однако влияния на снижение уровня ХС ЛПНП не было. После многократного подкожного введения 140 мг каждые 2 недели минимальные концентрации на 12 неделе были на 147% больше и на 70% ниже у пациентов весом 69 кг и 93 кг соответственно, чем у типичного пациента весом 81 кг. Меньшее влияние массы тела наблюдался при многократном подкожном введении месячных доз еволокумабу 420 мг.
Другие особые группы пациентов
Фармакокинетические анализы популяции свидетельствуют о том, что корректировка дозы по возрасту, расе или статью не нужны. На фармакокинетику еволокумабу влияла масса тела без какого-либо существенного эффекта на снижение уровня ХС ЛПНП. Поэтому корректировки дозы в зависимости от массы тела не требуется.
Клинические характеристики
Репата Показания
Гиперхолестеринемия и смешанная дислипидемия
Лекарственное средство Репата показан для взрослых с первичной гиперхолестеринемией (гетерозиготной семейной и несемейной) или смешанной дислипидемией в качестве вспомогательной терапии к диете:
- в комбинации со статинами или статинами и другими гиполипидемической терапии для пациентов, которые не способны достичь нужных уровней ХС ЛПНП при максимальной переносимой дозе статина, или
- отдельно или в комбинации с другими гиполипидемической терапии для пациентов с непереносимостью статинов или для которых статины противопоказаны.
Гомозиготная семейная гиперхолестеринемия
Лекарственное средство Репата показан для взрослых и подростков старше 12 лет с гомозиготной семейной гиперхолестеринемией в комбинации с другими гиполипидемической терапии.
Установлен атеросклероз сердечно-сосудистой системы
Лекарственное средство Репата показан взрослым с установленным атеросклерозом сердечно-сосудистой системы (инфаркт миокарда, инсульт или заболевания периферических артерий) для уменьшения сердечно-сосудистого риска за счет снижения уровня холестерина ЛПНП, как дополнение к коррекции других факторов риска:
- в сочетании с максимально переносимой дозой статина с или без других методов снижения уровня липидов, или
- самостоятельно или в сочетании с другими гиполипидемическими видами терапии у пациентов с непереносимостью статинов или у пациентов, которым противопоказан статин.
Результаты исследования влияния на уровень холестерина ЛПНП, явления со стороны сердечно-сосудистой системы и исследуемые популяции приведены в разделе «Фармакологические».
Противопоказания
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ, указанных в разделе «Состав».
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Формальные исследования взаимодействия с другими лекарственными средствами для лекарственного средства Репата не проводились.
Фармакокинетическое взаимодействие между статинами и еволокумабом оценивали в клинических исследованиях лекарственного средства Репата. Повышение клиренса еволокумабу примерно на 20% наблюдалось у пациентов, одновременно принимавших статины. Такой повышенный клиренс частично опосредованный статинами, которые повышают концентрацию пропротеинконвертазы 9-го субтилизин-кексинового типа (PCSK9), что негативно не влияло на фармакодинамический еволокумабу на липиды. Корректировка дозы статина при применении в комбинации с лекарственным средством Репата не нужно.
Никакие исследования фармакокинетического и фармакодинамического взаимодействия между лекарственным средством Репата и гиполипидемическими лекарственными средствами, другими, чем статины и эзетимиб, не проводились.
Особенности применения
Нарушение функции печени
У пациентов с нарушением функции печени средней степени наблюдалось уменьшение общей экспозиции еволокумабу, что может уменьшить эффект на снижение уровня ХС ЛПНП. Поэтому для таких пациентов необходим тщательный мониторинг.
Применение лекарственного средства у пациентов с нарушением функции печени тяжелой степени (класс С по шкале Чайлд - Пью) не исследовался (см. Раздел «Фармакокинетика»). Лекарственное средство Репата следует с осторожностью применять пациентам с нарушением функции печени тяжелой степени.
Сухой натуральный каучук
Репата, 140 мг, раствор для инъекций в предварительно наполненном шприце-ручке
Колпачок иглы предварительно наполненного шприца-ручки изготовлены из сухого натурального каучука (производной латекса), который может вызвать аллергические реакции.
содержание натрия
Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на дозу, то есть практически свободный от натрия.
Применение в период беременности или кормления грудью
беременность
Данных о применении лекарственного средства Репата беременным женщинам очень мало.
Исследования на животных не указывают на прямые или косвенные эффекты по репродуктивной токсичности.
Лекарственное средство Репата не следует применять во время беременности, если только клиническое состояние женщины не требует лечения еволокумабом.
кормление грудью
Неизвестно, выделяется еволокумаб с молоком человека.
Риск для младенца / ребенка, которого кормят грудью, исключить нельзя.
Следует принять решение относительно того, прекратить кормить грудью, или прекратить / воздержаться от терапии лекарственным средством Репата, учитывая пользу от кормления грудью для ребенка и пользу от терапии для женщины.
репродуктивная функция
Нет данных об эффекте еволокумабу на репродуктивную функцию человека. Исследования на животных не указывали на какие эффекты на конечные точки фертильности на площади под кривой концентрация / время (AUC) при уровнях экспозиции гораздо больших, чем у пациентов, принимающих еволокумаб в дозе 420 мг 1 раз в месяц.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Нет сведений о случаях влияния лекарственного средства Репата на скорость реакции при управлении автотранспортом или работе с другими механизмами.
Способ применения Репата и дозы
Подкожное применение.
Лекарственное средство Репата предназначен для подкожного введения в область живота, бедра или верхней части руки. Места введения следует чередовать; инъекции не следует делать в участки кожи с болевыми ощущениями, синяками, покраснением или уплотнением. Лекарственное средство Репата не следует вводить внутривенно или внутримышечно.
Репата, 140 мг, раствор для инъекций в предварительно наполненном шприце-ручке
Дозу 140 мг следует вводить, используя 1 предварительно наполненный шприц-ручку. Дозу 420 мг следует вводить, используя 3 предварительно наполненные шприцы-ручки друг за другом в течение 30 минут.
Лекарственное средство Репата предназначен для самостоятельного введения пациентами после надлежащего обучения. Лекарственное средство Репата может также вводиться другим лицом, прошла обучение по введению лекарственного средства.
Лекарственное средство предназначено только для одноразового использования.
См. также раздел «Особые указания по применению и утилизации».
Дозы.
Перед началом применения лекарственного средства Репата следует исключить вторичные причины гиперлипидемии или смешанной дислипидемии (например, нефротический синдром, гипотиреоз).
Первичная гиперхолестеринемия и смешанная дислипидемия у взрослых
Рекомендуемая доза лекарственного средства Репата составляет 140 мг каждые 2 недели или 420 мг 1 раз в месяц; обе дозы клинически эквивалентными.
Гомозиготная семейная гиперхолестеринемия у взрослых и подростков старше 12 лет
Начальная рекомендуемая доза составляет 420 мг 1 раз в месяц. Через 12 недель лечения частоту приема лекарственного средства можно увеличить до 420 мг 1 раз каждые 2 недели, если клинически значимой ответы достигнуто не было. Пациенты, получающие аферез, могут начинать с 420 мг каждые 2 недели, чтобы лечение соответствовало графику афереза.
Установлен атеросклероз сердечно-сосудистой системы
Рекомендуемая доза лекарственного средства Репата составляет 140 мг каждые 2 недели или 420 мг 1 раз в месяц; обе дозы клинически эквивалентными.
Пациенты с нарушением функции почек
Корректировка дозы у пациентов с нарушением функции почек не требуется.
Пациенты с нарушением функции печени
Корректировка дозы у пациентов с нарушением функции печени легкой степени не требуется, для пациентов с нарушением функции печени средней и тяжелой степени см. «Особенности применения».
Пациенты пожилого возраста (в возрасте ≥ 65 лет)
Для пациентов пожилого возраста коррекции дозы не требуется.
Дети.
Безопасность и эффективность применения лекарственного средства Репата детям (в возрасте до 18 лет) по показаниям первичная гиперхолестеринемия и смешанная дислипидемия не устанавливались. Нет никаких данных. Безопасность и эффективность применения лекарственного средства Репата детям до 12 лет по показаниям гомозиготная семейная гиперхолестеринемия не устанавливались. Нет никаких данных.
Особые предостережения относительно применения и утилизации.
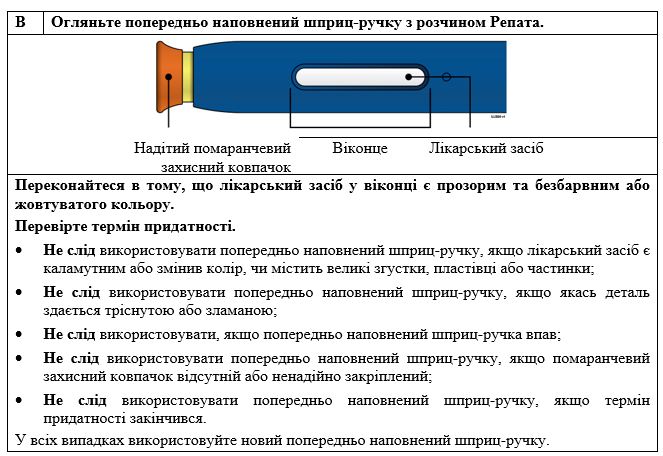
Перед применению раствор следует осмотреть. Не вводите раствор, если он содержит частицы или является мутным или обесцвеченными. Во избежание неприятных ощущений в месте введения доведите лекарственное средство до комнатной температуры (до 25 ° C) перед введением. Следует ввести все содержимое.
Неиспользованный препарат или отходы следует утилизировать в соответствии с местными требованиями.
Введение лекарственного средства .
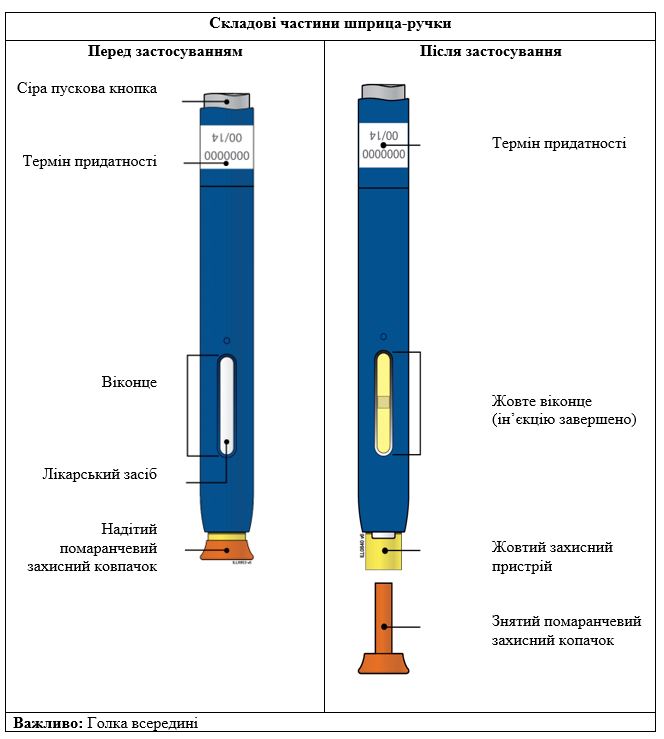
Репата, предварительно наполненный шприц-ручка одноразового использования SureClick
важноПеред применением раствора для инъекций Репата в одноразовой предварительно наполненном шприце-ручке прочитайте эту важную информацию:
|
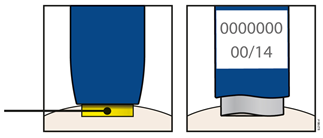
Этап 1. Подготовка | |
А | Выньте один предварительно наполненный шприц-ручку с упаковки. |
1. Осторожно выньте предварительно наполненный шприц-ручку из коробки. 2. Положите оригинальную упаковку с неиспользованными предварительно наполненными шприцами-ручками обратно в холодильник. 3. Подождите не менее 30 минут для того, чтобы предварительно наполненный шприц-ручка естественным путем достиг комнатной температуры перед введением. Не следует пытаться нагреть предварительно наполненный шприц-ручку, используя источник тепла, например горячую воду или микроволновую печь; Не следует оставлять предварительно наполненный шприц-ручку под прямыми солнечными лучами; Не следует встряхивать предварительно наполненный шприц-ручку; Не следует на этом этапе снимать оранжевый защитный колпачок с предварительно наполненного шприца-ручки. | |
С | Подготовьте все необходимое для инъекции. |
Тщательно вымойте руки водой с мылом. На чистую, хорошо освещаемую рабочую поверхность поместите:
| |
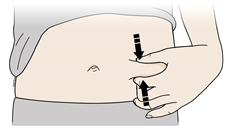
D | Подготовьте и очистите место введения. | |
Вы можете вводить лекарственное средство в: | ||
Очистите место введения с помощью спиртовой салфетки. Дайте коже высохнуть. | ||
| ||
- Не следует снова касаться места введения перед инъекцией.
- Каждый раз, когда Вы делаете себе инъекцию, выбирайте другой участок. Если Вам нужно сделать инъекцию в одно и то же место, убедитесь в том, что Вы не вводите препарат в ту же точку на этом участке, в которую Вы вводили в прошлый раз.
Не следует выбирать участок с болевыми ощущениями, синяками, покраснением или уплотнением на коже. Избегайте введения на участках со шрамами или стриями.
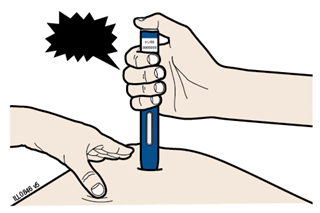
Этап 2. Приготовление | |
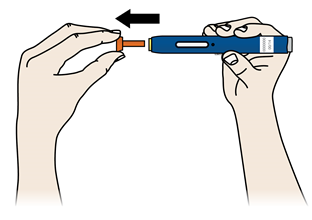
А | Когда Вы готовы делать инъекцию, снимите оранжевый защитный колпачок. Не следует держать шприц-ручку без оранжевого защитного колпачка в течение более 5 минут - это может привести к испарения лекарственного средства. |
| |
Наличие капли жидкости на конце иглы или желтого защитного устройства является нормальным явлением. Не следует скручивать, сгибать или откручивать оранжевый защитный колпачок Не следует надевать оранжевый колпачок обратно на предварительно наполненный шприц-ручку; Не следует держаться пальцами за желтый защитное устройство. | |
Важно: Не следует снимать оранжевый защитный колпачок с предварительно наполненного шприца-ручки, пока Вы не будете готовы делать инъекцию. | |
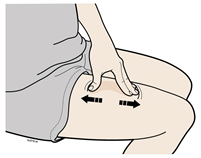
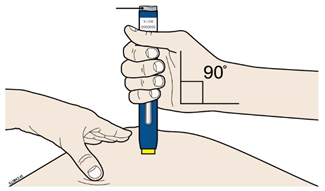
В | Растяните или зажмите место введения для создания твердой поверхности. |
метод растяжения
Сильно растяните кожу движением большого пальца и других пальцев в разные стороны, создавая участок шириной примерно 2 дюйма (5 см).ИЛИметод зажима
Крепко зажмите кожу между большим пальцем и остальными пальцами, создавая участок шириной примерно 2 дюйма (5 см). | |
Важно: важно держать кожу растянутой или зажатой во время введения препарата. | |
Этап 3. Введение | ||||
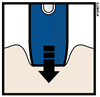
А | Держите растянутую или зажатую кожу, чтобы поверхность была жесткая. Снимите защитный колпачок, приложите предварительно наполненный шприц-ручку желтым защитным устройством для кожи под углом 90 °. | |||
Желтый защитное устройство | ||||
верно | неверно | |||
Не следует на этом этапе касаться серой пусковой кнопки |
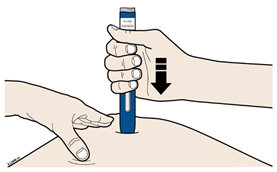
| |||
В | Сильно прижмите предварительно наполненный шприц-ручку к коже, чтобы он был неподвижен. | ||
|
| ||
Важно: Вы постоянно прижимать шприц-ручку, однако не следует касаться серой пусковой кнопки, пока не будете готовы сделать инъекцию. | |||
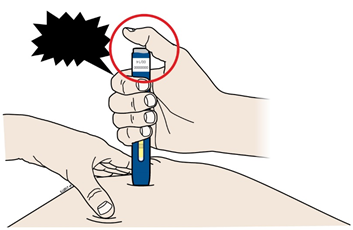
С | Когда Вы будете готовы сделать инъекцию, нажмите на серую пусковую кнопку. Вы услышите щелчок. | |
| ||
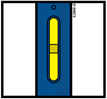
D | Продолжайте прижимать к коже. Затем поднимите большой палец. Введение может занять примерно 15 секунд. | |||
|
Когда инъекция завершится, окошко станет желтого цвета. | |||
ПРИМЕЧАНИЕ. После того, как Вы снимете предварительно наполненный шприц-ручку с кожи, игла автоматически скроется. | ||||
Этап 4. Завершение | |
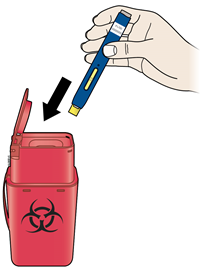
А | Выбросьте использован предварительно наполненный шприц-ручку и оранжевый защитный колпачок. |
Выбросьте использован предварительно наполненный шприц-ручку и оранжевый защитный колпачок в контейнер для утилизации острых предметов. Получить у врача, как нужно правильно утилизировать шприц. Могут существовать местные установки по утилизации. Храните использован предварительно наполненный шприц-ручку и контейнер для утилизации острых предметов в недоступном и незаметном для детей месте. Не следует повторно использовать предварительно наполненный шприц-ручку; Не следует надевать назад защитный колпачок на предварительно наполненный шприц-ручку или держаться пальцами за желтый защитное устройство; Не следует подвергать предварительно наполненный шприц-ручку или контейнер для утилизации острых предметов повторной переработке или выбрасывать их вместе с бытовыми отходами. | |
Осмотрите место введения.
Если выступает кровь, прижмите ватный тампон или марлевую салфетку к месту введения.
НЕ СЛЕДУЕТ растирать место введения. Наложите пластырь в случае необходимости.
Дети
Безопасность и эффективность применения лекарственного средства Репата детям (в возрасте до 18 лет) по показаниям первичная гиперхолестеринемия и смешанная дислипидемия не устанавливались. Нет никаких данных.
Безопасность и эффективность применения лекарственного средства Репата детям до 12 лет по показаниям гомозиготная семейная гиперхолестеринемия не устанавливались. Нет никаких данных.
Передозировка
Никакие побочные реакции не наблюдались в исследованиях на животных при экспозициях, что почти в 300 раз превышали экспозиции у пациентов, принимающих препарат Репата в дозе 420 мг 1 раз в месяц.
Специфического лечения передозировки лекарственным средством Репата нет. В случае передозировки пациента следует лечить симптоматически и принять поддерживающих мер, если необходимо.
Побочные эффекты
Резюме профиля безопасности
Наиболее частыми побочными реакциями при опорных исследований, в рекомендуемых дозах, были ринофарингит (7,4%), инфекция верхних дыхательных путей (4,6%), боль в спине (4,4%), артралгия (3,9%), грипп (3,2%) и реакции в месте введения (2,2%). Профиль безопасности в популяции с гомозиготной семейной гиперхолестеринемией согласовывался с профилем, который наблюдался в популяции с первичной гиперхолестеринемией и смешанной дислипидемией.
Сводная таблица побочных реакций
Побочные реакции, о которых сообщалось в опорных контролируемых клинических исследованиях и спонтанных сообщений, классифицированы по системам органов и частоте в таблице 8 ниже с использованием такого условного разделения: очень часто (≥ 1/10), часто (≥ 1/100 и <1 / 10), нечасто (≥ 1/1 000 и <1/100), редко (≥ 1/10 000 и < 1/1 000) и очень редко (<1/10 000).
Таблица 8. Побочные реакции при применении лекарственного средства Репата
Системы органов по классификации MedDRA | побочные реакции | Частота |
Инфекции и инвазии | Грипп | Часто |
ринофарингит | Часто | |
Инфекция верхних дыхательных путей | Часто | |
Со стороны иммунной системы | повышенная чувствительность | Часто |
сыпь | Часто | |
крапивница | Нечасто | |
Со стороны желудочно-кишечного тракта | тошнота | Часто |
Со стороны кожи и подкожных тканей | ангионевротический отек | редко |
Со стороны костно-мышечной системы и соединительной ткани | Боль в спине | Часто |
Артралгия | Часто | |
Общие нарушения и состояние места введения | Реакции в месте введения 1 | Часто |
гриппоподобное заболевания | Нечасто |
1 См. раздел «Описание отдельных побочных реакций».
Описание отдельных побочных реакций
Реакции в месте введения
Наиболее частыми реакциями в месте введения были образованию синяков в месте введения покраснение, кровоизлияние, боль в месте введения и отек.
дети
Опыт применения лекарственного средства Репата детям ограничен. В клинические исследования были включены 14 пациентов в возрасте ≥ 12 и <18 лет с гомозиготной семейной гиперхолестеринемией. Разница в безопасности между пациентами-детьми и взрослыми с гомозиготной семейной гиперхолестеринемией не отмечено.
Безопасность и эффективность применения лекарственного средства Репата детям с первичной гиперхолестеринемией и смешанной дислипидемией не устанавливались.
Пациенты пожилого возраста
С 18546 пациентов, которым применяли препарат Репата в двойных слепых клинических исследованиях, 7656 (41,3%) были в возрасте ≥ 65 лет, тогда как 1500 (8,1%) были в возрасте ≥ 75 лет. Между этими пациентами и молодыми пациентами одной общей разницы в безопасности или эффективности не наблюдалось.
иммуногенность
В клинических исследованиях 0,3% пациентов (48 из 17992 пациентов), которым было введено по крайней мере одну дозу лекарственного средства Репата, имели положительный результат испытания на выработку связующих антител. Пациенты, имели положительную реакцию сыворотки крови на связующие антитела, дальше оценивались на нейтрализующие антитела, и ни один из пациентов не имел положительного результата испытания на нейтрализующие антитела. Присутствие анти-еволокумаб-связывающих антител не влияла на фармакокинетический профиль, клинический ответ или безопасность лекарственного средства Репата.
Сообщение о подозреваемых побочные реакции
Важно сообщать о подозреваемых побочные реакции после регистрации лекарственного средства. Это позволяет постоянно контролировать соотношение польза / риск лекарственного средства. Обращаемся к работникам здравоохранения с просьбой сообщать о любых подозреваемые побочные реакции согласно действующему законодательству в сфере фармаконадзора.
Срок годности Репата
3 года.
Условия хранения Репата
Хранить в холодильнике (2-8 ° C). Не замораживать.
Хранить в оригинальной картонной упаковке для защиты от света.
После извлечения из холодильника препарат Репата можно хранить при комнатной температуре (до 25 ° C) в оригинальной картонной упаковке в течение 1 месяца.
Хранить в недоступном для детей месте.
Несовместимость.
При отсутствии исследований совместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Упаковка
Репата, 140 мг, раствор для инъекций в предварительно наполненном шприце-ручке
По 1 мл раствора в предварительно наполненном шприце-ручке одноразового использования, изготовленном из стекла I типа, с иглой из нержавеющей стали 27-го калибра.
Колпачок иглы предварительно наполненного шприца-ручки изготовлены из сухого натурального каучука (производной латекса, см. Раздел «Особенности применения»).
По 1 или по 2 предварительно наполненные шприцы-ручки в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Амджен Европа Б.В.
Амджен Текнолоджи (Айеленд) Анлимитед Компани.
Местонахождение производителя
Минервум 7061, 4817 ZK , Бреда, Нидерланды .
Поттере Роуд, Дан Лери, Ко. Дублин, Ирландия .
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Репата только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- https://www.amgen.nl - Амджен Европа Б.В.
| Тип данных | Сведения из реестра |
| Торговое наименование: | Репата |
| Производитель: | Амджен Европа Б.В. |
| Форма выпуска: | раствор для инъекций, 140 мг / мл по 1 мл раствора в предварительно наполнения шприце-ручке; по 1 или по 2 шприца-ручки в картонной коробке |
| Регистрационное удостоверение: | UA/17010/01/01 |
| Дата начала: | 31.10.2018 |
| Дата окончания: | 31.10.2023 |
| МНН: | Evolocumab |
| Условия отпуска: | по рецепту |
| Состав: | 1 предварительно наполненный шприц-ручка содержит 140 мг еволокумабу в 1 мл раствора |
| Фармакологическая группа: | Липидомодификувальни средства, простые. Другие липидомодификувальни средства. |
| Код АТХ: | C10AX13 |
| Заявитель: | Амджен Европа Б.В. |
| Страна заявителя: | Нидерланды |
| Адрес заявителя: | Минервум 7061, НЛ-4817 ЗК Брэда, Нидерланды |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| C | Средства, влияющие на сердечно-сосудистую систему |
| C10 | Гиполипидемические средства |
| C10A | Гипохолестеринемический и гипотриглицеридемични препараты |
| C10AX | Гипохолестеринемический и гипотриглицеридемични препараты другие |
| C10AX13 | Еволокумаб |