- Склад
- Лікарська форма
- Фармакотерапевтична група
- Фармакологічні властивості
- Клінічні характеристики
- Показання
- Протипоказання
- Взаємодія з іншими засобами
- Особливості застосування
- У період вагітності
- При керуванні автомобілем
- Спосіб застосування та дози
- Діти
- Передозування
- Побічні реакції
- Термін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
- Виробник
- Місцезнаходження виробника
Увага! Срок дії реєстраційного посвідчення UA/17010/01/01 закінчився 31.10.2023
Репата інструкція із застосування
Офіційна інструкція лікарського засобу Репата розчин 140 мг/мл. Опис та застосування Repata, аналоги та відгуки. Інструкція Репата розчин затверджена виробником.
Склад
діюча речовина: еволокумаб;
Репата, 140 мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
1 попередньо наповнений шприц-ручка містить 140 мг еволокумабу в 1 мл розчину.
Репата — це моноклональне антитіло людини IgG2, що виробляється з використанням технології рекомбінантної ДНК у клітинах яєчника китайського хом’ячка (ЯКХ).
допоміжні речовини: пролін, оцтова кислота льодяна, полісорбат 80, натрію гідроксид (для регулювання pH), вода для ін’єкцій.
Лікарська форма
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозора або опалесцентна рідина, безбарвна або жовтуватого кольору, практично без часток.
Фармакотерапевтична група
Ліпідомодифікувальні засоби, прості. Інші ліпідомодифікувальні засоби.
Код АТХ C10AX13.
Фармакологічні властивості
Фармакодинаміка.
Механізм дії
Еволокумаб селективно зв’язується з пропротеїнконвертазою 9-го субтилізин-кексинового типу (PCSK9) та інгібує зв’язування циркулюючої PCSK9 з рецептором ліпопротеїну низької щільності (Р-ЛПНЩ) на поверхні клітин печінки, таким чином запобігаючи PCSK9-опосередкованому розпаду Р-ЛПНЩ. Підвищення рівнів Р-ЛПНЩ у печінці призводить до зниження сироваткової концентрації холестерину ліпопротеїнів низької щільності (ХС-ЛПНЩ).
Фармакодинамічні властивості.
У клінічних випробуваннях лікарський засіб Репата знижував концентрації незв’язаної PCSK9, ХС-ЛПНЩ, загального холестерину (ЗХ), аполіпопротеїну В (АпоВ), холестерину ліпопротеїнів невисокої щільності (ХС не-ЛПВЩ), ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, холестерину ліпопротеїнів дуже низької щільності (ХС-ЛПДНЩ), тригліцеридів (ТГ) та ліпопротеїну(а) [Лп(а)] та підвищував холестерин ліпопротеїдів високої щільності (ХС-ЛПНЩ) та АпоА1 у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією.
Однократне підшкірне застосування лікарського засобу Репата 140 мг або 420 мг призводив до максимальної супресії циркулюючої незв’язаної PCSK9 через 4 години, що супроводжувалося зниженням ХС-ЛПНЩ, що досягав середньої найнижчої межі до 14 та 21 дня відповідно. Зміни концентрації незв’язаної PCSK9 та сироваткових ліпопротеїнів були оборотними після відміни лікарського засобу Репата. Жодного збільшення концентрації незв’язаної PCSK9 та ХС-ЛПНЩ порівняно з початковим рівнем під час виведення еволокумабу не спостерігалося, що свідчить про те, що компенсаторні механізми для підвищення продукування PCSK9 та ХС-ЛПНЩ під час лікування не з’являються.
Режими підшкірного застосування 140 мг кожні 2 тижні та 420 мг один раз на місяць були еквівалентними за середнім зниженням ХС-ЛПНЩ (середнє значення на тижнях 10 та 12), що призводило до зниження від -72 до -57% від початкового рівня порівняно з плацебо. Лікування за допомогою лікарського засобу Репата призвело до подібного зниження ХС-ЛПНЩ при застосуванні у вигляді монотерапії або в комбінації з іншою гіполіпідемічною терапією.
Клінічна ефективність при первинній гіперхолестеринемії та змішаній дисліпідемії
Зниження рівня ХС-ЛПНЩ приблизно від 55% до 75% за допомогою лікарського засобу Репата досягалося вже на тижні 1 та підтримувалося протягом тривалої терапії. Загалом максимальна відповідь досягалася протягом 1—2 тижнів після введення дози 140 мг кожні 2 тижні та 420 мг 1 раз на місяць. Лікарський засіб Репата був ефективним в усіх підгрупах порівняно з плацебо та езетимібом, при цьому між підгрупами суттєвих відмінностей, пов’язаних, наприклад, з віком, расою, статтю, регіоном, індексом маси тіла, ризиком за Національною освітньою програмою з холестерину, палінням, фактором ризику ішемічної хвороби серця (ІХС) на початковому етапі, сімейним анамнезом ранньої ІХС, статусом толерантності до глюкози (наприклад, цукровий діабет 2 типу, метаболічний синдром або ні те, ні інше), артеріальною гіпертензією, дозою статину та інтенсивністю, початковою незв’язаною PCSK9, початковим рівнем ХС-ЛПНЩ та початковим рівнем ТГ, не постерігалося.
У 80—85% всіх пацієнтів з первинною гіперхолестеринемією, що приймали одну з доз, лікарський засіб Репата демонстрував зниження на ≥ 50% рівня ХС-ЛПНЩ у середньому на тижнях 10 та 12. До 99% пацієнтів, що приймали одну з доз лікарського засобу Репата, досягали концентрації ХС-ЛПНЩ < 2,6 ммоль/л, а до 95% — досягали рівня ХС-ЛПНЩ < 1,8 ммоль/л в середньому на тижнях 10 та 12.
Комбінація зі статином і статином з іншими гіполіпідемічними препаратами
LAPLACE-2 — міжнародне багатоцентрове подвійно сліпе рандомізоване 12-тижневе дослідження за участю 1 896 пацієнтів з первинною гіперхолестеринемією або змішаною дисліпідемією, яких у довільному порядку було розподілено між групами прийому лікарського засобу Репата у комбінації зі статинами (розувастатин, симвастатин або аторвaстатин). Лікарський засіб Репата порівнювали з плацебо у групах прийому розувастатину та симвастатину і з плацебо та езетимібом у групі прийому аторвaстатину.
Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо у групах прийому розувастатину та симвастатину та порівняно з плацебо та езетимібом у групі аторвaстатину (p < 0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, рівні ТГ та Лп(а), підвищував рівень ХС-ЛПВЩ від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо у групах прийому розувастатину та симвастатину (p < 0,05) і суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1 та Лп(а), порівняно з плацебо та езетимібом у групі аторвaстатину (p < 0,001) (див. таблиці 1 та 2).
RUTHERFORD-2 — міжнародне багатоцентрове подвійно сліпе рандомізоване плацебо-контрольоване 12-тижневе дослідження за участю 329 пацієнтів з гетерозиготною сімейною гіперхолестеринемією, що проходили гіполіпідемічну терапію. Лікарський засіб Репата суттєво знижував рівні ХС-ЛПНЩ від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо (p < 0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, ТГ та Лп(а) і підвищував рівні ХС-ЛПВЩ та АпоА1 від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо (p < 0,05) (див. таблицю 1).
Таблиця 1. Ефекти від лікування лікарським засобом Репата порівняно з плацебо у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією — середнє значення процентної зміни від початкового рівня до середнього значення на тижнях 10 та 12 (%, 95% Довірчий інтервал (ДІ))
Дослідження | Режим засто-сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | АпоА1 (%) | Співвід- ношення ЗХ/ХС- ЛПВЩ % | Співвід- ношення АпоВ/ АпоА1 % |
LAPLACE-2 (HMD) (комбіновані групи прийому розувастатину, симвастатину та аторвастатину) | 140 мг Q2W (N = 555) | -72b (-75, -69) | -60b (-63, -58) | -56b (-58, -53) | -41b (-43, -39) | -30b (-35, -25) | -18b (-23, -14) | 6b (4, 8) | -17b (-22, -13) | 3b (1, 5) | -45b (-47, -42) | -56b (-59, -53) |
420 мг QM (N = 562) | -69b (-73, -65) | -60b (-63, -57) | -56b (-58, -53) | -40b (-42, -37) | -27b (-31, -24) | -22b (-28, -17) | 8b (6, 10) | -23b (-28, -17) | 5b (3, 7) | -46b (-48, -43) | -58b (-60, -55) | |
RUTHERFORD-2 (HeFH) | 140 мг Q2W (N = 110) | -61b (-67, -55) | -56b (-61, -51) | -49b (-54, -44) | -42b (-46, -38) | -31b (-38, -24) | -22b (-29, -16) | 8b (4, 12) | -22b (-29, -15) | 7a (3, 12) | -47b (-51, -42) | -53 (-58, -48) |
420 мг QM (N = 110) | -66b (-72, -61) | -60b (-65, -55) | -55b (-60, -50) | -44b (-48, -40) | -31b (-38, -24) | -16b (-23, -8) | 9b (5, 14) | -17b (-24, -9) | 5a (1, 9) | -49b (-54, -44) | -56b (-61, -50) |
Умовні позначення:
Q2W = 1 раз кожні 2 тижні
QM = 1 раз на місяць
HMD = первинна гіперхолестеринемія та змішана дисліпідемія
HeFH = гетерозиготна сімейна гіперхолестеринемія
а значення р < 0,05 порівняно з плацебо
b значення р < 0,001 порівняно з плацебо
Пацієнти з непереносимістю статинів
GAUSS-2 — міжнародне багатоцентрове подвійне сліпе рандомізоване езетиміб-контрольоване 12-тижневе дослідження за участю 307 пацієнтів, які мали непереносимість статинів або не могли переносити ефективну дозу статину. Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ порівняно з езетимібом (p < 0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1 та Лп(а) від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з езетимібом (p < 0,001) (див. таблицю 2).
Лікування за відсутності статину
MENDEL-2 — міжнародне багатоцентрове подвійно сліпе рандомізоване плацебо- та езетиміб-контрольоване 12-тижневе дослідження лікарського засобу Репата за участю 614 пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією. Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо та езетимібом (p < 0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1 та Лп(а) від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо та езетимібом (p < 0,001) (див. таблицю 2).
Таблиця 2. Ефекти від лікування лікарським засобом Репата порівняно з езетимібом у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією — середнє значення процентної зміни від початкового рівня до середнього значення на тижнях 10 та 12 (%, 95% ДІ)
Дослідження | Режим засто-сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | АпоА1 (%) | Співвід- ношення ЗХ/ХС- ЛПВЩ % | Співвід- ношення АпоВ/ АпоА1 % |
LAPLACE-2 (HMD) (комбіновані групи прийому аторвастатину) | 140 мг Q2W (N = 219) | -43с (-50, -37) | -34с (-39, -30) | -34с (-38, -30) | -23с (-26, -19) | -30с (-35, -25) | -1 (-7, 5) | 7с (4, 10) | -2 (-9, 5) | 7с (4, 9) | -27с (-30, -23) | -38с (-42, -34) |
420 мг QM (N = 220) | -46с (-51, -40) | -39с (-43, -34) | -40с (-44, -36) | -25с (-29, -22) | -33с (-41, -26) | -7 (-20, 6) | 8с (5, 12) | -8 (-21, 5) | 7с (2, 11) | -30с (-34, -26) | -42с (-47, -38) | |
GAUSS-2 (непереносимість статинів) | 140 мг Q2W (N = 103) | -38b (-44, -33) | -32b (-36, -27) | -32b (-37, -27) | -24b (-28, -20) | -24b (-31, -17) | -2 (-10, 7) | 5 (1, 10) | -3 (-11, 6) | 5a (2, 9) | -27b (-32, -23) | -35b (-40, -30) |
420 мг QM (N = 102) | -39b (-44, -35) | -35b (-39, -31) | -35b (-40, -30) | -26b (-30, -23) | -25b (-34, -17) | -4 (-13, 6) | 6 (1, 10) | -6 (-17, 4) | 3 (-1, 7) | -30b (-35, -25) | -36b (-42, -31) | |
MENDEL-2 (лікування за відсутності статину) | 140 мг Q2W (N = 153) | -40b (-44, -37) | -36b (-39, -32) | -34b (-37, -30) | -25b (-28, -22) | -22b (-29, -16) | -7 (-14, 1) | 6а (3, 9) | -9 (-16, -1) | 3 (0, 6) | -29b (-32, -26) | -35b (-39, -31) |
420 мг QM (N = 153) | -41b (-44, -37) | -35b (-38, -33) | -35b (-38, -31) | -25b (-28, -23) | -20b (-27, -13) | -10 (-19, -1) | 4 (1, 7) | -9 (-18, 0) | 4a (1, 7) | -28b (-31, -24) | -37b (-41, -32) |
Умовні позначення:
Q2W = 1 раз кожні 2 тижні
QM = 1 раз на місяць
HMD = первинна гіперхолестеринемія та змішана дисліпідемія
а значення р < 0,05 порівняно з езетимібом
b значення р < 0,001 порівняно з езетимібом
с номінальне значення р < 0,001 порівняно з езетимібом
Тривала ефективність при первинній гіперхолестеринемії та змішаній дисліпідемії
DESCARTES — міжнародне багатоцентрове подвійно сліпе рандомізоване плацебо-контрольоване 52-тижневе дослідження за участю 901 пацієнта з гіперліпідемією, які застосовували лише дієту, аторвaстатин або комбінацію аторвaстатину та езетимібу. Лікарський засіб Репата у дозі 420 мг 1 раз на місяць суттєво знижував рівень ХС-ЛПНЩ від початкового значення на тижні 52 порівняно з плацебо (p < 0,001). Ефекти від лікування підтримувалися протягом 1 року, що демонструвалося зниженням рівня ХС-ЛПНЩ з тижня 12 до тижня 52. Зниження рівня ХС-ЛПНЩ від початкового значення на тижні 52 порівняно з плацебо узгоджувалося протягом фонової гіполіпідемічної терапії, оптимізованої щодо ХС-ЛПНЩ та серцево-судинного ризику.
Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, ТГ та Лп(а) і підвищував рівні ХС-ЛПВЩ та АпоА1 на тижні 52 порівняно з плацебо (p < 0,001) (див. таблицю 3).
Таблиця 3. Ефекти від лікування лікарським засобом Репата порівняно з плацебо у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією — середнє значення процентної зміни від початкового рівня до тижня 52 (%, 95% ДІ)
Дослідження | Режим засто- сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | АпоА1 (%) | Співвід ношення ЗХ/ХС- ЛПВЩ % | Співвід ношення АпоВ/ АпоА1 % |
DESCARTES | 420 мг QM (N = 599) | -59b (-64, -55) | -50b (-54, -46) | -44b (-48, -41) | -33b (-36, -31) | -22b (-26, -19) | -29b (-40, -18) | 5b (3, 8) | -12b (-17, -6) | 3a (1, 5) | -37b (-40, -34) | -46b (-50, -43) |
Умовні позначення:
QM = 1 раз на місяць
а номінальне значення р < 0,001 порівняно з плацебо
b значення р < 0,001 порівняно з плацебо
OSLER та OSLER-2 були два рандомізованих контрольованих відкритих розширених дослідження з оцінки безпеки та ефективності лікарського засобу Репата за участю пацієнтів, які завершили лікування в початковому дослідженні. У кожному розширеному дослідженні пацієнтів було у довільному порядку розподілено у співвідношенні 2:1 у групи прийому лікарського засобу Репата + стандартне лікування (група прийому еволокумабу) або лише стандартного лікування (контрольна група) протягом першого року дослідження. Наприкінці першого року (тиждень 52 у дослідженні OSLER та тиждень 48 у дослідженні OSLER-2) пацієнти продовжили участь у лікуванні лікарським засобом Репата, коли всі пацієнти отримували незамаскований лікарський засіб Репата протягом ще 4 років (OSLER) або 2 років (OSLER-2).
Усього в дослідження OSLER було включено 1 324 пацієнти. Лікарський засіб Репата у дозі 420 мг 1 раз на місяць суттєво знижував рівень ХС-ЛПНЩ від початкового значення на тижні 12 та тижні 52 порівняно з контролем (номінальне значення p < 0,001). Ефекти від лікування підтримувалися протягом 272 тижнів, що демонструвалося зниженням рівня ХС-ЛПНЩ з тижня 12 у початковому дослідженні до тижня 260 у відкритому розширеному дослідженні. Усього в дослідження OSLER-2 було включено 3 681 пацієнт. Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ від початкового рівня на тижні 12 та тижні 48 порівняно з контролем (номінальне значення p < 0,001). Ефекти від лікування підтримувалися, що демонструвалося зниженням рівня ХС-ЛПНЩ з тижня 12 до тижня 104 у відкритому розширеному дослідженні. Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, ТГ та Лп(а) та підвищував рівні ХС-ЛПВЩ та АпоА1 від початкового значення до тижня 52 у дослідженні OSLER та до тижня 48 у дослідженні OSLER-2 порівняно з контролем (номінальне значення p < 0,001). Рівень ХС-ЛПНЩ та інші параметри ліпідів поверталися до початкових значень протягом 12 тижнів після припинення прийому лікарського засобу Репата на початку дослідження OSLER або OSLER-2 без прояву синдрому «рикошету».
TAUSSIG було поточним багатоцентровим відкритим 5-річним розширеним дослідженням з оцінки тривалої безпеки та ефективності лікарського засобу Репата як додаткової терапії до інших гіполіпідемічних препаратів за участю пацієнтів з тяжкою сімейною гіперхолестеринемією (СГ), включаючи гомозиготну сімейну гіперхолестеринемію. Усього в дослідження TAUSSIG було включено 194 пацієнти з тяжкою сімейною гіперхолестеринемією (не-ГоСГ) та 106 пацієнтів з гомозиготною сімейною гіперхолестеринемією. Усіх пацієнтів у дослідженні спочатку лікували лікарським засобом Репата у дозі 420 мг 1 раз на місяць, за винятком пацієнтів, які отримували аферез на момент включення і почали лікування лікарським засобом Репата у дозі 420 мг 1 раз кожні 2 тижні. Частоту прийому лікарського засобу у пацієнтів, що не отримували ліпідний аферез, можна було збільшити до 420 мг 1 раз кожні 2 тижні на підставі відповіді рівнів ХС-ЛПНЩ та PCSK9. Тривале застосування лікарського засобу Репата демонструвало стабільний ефект від лікування, що підтверджувалося зниженням рівня ХС-ЛПНЩ у пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ) (див. таблицю 4).
Зміни в інших параметрах ліпідів (ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ та АпоВ/АпоА1) також демонстрували стабільний ефект від тривалого прийому лікарського засобу Репата у пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ).
Таблиця 4. Ефект лікарського засобу Репата на ХС-ЛПНЩ у пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ) — медіанне значення процентної зміни від початкового рівня до тижня 216 ВРД (та асоційовані 95% ДІ)
Популяція пацієнтів (N) | Тиждень 12 ВРД (n = 191) | Тиждень 24 ВРД (n = 191) | Тиждень 36 ВРД (n = 187) | Тиждень 48 ВРД (n = 187) | Тиждень 96 ВРД (n = 180) | Тиждень 144 ВРД (n = 180) | Тиждень 192 ВРД (n = 147) | Тиждень 216 ВРД (n = 96) |
Тяжка СГ (не‑ГоСГ) (N = 194) | -54.9 (-57.4, -52.4) | -54.1 (-57.0, -51.3) | -54.7 (-57.4, -52.0) | -56.9 (-59.7, -54.1) | -53.3 (-56.9, -49.7) | -53.5 (-56.7, -50.2) | -48.3 (-52.9, -43.7) | -47.2 (-52.8, -41.5) |
Умовні позначення:
ВРД = відкрите розширене дослідження
СГ = сімейна гіперхолестеринемія
N (n) = кількість пацієнтів, що піддаються оцінці (N), та пацієнтів зі значеннями ЛПНЩ, що спостерігалися під час спеціального запланованого візиту (n) у проміжній аналізованій вибірці пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ).
Тривала безпека стабільних дуже низьких рівнів ХС-ЛПНЩ (а саме: < 0,65 ммоль/л [< 25 мг/дл]) ще не було встановлено. Наявні дані демонструють, що немає клінічно значимої різниці між профілями безпеки у пацієнтів з рівнями ХС-ЛПНЩ < 0,65 ммоль/л та пацієнтів з вищими рівнями ХС-ЛПНЩ (див. розділ «Побічні реакції»).
Лікування гомозиготної сімейної гіперхолестеринемії
TESLA було міжнародним багатоцентровим подвійно сліпим рандомізованим плацебо-контрольованим 12-тижневим дослідженням за участю 49 пацієнтів з гомозиготною сімейною гіперхолестеринемією віком від 12 до 65 років. Лікарський засіб Репата у дозі 420 мг 1 раз на місяць, як допоміжна терапія до інших гіполіпідемічних терапій (наприклад, статини, секвестранти жовчних кислот), суттєво знижував рівні ХС-ЛПНЩ та АпоВ на тижні 12 порівняно з плацебо (p < 0,001) (див. таблицю 5). Зміни в інших параметрах ліпідів (ЗХ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ та АпоВ/АпоА1) також демонстрували ефект від лікування лікарським засобом Репата у пацієнтів з гомозиготною сімейною гіперхолестеринемією.
Таблиця 5. Ефекти від лікування лікарським засобом Репата порівняно з плацебо у пацієнтів з гомозиготною сімейною гіперхолестеринемією — середнє значення процентної зміни від початкового рівня до тижня 12 (%, 95% ДІ)
Дослідження | Режим засто- сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | Співвід ношення ЗХ/ХС- ЛПВЩ % | Співвід ношення АпоВ/ АпоА1 % |
TESLA (ГоСГ) | 420 мг QM (N = 33) | -32b (-45, -19) | -30a (-42, -18) | -23b (-35, -11) | -27a (-38, -16) | -12 (-25, 2) | -44 (-128, 40) | -0,1 (-9, 9) | 0,3 (-15, 16) | -26a (-38, -14) | -28а (-39, -17) |
Умовні позначення:
ГоСГ = гомозиготна сімейна гіперхолестеринемія
QM = 1 раз на місяць
а номінальне значення р < 0,001 порівняно з плацебо
b значення р < 0,001 порівняно з плацебо.
Тривала ефективність при гомозиготній сімейній гіперхолестеринемії
У дослідженні TAUSSIG тривале застосування лікарського засобу Репата продемонструвало стабільний ефект лікування, що підтверджувався зниженням рівня ХС-ЛПНЩ приблизно від 20% до 30% у пацієнтів з гомозиготною сімейною гіперхолестеринемією, що не отримували аферез, та приблизно від 10% до 30% у пацієнтів з гомозиготною сімейною гіперхолестеринемією, що отримували аферез (див. таблицю 6). Зміни в інших параметрах ліпідів (ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ та АпоВ/АпоА1) також демонстрували стабільний ефект тривалого прийому лікарського засобу Репата у пацієнтів з гомозиготною сімейною гіперхолестеринемією. Зниження в рівні ХС-ЛПНЩ та зміни в інших параметрах ліпідів у 14 пацієнтів-підлітків (віком ≥ 12 і < 18 років) з гомозиготною сімейною гіперхолестеринемією були порівнянними зі значеннями в загальній популяції пацієнтів з гомозиготною сімейною гіперхолестеринемією.
Таблиця 6. Ефект лікарського засобу Репата на ХС-ЛПНЩ у пацієнтів з гомозиготною сімейною гіперхолестеринемією — середнє значення процентної зміни від початкового рівня до тижня 216 ВРД (та асоційовані 95% ДІ)
Популяція пацієнтів (N) | Тиждень 12 ВРД | Тиждень 24 ВРД | Тиждень 36 ВРД | Тиждень 48 ВРД | Тиждень 96 ВРД | Тиждень 144 ВРД | Тиждень 192 ВРД | Тиждень 216 ВРД |
ГоСГ (N = 106) | -21.2 (-26.0, -16.3) (n = 104) | -21.4 (-27.8, -15.0) (n = 99) | -27.0 (-32.1, -21.9) (n = 94) | -24.8 (-31.4, -18.3) (n = 93) | -25.0 (-31.2, -18.8) (n = 82) | -27.7 (-34.9, -20.5) (n = 79) | -27.4 (-36.9, -17.8) (n = 74) | -24.0 (-34.0, -14.0) (n = 68) |
Не отримували аферез (N = 72) | -22.7 (-28.1, -17.2) (n = 70) | -25.8 (-33.1, -18.5) (n = 69) | -30.5 (-36.4, -24.7) (n = 65) | -27.6 (-35.8, -19.4) (n = 64) | -23.5 (-31.0, -16.0) (n = 62) | -27.1 (-35.9, -18.3) (n = 60) | -30.1 (-37.9, -22.2) (n = 55) | -23.4 (-32.5, -14.2) (n = 50) |
Отримували аферез (N = 34) | -18.1 (-28.1, -8.1) (n = 34) | -11.2 (-24.0, 1.7) (n = 30) | -19.1 (-28.9, -9.3) (n = 29) | -18.7 (-29.5, -7.9) (n = 29) | -29.7 (-40.6, -18.8) (n = 20) | -29.6 (-42.1, -17.1) (n = 19) | -19.6 (-51.2, 12.1) (n = 19) | -25.9 (-56.4, 4.6) (n = 18) |
Умовні позначення:
ВРД = відкрите розширене дослідження
N (n) = кількість пацієнтів, що піддаються оцінці (N), та пацієнтів зі значеннями ЛПНЩ, що спостерігалися під час спеціального запланованого візиту (n) у фінальній аналізованій вибірці пацієнтів з гомозиготною сімейною гіперхолестеринемією (ГоСГ).
Вплив на атеросклероз
Вплив лікарського засобу Репата у дозі 420 мг 1 раз на місяць на перебіг атеросклерозу, що вимірюється внутрішньосудинним ультразвуковим дослідженням (ВСУЗД (IVUS)), оцінювали у межах 78-тижневого подвійно сліпого рандомізованого плацебо-контрольованого дослідження за участю 968 пацієнтів з ішемічною хворобою серця на фоні оптимальної терапії статином у стабільній дозі. Лікарський засіб Репата зменшив як відносний об’єм атероми (ВОА (PAV); 1,01% [95% ДІ 0,64, 1,38], p < 0,0001), так і загальний об’єм атероми (ЗОА (TAV); 4,89 мм3 [95% ДІ 2,53, 7,25], p < 0,0001) у порівнянні з плацебо. При вимірюванні ВОА атеросклеротична регресія спостерігалася у 64,3% (95% ДІ 59,6, 68,7) та 47,3% (95% ДІ 42,6, 52,0) пацієнтів, які отримували лікарський засіб Репата або плацебо відповідно При вимірюванні ЗОА атеросклеротична регресія спостерігалася у 61,5% (95% ДІ 56,7, 66,0) та 48,9% (95% ДІ 44,2, 53,7) пацієнтів, які отримували лікарський засіб Репата або плацебо відповідно. У дослідженні не вивчали взаємозв’язок між регресією атеросклеротичних бляшок та явищами з боку серцево-судинної системи.
Зниження серцево-судинного ризику у дорослих зі встановленим атеросклерозом серцево-судинної системи
Дослідження результатів застосування лікарського засобу Репата «Repatha Outcomes Study (FOURIER)» було рандомізованим подвійно сліпим дослідженням типу «випадок-контроль» за участю 27 564 суб’єктів, віком від 40 до 86 років (середній вік 62,5 років) зі встановленим атеросклерозом серцево-судинної системи; 81% мали попередній епізод інфаркту міокарда (ІМ), 19% — епізод інсульту, 13% — епізод захворювання периферичних артерій. Понад 99% пацієнтів отримували середньо- та високоінтенсивну терапію статинами та принаймні один інший серцево-судинний лікарський засіб, наприклад, антитромбоцитарні засоби, бета-блокатори, інгібітори АПФ або блокатори рецепторів ангіотензину; медіана рівня холестерину ЛПНЩ (1-й квартал, 3-й квартал) на вихідному рівні становила 2,4 ммоль/л (2,1, 2,8). Абсолютний серцево-судинний (СС) ризик був збалансований між групами лікування, на додачу до індексної події всі пацієнти мали щонайменше 1 значущий або 2 незначущих фактори СС ризику; 80% мали гіпертонічну хворобу, 36% мали цукровий діабет, 28% палили щоденно. Пацієнти були рандомізовані у співвідношенні 1:1 до групи терапії лікарським засобом Репата (140 мг кожні 2 тижні або 420 мг 1 раз на місяць) або у групу відповідного плацебо; середня тривалість подальшого спостереження за пацієнтом становила 26 місяців.
Значне зниження рівня холестерину ЛПНЩ спостерігалось протягом усього дослідження, при цьому досягався медіанний діапазон рівня холестерину ЛПНЩ від 0,8 до 0,9 ммоль/л при кожній оцінці; 25% пацієнтів досягли концентрації холестерину ЛПНЩ менше 0,5 ммоль/л. Незважаючи на досягнення дуже низького рівня холестерину ЛПНЩ, нових проблем безпеки не спостерігалося (див. розділ «Побічні реакції»); частота випадків вперше виявленого цукрового діабету та когнітивних подій була порівнянна у пацієнтів, які досягли рівнів холестерину ЛПНЩ < 0,65 ммоль/л, та у пацієнтів з більш високим рівнем холестерину ЛПНЩ.
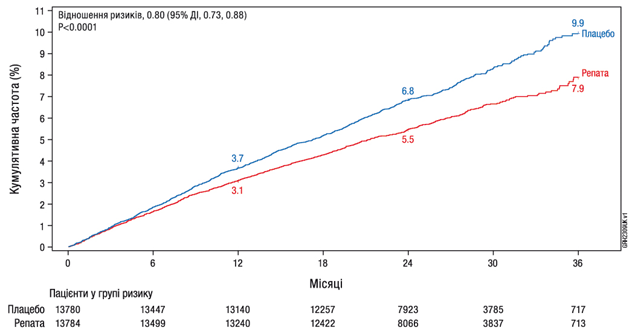
Лікарський засіб Репата значно знизив ризик явищ з боку серцево-судинної системи, визначених як композитна кінцева точка, що включає час до першої смерті через СС патологію, ІМ, інсульт, коронарну реваскуляризацію або госпіталізації з приводу нестабільної стенокардії (див. таблицю 7); криві Каплана-Мейєра для первинної та ключової вторинної композитних кінцевих точок, між якими було приблизно 5 місяців (трирічну криву Каплана-Мейєра для значного небажаного серцево-судинного явища (ЗНССЯ (MACE)) наведено на рисунку 1). Відносний ризик композитної кінцевої точки ЗНССЯ (смерть через СС патологію, ІМ або інсульт) був значно знижений на 20%. Ефект лікування був послідовним у всіх підгрупах (включаючи вік, тип захворювання, вихідний рівень холестерину ЛПНЩ, рівень інтенсивності терапії статинами, застосування езетимібу та наявність цукрового діабету) і був зумовлений зменшенням ризику інфаркту міокарда, інсульту та коронарної реваскуляризації; не спостерігалося значущої різниці щодо смертності через СС патологію та з усіх причин, однак дизайн дослідження не передбачав виявлення такої різниці.
Таблиця 7. Ефект лікарського засобу Репата на значущі явища з боку серцево-судинної системи
Значущі явища | Плацебо (N = 13 780) n (%) | Репата (N = 13 784) n (%) | Відношення ризиків a (95% ДІ) | p-значення b | |||||
ЗНССЯ+ (композитна ЗНССЯ, коронарної реваскуляризації або госпіталізації з приводу нестабільної стенокардії) | 1 563 (11,34) | 1 344 (9,75) | 0,85 (0,79, 0,92) | < 0,0001 | |||||
ЗНССЯ (композитна смерті через СС патологію, ІМ або інсульт) | 1 013 (7,35) | 816 (5,92) | 0,80 (0,73, 0,88) | < 0,0001 | |||||
Смерть через серцево-судинну патологію | 240 (1,74) | 251 (1,82) | 1,05 (0,88, 1,25) | 0,62 | |||||
Смертність з усіх причин | 426 (3,09) | 444 (3,22) | 1,04 (0,91, 1,19) | 0,54 | |||||
Інфаркт міокарда (смертельний/несмертельний) | 639 (4,64) | 468 (3,40) | 0,73 (0,65, 0,82) | < 0,0001c | |||||
Інсульт (смертельний/несмертельний) d | 262 (1,90) | 207 (1,50) | 0,79 (0,66, 0,95) | 0,0101c | |||||
Коронарна реваскуляризація | 965 (7,00) | 759 (5,51) | 0,78 (0,71, 0,86) | < 0,0001c | |||||
Госпіталізація з приводу нестабільної стенокардії e | 239 (1,7) | 236 (1,7) | 0,99 (0,82, 1,18) | 0,89 | |||||
a На основі моделі Кокса, стратифікованої за факторами стратифікації рандомізації, зібраними за допомогою Системи інтерактивної голосової відповіді (IVRS).
b Двобічний лог-ранговий критерій стратифікований за факторами стратифікації рандомізації, зібраними за допомогою Системи інтерактивної голосової відповіді (IVRS).
c Номінальна значущість.
d Вплив лікування на інсульт був зумовлений зменшенням ризику ішемічного інсульту; не було відмічено впливу на геморагічний або невизначений інсульт.
e Оцінка часу до госпіталізації при нестабільній стенокардії була ситуативною.
Рис. 1. Час до явища ЗНССЯ (композитна смерті через СС патологію, ІМ або інсульт); 3‑річний розрахунок за методом Каплана-Мейєра
Діти
Європейське агентство лікарських засобів відмовилося від права вимагати виконання зобов’язання подавати результати досліджень з лікарським засобом Репата в усіх субпопуляціях дітей для лікування змішаної дисліпідемії.
Європейське агентство лікарських засобів відстрочило зобов’язання подавати результати досліджень з лікарським засобом Репата в одній або більше субпопуляції дітей для лікування підвищеного рівня холестерину.
Наявні дані щодо застосування лікарського засобу Репата дітям обмежені. 14 пацієнтів-підлітків віком ≥ 12 і < 18 років з гомозиготною сімейною гіперхолестеринемією було включено в клінічні дослідження. Жодної загальної різниці у безпеці або ефективності між пацієнтами-підлітками та дорослими з гомозиготною сімейною гіперхолестеринемією не спостерігалося.
Інформація про застосування дітям наведена в розділі «Спосіб застосування та дози».
Фармакокінетика.
Абсорбція та розподіл
Після однократного підшкірного введення 140 мг або 420 мг лікарського засобу Репата здоровим дорослим медіанні пікові концентрації в сироватці досягалися через 3—4 дні. Застосування однократної підшкірної дози 140 мг спричиняло середнє значення (СКВ) Cmax 13,0 (10,4) мкг/мл і середнє значення (СКВ) AUClast 96,5 (78,7) добу•мкг/мл. Застосування однократної підшкірної дози 420 мг спричиняло середнє значення (СКВ) Cmax 46,0 (17,2) мкг/мл і середнє значення (СКВ) AUClast 842 (333) добу•мкг/мл. 3 підшкірні дози 140 мг були біоеквівалентними 1 підшкірній дозі 420 мг. Абсолютна біодоступність після підшкірного введення дози становила 72% від фармакокінетичних (ФК) моделей.
Після однократної внутрішньовенної дози 420 мг лікарського засобу Репата середній (СКВ) обсяг розподілу в рівноважному стані становив 3,3 (0,5) л, що свідчило про те, що еволокумаб має обмежений розподіл у тканинах.
Біотрансформація
Лікарський засіб Репата складається лише з амінокислот та вуглеводів, як природний імуноглобулін, та навряд чи буде виводитися через метаболічні механізми печінки. Очікується, що його метаболізм та виведення будуть здійснюватися шляхом розкладання на невеликі пептиди та окремі амінокислоти.
Виведення
Вважається, що еволокумаб має ефективний період напіввиведення від 11 до 17 днів.
У пацієнтів з первинною гіперхолестеринемією або змішаною дисліпідемією, що приймають високу дозу статину, системний вплив еволокумабу був трохи нижчим, ніж у пацієнтів, що приймали низьку або середню дозу статину (співвідношення AUClast 0,74 [90% ДІ 0,29; 1,9]). Підвищення приблизно на 20% кліренсу частково опосередковане статинами, що збільшувало концентрацію PCSK9, але не впливало негативно на фармакодинамічний ефект еволокумабу на ліпіди. Фармакокінетичний аналіз популяції не вказував на суттєву різницю в сироваткових концентраціях еволокумабу у пацієнтів з гіперхолестеринемією (несімейною гіперхолестеринемією або сімейною гіперхолестеринемією), що одночасно приймали статини.
Лінійність/нелінійність
Після однократної внутрішньовенної дози 420 мг середній (СКВ) системний кліренс становив 12 (2) мл/год. У клінічних дослідженнях з багатократним підшкірним введенням дози протягом 12 тижнів дозопропорційне збільшення експозиції спостерігалися при застосуванні дози 140 мг і більше. Приблизно 2—3-кратна кумуляція спостерігалася при мінімальних сироваткових концентраціях [Cmin (СКВ) 7,21 (6,6)] після введення дози 140 мг кожні 2 тижні або після введення дози 420 мг 1 раз на місяць [Cmin (СКВ) 11,2 (10,8)], сироваткові мінімальні концентрації наближалися до рівноважного стану через 12 тижнів після введення дози.
Часозалежні зміни не спостерігалися у сироваткових концентраціях протягом періоду 124 тижні.
Порушення функції нирок
Для пацієнтів з порушенням функції нирок коригування дози не потрібне. Дані з клінічних досліджень лікарського засобу Репата не виявив різниці у фармакокінетиці еволокумабу у пацієнтів з порушенням функції нирок легкого або середнього ступеня порівняно з пацієнтами, які не мають порушення функції нирок.
У клінічному дослідженні за участю 18 пацієнтів з нормальною функцією нирок (розрахункова швидкість клубочкової фільтрації [eGFR] ≥ 90 мл/хв/1,73 м2, n = 6), або тяжким порушенням функції нирок (eGFR від 15 до 29 мл/хв/1,73 м2, n = 6), або захворюванням ниркової хвороби кінцевої стадії (ЗНХ), що отримували гемодіаліз (n = 6), вплив незв’язаного еволокумабу за оцінкою Cmax після одноразової підшкірної дози 140 мг зменшився на 30% у пацієнтів із тяжким порушенням функції нирок та на 45% у пацієнтів із ЗНХ, які отримували гемодіаліз. Експозиція, за оцінкою AUClast, зменшилася приблизно на 24% у пацієнтів із вираженим порушенням функції нирок та приблизно на 45% у пацієнтів із ЗНХ, які отримували гемодіаліз. Точний механізм відмінностей РК невідомий; однак різниці у вазі тіла не змогли надати пояснення цим відмінностям. При інтерпретації результатів слід враховувати деякі фактори, включаючи невеликий розмір вибірки та велику мінливість між суб'єктами. Фармакодинаміка та безпека еволокумабу у пацієнтів із вираженим порушенням функції нирок та ЗНХ були схожими на ті, що були у пацієнтів із нормальною функцією нирок, та клінічно значущих відмінностей у зниженні рівня ХС-ЛПНЩ не було. Тому коригування дози не потрібне пацієнтам із тяжким порушенням функції нирок або ЗНХ, які отримують гемодіаліз.
Порушення функції печінки
У пацієнтів з порушенням функції печінки легкого ступеня (клас А за шкалою Чайлда — П’ю) коригування дози не потрібне. Однократні підшкірні дози 140 мг лікарського засобу Репата вивчали у 8 пацієнтів з порушенням функції печінки легкого ступеня, 8 пацієнтів з порушенням функції печінки середнього ступеня та 8 здорових учасників. Експозиція еволокумабу у пацієнтів з порушенням функції печінки була приблизно на 40—50% менше порівняно зі здоровими учасниками. Однак початкові рівні PCSK9 та ступінь і динаміка нейтралізації PCSK9 були подібними серед пацієнтів з порушенням функції печінки легкого або середнього ступеня та у здорових добровольців. Це обумовило подібну динаміку та ступінь абсолютного зниження рівня ХС-ЛПНЩ. Лікарський засіб Репата не вивчався у пацієнтів з порушенням функції печінки тяжкого ступеня (клас С за шкалою Чайлда — П’ю) (див. розділ «Особливості застосування»).
Маса тіла
Маса тіла була суттєвою коваріатою у ФК аналізі популяції, що впливала на мінімальні концентрації еволокумабу, однак впливу на зниження рівня ХС-ЛПНЩ не було. Після багатократного підшкірного введення 140 мг кожні 2 тижні мінімальні концентрації на 12 тижні були на 147% більші і на 70% нижче у пацієнтів вагою 69 кг та 93 кг відповідно, ніж у типового пацієнта вагою 81 кг. Менший вплив маси тіла спостерігався при багатократному підшкірному введенні місячних доз еволокумабу 420 мг.
Інші особливі групи пацієнтів
Фармакокінетичні аналізи популяції свідчать про те, що коригування дози за віком, расою або статтю не потрібні. На фармакокінетику еволокумабу впливала маса тіла без будь-якого суттєвого ефекту на зниження рівня ХС-ЛПНЩ. Тому коригування дози залежно від маси тіла не потрібне.
Клінічні характеристики
Репата Показання
Гіперхолестеринемія та змішана дисліпідемія
Лікарський засіб Репата показаний для дорослих з первинною гіперхолестеринемією (гетерозиготною сімейною та несімейною) або змішаною дисліпідемією як допоміжна терапія до дієти:
- у комбінації зі статином або статином та іншими гіполіпідемічними терапіями для пацієнтів, що не здатні досягти потрібних рівнів ХС-ЛПНЩ при максимальній переносимій дозі статину, або
- окремо або у комбінації з іншими гіполіпідемічними терапіями для пацієнтів, які мають непереносимість статинів або для яких статини протипоказані.
Гомозиготна сімейна гіперхолестеринемія
Лікарський засіб Репата показаний для дорослих та підлітків віком від 12 років з гомозиготною сімейною гіперхолестеринемією у комбінації з іншими гіполіпідемічними терапіями.
Встановлений атеросклероз серцево-судинної системи
Лікарський засіб Репата показаний дорослим зі встановленим атеросклерозом серцево-судинної системи (інфаркт міокарда, інсульт або захворювання периферичних артерій) для зменшення серцево-судинного ризику за рахунок зниження рівня холестерину ЛПНЩ, як доповнення до коригування інших факторів ризику:
- у поєднанні з максимально переносимою дозою статину з або без інших методів зниження рівнів ліпідів, або
- самостійно чи у поєднанні з іншими гіполіпідемічними видами терапії у пацієнтів з непереносимістю статинів або у пацієнтів, яким протипоказаний статин.
Результати дослідження щодо впливу на рівень холестерину ЛПНЩ, явища з боку серцево-судинної системи та досліджувані популяції наведено у розділі «Фармакодинаміка».
Протипоказання
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин, вказаних у розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Формальні дослідження взаємодії з іншими лікарськими засобами для лікарського засобу Репата не проводилися.
Фармакокінетичну взаємодію між статинами та еволокумабом оцінювали у клінічних дослідженнях лікарського засобу Репата. Підвищення кліренсу еволокумабу приблизно на 20% спостерігалося у пацієнтів, що одночасно приймали статини. Такий підвищений кліренс частково опосередкований статинами, які підвищують концентрацію пропротеїнконвертази 9-го субтилізин-кексинового типу (PCSK9), що негативно не впливало на фармакодинамічний ефект еволокумабу на ліпіди. Коригування дози статину при застосуванні у комбінації з лікарським засобом Репата не потрібне.
Жодні дослідження фармакокінетичної та фармакодинамічної взаємодії між лікарським засобом Репата та гіполіпідемічними лікарськими засобами, іншими, аніж статини та езетиміб, не проводилися.
Особливості застосування
Порушення функції печінки
У пацієнтів з порушенням функції печінки середнього ступеня спостерігалося зменшення загальної експозиції еволокумабу, що може зменшити ефект на зниження рівня ХС-ЛПНЩ. Тому для таких пацієнтів потрібен ретельний моніторинг.
Застосування лікарського засобу у пацієнтів з порушенням функції печінки тяжкого ступеня (клас С за шкалою Чайлда — П’ю) не досліджувалося (див. розділ «Фармакокінетика»). Лікарський засіб Репата слід з обережністю застосовувати пацієнтам з порушенням функції печінки тяжкого ступеня.
Сухий натуральний каучук
Репата, 140 мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
Ковпачок голки попередньо наповненого шприца-ручки виготовлено з сухого натурального каучуку (похідної латексу), який може викликати алергічні реакції.
Вміст натрію
Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на дозу, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю
Вагітність
Даних про застосування лікарського засобу Репата вагітним жінкам дуже мало.
Дослідження на тваринах не вказують на прямі або непрямі ефекти щодо репродуктивної токсичності.
Лікарський засіб Репата не слід застосовувати під час вагітності, якщо тільки клінічний стан жінки не вимагає лікування еволокумабом.
Годування груддю
Невідомо, чи виділяється еволокумаб з молоком людини.
Ризик для немовляти/дитини, яку годують груддю, виключити не можна.
Слід прийняти рішення щодо того, чи припинити годувати груддю, чи припинити/утриматися від терапії лікарським засобом Репата, беручи до уваги користь від годування груддю для дитини та користь від терапії для жінки.
Репродуктивна функція
Немає даних про ефект еволокумабу на репродуктивну функцію людини. Дослідження на тваринах не вказували на жодні ефекти на кінцеві точки фертильності на площі під кривою концентрація/час (AUC) при рівнях експозиції набагато більших, ніж у пацієнтів, що приймають еволокумаб у дозі 420 мг 1 раз на місяць.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Немає відомостей про випадки впливу лікарського засобу Репата на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Спосіб застосування Репата та дози
Підшкірне застосування.
Лікарський засіб Репата призначений для підшкірного введення в ділянку живота, стегна або верхньої частини руки. Місця введення слід чергувати; ін’єкції не слід робити в ділянки шкіри з больовими відчуттями, синцями, почервонінням або ущільненням. Лікарський засіб Репата не слід вводити внутрішньовенно або внутрішньом’язово.
Репата, 140 мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
Дозу 140 мг слід вводити, використовуючи 1 попередньо наповнений шприц-ручку. Дозу 420 мг слід вводити, використовуючи 3 попередньо наповнені шприци-ручки один за одним протягом 30 хвилин.
Лікарський засіб Репата призначений для самостійного введення пацієнтами після належного навчання. Лікарський засіб Репата може також вводитися іншою особою, що пройшла навчання з введення лікарського засобу.
Лікарський засіб призначений тільки для одноразового використання.
Див. також розділ «Особливі застереження щодо застосування та утилізації».
Дози.
Перед початком застосування лікарського засобу Репата слід виключити вторинні причини гіперліпідемії або змішаної дисліпідемії (наприклад, нефротичний синдром, гіпотиреоз).
Первинна гіперхолестеринемія та змішана дисліпідемія у дорослих
Рекомендована доза лікарського засобу Репата становить 140 мг кожні 2 тижні або 420 мг 1 раз на місяць; обидві дози є клінічно еквівалентними.
Гомозиготна сімейна гіперхолестеринемія у дорослих та підлітків віком від 12 років
Початкова рекомендована доза становить 420 мг 1 раз на місяць. Через 12 тижнів лікування частоту прийому лікарського засобу можна збільшити до 420 мг 1 раз кожні 2 тижні, якщо клінічно значимої відповіді досягнуто не було. Пацієнти, що отримують аферез, можуть починати лікування з 420 мг кожні 2 тижні, щоб лікування відповідало графіку аферезу.
Встановлений атеросклероз серцево-судинної системи
Рекомендована доза лікарського засобу Репата становить 140 мг кожні 2 тижні або 420 мг 1 раз на місяць; обидві дози є клінічно еквівалентними.
Пацієнти з порушенням функції нирок
Коригування дози у пацієнтів з порушенням функції нирок не потрібно.
Пацієнти з порушенням функції печінки
Коригування дози у пацієнтів з порушенням функції печінки легкого ступеня не потрібно, для пацієнтів з порушенням функції печінки середнього та тяжкого ступеня див. розділ «Особливості застосування».
Пацієнти літнього віку (віком ≥ 65 років)
Для пацієнтів літнього віку коригування дози не потрібне.
Діти.
Безпека та ефективність застосування лікарського засобу Репата дітям (віком до 18 років) за показанням первинна гіперхолестеринемія та змішана дисліпідемія не встановлювалися. Немає жодних даних. Безпека та ефективність застосування лікарського засобу Репата дітям віком до 12 років за показанням гомозиготна сімейна гіперхолестеринемія не встановлювалися. Немає жодних даних.
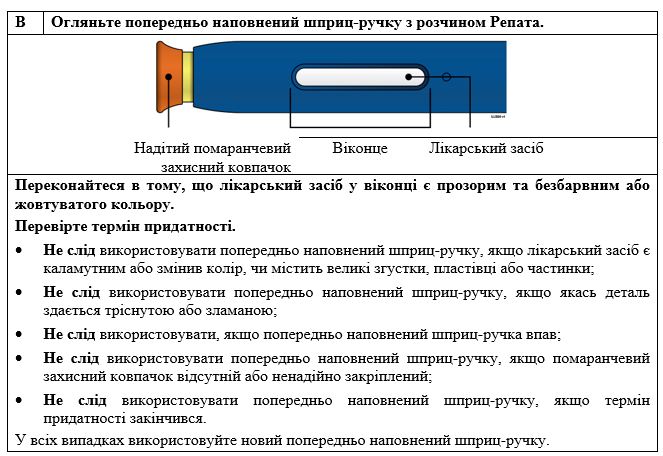
Особливі застереження щодо застосування та утилізації.
Перед застосування розчин слід оглянути. Не вводьте розчин, якщо він містить частинки або є мутним чи знебарвленим. Задля уникнення неприємних відчуттів у місці введення доведіть лікарський засіб до кімнатної температури (до 25 °C) перед введенням. Слід ввести весь вміст.
Невикористаний лікарський засіб або відходи слід утилізувати відповідно до місцевих вимог.
Введення лікарського засобу .
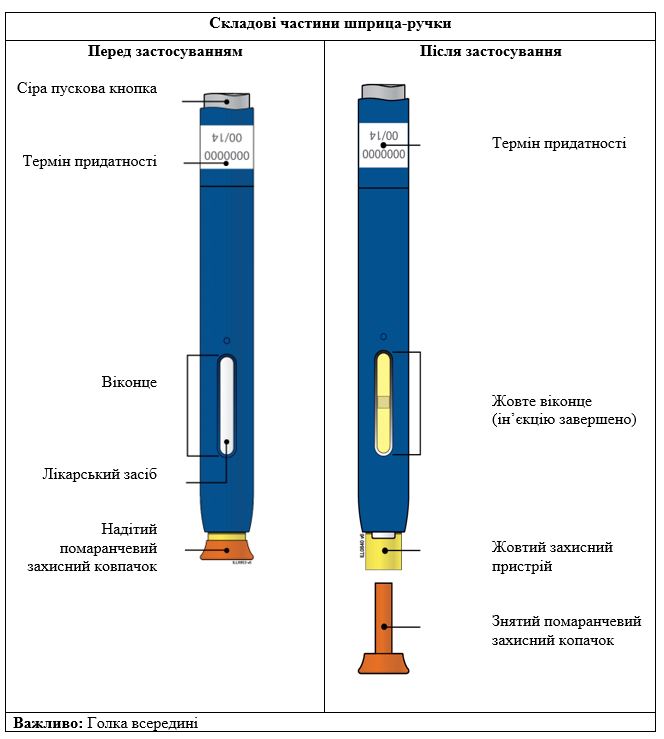
Репата, попередньо наповнений шприц-ручка одноразового використання SureClick
ВажливоПеред застосуванням розчину для ін’єкцій Репата в одноразовому попередньо наповненому шприці-ручці прочитайте цю важливу інформацію:
|
Етап 1. Підготовка | |
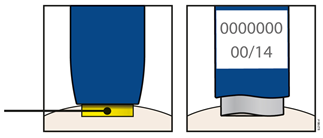
А | Вийміть один попередньо наповнений шприц-ручку з упаковки. |
1. Обережно вийміть попередньо наповнений шприц-ручку з коробки. 2. Покладіть оригінальну упаковку з невикористаними попередньо наповненими шприцами-ручками назад у холодильник. 3. Зачекайте принаймні 30 хвилин для того, щоб попередньо наповнений шприц-ручка природним шляхом досяг кімнатної температури перед введенням. Не слід намагатися нагріти попередньо наповнений шприц-ручку, використовуючи джерело тепла, наприклад гарячу воду або мікрохвильову пічку; Не слід залишати попередньо наповнений шприц-ручку під прямими сонячними променями; Не слід струшувати попередньо наповнений шприц-ручку; Не слід на цьому етапі знімати помаранчевий захисний ковпачок з попередньо наповненого шприца-ручки. | |
С | Підготуйте все необхідне для ін’єкції. |
Ретельно вимийте руки водою з милом. На чисту, добре освітлювану робочу поверхню помістіть:
| |
D | Підготуйте та очистіть місце введення. | |
Ви можете вводити лікарський засіб у: | ||
Очистіть місце введення за допомогою спиртової серветки. Дайте шкірі висохнути. | ||
| ||
- Не слід знову торкатися місця введення перед ін’єкцією.
- Кожного разу, коли Ви робите собі ін’єкцію, обирайте іншу ділянку. Якщо Вам потрібно зробити ін’єкцію в одне і те саме місце, переконайтеся у тому, що Ви не вводите лікарський засіб у ту саму точку на цій ділянці, в яку Ви вводили минулого разу.
Не слід обирати ділянку з больовими відчуттями, синцями, почервонінням або ущільненням на шкірі. Уникайте введення на ділянках зі шрамами або стріями.
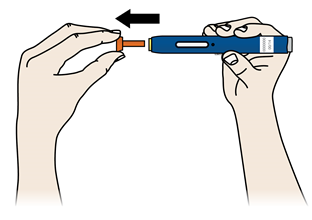
Етап 2. Приготування | |
А | Коли Ви готові робити ін’єкцію, зніміть помаранчевий захисний ковпачок. Не слід тримати шприц-ручку без помаранчевого захисного ковпачка протягом більше 5 хвилин — це може призвести до випарування лікарського засобу. |
| |
Наявність краплі рідини на кінці голки або жовтого захисного пристрою є нормальним явищем. Не слід скручувати, згинати або відкручувати помаранчевий захисний ковпачок; Не слід надягати помаранчевий ковпачок назад на попередньо наповнений шприц-ручку; Не слід триматися пальцями за жовтий захисний пристрій. | |
Важливо: Не слід знімати помаранчевий захисний ковпачок з попередньо наповненого шприца-ручки, поки Ви не будете готові робити ін’єкцію. | |
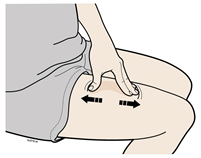
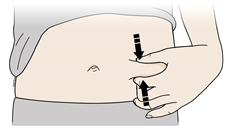
В | Розтягніть або затисніть місце введення для створення твердої поверхні. |
Метод розтягування
Сильно розтягніть шкіру рухом великого пальця та інших пальців в різні сторони, створюючи ділянку шириною приблизно 2 дюйми (5 см).АБОМетод затискання
Міцно затисніть шкіру між великим пальцем та іншими пальцями, створюючи ділянку шириною приблизно 2 дюйми (5 см). | |
Важливо: Важливо тримати шкіру розтягнутою або затиснутою під час введення препарату. | |
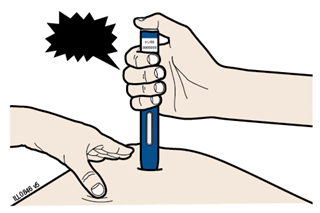
Етап 3. Введення | ||||
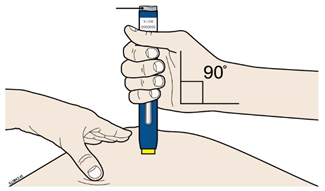
А | Тримайте розтягнуту або затиснуту шкіру, щоб поверхня була тверда. Зніміть захисний ковпачок, прикладіть попередньо наповнений шприц-ручку жовтим захисним пристроєм до шкіри під кутом 90 °. | |||
Жовтий захисний пристрій | ||||
Вірно | Невірно | |||
Не слід на цьому етапі торкатися сірої пускової кнопки |
| |||
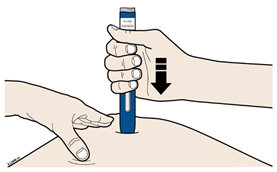
В | Сильно ПРИТИСНІТЬ попередньо наповнений шприц-ручку до шкіри, щоб він був нерухомий. | ||
|
| ||
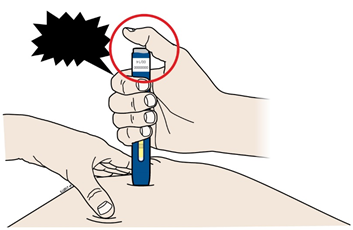
Важливо: Ви маєте постійно притискати шприц-ручку, проте не слід торкатися сірої пускової кнопки, поки Ви не будете готові зробити ін’єкцію. | |||
С | Коли Ви будете готові зробити ін’єкцію, натисніть на сіру пускову кнопку. Ви почуєте клацання. | |
| ||
D | Продовжуйте ПРИТИСКАТИ до шкіри. Потім ПІДНІМІТЬ великий палець. Введення може зайняти приблизно 15 секунд. | |||
|
Коли ін’єкція завершиться, віконце стане жовтого кольору. | |||
ПРИМІТКА. Після того, як Ви знімете попередньо наповнений шприц-ручку зі шкіри, голка автоматично сховається. | ||||
Етап 4. Завершення | |
А | Викиньте використаний попередньо наповнений шприц-ручку та помаранчевий захисний ковпачок. |
Викиньте використаний попередньо наповнений шприц-ручку та помаранчевий захисний ковпачок у контейнер для утилізації гострих предметів. Дізнайтесь у Вашого лікаря, як потрібно належним чином утилізувати шприц. Можуть існувати місцеві настанови стосовно утилізації. Зберігайте використаний попередньо наповнений шприц-ручку та контейнер для утилізації гострих предметів у недоступному та непомітному для дітей місці. Не слід повторно використовувати попередньо наповнений шприц-ручку; Не слід надягати назад захисний ковпачок на попередньо наповнений шприц-ручку або триматися пальцями за жовтий захисний пристрій; Не слід піддавати попередньо наповнений шприц-ручку чи контейнер для утилізації гострих предметів повторній переробці або викидати їх разом з побутовими відходами. | |
Огляньте місце введення.
Якщо виступає кров, притисніть ватний тампон або марлеву серветку до місця введення.
НЕ СЛІД розтирати місце введення. Накладіть пластир у разі необхідності.
Діти
Безпека та ефективність застосування лікарського засобу Репата дітям (віком до 18 років) за показанням первинна гіперхолестеринемія та змішана дисліпідемія не встановлювалися. Немає жодних даних.
Безпека та ефективність застосування лікарського засобу Репата дітям віком до 12 років за показанням гомозиготна сімейна гіперхолестеринемія не встановлювалися. Немає жодних даних.
Передозування
Жодні побічні реакції не спостерігалися в дослідженнях на тваринах при експозиціях, що майже у 300 разів перевищували експозиції у пацієнтів, що приймають лікарський засіб Репата в дозі 420 мг 1 раз на місяць.
Специфічного лікування передозування лікарським засобом Репата немає. У разі передозування пацієнта слід лікувати симптоматично та вжити підтримувальних заходів, якщо необхідно.
Побічні реакції
Резюме профілю безпеки
Найчастішими побічними реакціями під час опорних досліджень, в рекомендованих дозах, були ринофарингіт (7,4%), інфекція верхніх дихальних шляхів (4,6%), біль у спині (4,4%), артралгія (3,9%), грип (3,2%) та реакції у місці введення (2,2%). Профіль безпеки в популяції з гомозиготною сімейною гіперхолестеринемією узгоджувався з профілем, що спостерігався в популяції з первинною гіперхолестеринемією та змішаною дисліпідемією.
Зведена таблиця побічних реакцій
Побічні реакції, про які повідомлялося в опорних контрольованих клінічних дослідженнях та спонтанних повідомлень, класифіковано за системами органів та частотою у таблиці 8 нижче з використанням такого умовного поділу: дуже часто (≥ 1/10), часто (≥ 1/100 і < 1/10), нечасто (≥ 1/1 000 і < 1/100), рідко (≥ 1/10 000 і < 1/1 000) та дуже рідко (< 1/10 000).
Таблиця 8. Побічні реакції при застосуванні лікарського засобу Репата
Системи органів за класифікацією MedDRA | Побічні реакції | Частота |
Інфекції та інвазії | Грип | Часто |
Ринофарингіт | Часто | |
Інфекція верхніх дихальних шляхів | Часто | |
Порушення з боку імунної системи | Підвищена чутливість | Часто |
Висип | Часто | |
Кропив’янка | Нечасто | |
Порушення з боку шлунково-кишкового тракту | Нудота | Часто |
Порушення з боку шкіри та підшкірних тканин | Ангіоневротичний набряк | Рідко |
Порушення з боку кістково-м’язової системи та сполучної тканини | Біль у спині | Часто |
Артралгія | Часто | |
Загальні порушення та стан місця введення | Реакції у місці введення 1 | Часто |
Грипоподібне захворювання | Нечасто |
1 Див. розділ «Опис окремих побічних реакцій».
Опис окремих побічних реакцій
Реакції у місці введення
Найбільш частими реакціями у місцях введення були утворення синців у місці введення почервоніння, крововилив, біль у місці введення та набряк.
Діти
Досвід застосування лікарського засобу Репата дітям обмежений. У клінічні дослідження було включено 14 пацієнтів віком ≥ 12 і < 18 років з гомозиготною сімейною гіперхолестеринемією. Різниця у безпеці між пацієнтами-підлітками та дорослими з гомозиготною сімейною гіперхолестеринемією не спостерігалася.
Безпека та ефективність застосування лікарського засобу Репата дітям з первинною гіперхолестеринемією та змішаною дисліпідемією не встановлювалися.
Пацієнти літнього віку
Із 18 546 пацієнтів, яким застосовували лікарський засіб Репата у подвійно сліпих клінічних дослідженнях, 7 656 (41,3%) були віком ≥ 65 років, тоді як 1 500 (8,1%) були віком ≥ 75 років. Між цими пацієнтами та молодшими пацієнтами жодної загальної різниці у безпеці або ефективності не спостерігалося.
Імуногенність
У клінічних дослідженнях 0,3% пацієнтів (48 з 17 992 пацієнтів), яким було введено принаймні одну дозу лікарського засобу Репата, мали позитивний результат випробування на вироблення зв’язуючих антитіл. Пацієнти, які мали позитивну реакцію сироватки крові на зв’язуючі антитіла, далі оцінювалися на нейтралізуючі антитіла, і жодний з пацієнтів не мав позитивного результату випробування на нейтралізуючі антитіла. Присутність анти-еволокумаб-зв’язуючих антитіл не впливала на фармакокінетичний профіль, клінічну відповідь або безпеку лікарського засобу Репата.
Повідомлення про підозрювані побічні реакції
Важливо повідомляти про підозрювані побічні реакції після реєстрації лікарського засобу. Це дозволяє постійно контролювати співвідношення користь/ризик лікарського засобу. Звертаємося до працівників охорони здоров’я із проханням повідомляти про будь-які підозрювані побічні реакції згідно з чинним законодавством у сфері фармаконагляду.
Термін придатності Репата
3 роки.
Умови зберігання Репата
Зберігати в холодильнику (2—8 °C). Не заморожувати.
Зберігати в оригінальній картонній упаковці для захисту від світла.
Після виймання з холодильника лікарський засіб Репата можна зберігати при кімнатній температурі (до 25 °C) в оригінальній картонній упаковці протягом 1 місяця.
Зберігати в недоступному для дітей місці.
Несумісність.
За відсутності досліджень сумісності цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Упаковка
Репата, 140 мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
По 1 мл розчину в попередньо наповненому шприці-ручці одноразового використання, виготовленому зі скла І типу, з голкою із нержавіючої сталі 27-го калібру.
Ковпачок голки попередньо наповненого шприца-ручки виготовлено з сухого натурального каучуку (похідної латексу, див. розділ «Особливості застосування»).
По 1 або по 2 попередньо наповнені шприци-ручки у картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Амджен Європа Б.В.
Амджен Текнолоджі (Айеленд) Анлімітед Компані.
Місцезнаходження виробника
Мінервум 7061, 4817 ZK, Бреда, Нідерланди.
Поттері Роуд, Дан Лері, Ко. Дублін, Ірландія.
Подальша інформація
Пам'ятайте, зберігайте ці та всі інші ліки в недоступному для дітей місці, ніколи не передавайте свої ліки іншим і використовуйте Репата тільки за призначенням.
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин.
Увага! Ця інструкція для медичного застосування лікарського засобу є офіційною інструкцією виробника Амджен Європа Б.В..
Авторське право:
- https://www.amgen.nl - Амджен Європа Б.В.
| Тип даних | Відомості з реєстру |
| Торгівельне найменування: | Репата |
| Виробник: | Амджен Європа Б.В. |
| Форма випуску: | розчин для ін`єкцій, 140 мг/мл; по 1 мл розчину в попередньо наповненному шприці-ручці; по 1 або по 2 шприци-ручки в картонній коробці |
| Реєстраційне посвідчення: | UA/17010/01/01 |
| Дата початку: | 31.10.2018 |
| Дата закінчення: | 31.10.2023 |
| Міжнародне непатентоване найменування: | Evolocumab |
| Умови відпуску: | за рецептом |
| Склад: | 1 попередньо наповнений шприц-ручка містить 140 мг еволокумабу в 1 мл розчину |
| Фармакотерапевтична група: | Ліпідомодифікувальні засоби, прості. Інші ліпідомодифікувальні засоби. |
| Код АТС: | C10AX13 |
| Заявник: | Амджен Європа Б.В. |
| Країна заявника: | Нідерланди |
| Адреса заявника: | Мінервум 7061, НЛ-4817 ЗК Бреда, Нiдерланди |
| Тип ЛЗ: | Звичайний |
| ЛЗ біологічного походження: | Так |
| ЛЗ рослинного походження: | Нi |
| Гомеопатичний ЛЗ: | Нi |
| Тип МНН: | Моно |
| Дострокове припинення | Нi |
| Код ATC | Назва групи |
| C | Засоби, що впливають на серцево-судинну систему |
| C10 | Гіполіпідемічні засоби |
| C10A | Гіпохолестеринемічні та гіпотригліцеридемічні препарати |
| C10AX | Гіпохолестеринемічні та гіпотригліцеридемічні препарати інші |
| C10AX13 | Еволокумаб |