- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/16818/01/01 закончился 22.02.2024
Хумира инструкция по применению
Официальная инструкция лекарственного препарата Хумира раствор 20 мг/0,2 мл. Описание и применение Humira, аналоги и отзывы. Инструкция Хумира раствор утвержденная компанией производителем.
Состав
действующее вещество: адалимумаб;
1 предварительно наполненный однократно шприц содержит 20 мг адалимумаба в 0,2 мл раствора;
вспомогательные вещества: маннит (Е 421), полисорбат 80, вода для инъекций.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: бесцветный водный раствор от прозрачного до опалесцирующая, практически свободен от посторонних примесей.
Фармакологическая группа
Иммунодепрессанты. Ингибиторы фактора некроза опухоли-альфа. Адалимумаб.
Код АТХ L04А В04.
Фармакологические свойства
Хумира (адалимумаб) - это рекомбинантный иммуноглобулин (IgG1) человека, моноклональное антитело, содержащее только пептидные последовательности человека. Хумира была создана по технологии фагового отображения, что позволило получить характерные только для человека вариабельны участки тяжелых и легких цепей, которые проявляют свою специфичность в отношении фактора некроза опухолей (ФНО), а также тяжелую цепь IgG1 человека и последовательность легких цепей каппа-типа. Хумира связывается с высокой степенью родства и со спецификой с растворимым ФНО-альфа, но не с лимфотоксин (ФНО-бета). Хумира производится путем получения рекомбинантной ДНК в экспрессирующие системе клеток млекопитающих. Состоит из 1300 аминокислот, молекулярная масса составляет около 148 килодальтон.
Адалимумаб специфически связывается с ФНС и нейтрализует биологические эффекты ФНО, блокируя его взаимодействие с p55- и p75-рецепторами ФНО на поверхности клетки. ФНС - это естественный цитокин, который участвует в нормальных воспалительных и иммунных реакциях организма. Повышенные уровни ФНО обнаруживают в синовиальной жидкости пациентов с ревматоидным артритом (РА), ювенильным ревматоидным артритом (ЮРА), псориатическим артритом (ПСА) и анкилозирующим спондилитом (АС). ФНС играет важную роль в развитии патологического воспаления и разрушении тканей суставов, что характерно для этих заболеваний. Повышенные уровни ФНО оказываются также в псориатических бляшках. Применение Хумира пациентам с бляшечная псориазом может уменьшить утолщение эпидермиса и инфильтрацию воспалительными клетками. Взаимосвязь между этими фармакодинамическими эффектами и механизмом (звеньями),
Адалимумаб модулирует также биологические реакции ответа, индуцированных или регулируются ФНО, включая изменения уровней молекул адгезии, ответственных за миграцию лейкоцитов (ELAM-1, VCAM-1 и ICAM-1 при IC50 1 - 2 × 10-10 М).
Фармакологические.
У пациентов с РА Хумира вызывала быстрое уменьшение по сравнению с начальными параметрами, уровней показателей острой фазы воспаления (С-реактивного протеина (СРП), цитокинов сыворотки крови (IL-6) и скорости оседания эритроцитов). Снижение уровней СРП наблюдался также и у пациентов с ЮРА, болезнью Крона, язвенным колитом и гнойным гидраденитом наряду со значительным уменьшением экспрессии ФНО-альфа и воспалительных маркеров, таких как лейкоцитарный антиген (HLA-DR) и миелопероксидазы (МРО), в толстом кишечнике пациентов с болезнью Крона. Также наблюдалось снижение уровней матриксных металлопротеиназ (MMP-1 и MMP-3) в сыворотке крови, которые вызывают ремоделирования тканей, лежащий в основе разрушения хряща. У больных с РА, ПСА и АС часто наблюдается от слабого до умеренного степени анемия и лимфоцитопения, а также увеличение количества нейтрофилов и тромбоцитов. При применении Хумира обычно наблюдается улучшение этих гематологических признаков хронического воспаления.
Фармакокинетика.
Абсорбция и распределение.
После однократного подкожного введения 40 мг Хумира абсорбция и распределение Адалимумаб были медленными, средняя максимальная концентрация в сыворотке крови достигалась через 5 дней после введения. Средняя биодоступность Адалимумаб, рассчитанная в трех исследованиях, после приема однократной дозы 40 мг подкожно составляла 64%.
После однократного введения в дозах от 0,25 до 10 мг / кг концентрации были пропорциональны дозам. После приема 0,5 мг / кг (примерно 40 мг) клиренс был в диапазоне 11-15 мл / ч, объем распределения (Vss) составлял от 5 до 6 л, средний терминальный период полувыведения составлял примерно 2 недели. Концентрации Адалимумаб в синовиальной жидкости у пациентов с РА составляли 31-96% от уровня в сыворотке крови.
После подкожного применения Хумира в дозе 40 мг 1 раз в 2 недели у пациентов с РА равновесные концентрации составляли от 5 мкг / мл (без сопутствующего применения метотрексата) до 8-9 мкг / мл (с метотрексатом) соответственно. Концентрации Адалимумаб в сыворотке крови в равновесном состоянии росли почти пропорционально подкожно введенных доз 20, 40 и 80 мг 1 раз в 2 недели или еженедельно.
После подкожного применения Хумира в дозе 24 мг / м2 (до 40 мг) 1 раз в 2 недели у пациентов с полиартикулярним ЮРА в возрасте от 4 до 17 лет равновесные концентрации (показатели измерялись с 20-го по 48-ю неделю) составляли 5,6 ± 5,6 мкг / мл (102% CV - коэффициент вариации) без сопутствующего применения метотрексата и 10,9 ± 5,2 мкг / мл (47,7% CV) с метотрексатом.
У детей с полиартикулярним ЮРА в возрасте 2-4 года и в возрасте от 4 лет, масса тела которых меньше 15 кг, после применения Хумира в дозе 24 мг / м2 с метотрексатом среднее значение равновесной концентрации составило 7,9 ± 5,6 мкг / мл (101% CV).
После подкожного применения Хумира в дозе 24 мг / м2 (до 40 мг) 1 раз в 2 недели у пациентов в возрасте от 6 до 17 лет с ентезит-ассоциированным артритом равновесные концентрации (показатели измерялись на 24-й неделе) составляли 8,8 ± 6 6 мкг / мл без сопутствующего применения метотрексата и 11,8 ± 4,3 мкг / мл с метотрексатом соответственно.
У пациентов с псориазом средняя равновесная концентрация составляла 5 мкг / мл в течение монотерапии Адалимумаб в дозе 40 мг 1 раз в 2 недели.
После подкожного применения Хумира в дозе 0,8 мг / кг (до максимум 40 мг) 1 раз в 2 недели у детей с хроническим бляшечная псориазом равновесные концентрации составляли примерно 7,4 ± 5,8 мкг / мл (79% CV).
У пациентов с гнойным гидраденитом после введения Хумира в дозе 160 мг на неделе 0 с последующим введением 80 мг недели 2 концентрация в сыворотке крови составляла примерно от 7 до 8 мкг / мл недели 2 и недели 4. Средняя равновесная концентрация с недели 12 до недели 36 составляла примерно от 8 до 10 мкг / мл при введении Хумира в дозе 40 мг каждую неделю.
Влияние Адалимумаб на подростков с гидраденитом было определено с помощью фармакокинетического моделирования и симуляции на основе фармакокинетики при других показаниях у детей (бляшечная псориаз, ювенильный ревматоидный (идиопатический) артрит (ЮРА), болезнь Крона (БК) и ентезит-ассоциированный артрит). Рекомендуемый режим дозирования для подростков с гидраденитом - 40 мг 1 раз в 2 недели. Поскольку влияние Адалимумаб может зависеть от массы тела, подросткам с высокой массой тела и недостаточной ответом на лечение можно применять рекомендуемую дозу для взрослых - по 40 мг один раз в неделю.
У пациентов с болезнью Крона после введения Хумира в дозе 80 мг на неделе 0 с последующим введением 40 мг недели 2 концентрация в сыворотке крови составляла примерно 5,5 мкг / мл в течение индукционной терапии. После введения Хумира в дозе 160 мг на неделе 0 с последующим введением 80 мг недели 2 концентрация в сыворотке крови составляла примерно 12 мкг / мл в течение индукционной терапии. Средняя равновесная концентрация составляла примерно 7 мкг / мл при введении Хумира в поддерживающей дозе 40 мг 1 раз в 2 недели.
У детей с болезнью Крона средней и высокой степени активности начальная доза Хумира в открытом исследовании составляла 160/80 мг 80/40 мг на неделях 0 и 2 в зависимости от массы тела. На неделе 4 пациента были рандомизированы в соотношении 1: 1 в группы, которые получали в зависимости от массы тела или стандартную дозу (40/20 мг 1 раз в 2 недели), или низкую дозу (20/10 мг 1 раз в 2 недели) для поддерживающей терапии. Средняя равновесная концентрация составляла примерно 15,7 ± 6,6 мкг / мл недели 4 у пациентов с массой тела 40 кг и более (160/80 мг) и 10,6 ± 6,1 мкг / мл у пациентов с массой тела менее 40 кг (80/40 кг).
У пациентов с язвенным колитом после введения Хумира в начальной дозе 160 мг на неделе 0 с последующим введением 80 мг недели 2 концентрация в сыворотке крови составляла примерно 12 мкг / мл в течение индукционной терапии. Средняя равновесная концентрация составляла примерно 8 мкг / мл при введении Хумира в поддерживающей дозе 40 мг 1 раз в 2 недели.
У пациентов с увеитом после введения Хумира в начальной дозе 80 мг на неделе 0 с последующим введением 40 мг 1 раз в 2 недели, начиная с недели 1, средняя равновесная концентрация составляла примерно от 8 до 10 мкг / мл.
Влияние Адалимумаб на состояние детей с увеитом было определено с помощью фармакокинетического моделирования и симуляции на основе фармакокинетики при других показаниях у детей (бляшечная псориаз, ювенильный ревматоидный (идиопатический) артрит (ЮРА), болезнь Крона (БК) и ентезит-ассоциированный артрит).
Нет клинических данных о влиянии начальной дозы Адалимумаб на состояние детей в возрасте до 6 лет. Прогнозируется, что в отсутствие метотрексата начальная доза может привести к повышению системного воздействия.
Вывод.
Популяционный фармакокинетический анализ данных более чем 1300 пациентов с РА обнаружил тенденцию к повышению явного клиренса Адалимумаб с повышением массы тела пациентов. С учетом поправок по разнице массы тела было установлено, что пол и возраст имеют минимальное влияние на клиренс Адалимумаб. Уровни свободного Адалимумаб (не связанному с антителами против Адалимумаб (ААА)) в сыворотке крови были ниже у пациентов, у которых выявлялись ААА. Хумира не изучалась у пациентов с нарушениями функции печени и почек.
Клинические характеристики
Хумира Показания
Ювенильный ревматоидный (идиопатический) артрит (ЮРА).
Полиартикулярний ювенильный ревматоидный (идиопатический) артрит.
Хумира в комбинации с метотрексатом показана для лечения активного полиартикулярного ювенильного идиопатического артрита у детей от 2 лет, у которых не было адекватного ответа на терапию одним или несколькими противоревматическими препаратами, модифицирующих течение заболевания (DMARDs).
Хумира можно применять в качестве монотерапии при непереносимости метотрексата или когда продолжение терапии метотрексатом неприемлемо. Не было проведено исследований применения Хумира пациентам в возрасте до 2 лет.
Ентезит-ассоциированный артрит.
Хумира показана для лечения активного ентезит-ассоциированного артрита у детей в возрасте от 6 лет, не отвечали на традиционную терапию, или при наличии непереносимости или медицинских противопоказаний к таким видам терапии.
Болезнь Крона (БК) у детей.
Хумира показана для лечения болезни Крона средней и высокой степени активности у детей в возрасте от 6 лет, не отвечали на традиционную терапию, включая первичную нутритивную терапию, терапию кортикостероидами и / или иммуномодуляторами, или при наличии непереносимости или медицинских противопоказаний к таким видам терапии.
Бляшечная псориаз (БП) у детей.
Хумира показана для лечения хронического бляшечного псориаза с тяжелым течением у детей в возрасте от 4 лет, у которых не получено клинического ответа или есть противопоказания / непереносимость местной терапии или фототерапии.
Увеит у детей.
Хумира показана для лечения хронического неинфекционного переднего увеита у детей в возрасте от 2 лет, которые не соответствовали или имели непереносимость традиционной терапии или каким традиционная терапия противопоказана.
Противопоказания
- Повышенная чувствительность к Адалимумаб или к любому другому компоненту препарата.
- Активный туберкулез или другие тяжелые инфекции, такие как сепсис и оппортунистические инфекции (см. Раздел «Особенности применения»).
- Умеренная и тяжелая сердечная недостаточность (III / IV класс по NYHA) (см. Раздел «Особенности применения»).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
- Хумира изучали с участием пациентов с РА, ЮРА и ПСА, получавших препарат в качестве монотерапии и одновременно с метотрексатом. При одновременном применении Хумира и метотрексата у 21 пациента с РА никаких статистически значимых изменений в профилях концентрации метотрексата в сыворотке крови не обнаружено. Для сравнения, при однократном и многократном применении метотрексата уменьшаются клиренсы Адалимумаб на 29% и 44% соответственно. Однако изменение дозы Хумира или метотрексата не нужна. Уровень формирования антител был ниже при одновременном применении Хумира с метотрексатом по сравнению с монотерапией. Введение Хумира без метотрексата приводило к увеличению уровня формирования антител, увеличение клиренса и снижение эффективности Адалимумаб.
- Взаимодействие между Хумирой и другими препаратами (кроме метотрексата) не изучалось в фармакокинетических исследованиях. В клинических исследованиях не наблюдалось никаких взаимодействий при применении Хумира с противоревматическими препаратами, модифицирующих течение заболевания (DMARDs) (сульфасалазин, гидрохлорохин, лефлуномид и препараты золота), с ГКС, салицилатами, нестероидными противовоспалительными препаратами или анальгетиками.
- Не рекомендуется одновременное применение Хумира с анакинры (см. Раздел «Особенности применения»).
- Не рекомендуется одновременное применение Хумира с абатацептом (см. Раздел «Особенности применения»).
Особенности применения
С целью улучшения контроля применения биологических препаратов необходимо четко фиксировать торговое название и номер серии введенного препарата.
Инфекции.
Тяжелые инфекции: бактериальные, микобактериальные, инвазивные грибковые (диссеминированный или екстрапульмонарний гистоплазмоз, аспергиллез, кокцидиоидомикоз), вирусные, паразитарные или другие оппортунистические инфекции - наблюдались у пациентов, получавших блокаторы ФНО. О развитии сепсиса, редко - туберкулеза, кандидоза, листериоза, легионеллеза и пневмоцистной инфекции также сообщалось при применении антагонистов ФНО, включая Хумира. В клинических исследованиях наблюдались и другие серьезные инфекции: пневмония, пиелонефрит, септический артрит и септицемия. Были сообщения о госпитализации пациентов с инфекциями, возникшие (в том числе с летальным исходом). Большинство тяжелых инфекций развилась на фоне применения иммуносупрессивных средств и основного заболевания.
Не следует применять Хумира пациентам с активным инфекционным процессом, включая хронические или локализованные инфекции, пока инфекция не будет контролируема. У пациентов, имеющих контакт с больным туберкулезом или вернулись из стран с высоким уровнем заболеваемости туберкулезом или эндемичных зон по микозов (гистоплазмоз, кокцидиоидомикоз или бластомикоз), следует оценить соотношение польза / риск до начала применения Хумира (см. Ниже «Другие оппортунистические инфекции »).
Как и при применении других антагонистов ФНО, пациентов следует тщательно наблюдать до, во время и после лечения Хумирой учитывая возможность развития инфекций (в том числе туберкулеза).
Необходимо провести полное обследование и тщательно наблюдать за пациентами, у которых во время лечения Хумирой развилась новая инфекция. Лечение прекратить при развитии тяжелой инфекции или сепсиса и применить соответствующие противомикробные или противогрибковые препараты, пока инфекция не будет контролируема.
Следует с осторожностью применять Хумира пациентам с рекуррентными инфекциями или при преморбидных состояниях, повышающих склонность к развитию инфекций.
Туберкулез.
Сообщалось о случаях реактивации и о развитии новой инфекции туберкулеза, включая легочную и нелегеневу формы (то есть диссеминированный туберкулез), у пациентов, получавших лечение препаратом Хумира. До начала терапии Хумирой пациентов нужно тщательно обследовать по активному и неактивного (латентного) туберкулеза. Обследование должно включать исчерпывающую оценку анамнеза пациента с туберкулезом или сведения о возможных контактах с больными активным туберкулезом и о предыдущей и / или сопутствующую иммуносупрессивную терапию. Следует провести всем пациентам до начала терапии кожный туберкулиновый тест (проба Манту) и рентгенографию грудной клетки. Положительным результатом кожного туберкулиновых теста при проведении диагностики латентного туберкулеза считается появление уплотнения (папулы) диаметром 5 мм или более (без учета предыдущей вакцинации БЦЖ). Следует учитывать возможность недиагностированного латентного туберкулеза у пациентов, вернувшихся из стран с высоким уровнем заболеваемости туберкулезом или имели тесный контакт с больным активным туберкулезом. Лечение Хумирой не следует проводить, если диагностируется активный туберкулез.
В случае латентного туберкулеза до начала терапии Хумирой нужно провести специфическое профилактическое лечение. Следует учесть необходимость применения противотуберкулезного лечения перед началом терапии Хумирой пациентам, имеющим факторы риска развития туберкулезной инфекции, но в которых получен отрицательный результат теста на латентный туберкулез, и пациентам, в анамнезе латентный или активный туберкулез и для которых не может быть подтверждено соответствующее лечение. Решение о начале противотуберкулезной терапии для таких пациентов принимают после консультации с фтизиатром и оценки риска развития латентного туберкулеза и безопасности противотуберкулезного лечения.
Специфическое лечение латентного туберкулеза уменьшает риск реактивации туберкулеза у пациентов, получающих лечение препаратом Хумира. Несмотря на профилактическое противотуберкулезное лечение, случаи реактивации туберкулеза случались у пациентов, получавших препарат Хумира. Также активный туберкулез развивался на фоне лечения Хумирой у некоторых пациентов с отрицательными результатами скрининга на латентную туберкулезную инфекцию, а у некоторых пациентов, ранее перенесших успешную терапию активного туберкулеза, наблюдался повторный развитие туберкулеза на фоне приема блокаторов ФНО. При применении Хумира пациентов следует осматривать относительно появления симптомов активного туберкулеза, особенно учитывая возможность получения ложноотрицательных результатов тестов на латентный туберкулез (таких как,
Всех пациентов нужно предупредить о необходимости консультации врача в случае появления признаков, напоминающие симптомы туберкулеза (например, постоянный кашель, уменьшение массы тела, субфебрильная температура, апатия) во время или после лечения Хумирой.
Другие оппортунистические инфекции.
Во время лечения Хумирой сообщалось о развитии оппортунистических инфекций, в том числе инвазивных грибковых инфекций. Иногда такие инфекции своевременно не диагностировались, что приводило к позднему началу лечения и иногда завершалось летально. Пациенты, применяющие блокаторы ФНО, более склонны к развитию серьезных грибковых инфекций, таких как гистоплазмоз, кокцидиоидомикоз, бластомикоз, аспергиллез, кандидоз и др. Всех пациентов в случае развития лихорадки, недомогания, снижение массы тела, повышение потливости, кашля, одышки и / или инфильтратов в легких или других признаков серьезного системного заболевания (с шоком или без) следует немедленно обследовать по выявлению возбудителей оппортунистических инфекций.
У пациентов, проживающих или находящихся в эндемичных к микозов регионах, инвазивные грибковые инфекции следует подозревать при появлении соответствующих симптомов системных грибковых инфекций. Из-за существования повышенного риска развития гистоплазмоза или других инвазивных грибковых инфекций следует проводить эмпирическую противогрибковую терапию до определения возбудителя. У некоторых пациентов результаты теста на выявление гистоплазмозного антигена или антител могли быть отрицательными даже при активной инфекции. Если целесообразно, решение о применении эмпирической противогрибковой терапии таким больным следует принимать после консультации со специалистом в области диагностики и лечения инвазивных грибковых инфекций, учитывая риск развития грибковой инфекции, а также риск вследствие применения противогрибковой терапии.
Реактивация гепатита В.
Применение блокаторов ФНО связывалось с реактивацией вируса гепатита В (ВГВ) в хронических носителей. Иногда реактивация ВГВ на фоне терапии блокаторами ФНО была летальной. В большинстве случаев пациенты одновременно получали и другие медицинские препараты, подавляющие иммунную систему, что также могло повлиять на реактивацию ВГВ. До начала применения блокаторов ФНО следует обследовать пациентов группы риска ВГВ. Следует с осторожностью назначать блокаторы ФНО пациентам-носителям ВГВ, а в случае назначения - тщательно наблюдать за появлением симптомов реактивации ВГВ в течение терапии и несколько месяцев после прекращения лечения. Нет данных об эффективности и безопасности применения противовирусных препаратов для профилактики реактивации ВГВ у носителей, которые получают блокаторы ФНО.
Неврологические расстройства.
При применении блокаторов ФНО, в том числе Хумира, сообщалось о единичных случаях появления или обострения клинических симптомов и / или радиографических признаков демиелинизирующих заболеваний центральной нервной системы, включая рассеянный склероз, неврит зрительного нерва и демиелинизирующие заболевания периферической нервной системы, синдром Гийена - Барре. Рекомендуется тщательная оценка преимуществ / риска применения Хумира для пациентов с демиелинизирующими расстройствами центральной или периферической нервной системы. Необходимо прекратить терапию Хумирой в случае возникновения указанных расстройств. Известно, что существует связь между интермедиарным увеитом и демиелинизирующими расстройствами центральной нервной системы. Неврологическое обследование необходимо проводить пациентам с неинфекционным интермедиарным увеитом перед тем, как начать терапию Хумирой,
Злокачественные новообразования.
В контролируемых клинических исследованиях блокаторов ФНО чаще сообщалось о развитии злокачественных новообразований у пациентов, получавших ФНО-блокатор, чем у пациентов контрольной группы. Однако небольшая выборка пациентов контрольной группы и недостаточная продолжительность испытаний не позволяют сделать окончательные выводы. Более того, у пациентов с давним высокоактивным РА существует высокий фоновый риск возникновения лимфомы, что затрудняет оценку риска. В течение длительных открытых клинических испытаний Хумира общая частота возникновения злокачественных новообразований была аналогичная ожидаемой в общей популяции с такими же возрастными, половыми и расовыми параметрами. Однако нельзя исключать возможный риск развития лимфом и других злокачественных новообразований у пациентов, которые лечатся антагонистами ФНО.
Сообщалось об отдельных случаях развития злокачественных новообразований с летальным исходом у детей и подростков, получавших лечение блокаторами ФНО. Примерно половина из этих случаев - лимфомы, включая ходжкинских и неходжкинской. Другие случаи были представлены различными видами злокачественных новообразований, в том числе сообщалось о редких случаях злокачественных новообразований, которые обычно связаны с иммуносупрессией. Злокачественные новообразования возникали в среднем через 30 месяцев терапии. Большинство пациентов одновременно получали иммунодепрессанты. Эти сообщения были получены при постмаркетинговом наблюдении и поступали из разных источников, включая реестры и постмаркетинговые отчеты.
В постмаркетинговой практике очень редко у пациентов, получавших адалимумаб, сообщалось о развитии гепатолиенальной Т-клеточной лимфомы (редкий тип лимфомы, характеризующаяся очень агрессивным течением и обычно является летальным). Большинство из этих пациентов ранее получала терапию инфликсимабом в сочетании с азатиоприном или 6-меркаптопурином для лечения воспалительных заболеваний кишечника. Потенциальный риск одновременного применения азатиоприна или 6-меркаптопурину с Хумирой должно быть тщательно оценено. Причинно-следственная связь между развитием гепатолиенальной Т-клеточной лимфомы и применением Адалимумаб остается не выясненным.
Исследований по применению Хумира пациентам со злокачественными новообразованиями в анамнезе или продолжения терапии у пациентов, у которых развилось злокачественное новообразование, не проводилось. Это нужно учитывать и с осторожностью принимать решения о применении Хумира таким больным.
У всех пациентов, особенно при интенсивной иммуносупрессивной терапии в анамнезе, или у пациентов с псориазом, которым проводили PUVA-терапию, следует исключить наличие немеланомного рака кожи до и на протяжении периода применения Хумира.
В постмаркетинговой практике сообщалось о случаях острой и хронической лейкемии, связанной с применением ФНО-блокаторов при ревматоидном артрите, а также при других показаниях. Пациенты с ревматоидным артритом могут иметь повышенный риск развития лейкемии (почти в два раза) по сравнению с общей популяцией, даже при отсутствии терапии ФНО-блокаторами.
В поисковом клиническом исследовании, в котором оценивали применение другого ФНО-блокатора (инфликсимаб), у пациентов с хронической обструктивной болезнью легких сообщалось о более частые случаи возникновения новообразований, в основном в легких, голове и области шеи, по сравнению с контрольной группой. Все пациенты долгое время были курильщиками. Поэтому необходимо с осторожностью применять любые ФНО-блокаторы больным с хронической обструктивной болезнью легких и пациентам с повышенным риском возникновения новообразований на фоне курения.
В настоящее время неизвестно, влияет ли применение Адалимумаб на риск развития дисплазии или рака кишечника. Все больные язвенный колит, входящих в группу повышенного риска развития дисплазии или рака кишечника (например пациенты с длительным язвенным колитом или первичным склерозирующим холангитом), или те, кто имел в анамнезе дисплазию или рак кишечника, должны подлежать регулярному обследованию на наличие дисплазии перед началом терапии и в течение течении всей болезни. Обследование должно включать колоноскопию и биопсию.
Аллергические реакции.
Во время клинических исследований серьезные аллергические реакции, связанные с Хумирой, возникали редко. Сообщалось о серьезных аллергические реакции, включая анафилаксии, после введения Хумира. При возникновении анафилактической реакции или другой серьезной аллергической реакции необходимо немедленно прекратить применение Хумира и начать соответствующую терапию.
Гематологические расстройства.
Редко при применении блокаторов ФНО сообщалось о развитии панцитопении, апластической анемии. При применении Хумира (причинно-следственная связь не выяснен) сообщалось о развитии цитопении (тромбоцитопения, лейкопения), имевшая клиническое значение. Всех пациентов нужно предупредить о необходимости немедленной консультации врача при появлении симптомов, характерных заболеванием крови (таких как постоянная лихорадка, кровоподтеки, кровотечение, бледность кожи и слизистых оболочек), на фоне применения Хумира. Следует рассмотреть необходимость отмены Хумира пациентам в случае подтверждения серьезных нарушений со стороны крови.
Одновременное применение с биологическими DMARDs или антагонистами ФНО.
Наблюдались серьезные инфекции во время клинических исследований сопутствующего применения анакинры и этанерцепт, что не имело терапевтических преимуществ по сравнению с монотерапией этанерцепт. Учитывая характер побочных явлений, которые наблюдались во время комбинированного лечения этанерцепт и анакинры, подобная токсичность может развиться при комбинации анакинры и другого блокатора ФНО. Поэтому комбинация Адалимумаб и анакинры не рекомендуется.
Одновременное применение Адалимумаб с другими биологическими DMARDs (например, анакинры и абатацепт) или с другими антагонистами ФНО не рекомендуется, учитывая возможное повышение риска инфекций и других потенциальных фармакологических взаимодействий.
Иммуносупрессия.
Во время клинических исследований Хумира в 64 пациентов с РА случаев подавления гиперчувствительности замедленного типа, снижение уровней иммуноглобулинов или количественных изменений эффекторных Т- и В-клеток, а также NK-клеток, моноцитов / макрофагов и нейтрофилов не наблюдалось.
Вакцинация.
Пациентам при применении Хумира можно проводить вакцинацию, за исключением применения живых вакцин. Никаких данных о вторичной передачи инфекции живыми вакцинами у пациентов, получавших Хумира, не существует.
Для пациентов детского возраста рекомендуется по возможности провести все необходимые прививки согласно календарю до начала терапии Хумирой.
Применение живых вакцин младенцам, которые подвергались воздействию Адалимумаб внутриутробно, не рекомендуется в течение 5 месяцев после последней инъекции Адалимумаб матери в период беременности.
Хроническая сердечная недостаточность (ХСН).
Применение Хумира пациентам с хронической сердечной недостаточностью не исследовался, однако в клинических исследованиях с другим блокатором ФНС сообщалось о более высокую частоту побочных явлений, связанных с ХСН, включая ухудшение течения ХСН и впервые обнаруженную ХСН. Сообщалось также о случаях прогрессирования ХСН у пациентов, получающих терапию Хумирой. Хумира следует с осторожностью применять пациентам с сердечной недостаточностью и под тщательным контролем их состояния (см. Раздел «Побочные реакции»).
Аутоиммунные процессы.
Лечение Хумирой может привести к появлению аутоантител. Влияние длительного применения Хумира на развитие аутоиммунных заболеваний неизвестен. При возникновении симптомов, напоминающих волчаночноподобный синдром, лечение Хумирой необходимо прекратить.
Хирургические вмешательства.
Доступные ограниченные данные по безопасности хирургических процедур у пациентов, получающих Хумира. Длительный период полувыведения Адалимумаб необходимо принимать во внимание, если планируется хирургическое вмешательство. Пациента, требует хирургического вмешательства и находится на лечении Хумирой, нужно тщательно обследовать на наличие инфекций. В случае необходимости следует принять соответствующие меры. Доступные ограниченные данные о безопасности применения у пациентов, подвергавшихся артропластике во время терапии Хумирой.
Непроходимость тонкой кишки.
Отсутствие ответа на лечение болезни Крона может свидетельствовать о наличии фиксированной фиброзной стриктуры, которая требует лечения хирургическим путем. Доступные данные позволяют считать, что лечение Хумирой не вызывает возникновения или прогрессирования стриктур.
Пациенты пожилого возраста.
Частота развития серьезных инфекций у пациентов в возрасте от 65 лет, получали Хумира (3,7%), выше, чем у более молодых пациентов (1,5%). Некоторые случаи были летальными. Всего в клинических исследованиях участвовали 9,5% пациентов в возрасте от 65 лет, из которых примерно 2,0% - пациенты в возрасте от 75 лет. В связи с тем, что частота развития инфекций у пациентов пожилого возраста выше, применять Хумира пациентам этой возрастной категории необходимо с осторожностью.
Дети.
См. подразделение «Вакцинация» выше.
Применение в период беременности или кормления грудью
Женщины репродуктивного возраста.
Для предотвращения беременности женщины репродуктивного возраста должны пользоваться надежными методами контрацепции во время лечения и в течение не менее пяти месяцев после введения последней дозы препарата Хумира.
Беременность.
В результате проспективного анализа данных по применению Адалимумаб во время беременности (примерно 2100 случаев беременностей, завершившихся рождением живых детей с известными последствиями, в том числе более 1500 случаев применения препарата в первом триместре) не выявлено увеличения частоты пороков развития у новорожденных.
В проспективных когортный реестр было включено 257 женщин с РА или ХК, получавших адалимумаб как минимум в течение первого триместра, и 120 женщин с РА или ХК, не получавших адалимумаб. Первичной конечной точкой была частота развития значительных врожденных пороков у новорожденных. Частота случаев беременностей, завершившихся рождением хотя бы одного живого ребенка со значительной врожденным пороком, составляла 6 из 69 (8,7%) в группе женщин с РА, получавших адалимумаб, и 5 из 74 (6,8%) - в группе женщин РА, не применяли препарат (нескорректированный отношение шансов [ОШ] - 1,31, 95% доверительный интервал [ДИ] - 0,38 - 4,52). В группе женщин с ХК, получавших адалимумаб, частота таких случаев составляла 16 из 152 (10,5%), а в группе женщин с ХК, не применяли препарат, соответственно 3 из 32 (9,4%) (нескорректированный ВШ - 1,14, 95% ДИ - 0,31 - 4,16). В объединенной группе женщин с РА и ХК скорректированное ОШ (с поправкой на различия в исходном уровне) составило 1,10 (95% ДИ - 0,45 - 2,73). Между женщинами, которые применяли и не применялись адалимумаб, не было выявлено четко выраженных различий по вторичных конечных точек в виде спонтанных абортов, незначительных врожденных пороков, преждевременных родов, массы тела и роста новорожденных и серьезных или оппортунистических инфекций, а также не было зарегистрировано случаев мертворождения или развития злокачественных опухолей. На интерпретацию данных могли влиять методологические ограничения исследования, в том числе малый объем выборки и НЕРАНДОМИЗИРОВАННОГО дизайн исследования. которые применяли и не применялись адалимумаб, не было выявлено четко выраженных различий по вторичных конечных точек в виде спонтанных абортов, незначительных врожденных пороков, преждевременных родов, массы тела и роста новорожденных и серьезных или оппортунистических инфекций, а также не было зарегистрировано случаев мертворождения или развития злокачественных опухолей. На интерпретацию данных могли влиять методологические ограничения исследования, в том числе малый объем выборки и НЕРАНДОМИЗИРОВАННОГО дизайн исследования. которые применяли и не применялись адалимумаб, не было выявлено четко выраженных различий по вторичных конечных точек в виде спонтанных абортов, незначительных врожденных пороков, преждевременных родов, массы тела и роста новорожденных и серьезных или оппортунистических инфекций, а также не было зарегистрировано случаев мертворождения или развития злокачественных опухолей. На интерпретацию данных могли влиять методологические ограничения исследования, в том числе малый объем выборки и НЕРАНДОМИЗИРОВАННОГО дизайн исследования.
В экспериментальном исследовании токсичности на обезьянах не было выявлено признаков токсического действия на материнский организм, а также эмбриотоксического и тератогенного действия. Доклинические данные по постнатальной токсичности Адалимумаб отсутствуют.
Поскольку адалимумаб ингибирует ФНО-α, его применение во время беременности может нарушить нормальные иммунные реакции у новорожденного ребенка. Беременным женщинам следует применять адалимумаб только в случае очевидной необходимости.
Адалимумаб может проникать через плаценту в сыворотку крови новорожденных, матери которых получали адалимумаб во время беременности. Поэтому у таких новорожденных может быть повышен риск инфицирования. Применение живых вакцин (например вакцины БЦЖ) новорожденным, подвергавшихся воздействию Адалимумаб внутриутробно, не рекомендуется в течение 5 месяцев после последней инъекции Адалимумаб матери в период беременности.
Кормления грудью.
Ограниченные опубликованные данные свидетельствуют о том, что адалимумаб выводится в грудное молоко в очень низких концентрациях - от 0,1% до 1% от уровня в сыворотке матери. Учитывая то, что белки иммуноглобулина G подвергаются в кишечнике протеолиза и имеют низкую биодоступность, системное воздействие Адалимумаб на младенцев, находящихся на грудном вскармливании, маловероятен. Итак, препарат Хумира можно применять в период кормления грудью.
Фертильность.
Доклинические данные о влиянии Адалимумаб на фертильность отсутствуют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Хумира может иметь незначительное влияние на скорость реакции при управлении автотранспортом или другими механизмами. Применение Хумира может вызвать вертиго и нарушение остроты зрения (см. Раздел «Побочные реакции»).
Способ применения Хумира и дозы
Терапию Хумирой должен назначать врач, имеющий опыт в диагностике и терапии заболеваний, при которых показана Хумира. Офтальмологам рекомендуется проконсультироваться с соответствующим специалистом перед тем, как назначать терапию Хумирой. Хумира можно вводить самостоятельно только в случае, если пациент или родители ребенка, которому назначена терапия Хумирой, прошли соответствующий инструктаж у врача по технике введения препарата и врач подтвердил, что это возможно. Дополнительно необходимо ознакомиться с информацией относительно самостоятельного ввода, которая содержится в упаковке. Пациент или родители ребенка, которому назначена терапия Хумирой, должны с информационной карточкой, также находится в упаковке. Во время лечения Хумирой другие сопутствующие виды терапии (например терапию кортикостероидами и / или иммуномодулирующими препаратами) для просмотра.
Ювенильный ревматоидный (идиопатический) артрит (ЮРА).
Полиартикулярний ювенильный ревматоидный (идиопатический) артрит.
Рекомендуемая доза Хумира для детей от 2 лет с полиартикулярною формой ЮРА зависит от массы тела (таблица 1). Хумира применяют 1 раз в 2 недели подкожно.
Таблица 1. Дозировка Хумира для пациентов с полиартикулярною формой ЮРА
масса тела | Доза |
От 10 кг до 30 кг | 20 мг 1 раз в 2 недели |
30 кг и больше | 40 мг 1 раз в 2 недели |
Клинический ответ, согласно имеющимся данным, обычно достигается в течение 12 недель лечения. Следует пересмотреть необходимость продолжения терапии для пациентов, у которых в течение указанного срока не наблюдается ответа на лечение.
Хумира не применяется по этому показаниям детям до 2 лет.
Лекарственное средство Хумира доступен в других дозировках в зависимости от индивидуальных потребностей в лечении.
Ентезит-ассоциированный артрит.
Рекомендуемая доза Хумира для детей от 6 лет зависит от массы тела (таблица 2). Хумира применяют 1 раз в 2 недели подкожно.
Таблица 2. Дозировка Хумира для пациентов с ентезит-ассоциированным артритом
масса тела | Доза |
От 15 кг до 30 кг | 20 мг 1 раз в 2 недели |
30 кг и больше | 40 мг 1 раз в 2 недели |
Применение Хумира детям до 6 лет с ентезит-ассоциированным артритом не изучалось. Лекарственное средство Хумира доступен в других дозировках в зависимости от индивидуальных потребностей в лечении.
Болезнь Крона у детей.
Рекомендуемая доза Хумира для пациентов в возрасте от 6 до 17 лет с болезнью Крона зависит от массы тела (таблица 3). Хумира применяют подкожно.
Таблица 3. Дозировка Хумира для детей с болезнью Крона
масса тела | Индукционная доза | Поддерживающая терапия, начиная с недели 4 |
<40 кг | 40 мг недели 0 и 20 мг недели 2 Если существует потребность в более быстрой ответа на терапию, можно использовать следующую схему: 80 мг недели 0 и 40 мг недели 2. Но следует учитывать, что риск побочных явлений при применении более высокой индукционной дозы растет. | 20 мг 1 раз в 2 недели |
≥ 40 кг | 80 мг недели 0 и 40 мг недели 2 Если существует потребность в более быстрой ответа на терапию, можно использовать следующую схему: 160 мг недели 0 и 80 мг недели 2. Но следует учитывать, что риск побочных явлений при применении более высокой индукционной дозы растет. | 40 мг 1 раз в 2 недели |
Для пациентов с недостаточным ответом может быть целесообразным увеличение частоты применений Хумира:
- пациентам с массой тела <40 кг: 20 мг 1 раз в неделю;
- пациентам с массой тела ≥ 40 кг 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели.
Следует тщательно пересмотреть необходимость продолжения терапии для пациентов, у которых в течение 12 недель не наблюдается клинического ответа.
Хумира не применяется по этому показаниям детям до 6 лет.
Лекарственное средство Хумира доступен в других дозировках в зависимости от индивидуальных потребностей в лечении.
Бляшечная псориаз у детей.
Рекомендуемая доза Хумира для пациентов в возрасте от 4 до 17 лет с бляшечная псориазом зависит от массы тела (таблица 4). Хумира применяют подкожно.
Таблица 4. Дозировка Хумира для детей с бляшечная псориазом
масса тела | Доза |
От 15 кг до 30 кг | Начальная доза составляет 20 мг на неделе 0, затем 20 мг 1 раз в 2 недели, начиная с недели 1 |
30 кг и больше | Начальная доза составляет 40 мг на неделе 0, затем 40 мг 1 раз в 2 недели, начиная с недели 1 |
Следует тщательно пересмотреть необходимость продолжения терапии для пациентов, у которых в течение 16 недель не наблюдается клинического ответа. Если назначена повторная терапию Хумирой, необходимо придерживаться схемы лечения, указанной выше. Безопасность применения Хумира детям с бляшечная псориазом изучалась в среднем в течение 13 месяцев.
Применение Хумира детям до 4 лет с бляшечная псориазом не изучалось.
Лекарственное средство Хумира доступен в других дозировках в зависимости от индивидуальных потребностей в лечении.
Увеит у детей.
Рекомендуемая доза Хумира для детей от 2 лет с хроническим неинфекционным увеитом зависит от массы тела (таблица 5). Хумира применяют подкожно. Нет данных относительно применения Хумира без сопутствующей терапии метотрексатом детям с увеитом.
Таблица 5. Дозировка Хумира детям с увеитом
масса тела | Доза |
До 30 кг | 20 мг 1 раз в 2 недели в комбинации с метотрексатом |
30 кг и больше | 40 мг 1 раз в 2 недели в комбинации с метотрексатом |
Хумира можно применять в комбинации с метотрексатом или другими небиологическими иммуномодулирующими препаратами в соответствии с клинического опыта. Начальная нагрузочная доза Хумира составляет 40 мг для пациентов с массой тела до 30 кг и 80 мг для пациентов с массой тела 30 кг и более; ее можно ввести за неделю до начала поддерживающей терапии. Нет клинических данных о введении начальной нагрузочной дозы Хумира детям до 6 лет. Применение Хумира детям до 2 лет по данным показаниям не обосновано. Рекомендуется ежегодно оценивать пользу и риск длительного лечения. Лекарственное средство Хумира доступен в других дозировках в зависимости от индивидуальных потребностей в лечении.
Пациенты пожилого возраста.
Коррекция дозы для данной группы пациентов не требуется.
Нарушение функции печени и / или почек.
Применение Хумира таким пациентам не исследовалось, поэтому рекомендации по изменению дозы отсутствуют.
Введение.
Хумира необходимо применять под наблюдением врача. По рекомендации врача пациенты или их родители / близкие люди могут самостоятельно вводить препарат после соответствующего обучения технике подкожного введения.
Используйте каждый предварительно наполненный шприц только для одной инъекции.
Поршень Упор для пальцев Колпачок иглы
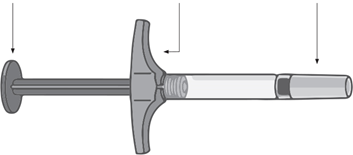
Не используйте шприц и сообщите Вашему врачу, если:
- если раствор помутнел, изменил цвет или содержит посторонние частицы
- если просроченный срок годности
- если жидкость замораживали или оставляли под прямыми солнечными лучами
- если шприц упал или поврежден
Не удаляйте колпачок до самой др ' инъекции. Храните Хумира в недоступном для детей месте.
ШАГ 1
Вытяните Хумира из холодильника.
Оставьте Хумира при комнатной температуре на 15 - 30 минут перед выполнением инъекции.
- Не удаляйте колпачок с иглы пока Хумира не достигнет комнатной температуры.
- Не нагревайте Хумира любым другим способом (например, в микроволновой печи или в горячей воде).
ШАГ 2
Шприц
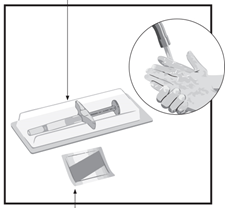
салфетка
Посмотрите на срок годности лекарственного средства. Не используйте препарат со сроком годности.
Выложите следующие предметы на чистую и ровную поверхность:
- один шприц для инъекции с Хумирой
- одну спиртовую салфетку
Хорошо помойте и высушите руки.
ШАГ 3
места для инъекций
Выберите места для инъекции
- передняя часть бедер или
- живот на расстоянии не менее 5 см от пупка
- каждая новая инъекция должна быть сделана на расстоянии как минимум 3 см от места предыдущего введения
Протрите спиртовой салфеткой круговыми движениями выбранное Вами место для инъекции.
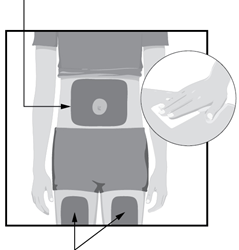
- Не вводите препарат через одежду
Не вводите препарат в область кожи, которая является чувствительной, где образовался синяк, покраснение, которая является твердой имеет шрамы, растяжки, или в участки с псориатическим бляшками.
ШАГ 4
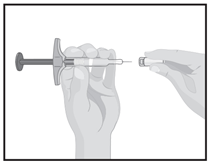
Держите предварительно наполненный шприц в одной руке.
Проверьте жидкость в шприце.
- Убедитесь, что жидкость чистая и бесцветная
- Не используйте шприц, если раствор помутнел или содержит посторонние частицы
- Не используйте шприц, если он упал или поврежден
Осторожно снимите колпачок с иглы шприца другой рукой. Не надевайте снова колпачок на иглу.
- Не прикасайтесь пальцами иглы и избегайте контакта иглы с любыми предметами.
ШАГ 5
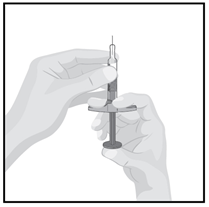
Держите шприц иглой вверх одной рукой на уровне глаз, так чтобы Вы могли видеть воздуха в шприце.
Медленно нажимайте поршень, чтобы выпустить воздух через иглу.
Это нормально увидеть каплю жидкости на конце иглы.
ШАГ 6
Держите корпус шприца одной рукой между большим и указательным пальцами так, будто держите карандаш.
Другой рукой осторожно возьмите участок очищенной кожи в складку и крепко удерживайте ее.
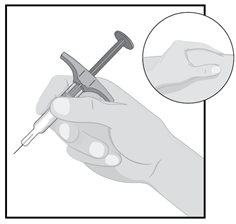
ШАГ 7
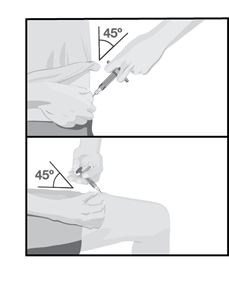
Одним быстрым коротким движением введите иглу полностью в кожу под углом примерно 45 градусов, после чего отпустите кожу.
Медленно нажимайте на поршень шприца до конца, пока вся жидкость не будет введена.
ШАГ 8
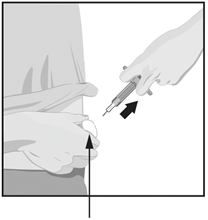
Когда инъекцию завершено, медленно вытяните иглу из кожи под тем же углом, что и вводили.
Прижмите ватным шариком или марлевой подушечкой место инъекции на 10 секунд.
Не трите кожу в месте инъекции.
В месте инъекции может возникать небольшое кровотечение - это нормально.
ШАГ 9
- Утилизация использованный шприц в соответствии с инструкциями Вашего врача, медсестры или фармацевта в соответствии с требованиями действующего законодательства.
- НИКОГДА не надевайте колпачок на иглу шприца после инъекции, Вы можете травмироваться.
- Не выбрасывайте использованные шприцы вместе с бытовым мусором.
- Держите шприц подальше от детей.
Дети
Показан для применения у детей в соответствии с разделом «Показания».
Передозировка
Максимальная доза Хумира, что переносится человеком, не установлена. В ходе клинических исследований Адалимумаб не было выявлено случаев дозолимитирующим токсичности. Пациентам назначались многократные дозы до 10 мг / кг, не сопровождалось признаками токсичности, связанной с передозировкой. В случае передозировки необходимо наблюдать за пациентом относительно появления каких-либо симптомов побочных реакций и немедленно проводить соответствующую симптоматическую терапию.
Побочные эффекты
В течение клинических испытаний.
Хумира исследовали в контролируемых клинических исследованиях и исследованиях открытого периода продолжительностью около 60 месяцев с участием 9506 пациентов с ранним и длительным ревматоидным артритом, ЮРА (полиартикулярним артритом и ентезит-ассоциированным артритом), а также с псориатическим артритом, аксиальным спондилоартритом (анкилозирующий спондилит и нерентгенографичний осевой спондилоартрит), болезнью Крона, язвенным колитом, псориазом, гнойным гидраденитом, увеитом.
Ниже приведены данные, полученные во время основных контролируемых исследований, в которых 6089 пациентам применяли Хумира и 3801 пациенту применяли плацебо или препарат сравнения в течение контролируемого периода.
В течение основных клинических испытаний 5,9% пациентов, получавших Хумира, и 5,4% пациентов из контрольной группы прекратили лечение из-за побочных реакции.
Общая информация по профилю безопасности.
Ожидается, что примерно у 13% пациентов могут возникнуть реакции в месте введения, что является одной из самых частых побочных реакций, которые наблюдались в течение применения Адалимумаб в контролируемых клинических испытаниях.
Чаще всего сообщалось о возникновении побочных реакций в виде инфекций (таких как назофарингит, инфекции верхних отделов дыхательных путей и синусит), реакций в месте введения (покраснение, зуд, геморрагии, боль или отек), головная боль и скелетно-мышечная боль.
Антагонисты ФНО, такие как Хумира, влияют на иммунную систему, их применение может привести к снижению сопротивляемости организма к инфекциям и злокачественных новообразований. При применении Хумира сообщалось о возникновении инфекций, которые могут представлять угрозу жизни человека и привести к смерти (включая сепсис, оппортунистические инфекции и туберкулез), о реактивации гепатита В и возникновения различных новообразований (включая лейкоз, лимфому и гепатолиенальную Т-клеточную лимфому).
Сообщалось также о серьезных гематологические, неврологические и аутоиммунные реакции, а именно: панцитопению, апластической анемией, случаи центральных и периферических демиелинизирующих расстройств, возникновения волчанки, волчаночноподобного состояний и синдрома Стивенса - Джонсона.
В таблице 6 представлены побочные реакции с возможным причинно-следственной связью, которые наблюдались в течение клинических и постмаркетинговых исследований у пациентов с РА, ЮРА, ПСА, аксиальным спондилоартритом (АС и нерентгенографичний осевой спондилоартрит), ПК, ХК или псориазом. Побочные реакции указано по органам и системам организма и частоте возникновения (≥ 1/10 - очень часто, от ≥1 / 100 до ˂1 / 10 - часто, от ≥ 1/1000 до ˂1 / 100 - нечасто, от ≥1 / 10000 до ˂1 / 1000 - редко).
Таблица 6
Органы и системы организма | Частота | побочные реакции |
Инфекции и инвазии * | очень часто | инфекции дыхательных путей (включая инфекции нижних и верхних отделов дыхательных путей, пневмония, синусит, фарингит, ринофарингит, пневмонию, вызванную вирусом герпеса) |
часто | системные инфекции (включая сепсис, кандидоз и грипп), кишечные инфекции (включая вирусный гастроэнтерит), инфекции кожи и мягких тканей (паронихия, целлюлит, импетиго, некротический фасциит, опоясывающий герпес), инфекции уха, инфекции ротовой полости (включая вирус простого герпеса, герпес ротовой полости и зубов), инфекции половых органов (включая грибковый вульвовагинит), инфекции мочевыводящих путей (включая пиелонефрит), грибковые инфекции, инфекции суставов | |
нечасто | оппортунистические инфекции (включая кокцидиоидомикоз, гистоплазмоз и инфекции комплекса mycobacterium avium), туберкулез, неврологические инфекции (включая вирусный менингит), инфекции глаза, бактериальные инфекции | |
Доброкачественные, злокачественные и неспецифические новообразования (включая кисты и полипы) * | часто | доброкачественные новообразования, рак кожи, за исключением меланомы (включая Базальноклеточный карциному и плоскоклеточное карциному) |
нечасто | лимфома **, новообразования паренхиматозных органов (включая рак молочной железы, опухоль легких и опухоль щитовидной железы), меланома ** | |
Со стороны кровеносной и лимфатической систем * | очень часто | лейкопения (включая нейтропению и агранулоцитоз), анемия |
часто | тромбоцитопения, лейкоцитоз; | |
нечасто | идиопатическая тромбоцитопеническая пурпура | |
редко | панцитопения | |
Со стороны иммунной системы * | часто | гиперчувствительность, аллергия (включая сезонную аллергию) |
Нарушение обмена веществ, метаболизма | очень часто | повышение уровня липидов крови |
часто | гипокалиемия, гиперурикемия, отклонения от нормы концентрации натрия в плазме крови, гипокальциемия, гипергликемия, гипофосфатемия, дегидратация | |
психические расстройства | часто | изменения настроения (включая депрессию), тревога, бессонница |
Неврологические расстройства * | очень часто | головная боль |
часто | парестезии (включая гипестезия), мигрень, сжатие нервных корешков; | |
нечасто | тремор, невропатия; | |
редко | рассеянный склероз | |
Со стороны органов зрения | часто | нарушение остроты зрения, конъюнктивит, блефарит, отек глаза; |
нечасто | диплопия | |
Со стороны органов слуха и вестибулярного аппарата | часто нечасто | головокружение; глухота, звон в ушах |
Кардиальные нарушения * | часто | тахикардия |
нечасто | аритмия, хроническая сердечная недостаточность | |
редко | остановка сердца | |
сосудистые расстройства | часто | артериальная гипертензия, приливы, гематома; |
нечасто | окклюзия артерий, тромбофлебит, аневризма аорты | |
Со стороны дыхательной системы, органов грудной клетки и средостения * | часто | кашель, астма, диспное; |
нечасто | хроническое обструктивное заболевание легких, интерстициальное заболевание легких, пневмонит | |
Желудочно-кишечные расстройства | очень часто | боль в животе, тошнота и рвота |
часто | желудочно-кишечное кровотечение, диспепсия, гастроэзофагеальный рефлюкс, сухой синдром (синдром Шегрена) | |
нечасто | панкреатит, дисфагия, отек лица | |
Расстройства пищеварительной системы * | очень часто | повышение уровня печеночных ферментов |
нечасто | холецистит и холелитиаз, повышение уровня билирубина, стеатоз печени | |
Со стороны кожи и подкожной клетчатки | очень часто | сыпь (включая эксфолиативный сыпь) |
часто | зуд, крапивница, экхимозы (включая пурпура), дерматит (включая экзему), онихоклазия, повышенная потливость; | |
нечасто | ночная потливость, рубцы | |
Со стороны опорно-двигательной системы и соединительной ткани | очень часто | скелетно-мышечная боль |
часто | спазмы мышц (включая повышение уровня КФК в плазме крови) | |
нечасто | рабдомиолиз, системная красная волчанка | |
Со стороны мочевыделительной системы | часто | гематурия, почечная недостаточность |
нечасто | никтурия | |
Расстройства репродуктивной системы и молочных желез | нечасто | эректильная дисфункция |
Общие нарушения и реакции в месте введения * | очень часто | реакции в месте введения (включая покраснение в месте введения) |
часто | боль в груди, отек | |
нечасто | воспаление | |
лабораторные исследования | часто | коагуляция и нарушения системы свертывания крови (включая удлинение активированного частично тромбопластинового времени (АЧТВ)), положительные тесты на аутоантитела (включая антитела к двухцепочечной ДНК), повышение уровня лактатдегидрогеназы в плазме крови |
Повреждения, отравления и процедурные осложнения * | часто | медленное заживление |
* См. также разделы «Противопоказания», «Особенности применения».
** Включая открытый период исследований.
Дети.
Обычно побочные реакции, возникающие у детей, были одинаковые по частоте и характеру с побочными реакциями, которые наблюдались у взрослых пациентов.
Реакции в месте введения.
В контролируемых клинических исследованиях у взрослых и детей, получавших Хумира, в 12,9% случаев развились реакции в месте введения (эритема и / или зуд, кровоизлияние, боль или отек) по сравнению с 7,2% пациентов контрольной группы. Большинство реакций были легкими и вообще не нуждались отмены препарата.
Инфекции.
В контролируемых клинических исследованиях у взрослых и детей уровень инфекций составил 1,51 / пациенто-год в группе пациентов, получавших Хумира, и 1,46 / пациенто-год в контрольной группе пациентов. Уровень серьезных инфекций составил 0,04 / пациенто-год в группе пациентов, получавших Хумира, и 0,03 / пациенто-год в контрольной группе пациентов. Преимущественно это были назофарингит, инфекции верхних дыхательных путей и синусит. Большинство пациентов продолжили применять Хумира после выздоровления.
В контролируемых и открытых исследованиях у взрослых и детей сообщалось о развитии тяжелых инфекций (редко с летальным исходом): туберкулеза (в том числе милиарного и внелегочной локализации) и инвазивных оппортунистических инфекций (таких как диссеминированный гистоплазмоз, пневмоцистная пневмония, аспергиллез, листериоз).
Новообразования и лимфопролиферативные расстройства.
В течение клинических исследований Адалимумаб у детей с ЮРА (полиартикулярним артритом и ентезит-ассоциированным артритом) злокачественных новообразований не наблюдалось (n = 249, 655,6 пациенто-года).
Дополнительно не наблюдалось злокачественных новообразований в клинических исследованиях у детей с болезнью Крона (n = 192; 498,1 пациенто-года), бляшечная псориазом (n = 77; 80,0 пациенто-года), увеитом (n = 60; 58,4 пациенто-года).
Во время контролируемых периодов основных исследований применения Хумира взрослым в течение не менее 12 недель у пациентов с ревматоидным артритом от среднего до высокой степени активности, пациентов с псориатическим артритом, аксиальным спондилоартритом (анкилозирующим спондилитом и нерентгенографичним аксиальным спондилоартритом), болезнью Крона, язвенным колитом, гнойным гидраденитом, увеитом и псориазом уровень новообразований (за исключением лимфомы и немеланомного рака кожи) составил (95% доверительный интервал) 6,8 (4,4; 10,5) на 1000 пациенто-лет в 5291 пациента, принимавших Хумира, по сравнению с уровнем 6,3 (3,4; 11,8) на 1000 пациенто-лет в 3444 пациентов контрольной группы (средняя продолжительность лечения составляла 4,0 месяца в группе применения Хумира и 3,8 месяца у пациентов контрольной группы).
Уровень немеланомного рака кожи (95% доверительный интервал) составил 8,8 (6,0; 13,0) на 1000 пациенто-лет у пациентов, принимавших Хумира, и 3,2 (1,3; 7,6) на 1000 пациенто-лет у пациентов контрольной группы. Среди приведенных случаев частота возникновения рака кожи, плоскоклеточной карциномы (95% доверительный интервал) составила 2,7 (1,4; 5,4) на 1000 пациенто-лет у пациентов, принимавших Хумира, и 0,6 (0,1; 4,5) на 1000 пациенто-лет у пациентов контрольной группы.
Уровень лимфом (95% доверительный интервал) составил 0,7 (0,2; 2,7) на 1000 пациенто-лет у пациентов, принимавших Хумира, и 0,6 (0,1; 4,5) на 1000 пациенто- лет у пациентов контрольной группы.
Темпы развития новообразований, наблюдались (за исключением лимфомы и немеланомного рака кожи), составляют примерно 8,5 / 1000 пациенто-лет в контролируемых исследованиях и в исследованиях открытого периода, которые еще продолжаются и уже завершены. Темпы развития немеланомного рака кожи составляли примерно 9,6 / 1000 пациенто-лет, а темпы развития лимфом - примерно 1,3 / 1000 пациенто-лет. Эти исследования продолжались примерно 3,3 года и включали 6427 пациентов, получавших Хумира крайней мере в течение 1 года или в которых новообразования возникли в течение года от начала терапии составляет более 26 439 пациенто-лет терапии.
Аутоантитела.
В ходе клинических исследований ревматоидного артрита 1-5 фазы пациентам несколько раз проводили анализ крови на наличие аутоантител. В этих контролируемых исследованиях у 11,9% пациентов, принимавших Хумира, и в 8,1% пациентов группы плацебо сообщалось о положительных титры, при активном мониторинга лечения наблюдались негативные титры антинуклеарных антител на 24 неделе.
У двух пациентов (с 3989 пациентов с РА, ПСА и АС, которые получали Хумира течение клинических испытаний) развились признаки волчаночноподобного синдрома (впервые выявленного), которые исчезли после прекращения лечения. Ни у одного пациента не развились люпус-нефрит или поражения центральной нервной системы. Влияние длительного применения Хумира на развитие аутоиммунных заболеваний неизвестен.
Псориаз.
Сообщалось о новых случаях возникновения псориаза, включая пустулезный псориаз и ладонно-подошвенный псориаз, а также о случаях ухудшения течения псориаза на фоне лечения ФНО-блокаторами, включая Хумира. Большинство пациентов получали параллельно иммунодепрессанты (например метотрексат, кортикостероиды). Некоторые из этих пациентов нуждались в госпитализации. У большинства пациентов наблюдалось улучшение течения псориаза после отмены блокатора ФНО. У некоторых пациентов наблюдался рецидив псориаза после повторной попытки применения различных блокаторов ФНО. В тяжелых случаях, а также если улучшения не наблюдается или наоборот, течение псориаза ухудшается, несмотря на местное лечение, следует рассмотреть вопрос о прекращении применения Хумира.
Активность печеночных ферментов.
В контролируемых клинических исследованиях 3 фазы (40 мг подкожно 1 раз в 2 недели) с участием пациентов с ревматоидным артритом и псориатическим артритом в течение контролируемого периода продолжительностью от 4 до 104 недель повышение АЛТ (АлАТ) в 3 или более раз от верхней границы нормы наблюдалось в 3,7% пациентов, получавших Хумира, и в 1,6% пациентов контрольной группы. Поскольку многие пациенты в этих исследованиях принимали лекарства, которые вызывают повышение уровня печеночных ферментов (например НПВС, метотрексат), взаимосвязь между Хумирой и повышением уровня печеночных ферментов не выяснен.
В контролируемых клинических исследованиях 3 фазы (начальная доза 160 мг и 80 мг или 80 мг и 40 мг в 1-й и на 15 день соответственно, а затем 40 мг 1 раз в 2 недели) с участием пациентов с болезнью Крона с продолжительностью контролируемого периода от 4 до 52 недель повышение АЛТ в 3 или более раз от верхней границы нормы наблюдалось в 0,9% пациентов обеих групп.
В контролируемых клинических исследованиях 3 фазы (начальная доза 160 мг и 80 мг в 1 и 15 день соответственно, затем 40 мг 1 раз в 2 недели) с участием пациентов с язвенным колитом с длительностью контролируемого периода от 1 до 52 недель повышение АЛТ в 3 или более раз от верхней границы нормы наблюдалось у 1,5% пациентов, получавших Хумира, и в 1,0% пациентов контрольной группы.
В контролируемых клинических исследованиях 3 фазы (начальная доза 80 мг, затем 40 мг 1 раз в 2 недели) с участием пациентов с бляшечная псориазом с продолжительностью контрольного периода от 12 до 24 недель повышение АЛТ в 3 или более раз от верхней границы нормы наблюдалось в 1 , 8% пациентов обеих групп.
В контролируемых клинических исследованиях (начальная доза 160 мг и 80 мг на 1-й и 15 день соответственно, а затем 40 мг 1 раз в неделю) с участием пациентов с гнойным гидраденитом с продолжительностью контролируемого периода от 12 до 16 недель повышение АЛТ в 3 или больше раз от верхней границы нормы наблюдалось в 0,3% пациентов, получавших Хумира, и в 0,6% пациентов контрольной группы.
В контролируемых клинических исследованиях (начальная доза 80 мг (неделя 0), а затем, начиная с недели 1, по 40 мг 1 раз в 2 недели) с участием пациентов с увеитом с продолжительностью контрольного периода до 80 недель (представлены средние значения 166,5 дня и 105 дней в группе терапии Хумирой и контрольной группе соответственно) повышение АЛТ в 3 или более раз от верхней границы нормы наблюдалось у 2,4% пациентов, получавших Хумира, и в 2,4% пациентов контрольной группы.
В контролируемых клинических исследованиях 3 фазы (40 мг каждые две недели) с участием пациентов с аксиальным спондилоартритом (анкилозирующим спондилитом и нерентгенографичним аксиальным спондилоартритом) с продолжительностью контрольного периода от 12 до 24 недель повышение АЛТ в 3 или более раз от верхней границы нормы наблюдалось в 2 , 1% пациентов, получавших Хумира, и 0,8% пациентов контрольной группы.
В контролируемых клинических исследованиях 3 фазы с участием пациентов в возрасте 4-17 лет с полиартикулярним артритом и пациентов в возрасте 6-17 лет с ентезит-ассоциированным артритом повышение АЛТ в 3 или более раз от верхней границы нормы наблюдалось в 6,1% пациентов, получавших Хумира, и 1,3% пациентов контрольной группы. Большинство случаев повышение АЛТ наблюдалось при сопутствующей терапии метотрексатом. Не наблюдалось повышение АЛТ в 3 или более раз от верхней границы нормы в клинических исследованиях 3 фазы у пациентов с полиартикулярним артритом в возрасте 2-4 года.
В клиническом исследовании 3 фазы с участием детей с болезнью Крона, где была оценена эффективность и безопасность двукратного по отношению к массе тела режима дозирования с последующим приведением к режиму дозирования в соответствии с массой тела с продолжительностью терапии до 52 недель, повышение АЛТ в 3 или более раз выше верхней границы нормы наблюдалось в 2,6% (5/192) пациентов, 4 из которых получали Хумира на фоне одновременного применения имуносупресантив.
Для всех показаний в клинических испытаниях пациенты имели бессимптомное повышение уровня АЛТ и в большинстве случаев повышение было преходящим на фоне длительного лечения. Однако были очень редкие постмаркетинговые сообщения о печеночной недостаточности и менее серьезные печеночные реакции, которые могут привести к печеночной недостаточности, такие как гепатит, включая аутоиммунный гепатит, у больных, получавших адалимумаб. Причинно-следственная связь с Адалимумаб остается не выясненным.
Сопутствующая терапия с азатиоприном / 6-меркаптопурином.
В исследованиях у взрослых пациентов с болезнью Крона, которые получали Хумира в сочетании с азатиоприном / 6-меркаптопурином, наблюдалось повышение частоты возникновения новообразований и тяжелых инфекций по сравнению с пациентами, получавшими монотерапию Хумирой.
Дополнительные побочные реакции, о которых сообщалось в течение постмаркетингового наблюдения или 4 фазы клинических испытаний (таблица 7).
Поскольку данная информация предоставляется добровольно, не всегда есть возможность достоверно оценить частоту таких осложнений и причинно-следственная связь.
Таблица 7
Органы и системы организма | побочные реакции |
Инфекции и инвазии | дивертикулит |
Доброкачественные, злокачественные и неопределенные новообразования (включая кисты и полипы) * | гепатолиенального Т-клеточная лимфома, лейкоз, карцинома Меркеля (нейроэндокринная карцинома кожи) |
Со стороны иммунной системы * | анафилаксия, саркоидоз, васкулит |
Неврологические расстройства * | демиелинизирующие расстройства (например неврит зрительного нерва, синдром Гийена - Барре), инсульт |
Со стороны дыхательной системы, органов грудной клетки и средостения | легочная эмболия, плевральный выпот, легочный фиброз |
Желудочно-кишечные расстройства * | перфорация кишечника |
Расстройства пищеварительной системы * | гепатит, реактивация гепатита В, печеночная недостаточность, аутоиммунный гепатит |
Со стороны кожи и подкожной клетчатки | кожный васкулит, синдром Стивенса - Джонсона, ангионевротический отек, новые случаи или ухудшение течения псориаза (в том числе ладонно-подошвенного пустулезной псориаза), мультиформная эритема, алопеция, ухудшение симптомов дерматомиозита, лихеноидная реакция кожи |
Со стороны опорно-двигательной системы и соединительной ткани | волчаночноподобный синдром |
Сердечно-сосудистые расстройства | инфаркт миокарда |
Общие нарушения и реакции в месте введения * | пирексия |
* Подробнее см. в разделах "Противопоказания», «Особенности применения» и «Побочные реакции».
Срок годности Хумира
2 года.
Не следует применять препарат после окончания срока годности.
Условия хранения Хумира
Хранить в недоступном для детей месте при температуре от 2 до 8 ° С (в холодильнике) в оригинальной картонной упаковке. Не замораживать.
Возможно хранение при комнатной температуре (не выше 25 ° С) в течение не более 14 дней в защищенном от света месте. Не использовать через 14 дней после извлечения из холодильника (даже если препарат был снова помещен в холодильник).
Упаковка
По 0,2 мл раствора в предварительно наполненном однократной шприце.
По 1 шприцу вместе с 1 салфеткой, пропитанной 70% изопропилового спирта, помещают в контурной ячейковой упаковке. По 2 шприца (в контурной ячейковой упаковке с 1 салфеткой каждый) в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Выпуск серии.
Еббви Биотекнолоджи ГмбХ, Германия / AbbVie Biotechnology GmbH, Germany.
Местонахождение производителя
Кнольштрассе, 67061 Людвигсхафен, Германия / Knollstrasse, 67061 Ludwigshafen, Germany.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Хумира только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Веттер Фарма-Фертигунг ГмбХ и Ко. КГ
Хумира и Алкоголь?
Ваше состояние само по себе может ухудшаться после приема спиртного, так как алкоголь расширяет сосуды и вызывает отечность. Не рекомендуем принимать алкоголь в течение всего курса приема препарата Хумира, а также несколько дней после завершения лечения.
| Тип данных | Сведения из реестра |
| Торговое наименование: | Хумира |
| Производитель: | Веттер Фарма-Фертигунг ГмбХ и Ко. КГ |
| Форма выпуска: | раствор для инъекций 20 мг / 0,2 мл по 0,2 мл раствора в предварительно наполненном однократной шприце, по 1 шприцу вместе с 1 салфеткой, пропитанной 70% изопропилового спирта (в ламинированной полиэтиленом бумаге), помещают в контурной ячейковой упаковке; по 2 шприца (в контурной ячейковой упаковке с 1 салфеткой каждый) в картонной коробке |
| Регистрационное удостоверение: | UA/16818/01/01 |
| Дата начала: | 22.02.2019 |
| Дата окончания: | 22.02.2024 |
| МНН: | Adalimumab |
| Условия отпуска: | по рецепту |
| Состав: | 1 предварительно наполненный однократной шприц содержит 20 мг Адалимумаб в 0,2 мл раствора |
| Фармакологическая группа: | Иммунодепрессанты. Ингибиторы фактора некроза опухоли-альфа. Адалимумаб. |
| Код АТХ: | L04AB04 |
| Заявитель: | ЕббВи Биофармасьютикалз ГмбХ |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Нейхофштрассе 23 6341 Баар, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
