- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Фулведжект инструкция по применению
Официальная инструкция лекарственного препарата Фулведжект раствор 250 мг/5 мл. Описание и применение Fulvedzhekt, аналоги и отзывы. Инструкция Фулведжект раствор утвержденная компанией производителем.
Состав
действующее вещество : фулвестрант;
1 предварительно заполненный шприц (5 мл) содержит фулвестрант 250 мг.
вспомогательные вещества : этанол 96%, спирт бензиловый, бензилбензоат, масло касторовое.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: прозрачный, вязкий, маслянистый раствор от бесцветного до желтого цвета.
Фармакологическая группа
Антагонисты гормонов и аналогичные средства. Антиэстрогеновые средства.
Код АТХ L02B A03.
Фармакологические свойства
Фармакологические.
Механизм действия и фармакодинамические эффекты
Фулвестрант является конкурентным антагонистом эстрогеновых рецепторов (ЭР), родство с которыми сравнима с эстрадиолом. Фулвестрант блокирует трофическое действие эстрогенов, не проявляя частичной агонистической (эстрогеноподобной) активности. Механизм действия связан с отрицательной регуляцией уровня белков эстрогеновых рецепторов. Клинические исследования с участием женщин в постменопаузе с первичным раком молочной железы показали, что фулвестрант сравнению с плацебо значительно уменьшает уровень белков ЭР при опухоли с положительными ЭР. Наблюдалось также значительное уменьшение экспрессии прогестероновых рецепторов, что согласуется с отсутствием характерных агонистам эстрогенов эффектов. Также было показано, что фулвестрант в дозе 500 мг в большей степени, чем фулвестрант в дозе 250 мг,
Клиническая безопасность и эффективность применения препарата на поздних стадиях рака молочной железы
Клиническое исследование фазы ИИИ CONFIRM было проведено с участием 736 женщин в постменопаузе с поздними стадиями рака молочной железы, имели рецидив заболевания на фоне или после адъювантной эндокринной терапии или прогрессирования после эндокринной терапии по поводу поздних стадий заболевания.
В исследование было включено 423 пациентки, у которых болезнь прогрессировала или отмечался рецидив на фоне антиэстрогенной терапии (подгруппа АЭ), и 313 пациенток, у которых болезнь прогрессировала или рецидивировала на фоне лечения ингибитором ароматазы (подгруппа АИ). Это исследование сравнивало эффективность и безопасность применения Фулвестрант в дозе 500 мг (n = 362) с Фулвестрант в дозе 250 мг (n = 374). Главной конечной точкой была выживаемость без прогрессирования заболевания (ВБП) ключевые вторичные конечные точки эффективности включали частоту объективного ответа (ЧОО), частоту клинической эффективности (ЧКЕ) и общую выживаемость (ОВ). Результаты эффективности для исследования CONFIRM обобщенно ниже в Таблице 1.
Таблица 1
Обобщение результатов анализа главной конечной точки эффективности (ВБП) и ключевых вторичных конечных точек эффективности в исследовании CONFIRM
| Тип оценки; сравнения лечения | Фулвестрант | Фулвестрант 250 мг | Сравнение между группами | ||
соотношение рисков | 95% ДИ | p-значение | ||||
ВБП | KM медиана в месяцах; | |||||
все пациенты | 6,5 | 5,5 | 0,80 | 0,68, 0,94 | 0,006 | |
- подгруппа AE (n = 423) | 8,6 | 5,8 | 0,76 | 0,62, 0,94 | 0,013 | |
- подгруппа AI (n = 313) a | 5,4 | 4,1 | 0,85 | 0,67, 1,08 | 0,195 | |
ЗВb | KM медиана в месяцах; | |||||
все пациенты | 26,4 | 22,3 | 0,81 | 0,69, 0,96 | 0,016c | |
- подгруппа AE (n = 423) | 30,6 | 23,9 | 0,79 | 0,63, 0,99 | 0,038c | |
- подгруппа AI (n = 313) a | 24,1 | 20,8 | 0,86 | 0,67, 1,11 | 0,241c | |
переменная | Тип оценки; сравнения лечения | Фулвестрант | фулвестрант 250 мг | Сравнение между группами | ||
Абсолютная разница в% | 95% ДИ | |||||
ЧОВ д | % Пациентов с ОВ; | |||||
все пациенты | 13,8 | 14,6 | -0,8 | -5,8, 6,3 | ||
- подгруппа AE (n = 296) | 18,1 | 19,1 | -1,0 | 8,2, -9,3 | ||
- подгруппа AI (n = 205) a | 7,3 | 8,3 | -1,0 | -5,5, 9,8 | ||
ЧКЕе | % Пациентов с КЭ; | |||||
все пациенты | 45,6 | 39,6 | 6,0 | -1,1, 13,3 | ||
- подгруппа AE (n = 423) | 52,4 | 45,1 | 7,3 | -2,2, 16,6 | ||
- подгруппа AI (n = 313) a | 36,2 | 32,3 | 3,9 | -6,1, 15,2 | ||
а Фулвестрант показан пациенткам, чья болезнь рецидивировала или прогрессировала на фоне антиэстрогенной терапии. Результаты в подгруппе АИ не являются окончательными.
b Значение ЗВ представлено для окончательного анализа выживаемости при обработке 75% данных.
с Номинальное р-значение без каких-либо корректировок, сделанных для повторяемости между первичными анализами ЗВ при 50% обработке и обновленными анализами выживаемости при обработке 75% данных.
d ЧОО была проанализирована у пациенток, ответ которых оценивалась на исходном уровне (то есть они имели проявления заболевания, которые можно было оценить на исходном уровне 240 пациенток в группе применения Фулвестрант в дозе 500 мг и 261 пациенток в группе применения Фулвестрант в дозе 250 мг) .
eПациенты с лучшей объективной ответом полного ответа, частичным ответом или стабилизацией заболевания в течение ≥ 24 недель.
ВБП: выживаемость без прогрессирования заболевания; ЧОО: частота объективного ответа; ОВ: объективный ответ; ЧКЕ: частота клинической эффективности; КЭ: клиническая эффективность; ЗВ: общая выживаемость; К М: Каплан-Мейер; ДИ: доверительный интервал; AI: ингибитор ароматазы; АЕ: антиэстрогены.
Было проведено рандомизированное двойное слепое с двойным маскировкой мультицентровые исследования Фазы 3 по изучению эффективности Фулвестрант 500 мг по сравнению с анастрозолом 1 мг у женщин в постменопаузе с местно или метастатическим раком молочной железы с положительными эстроген- и / или прогестерон-рецепторами, которые ранее не получали гормонотерапии . В общем 462 пациентки были последовательно рандомизированы 1: 1 в группу Фулвестрант 500 мг анастрозола 1 мг.
Рандомизация была стратифицированная по признакам заболевания (местно рак или метастатическим), предварительно проведенной химиотерапией в случае распространенного заболевания и клиническими проявлениями заболевания.
Первичной конечной точкой эффективности была ВБП, по оценке исследователя в соответствии с RESIST1.1 (Response Evaluation Criteria in Solid Tumors). Ключевыми вторичными точками эффективности были приняты ЗВ и ЧОО.
Медиана возраста пациенток, вовлеченных в это исследование, составляла 63 года (в диапазоне от 39 до 90 лет). У большинства пациенток (87,0%) наблюдалась метастатическая форма заболевания в начале исследования. 55% пациенток имели метастазы во внутренние органы в начале исследования. В общем 17,1% пациенток получали химиотерапию ранее в связи с распространенным заболеванием, 84,2% пациенток имели измеряемые проявления заболевания.
Достоверные результаты наблюдались у большинства пациенток с предварительно определенных подгрупп. В подгруппе пациенток с метастазами не во внутренние органы (n = 208), получавших фулвестрант, ВР составило 0,592 (95% ДИ = 0,419-0,837) по сравнению с пациентками, которые получали анастрозол. В подгруппе пациенток с метастазами во внутренние органы (n = 254), получавших фулвестрант 500 мг ВР составило 0,993 (95% ДИ = 0,740-1,331) по сравнению с пациентками, которые получали анастрозол. Результаты эффективности исследования FALCON приведены в таблице 2 и на графике 1.
Таблица 2.
Обобщение результатов анализа главной конечной точки эффективности (ВБП) и ключевых вторичных конечных точек эффективности в исследовании FALCON (оценка исследователем, выборка «все рандомизированные пациенты согласно назначенного лечения»)
Фулвестрант 500 мг (n = 230) | Анастрозол 1 мг (n = 232) | |
ВБП | ||
Количество случаев ВБП (%) | 143 (62,2 %) | 166 (71,6 %) |
ВБП ВР (95% ДИ) и р-значения | АД = 0,797 (0,637-0,999) р = 0,0486 | |
ВБП в среднем [месяц (95% ДИ)] | 16,6 (13,8, 21,0) | 13,8 (12,0, 16,6) |
Количество случаев ЗВ * | 67 (29,1 %) | 75 (32,3 %) |
ЗВ ВР (95% ДИ) и р-значения | АД = 0,875 (0,629-1,217) р = 0,4277 | |
ЛОДКА ** | 89 (46,1 %) | 88(44,9 %) |
ЧОО ВР (95% ДИ) и р-значения | АД = 1074 (0,716—1,614) р = 0,7290 | |
Медиана продолжительности ответа (месяцев) | 20,0 | 13,2 |
ЧКЕ | 180 (78,3 %) | 172 (74,1 %) |
ЧКЕ ВР (95% ДИ) и p-значение | АД = 1253 (0,815—1,932) р = 0,3045 | |
* (31% обработка) - не финальный анализ ЗВ.
** Для пациенток с измеряемыми проявлениями болезни.
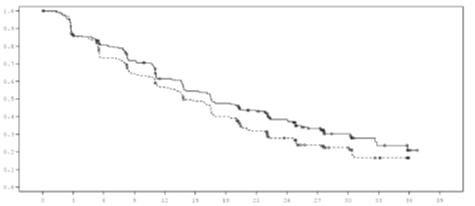
График 1.
Кривая ВБП по Капланом-Мейером (оценка исследователя, выборка «все рандомизированные пациенты согласно назначенного лечения» ) - исследование FALCON.
вероятность ВБП |
Время от рандомизации (месяцы) |
Лечение фулвестрант 500 мг (n = 230) ... анастрозол 1 мг (n = 232) | |
Количество пациентов с рисками Ful500 230187171150124110 96 81 63 44 24 11 2 0 Анас1 232 194 162 139 120 102 81 60 45 31 22 10 0 0 |
Влияние на эндометрий в постменопаузе
Доклинические данные свидетельствуют об отсутствии стимулирующего влияния Фулвестрант на эндометрий в постменопаузе. Двухнедельное исследование с участием здоровых добровольцев в постменопаузе, которые получали этинилэстрадиол по 20 мкг в сутки, показало, что по сравнению с предыдущим лечением плацебо, предварительное лечение Фулвестрант в дозе 250 мг приводило к значительному уменьшению стимулирующего влияния на эндометрий в постменопаузальный период по данным ультразвукового измерения толщины эндометрия.
НЕОАДЪЮВАНТНАЯ лечения продолжительностью до 16 недель у пациенток с раком молочной железы, получавших лечение или Фулвестрант в дозе 500 мг Фулвестрант в дозе 250 мг, не приводил к клинически значимых изменений в толщине эндометрия, что указывало на отсутствие агонистического влияния. До сих пор нет доказательств отрицательного влияния на эндометрий при лечении пациенток с раком молочной железы. Нет доступных данных по морфологической структуры эндометрия.
В двух краткосрочных исследованиях (1 и 12 недель) с участием пациенток в пременопаузе с доброкачественными гинекологическими заболеваниями между группами лечения Фулвестрант и плацебо не наблюдалось никаких статистически значимых различий в толщине эндометрия, что было подтверждено данными ультразвукового обследования.
Влияние на кости
Долгосрочные данные о влиянии Фулвестрант на кости отсутствуют. НЕОАДЪЮВАНТНАЯ лечения продолжительностью до 16 недель у пациенток с раком молочной железы, получавших лечение или Фулвестрант в дозе 500 мг, или Фулвестрант в дозе 250 мг, не приводил к клинически значимых изменений в уровнях сывороточных маркеров костного ремоделирования.
педиатрическая популяция
Фулвестрант не показан для лечения детей.
В открытом исследовании Фазы 2 исследовали безопасность, эффективность и фармакокинетику Фулвестрант в 30 девочек в возрасте от 1 до 8 лет с нарастающим преждевременным половым созреванием, связанным с синдромом Олбрайта - Мак-Кьюна - Штернберга (MAS). Дети получали ежемесячно внутримышечно 4 мг / кг Фулвестрант. В этом 12-месячном исследовании изучался спектр конечных точек по эффективности применения препарата при MAS. Результаты исследования показали снижение частоты вагинальных кровотечений и снижение темпов созревания костного возраста. Минимальные равновесные концентрации Фулвестрант у детей в этом исследовании согласовывались с концентрацией препарата у взрослых (см. Раздел «Фармакокинетика»). Никаких новых вопросов, связанных с безопасностью применения препарата, не возникло в процессе проведения этого небольшого исследования,
Фармакокинетика.
всасывания
После введения Фулвестрант в виде инъекции пролонгированного действия фулвестрант медленно всасывается, а максимальная концентрация в плазме крови (Cmax) достигается через 5 дней. При режиме применения Фулвестрант в дозе 500 мг уровне экспозиции равновесного состояния или близкого к нему достигается в течение первого месяца лечения (среднее значение [коэффициент вариации (КВ)]: AUC 475 [33,4%] нг.день / мл, Cmax 25,1 [35,3%] нг / мл, Cmin 16,3 [25,9%] нг / мл соответственно). В равновесном состоянии концентрации Фулвестрант в плазме крови сохраняются в пределах относительно узкого диапазона с примерно трехкратной разницей между максимальной и минимальной концентрациями. После введения в диапазоне дозирования от 50 до 500 мг экспозиция примерно пропорциональна дозе.
распределение
Фулвестрант экстенсивно и быстро распределяется. Значительный кажущийся объем распределения в равновесном состоянии (Vdss), что составляет примерно от 3 до 5 л / кг, свидетельствует о преимущественно экстраваскулярный распределение. Фулвестрант значительной степени (99%) связывается с белками плазмы крови. Главными компонентами связывания являются фракции липопротеидов очень низкой плотности (ЛПОНП), липопротеидов низкой плотности (ЛПНП) и липопротеидов высокой плотности (ЛПВП). Исследование взаимодействия на предмет конкурентного связывания белков не проводили. Роль глобулина, связывается с половыми гормонами (ГСПГ), не установлена.
Метаболизм
Метаболизм Фулвестрант полностью не изучен, но включает комбинацию многочисленных возможных метаболических путей биотрансформации, аналогичных в метаболических путей биотрансформации эндогенных стероидов. Идентифицированы метаболиты (включая метаболиты 17-кетон, сульфон, 3-сульфат, 3- и 17-глюкуронид) в антиэстрогенной моделях более или менее активными, либо демонстрируют подобную Фулвестрант активность. Исследования с использованием препаратов печени человека и рекомбинантных человеческих ферментов показывают, что CYP3A4 является единственным изоферментом 450, участвующий в окислении Фулвестрант, однако считается, что in vivo преобладают не связаны с 450 пути. In vitro данные свидетельствуют, что фулвестрант не угнетает изоферменты CYP450.
вывод
Фулвестрант выводится преимущественно в Метаболизированный форме. Основной путь удаления - с калом, при этом менее 1% выводится с мочой. Фулвестрант имеет высокий клиренс, 11 ± 1,7 мл / мин / кг, что свидетельствует о высоком печеночный коэффициент экстракции. Конечный период полувыведения (t1 / 2) после внутримышечного введения определяется скоростью всасывания и оценено 50 дней.
Отдельные категории пациентов
При популяционном фармакокинетического анализа данных исследований Фазы 3 не выявлено различий в фармакокинетическом профили Фулвестрант в силу возраста (диапазон от 33 до 89 лет), массу тела (от 40 до 127 кг) или расовую принадлежность.
Нарушение функции почек
Степень влияния легкой или умеренной нарушения функции почек на фармакокинетику Фулвестрант не достигает клинически существенного значения.
Нарушение функции печени
Фармакокинетика Фулвестрант оценивалась в клиническом исследовании с использованием одноразовой дозы препарата, проведенном с участием женщин с легкими и умеренными нарушениями функции печени (класс A и B по Чайлд-Пью). В течение непродолжительного времени применяли высокую дозу препарата для инъекций. По сравнению со здоровыми добровольцами у женщин с нарушениями функции печени наблюдалось увеличение AUC почти в 2,5 раза. Ожидается, что увеличение AUC до такой величины у пациенток, которым вводится фулвестрант, будет хорошо переноситься. Женщины с тяжелыми нарушениями функции печени (класс C по Чайлд-Пью) не оценивали.
педиатрическая популяция
Фармакокинетика Фулвестрант оценивалась в клиническом исследовании, проведенном с участием 30 девочек с нарастающим преждевременным половым созреванием, связанным с синдромом Олбрайта-Мак-Кьюна-Штернберга (см. Раздел «Фармакологические»). Педиатрические пациенты в возрасте от 1 до 8 лет получали внутримышечно фулвестрант в дозе 4 мг / кг в месяц. Геометрическая средняя (стандартное отклонение) минимальная концентрация в равновесном состоянии (Cmin, ss) и AUCss составили 4,2 (0,9) нг / мл и 3680 (1020) нг * ч / мл соответственно. Хотя полученные данные ограничены, равновесные минимальные концентрации Фулвестрант у детей, вероятно, согласуются с таковыми у взрослых.
Клинические характеристики
Фулведжект Показания
Фулвестрант показан для лечения рака молочной железы с естрогенпозитивнимы рецепторами, местно или с метастазами у женщин в постменопаузе:
- ранее не получавших гормональную терапию,
- в случае рецидива болезни во время или после адъювантной антиэстрогенной терапии или прогрессирования болезни при антиэстрогенной терапии.
Противопоказания
Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ препарата.
Беременность и лактация (см. Раздел «Применение в период беременности или кормления грудью»).
Тяжелая печеночная недостаточность (см. Разделы «Фармакокинетика» и «Особенности применения»).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследование клинической взаимодействия с мидазоламом (субстратом CYP3A4) продемонстрировало, что фулвестрант не угнетает CYP3A4. Исследование клинического взаимодействия с рифампицином (индуктором CYP3A4) и кетоконазолом (ингибитором CYP3A4) не показали клинически значимых изменений в клиренсе Фулвестрант. Таким образом, для пациентов, которые одновременно принимают фулвестрант и ингибиторы или индукторы CYP 3А4, коррекции дозы не требуется.
Особенности применения
Фулвестрант следует с осторожностью применять пациентам с нарушениями функции печени легкой и средней степени тяжести (См. «Фармакокинетика», «Противопоказания» и «Применение»).
Фулвестрант следует с осторожностью применять пациентам с тяжелыми нарушениями функции почек (клиренс креатинина менее 30 мл / мин).
Учитывая внутримышечно путь введения, фулвестрант следует с осторожностью применять при лечении пациентов с геморрагический диатез, тромбоцитопения или тех, которые принимают антикоагулянты.
Тромбоэмболические реакции обычно наблюдаются у женщин, больных прогрессирующий рак молочной железы и были зарегистрированы в клинических исследованиях Фулвестрант (см. Раздел «Побочные реакции»). Это следует учитывать при назначении Фулвестрант пациенткам, которые входят в группу риска.
При введении препарата Фулведжект сообщали о реакции, связанные с местом инъекции, включая ишиас, невралгии, нейропатической боли и периферической нейропатии. Из-за близости расположения седалищного нерва следует соблюдать осторожность при введении препарата Фулведжект в верхний наружный квадрант ягодичной области (см. Разделы «Способ применения и дозы» и «Побочные реакции»).
Нет данных долгосрочных исследований влияния Фулвестрант на кости. Через механизм действия Фулвестрант существует потенциальный риск развития остеопороза.
Препарат содержит этанол. Вреден для пациентов, больных алкоголизмом. Следует соблюдать осторожность при применении препарата пациенткам с заболеваниями печени и больным эпилепсией.
Препарат содержит масло касторовое, которая может вызвать тяжелые аллергические реакции.
Влияние на исследование эстрадиола с помощью антител
Через структурное сходство Фулвестрант и эстрадиола фулвестрант может влиять на результаты исследований уровня эстрадиола, проводимых на основе реакции с антителами, и вызывать получения ложно повышенных уровней эстрадиола.
педиатрическая популяция
Фулвестрант не рекомендуется для применения детям и подросткам, поскольку его безопасность и эффективность для этой возрастной группы установлен (см. Раздел «Фармакологические»).
Применение в период беременности или кормления грудью
Женщины репродуктивного лет
Пациенткам репродуктивного возраста следует рекомендовать использовать эффективные средства контрацепции во время лечения.
беременность
Фулвестрант противопоказан в период беременности (см. Раздел «Противопоказания»). Было показано, что фулвестрант проходит через плацентарный барьер после однократного внутримышечного введения препарата у крыс и кроликов. Исследования на животных показали репродуктивной токсичности, включая рост частоты аномалий и смерти плода. Если пациентка забеременела в период лечения Фулвестрант, ее следует проинформировать о потенциальной опасности для плода и потенциальный риск прерывания беременности.
Период кормления грудью
Во время лечения Фулвестрант грудное вскармливание следует прекратить. Фулвестрант выводится в молоко у лактирующих крыс. До сих пор неизвестно, выделяется фулвестрант в грудное молоко. Учитывая возможность возникновения в младенцев, находящихся на грудном вскармливании, серьезных нежелательных реакций, вызванных Фулвестрант, кормление грудью противопоказано в период применения этого лекарственного средства (см. Раздел «Противопоказания»).
фертильность
Влияние Фулвестрант на фертильность у человека не исследован.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Фулвестрант не влияет или оказывает незначительное влияние на способность управлять транспортными средствами и работать с механизмами. Однако, поскольку при лечении Фулвестрант сообщали об очень частые случаи астении, пациентам, у которых во время управления транспортными средствами или работе с механизмами развилась эта побочная реакция, следует соблюдать осторожность.
Способ применения Фулведжект и дозы
дозировка
Взрослые женщины (включая лиц пожилого возраста)
Рекомендуемая доза составляет 500 мг с интервалом один месяц, через 2 недели после первой инъекции вводится дополнительная доза 500 мг.
Отдельные категории пациентов
Нарушение функции почек
Для пациенток с нарушением функции почек легкой и средней степени тяжести (клиренс креатинина ≥ 30 мл / мин) коррекции дозы не требуется. Эффективность и безопасность лекарственного препарата ни оценивали у пациенток с тяжелыми нарушениями функции почек (клиренс креатинина <30 мл / мин) поэтому таким пациенткам препарат следует применять с осторожностью (см. Раздел «Особенности применения»).
Нарушение функции печени
Для пациенток с нарушениями функции печени легкой и средней степени тяжести коррекция дозы не требуется. Однако таким пациенткам фулвестрант следует применять с осторожностью, учитывая возможный рост AUC Фулвестрант. Данные по пациенток с тяжелыми нарушениями функции печени отсутствуют (см. Разделы «Фармакокинетика» и «Особенности применения»).
способ применения
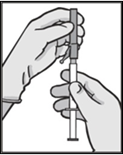
Фулведжект следует вводить в виде двух последовательных медленных (1-2 минуты на инъекцию) внутримышечных инъекций по 5 мл, по одной в каждую ягодицу (ягодичную область).
Из-за близости расположения седалищного нерва следует соблюдать осторожность при введении препарата Фулведжект в верхний наружный квадрант ягодичной области.
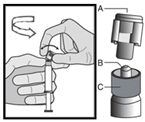
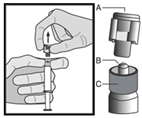
Инструкция по введению
Препарат следует вводить в соответствии с местными правилами проведения внутримышечных инъекций большого объема.
ПРИМЕЧАНИЕ.
Из-за близости расположения седалищного нерва следует соблюдать осторожность при введении препарата Фулведжект в верхний наружный квадрант ягодичной области (см. Раздел «Особенности применения»).
Предостережение: не стерилизовать в автоклаве безопасную иглу перед использованием.
В течение всего времени использования и удаления руки должны находиться позади иглы.
Для каждого из двух шприцев:
|
|
|
|
Утилизация
Предварительно заполненные шприцы предназначены только для однократного использования.
Любые неиспользованные изделия медицинского назначения или отходы необходимо утилизировать в соответствии с местными требованиями.
Дети
Безопасность и эффективность применения Фулвестрант для детей от рождения до 18 лет не установлены. Доступна до сих пор информация приведена в разделах «Фармакологические» и «Фармакокинетика», однако рекомендаций относительно дозирования сделать нельзя.
Передозировка
Есть отдельные сообщения о случаях передозировки Фулвестрант у людей. В случае передозировки рекомендуется проводить симптоматическое поддерживающее лечение. В исследованиях на животных высокие дозы Фулвестрант не проявляли других эффектов кроме прямым или косвенно связанные с антиэстрогенным действием.
Побочные эффекты
Побочными реакциями, о которых сообщали чаще всего, являются реакции в месте инъекции, астения, тошнота и повышение уровня печеночных ферментов (АЛТ (аланинаминотрансфераза), АСТ (аспартатаминотрансфераза), ЛФК (ЩФ)).
Следующие категории частоты побочных реакций были рассчитаны на основании данных группы лечения Фулвестрант 500 мг с объединенного анализа безопасности исследований, где сравнивались фулвестрант 500 мг и фулвестрант 250 мг [CONFIRM (исследование D6997C00002), FINDER 1 (исследования D6997C00004), FINDER 2 ( исследования D6997C00006) и NEWEST (исследование D6997C00003)], или с отдельного исследования FALCON (исследование D699BC00001), в котором сравнивались фулвестрант 500 мг и анастрозол 1 мг. Если частота побочных реакций в объединенном анализе безопасности и в FALCON отличалась, то брали самую высокую частоту. Частота в приведенной таблице 3 была определена на основании данных о всех зафиксированных побочных реакций, независимо от оценки исследователем причинной связи.
Приведенные ниже побочные реакции классифицированы по частоте и классами систем органов. Частоту определены следующим образом: очень часто (≥ 1/10), часто (≥ 1/100, <1/10), нечасто (≥ 1/1000, <1/100). В рамках группы по частоте побочные реакции указаны в порядке уменьшения их серьезности.
Таблица 3.
Побочные реакции на препарат
Побочные реакции, классифицированные в соответствии с частотой и класса систем органов | ||
Инфекции и инвазии | часто | Инфекции мочевыводящих путей |
Со стороны иммунной системы | очень часто | реакции гиперчутливостиe |
нечасто | анафилактические реакции | |
Со стороны метаболизма и питания | часто | анорексия а |
Со стороны нервной системы | часто | Головная боль |
Со стороны сосудов | очень часто | приливы e |
часто | Венозная тромбоэмболия а | |
Со стороны пищеварительного тракта | очень часто | тошнота |
часто | Рвота, диарея | |
Со стороны печени и желчевыводящих путей | очень часто | Повышение уровня печеночных ферментов (АЛТ, АСТ, ЩФ) а |
часто | Повышение уровня билирубина a | |
нечасто | Печеночная недостаточность с, f, гепатит f, повышение уровня ГГТ f | |
Со стороны кожи и подкожной клетчатки | очень часто | высыпания e |
Со стороны костно-мышечной системы и соединительной ткани | очень часто | Боль в суставах и скелетных мышцах d |
часто | Боль в спине а | |
Со стороны репродуктивной системы и молочных желез | часто | Вагинальное кровотечение e |
нечасто | Вагинальный кандидоз f, лейкорея f | |
Общие нарушения и состояния в месте введения препарата | очень часто | Астения а реакции в месте инъекции b |
часто | Периферическая нейропатия e, ишиас e | |
нечасто | Геморрагии в месте инъекции f, гематомы в месте инъекции f, невралгия c, f, | |
Со стороны крови и лимфатической системы | часто | Снижение количества тромбоцитов e |
a Включено побочные реакции на препарат, для которых связь с Фулвестрант не может быть установлен через основное заболевание.
b Термин «реакции в месте инъекции» не включает в себя термины «геморрагии в месте инъекции» и «гематома в месте инъекции», «ишиас», «невралгия», «периферическая нейропатия».
c Реакция наблюдалась в крупных клинических исследованиях (CONFIRM, FINDER 1, FINDER 2, NEWEST).
Частота была рассчитана с использованием верхнего предела 95% ДИ для оценки точки. Она рассчитывалась как 3/560 (где 560 - это количество пациентов в крупных клинических исследованиях), что соответствует частоте категории «редко».
d Включает артралгию и реже - мышечно-костный боль, миалгии и боль в конечностях.
e Существуют некоторые различия между частотой побочных реакций в соответствующих категориях в отношении органов и систем органов в исследовании по безопасности и исследовании FALCON.
f Нежелательные реакции не наблюдали в исследовании FALCON.
Описание отдельных побочных реакций
Приведено описание базируется на анализе безопасности группы с 228 пациенток, получивших не менее 1 дозу Фулвестрант и группы с 232 пациенток, получивших не менее 1 дозу анастрозола в исследовании Фазы 3 FALCON.
Боль в суставах и костно-мышечная боль
По данным исследования FALCON, количество пациенток, сообщили о боли в суставах и костно-мышечная боль, составляла 65 (31,2%) и 48 (24,1%) при приеме Фулвестрант и анастрозола соответственно. С 65 пациенток, получавших фулвестрант, 40% (26/65) пациенток отмечали суставной и костно-мышечная боль в течение первого месяца лечения, 66% (43/65) пациенток - в течение первых 3 месяцев лечения. Ни одна из пациенток не сообщала о случаях степени ≥3 за CTCAE или о случаях, требовавших снижения дозы препарата, временного прекращения приема или отмены лечения в связи с этими побочными реакциями.
Сообщение о подозреваемых побочные реакции
Важно сообщать о подозреваемых побочные реакции после регистрации лекарственного средства. Это позволяет продолжать контроль за соотношением польза / риск при применении лекарственного средства. Медицинских работников просят сообщать о любых подозреваемые побочные реакции.
Срок годности Фулведжект
4 года.
Условия хранения Фулведжект
Хранить в оригинальной упаковке для защиты от света при температуре от 2 до 8 ̊С.
Хранить в недоступном для детей месте.
Несовместимость.
Поскольку исследования совместимости отсутствуют, это лекарственное средство не следует смешивать с другими лекарственными средствами.
Упаковка
По 5 мл в предварительно наполненном шприце и блистере, по 2 блистера со шприцем и 2 иглы в картонной пачке.
Категория отпуска
По рецепту.
Производитель
К.Т. Ромфарм Компани С.Р.Л. /
SC ROMPHARM COMPANY SRL.
Местонахождение производителя
ул. Ероилор № 1А, г.. Отопень, 075100, округ Илфов, Румыния /
Ул. Ероилор № 1 А, г. Отопень, 075100, уезд Илфов, Румыния.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Фулведжект только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- К.Т.Ромфарм Компани С.Р.Л.
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Фулведжект |
| Производитель: | К.Т.Ромфарм Компани С.Р.Л. |
| Форма выпуска: | раствор для инъекций, 250 мг / 5 мл по 5 мл в шприце и блистере, по 2 блистера со шприцем и 2 иглы в картонной пачке |
| Регистрационное удостоверение: | UA/17896/01/01 |
| Дата начала: | 23.01.2020 |
| Дата окончания: | 23.01.2025 |
| МНН: | Fulvestrant |
| Условия отпуска: | по рецепту |
| Состав: | 1 предварительно заполненный шприц (5 мл) содержит Фулвестрант 250 мг |
| Фармакологическая группа: | Антагонисты гормонов и аналогичные средства. Антиэстрогеновые средства. |
| Код АТХ: | L02BA03 |
| Заявитель: | ЕлЕлСи Ромфарм Компани Джорджия |
| Страна заявителя: | Грузия |
| Адрес заявителя: | спуск Саакадзе, 8, офис 7а, Тбилиси, Грузия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L02 | Средства, применяемые для гормональной терапии |
| L02B | Антагонисты гормонов и аналогичные средства |
| L02BA | Антиэстрогеновые средства |
| L02BA03 | Фулвестрант |