- Общая характеристика
- МНН
- Описание
- Состав
- Форма выпуска
- Фармакотерапевтическая группа
- Фармакологические свойства
- Показания к применению
- Способ применения и дозировка
- Побочные действия
- Противопоказания
- Передозировка
- Меры предосторожности
- Дети
- Период беременности
- Управление автомобилем
- Взаимодействие
- Условия и срок хранения
- Упаковка
- Правила отпуска
- Информация о производителе
Хиберикс инструкция по применению
Официальная инструкция лекарственного препарата Хиберикс лиофилизат 0,5мл. Описание и применение Hiberiks, аналоги и отзывы. Инструкция Хиберикс лиофилизат утвержденная компанией производителем.
Общая характеристика
Международное непатентованное наименование
Hemophilus influenzae B, purified antigen conjugated.
Описание
Порошок или плотная масса белого цвета, помещенная в стеклянный флакон, закрытый резиновой пробкой. После восстановления растворителем: бесцветный раствор от прозрачного до опалесцирующего.
Растворитель - прозрачная бесцветная жидкость, свободная от видимых механических включений
Состав лекарственного средства
1 доза вакцины содержит: капсулярный полисахарид Haemophilusinfluenzae типа b - 10 мкг, конъюгированный со столбнячным анатоксином - ~25 мкг.
Вспомогательное вещество: лактоза.
Растворитель (0,9 % раствор натрия хлорида для инъекций): натрия хлорид, вода для инъекций.
Хиберикс отвечает требованиям ВОЗ по производству биологических препаратов и к конъюгированным вакцинам Hib.
Форма выпуска
Лиофилизат для приготовления раствора для внутримышечного и подкожного введения.
Фармакотерапевтическая группа
Вакцины для профилактики бактериальных инфекций. Вакцины для профилактики инфекций, вызываемых Haemophilus influenzae В.
Код АТС: J07AG01.
Фармакологические свойства
Антитела в защитном титре ≥ 0,15 мкг/мл появляются через 1 месяц после окончания курса первичной вакцинации у 95-100 % детей, а через 1 месяц после ревакцинации - у 100% детей (при этом у 94,7 % из последних титр антител ≥ 1 мкг/мл).
Хиберикс Показания к применению
Профилактика гемофильной b инфекции у детей в возрасте с трех месяцев до пяти лет. Согласно рекомендациям ВОЗ и эпидемиологической ситуации вакцина может вводиться в возрасте с 6 недель.
Хиберикс не предохраняет от заболеваний, вызванных другими типами Haemophilusinfluenzae, и бактериальных менингитов другой этиологии.
Способ применения Хиберикс и дозировка
Курс первичной вакцинации состоит из трех доз, вводимых в течение первых 6 месяцев жизни ребенка, начиная с возраста 6 недель. Для обеспечения долгосрочной иммунной защиты на втором году жизни рекомендуется проводить ревакцинацию. Схема вакцинации в разных странах может варьировать.
В соответствии с Национальным календарем профилактических прививок Республики Беларусь вакцинацию рекомендуется проводить по схеме 3, 4, 5 месяцев с ревакцинацией в возрасте 18 месяцев.
Курс первичной вакцинации у ранее не вакцинированных детей в возрасте с 6 до 12 месяцев состоит из двух доз вакцины, вводимых с интервалом в 1 месяц. Ревакцинацию проводят однократно на втором году жизни.
Ранее не вакцинированным детям в возрасте 1-5 лет вводят одну дозу вакцины, ревакцинация не требуется.
Вакцину вводят внутримышечно. Пациентам с тромбоцитопенией и другими нарушениями свертывающей системы крови вакцину вводят подкожно (см. раздел «Меры предосторожности»).
Растворитель и восстановленную вакцину перед использованием следует осмотреть на предмет наличия посторонних частиц и/или несоответствие внешнего вида. При наличии посторонних частиц или изменении внешнего вида раствора его не следует использовать. Инструкция по восстановлению вакцины растворителем в ампуле
Непосредственно перед применением во флакон с вакциной вводят все содержимое контейнера с растворителем. Флакон хорошо встряхивают до полного растворения содержимого. Восстановленная вакцина представляет собой бесцветный раствор от прозрачного до опалесцирующего. Вакцину вводят сразу же после восстановления. Для введения препарата должна быть использована новая игла. Вводят все содержимое флакона. Препарат должен извлекаться из флакона при строгом соблюдении правил асептики для предотвращения контаминации содержимого.
Как указано в разделе «Взаимодействие с другими лекарственными средствами», вакцину Хиберикс можно восстанавливать однодозовой вакциной Инфанрикс. В данном случае вакцина Инфанрикс заменяет растворитель, необходимый для введения вакцины Хиберикс.
Следует убедиться, что контейнер с вакциной Инфанрикс, используемый для восстановления вакцины Хиберикс содержит только одну дозу вакцины. При этом растворитель из упаковки с вакциной Хиберикс следует уничтожить.
Комбинированная вакцина восстанавливается путем добавления всего содержимого контейнера с вакциной Инфанрикс в контейнер с лиофилизатом белого цвета вакцины Хиберикс.
После восстановления Хиберикс вакциной Инфанрикс полученную вакцину следует быстро ввести внутримышечно в передненаружную часть бедра.
Инструкция по восстановлению вакцины растворителем в предварительно заполненном шприце
Хиберикс необходимо восстановить путем добавления полного объема растворителя из предварительно заполненного шприца во флакон, содержащий лиофилизат.
Для правильного соединения иглы и шприца, следуйте представленным ниже инструкциям. Следует отметить, что шприц с растворителем, может несколько отличаться от шприца, изображенного на картинке ниже.
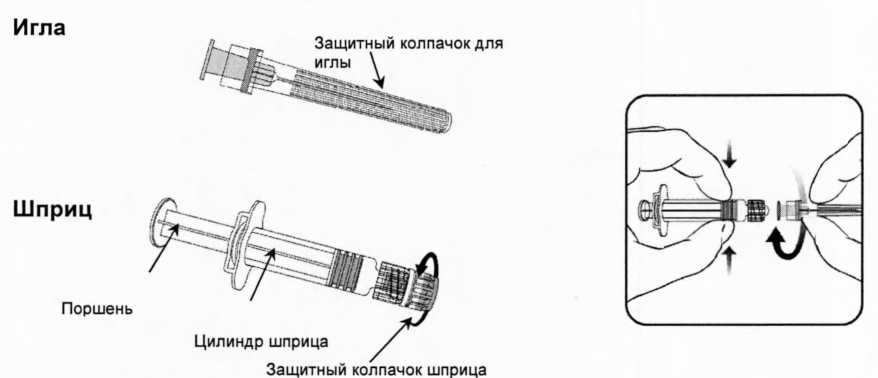
Открутите защитный колпачок шприца, поворачивая его против часовой стрелки (при этом следует удерживать шприц за цилиндр, избегая контакта с поршнем шприца).
Крутящим движением по часовой стрелке соедините иглу со шприцем до момента, когда вы ощутите их защелкивание друг на друге.
Удалите защитный колпачок с иглы (в отдельных случаях он может быть туго закреплен на игле).
Растворитель вводят в лиофилизат. Флакон хорошо встряхивают до полного растворения содержимого.
Комбинированная восстановленная вакцина представляет собой слегка более опалесцирующую суспензию, по сравнению с вакциной Инфанрикс. Вакцину вводят сразу же после восстановления. Для введения препарата должна быть использована новая игла. Вводят все содержимое флакона.
С полученной комбинированной вакциной следует обращаться так же, как и с однокомпонентной восстановленной вакциной Хиберикс.
Неиспользованную вакцину или другие сопутствующие отходы утилизируют в соответствии с местными требованиями.
Побочные действия
Клинические исследования
Общие реакции и реакции в месте введения
Наиболее частой реакцией в месте введения, появлявшейся в течение первых 48 часов после иммунизации, является незначительное спонтанно исчезающее покраснение. Другие местные реакции включали незначительную отечность и болезненность в месте введения, лихорадку. Общие реакции, наблюдаемые в течение первых 48 часов после введения, были незначительными и исчезали самопроизвольно.
В ходе клинических исследований вакцина Хиберикс всегда вводилась совместно с другими вакцинами, содержащими дифтерийно-столбнячно-коклюшный компонент (DTP). В связи с этим перечисленные побочные реакции не могут быть напрямую связаны конкретно с введением вакцины Хиберикс.
Со стороны желудочно-кишечного тракта
диарея, рвота
Со стороны метаболизма и пищеварения
потеря аппетита
Психиатрические расстройства необычный плач, беспокойство
Пострегистрационное наблюдение
В редких случаях (<1/10000) регистрировались перечисленные ниже побочные действия: Со стороны иммунной системы: аллергические реакции (включая анафилактические и анафилактоидные реакции), ангионевротический отек.
Со стороны нервной системы: гипотонический-гипореактивный эпизод, судороги (с лихорадкой и без), обмороки или вазовагальная реакция на инъекцию, сонливость.
Со стороны дыхательной системы, органов грудной клетки и средостения: апноэ (см. раздел «Меры предосторожности»).
Со стороны кожи и подкожной клетчатки: крапивница, сыпь (местная или генерализованная).
Общие и местные реакции: распространенный отек конечности в области введения, уплотнение в месте введения.
Информирование о возможных побочных явлениях
Предоставление информации о подозреваемых побочных реакциях, выявленных после регистрации, имеет большое значение, так как позволяет проводить постоянный мониторинг баланса пользы и риска лекарственного средства. Сообщить о любых подозреваемых побочных реакциях специалисты области здравоохранения могут посредством национальной системы информирования.
Противопоказания Хиберикс
Гиперчувствительность к компонентам вакцины; развитие аллергических реакций на предшествовавшее введение вакцины Haemophilusinfluenzae типа b.
Как и в случае с другими вакцинами, введение вакцины Хиберикс следует отложить в остром периоде заболевания, сопровождающемся повышением температуры. Наличие незначительной инфекции не является противопоказанием.
Передозировка
Не применимо.
Меры предосторожности
Пациентам с тромбоцитопенией и другими нарушениями свертывающей системы крови вакцину вводят подкожно, в связи с возможностью кровотечения после внутримышечной инъекции у данной категории пациентов.
ВИЧ-инфекция не является противопоказанием к введению Хиберикс.
Хотя введение Хиберикс может вызвать незначительный иммунный ответ на столбнячный анатоксин, его введение не может заменить вакцинацию против столбняка.
У лиц, которым вводилась вакцина против Haemophilusinfluenzae, было зафиксировано выделение капсульного полисахарида с мочой, поэтому определение антигена в моче в течение 1 -2 недель после прививки не имеет диагностической ценности при подозрении на Hib инфекцию.
Как и при применении других инъекционных вакцин, в связи с возможностью развития в редчайших случаях анафилактической реакции, привитые должны находиться под медицинским наблюдением в течение 30 мин и в наличии должны быть все необходимые средства для купирования анафилактической реакции.
ХИБЕРИКС НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ НЕЛЬЗЯ ВВОДИТЬ ВНУТРИВЕННО. Необходимо учитывать потенциальный риск апноэ и необходимость мониторинга дыхательной функции в течение 48-72 часов при проведении курса первичной вакцинации детей, родившихся преждевременно (≤ 28 недель гестации) и, особенно, детей с незрелостью органов дыхания в анамнезе. Ввиду особой пользы вакцинации детей данной группы, вакцинацию нельзя откладывать или отказывать в ее проведении. После вакцинации или иногда перед ней возможны обмороки как психогенная реакция на инъекцию. Перед вакцинацией важно удостовериться, что пациент не получит повреждений в случае обморока.
Дети
Вакцина не предназначена для применения у взрослых.
Применение в период беременности и кормления грудью
Вакцина Хиберикс не предназначена для применения у взрослых. Данных о применении вакцины у женщин в период беременности или лактации не получено.
Способность влиять на скорость реакции при управлении транспортом
Крайне маловероятно, что вакцина Хиберикс может оказывать влияние на способность управлять автомобилем или движущимися механизмами.
Взаимодействие с другими лекарственными средствами
Хиберикс может вводиться одновременно или в любое время до или после введения других инактивированных или живых вакцин.
При этом вакцину Хиберикс нельзя смешивать в одном шприце с другими вакцинами, препараты должны быть введены разными шприцами в разные участки тела.
Однако вакцину Хиберикс можно смешивать в одном шприце с вакциной Инфанрикс (комбинированная вакцина для профилактики дифтерии, столбняка и коклюша). В данном случае вакцина Инфанрикс заменяет растворитель, необходимый для введения вакцины Хиберикс.
Как и в случае применения других вакцин, можно ожидать, что у лиц с иммунодефицитом или у лиц, получающих иммунодепрессивную терапию, может не быть достигнут адекватный иммунный ответ.
Условия и срок хранения Хиберикс
Срок годности вакцины 3 года, растворителя - 5 лет.
Дата окончания срока годности указана на упаковке. Препарат с истекшим сроком годности применению не подлежит.
Условия хранения и транспортирования
Вакцину, упакованную отдельно от растворителя, хранят и транспортируют при температуре от 2 до 8 °C в защищенном от света месте. Замораживание допускается. Растворитель, упакованный отдельно от вакцины, хранят и транспортируют при температуре от 2 до 25 °C, не замораживать.
Хранить вакцину и растворитель в недоступном для детей месте.
Упаковка
По 1 дозе вакцины в стеклянном флаконе. По 100 флаконов вместе с 5-10 инструкциями по применению в картонной коробке. Растворитель в отдельной коробке: по 0,5 мл растворителя в ампуле. По 25 ампул в блистере, по 4 блистера в картонной коробке.
Правила отпуска
По рецепту врача.
Информация о производителе
Производитель, осуществляющий производство готовой лекарственной формы, фасовку и упаковку:
GlaxoSmithKline Biologicals S.A.S., France, 637 rue des Aulnois, 59230 Saint Amand Les Eaux, France I ГлаксоСмитКляйн Байолоджикалз C.A.C., Франция, 637 рю дез Олнуа, 59230 Сент-Аман ле-Зо, Франция.
Производитель, осуществляющий контроль качества:
GlaxoSmithKline Biologicals SA, 89, Rue de I'lnstitut, 1330 Rixensart, Belgium IГлаксоСмитКляйн Байолоджикалз CA, 89, Рюдель Институт 1330, Риксенсарт, Бельгия.
За дополнительной информацией обращаться по адресу:
Представительство ООО «GlaxoSmithKline Export Limited» (Великобритания) в Республике Беларусь.
Минск, ул. Воронянского 7А, офис 400.
Тел.: + 375 17 213 20 16; факс + 375 17 213 18 66.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Хиберикс только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание! Эта инструкция по применению лекарственного средства является официальной инструкцией производителя GlaxoSmithKline Biologicals.
Авторское право:
- GlaxoSmithKline Biologicals
- https://www.rceth.by - Государственный реестр ЛС Республики Беларусь
| Тип данных | Сведения из реестра |
| Торговое наименование: | Хиберикс |
| Форма выпуска: | лиофилизат для приготовления раствора для внутримышечного и подкожного введения 0,5мл (1доза) во флаконах в упаковке №100 и растворитель (0,9% раствор натрия хлорида в ампулах 0,5мл) в блистерах в упаковке №25х4 |
| Международное наименование: | Hemophilus influenzae B, purified antigen conjugated |
| Производитель: | GlaxoSmithKline Biologicals, Франция |
| Заявитель: | GlaxoSmithKline Export Ltd, Великобритания |
| Номер регистрации: | 7589/06/11/15/16/17 |
| Дата регистрации: | 28.07.2016 |
| Срок действия: | бессрочно |
| Дата переоформления: | 04.12.2017 |
| Тип: | Иммунобиологическое лекарственное средство (вакцины) |
| Оригинальное: | оригинальное |
| Состав лекарственного средства: | Haemophilus influenzae type B conjugate vaccine |
| Код АТХ: | J07AG01 |
| Производитель готовой лекарственной формы: | GlaxoSmithKline Biologicals, Франция |
| Производитель, осуществляющий фасовку/упаковку: | GlaxoSmithKline Biologicals, Франция |
| Контроль качества: | |
| Выдача разрешения на выпуск лекарственного средства: | GlaxoSmithKline Biologicals s.a., Бельгия |
| Другие участники производства: | DELPHARM TOURS, Франция - производитель растворителя |
| Заявленная цена: | 840USD |
| Порядок отпуска: | для стационаров |
| Список хранения: | |
| Срок годности лекарства: | 3 года |
| Нормативная документация: | РБ 5470-2016 |
| Дата утверждения нормативной документации: | 28 июля 2016 г. 0:00 |
| Срок действия нормативной документации: | |
| Изменение в нормативной документации: | Изменение по разделам "Спецификация растворителя", "Сертификат качества растворителя" (пр. №1449 от 13.12.2017) Изменение по разделу "Методы контроля качества" (пр. №392 от 12.04.2017) Изменение по разделу "Состав" (пр. №392 от 12.04.2017) Изменение по разделу "Спецификация" (пр. №392 от 12.04.2017) |
| Номер разрешения НД: | 7101 |
| Код АТХ | Название группы |
| J | Противомикробные препараты для системного применения |
| J07 | Вакцины |
| J07A | Вакцины для профилактики бактериальных инфекций |
| J07AG | Вакцина для профилактики инфекций, вызываемых Haemophilus influenza B |
| J07AG01 | Hemophilus influenza B, purified antigen conjugated |
