- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/16852/01/01 закончился 27.07.2023
Пиксуври инструкция по применению
Официальная инструкция лекарственного препарата Пиксуври порошок 29 мг. Описание и применение Piksuvri, аналоги и отзывы. Инструкция Пиксуври порошок утвержденная компанией производителем.
Состав
действующее вещество: пиксантрон (pixantrone)
1 флакон содержит 50 мг пиксантрон дималеата, что эквивалентно 29 мг пиксантрона;
1 мл восстановленного раствора содержит пиксантрону дималеата, что эквивалентно 5,8 мг пиксантрона;
Вспомогательные вещества : натрия хлорид, лактоза, натрия гидроксид, кислота соляная.
Лекарственная форма
Порошок для приготовления концентрата для приготовления раствора для инфузий.
Основные физико-химические свойства: лиофилизированный прессованный порошок темно-синего цвета без повреждений его целостности, оплавлений или видимых инородных частиц.
Фармакологическая группа
Антинеопластические средства, антрациклины и родственные соединения.
Код ATX L01D B11.
Фармакологические свойства
Фармакологические.
механизм действия
Действующим веществом препарата Пиксуври® является пиксантрон, цитотоксический аза-антрацендионами.
В отличие от других антрациклинов (доксорубицина и т.д.) и антрацендионами (митоксантрона), пиксантрон является слабым ингибитором топоизомеразы II. Кроме того, в отличие от других антрациклинов или антрацендионами, пиксантрон непосредственно алкилуе ДНК, образуя при этом устойчивые ДНК-аддукты и перекрестные мижланцюгови разрывы. Более того, поскольку пиксантрон включает гетероатом азота в структуру кольца и не содержит кетоновые группы, он имеет меньший потенциал к образованию реактивных форм кислорода, связывается ния железа и образования метаболитов этанола, Которые могут привести к развитию кардиотоксичности при применении антрациклинов. Уникальная структура пиксантрону обусловливает его минимальную кардиотоксичность сравнению с доксорубицином или митоксантроном, что было доказано в ходе исследований на животных.
Комплексный ретроспективный анализ фармакокинетических / фармакодинамических данных исследований I фазы и схем комбинированной терапии (исследование I / II фазы) продемонстрировал, что показатели выживаемости без прогрессирования заболевания и развития нейтропении 2 и 3 степени были обусловлены применением лекарственного средства Пиксуври®.
Клиническая эффективность и безопасность
Безопасность и эффективность препарата Пиксуври® качестве монотерапии оценивались в ходе многоцентрового рандомизированного исследования с активным контролем при применении у пациентов с рецидивирующей или рефрактерной злокачественной неходжкинской лимфомой (НХЛ) после прохождения минимум двух предыдущих курсов лечения (PIX301). В этом исследовании 140 пациентов были рандомизированы (в соотношении 1: 1) или в группу лечения Пиксуври®, или к группе сравнения с применением монохимиотерапии, выбранной исследователем. Демографические данные и характеристики заболевания на момент включения в исследование были хорошо сбалансированы между группами лечения и статистически достоверных различий между ними не отмечалось. В исследовании средний возраст пациентов составил 59 лет, 61% составили мужчины, 64% были европеоидной расы,76% на момент начала исследования имели III / IV стадию заболевания по классификации Энн-Арбор, 74% на момент включения в исследование имели международный прогностический индекс (IPI) ≥ 2 и 60% прошли ≥ 3 предыдущих курсов химиотерапии. Пациенты с лимфомой клеток мантии не были включены в базовый исследования. Обязательным критерием для пациентов в исследовании PIX301 было наличие чувствительности к предыдущему лечения антрациклинами (подтвержденная / неподтвержденная полная (CR) или частичная (PR) ответ).
Данные о больных, ранее принимавших ритуксимаб, ограничены (38 пациентов в группе лечения Пиксуври® и 39 пациентов в группе сравнения).
Ответ опухоли на лечение оценивала независимая центральная экспертная группа, которой не было известно о назначенных пациентам препараты, согласно рекомендациям международной рабочей группы по стандартизации критериев ответы пациентов с НХЛ на терапию. По сравнению с группой сравнения, у пациентов, получавших препарат Пиксуври®, было зарегистрировано достоверно большее количество случаев полного ответа и неподтвержденной полного ответа (CR / CRu), а также более высокий показатель объективного ответа (ORR) (см. Табл. 1).
Таблица 1
Результаты ответа на лечение согласно данным независимой экспертной группы (ITT-популяция)
Ответ на лечение | В конце лечения | В конце исследования | ||||
Пиксуври® (n = 70) | Препарата по сравнению ния (n = 70) | р-значе- ния | Пиксуври® (n = 70) | Препарата по сравнению ния (n = 70) | р-значе- ния | |
CR / CRu | 14 (20,0 %) | 4 (5,7 %) | 0,021 | 17 (24,3 %) | 5 (7,1 %) | 0,009 |
CR | 8 (11,4 %) | 0 (0 %) | 11 (15,7 %) | 0 (0 %) | ||
Верил | 6 (8,6 %) | 4 (5,7 %) | 6 (8,6 %) | 5 (7,1 %) | ||
ORR (CR, CRu та PR) | 26 (37,1 %) | 10 (14,3 %) | 0,003 | 28 (40,0 %) | 10 (14,3 %) | 0,001 |
Для сравнения соотношение значений в группе лечения Пиксуври® и группе сравнения использованы точный тест Фишера
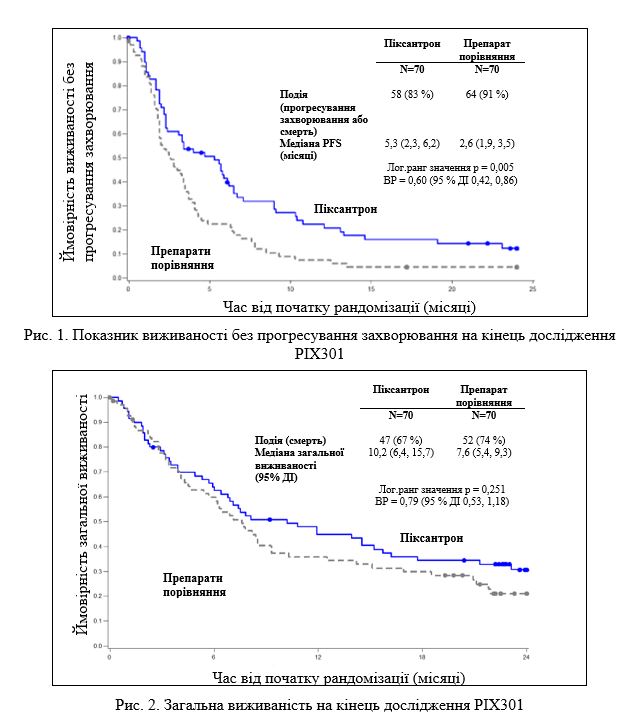
Пациенты, принимавшие препарат Пиксуври®, продемонстрировали улучшение показателя выживаемости без прогрессирования заболевания (PFS) на 40% по сравнению с пациентами, получавшими лечение препаратом сравнения, с длиннее на 2,7 месяца медианой показателя PFS (относительный риск (ОР) = 0 , 60; логарифмическое ранговое значение р = 0,005) (см. рис. 1).
Медиана общей выживаемости пациентов в группе лечения Пиксуври® была на 2,6 месяца длиннее по сравнению с данными в группе сравнения (ОР = 0,79; логарифмическое ранговое значение р = 0,25) (см. Рис. 2).
По результатам, полученным у пациентов, предварительно проходили лечение ритуксимабом, установлены значительные преимущества терапии лекарственным средством Пиксуври® сравнению с препаратом сравнения по показателям общего ответа на лечение (31,6% при применении Пиксуври® и 17,9% при применении препарата сравнения) и медианы выживаемости без прогрессирования заболевания (3,3 месяца при применении Пиксуври® и 2,5 месяца при применении препарата сравнения). Однако преимуществ Пиксуври® не было установлено при его применении как препарата пятой линии химиотерапии или выше у пациентов, рефрактерных к последнему курсу лечения , и данные по этой группы пациентов являются очень ограниченными.
Фармакокинетика.
абсорбция
После введения максимальная концентрация пиксантрону в плазме крови достигается в конце инфузии, а затем уменьшается полиэкспоненциально. Фармакокинетика лекарственного средства Пиксуври® не зависела от дозы в диапазоне доз 3-105 мг / м2; в ходе исследований при применении препарата в качестве монотерапии или в комбинации с другими препаратами существенных различий не наблюдалось.
Таблица 2
Средние концентрации пиксантрону при применении в качестве монотерапии
Доза Пиксуври®, мг / м2 | количество пациентов | AUC (0—24 години), нг/год/мл |
33 | 3 | 982 ± 115 |
49 | 6 | 1727 ± 474 |
88 | 2 | 3811 |
По результатам анализа фармакокинетических данных в популяции было выявлено, что для зарегистрированной целевой дозы 50 мг / м2 средняя концентрация пиксантрону течение 28-дневного курса лечения составляла 6320 нг / ч / мл (90% ДИ, 5990 - 6800 нг / ч / мл) для 3 доз в течение 4-недельного курса.
распределение
Пиксуври® имеет большой объем распределения - 25,8 л, и примерно 50% препарата связывается с белками плазмы.
Метаболизм
Основными продуктами биотрансформации пиксантрону является ацетилированные метаболиты. Однако в исследованиях in vitro преобразования пиксантрону в ацетилированные метаболиты с помощью или NAT1, или NAT2 было очень ограниченным. С мочой у человека вещество выводилась преимущественно в неизмененном виде и было обнаружено очень небольшое количество ацетилированных метаболитов I и II фаз. Таким образом, метаболизм не является основным путем выведения пиксантрону. Ацетилированные метаболиты были фармакологически неактивными и метаболически стабильными.
вывод
Пиксантрон имеет умеренную или высокую скорость общего клиренса из плазмы крови (72,7 л / ч) и низкий уровень экскреции почками, на которую приходится менее 10% от введенной дозы в период 0-24 часа. Конечный период полувыведения составляет от 14,5 до 44,8 часа при среднем значении 23,3 ± 8,0 (n = 14 CV = 34%) с медианой 21,2 часа. Учитывая низкий уровень почечного клиренса, выведения препарата из плазмы крови является преимущественно непочечный. Препарат Пиксуври® может быть Метаболизированный в печени и / или выведен с желчью. Поскольку процесс метаболизма незначительно, экскреция с желчью в неизмененном пиксантрону может быть основным путем выведения. Уровень печеночного клиренса примерно соответствует току плазмы крови, который проходит через печень, что предполагает высокий уровень печеночной экстракции и, следовательно, эффективное выведение неизмененной действующего вещества.
В исследовании in vitro пиксантрон продемонстрировал слабую способность ингибировать транспортный механизм P-gp, BCRP и BSEP или вообще ее отсутствие.
В исследовании in vitro пиксантрон ингибировал транспортировки метформина с участием транспортеров ОСТ1, но in vivo ингибирования ОСТ1 в клинически значимых концентрациях не ожидается.
В исследовании in vitro пиксантрон показал слабую способность ингибировать транспортеры поглощения OATP1B1 и OATP1B3.
Линейность / нелинейность
Линейный характер фармакокинетических свойств пиксантрону было подтверждено в широком диапазоне доз - от 3 до 105 мг / м2.
Связь между фармакокинетикой и фармакодинамики
При проведении исследований наблюдался взаимосвязь между концентрацией пиксантрону в плазме крови и количеством нейтрофилов.
Клинические характеристики
Пиксуври Показания
Пиксуври® назначают в качестве монотерапии для лечения взрослых пациентов с неоднократно рецидивирующей или рефрактерной злокачественной неходжкинской В-клеточной лимфомой. Эффективность пиксантрону при применении в качестве препарата пятой или более линии терапии у больных, резистентных к предыдущему лечения не установлена.
Противопоказания
- Гиперчувствительность к пиксантрону дималеату или любой из вспомогательных веществ.
- Иммунизация живыми вирусными вакцинами.
- Выраженное угнетение функции костного мозга.
- Нарушение функции печени тяжелой степени.
Особые меры безопасности.
Пиксуври® является цитотоксическим средством. Следует избегать контакта препарата с кожей и глазами. Во время применения препарата и в течение процедур деконтаминации рекомендуется пользоваться перчатками, маской и защитными очками.
Флакон с препаратом Пиксуври® предназначен только для одноразового использования. Любые остатки неиспользованного лекарственного средства или расходных материалов, в том числе материалов для восстановления (растворения), разведение и введение необходимо утилизировать в соответствии с действующими нормативными требованиями цитотоксических средств.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
О взаимодействии с другими лекарственными средствами при применении человеку не сообщалось. Исследования взаимодействия с другими лекарственными средствами с участием человека проведено не было.
Исследование ингибирующего способности in vitro
В ходе исследований in vitrо с наиболее распространенными изоформами цитохрома P450 у человека (в том числе CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 и 3A4) было продемонстрировано вероятно ингибирования смешанного типа цитохрома CYP1A2 и CYP2C8, что может иметь клиническое значение. Других клинически значимых взаимодействий с изоферментами цитохрома CYPP450 обнаружено не было.
Теофиллин. При применении в комбинации с теофиллином, что имеет узкий терапевтический индекс и преимущественно метаболизируется цитохромом CYP1A2, теоретически возможно увеличение концентрации теофиллина, что может привести к теофиллиновой токсичности. Уровень теофиллина следует тщательно контролировать в течение нескольких недель после начала сопутствующей терапии препаратом Пиксуври®.
Варфарин частично метаболизируется цитохромом CYP1A2, поэтому теоретически существует риск, что ингибирование метаболизма варфарина в результате одновременного применения с Пиксуври® может иметь влияние на его действие. Следует контролировать показатели коагуляции, в частности международное нормализованное отношение (МНО), в течение нескольких дней после начала сопутствующей терапии лекарственным средством Пиксуври®.
Амитриптилин, галоперидол, клозапин, ондансетрон и пропранолол метаболизируется с помощью цитохрома CYP1A2, поэтому теоретически существует риск повышения их концентрации в крови при одновременном применении с Пиксуври®.
Хотя нельзя с уверенностью утверждать о риске ингибирования пиксантроном цитохрома CYP2C8, его следует назначать с осторожностью одновременно с веществами, которые главным образом метаболизируются цитохромом CYP2C8, такими как репаглинид, розиглитазон или паклитаксел , и тщательно контролировать побочные реакции.
На основе данных исследований in vitrо было обнаружено, что пиксантрон является субстратом для мембранных белков-переносчиков Р-gp / BRCP и OCT1, а вещества, которые ингибируют эти белки, могут уменьшать поглощение печенью пиксантрону и эффективность его вывода. Следует тщательно контролировать количество клеток крови при одновременном применении с препаратами, такими как циклоспорин А такролимус, широко используются для контроля проявлений хронической реакции «трансплантат против хозяина», а также с анти-ВИЧ средствами - ритонавиром, саквинавиром или нелфинавиром, которые ингибируют эти белки-переносчики.
Кроме того, следует соблюдать осторожность при длительном одновременном применении пиксантрону с индукторами ефлюксних переносчиков, такими как рифампицин, карбамазепин и глюкокортикоиды, поскольку экскреция пиксантрону может увеличиться, что приведет к снижению системного воздействия.
Особенности применения
Перед началом лечения Пиксуври® необходимо провести тщательную оценку показателей крови, уровня общего билирубина и креатинина в сыворотке крови, а также функции сердца по величине фракции выброса левого желудочка (ФВЛЖ).
миелосупрессия
При применении препарата может развиться миелосупрессия тяжелой степени. Пациенты, применявшие Пиксуври®, были склонны к возникновению миелосупрессии (нейтропения, лейкопения, анемия, тромбоцитопения и лимфопении) преимущественно в виде нейтропении. При применении рекомендуемой дозы по рекомендованной схеме лечения нейтропения обычно временной , самые низкие показатели наблюдаются с 15-го по 22-й дни после введения препарата в 1-й на 8-й и 15-й дни курса лечения с восстановлением показателей на 28- й день.
Необходимо тщательно контролировать показатели крови, в том числе количество лейкоцитов, эритроцитов, тромбоцитов и абсолютное количество нейтрофилов. Могут быть использованы рекомбинантные гемопоэтические факторы роста согласно установленным стандартам или рекомендациям Европейского общества медицинской онкологии (ESMO). Следует рассмотреть возможность коррекции дозы (см. Раздел «Способ применения и дозы»).
кардиотоксичность
Во время или после лечения Пиксуври® возможные изменения функции сердца, включая уменьшение фракции выброса левого желудочка или возникновения летальной застойной сердечной недостаточности.
Сердечно-сосудистое заболевание в активной или неактивной фазе, предшествующая терапия антрациклинами или антрацендионами, предыдущая или одновременно радиотерапия средостения участка или одновременное применение других кардиотоксического лекарственных средств могут повышать риск сердечной токсичности. Кардиотоксичность при применении препарата Пиксуври® может возникнуть независимо от наличия или отсутствия сердечных факторов риска.
У пациентов с сердечным заболеванием или факторами риска, такими как исходное значение фракции выброса левого желудочка <45%, определенное с помощью радионуклидной ангиографии (MUGA), клинически достоверные сердечно-сосудистые нарушения (которые соответствуют функциональным классам III или IV по шкале Нью-Йоркской кардиологической ассоциации [NYHA ]), инфаркт миокарда в течение последних 6 месяцев, аритмия тяжелой степени, неконтролируемая артериальная гипертензия, неконтролируемая стенокардия или предварительное применение доксорубицина (в кумулятивной или эквивалентной дозах> 450 мг / м2), следует тщательно взвесить риск и пользу, прежде чем назначить лечение препаратом Пиксуври ®.
Необходимо проводить мониторинг функции сердца до начала применения препарата Пиксуври® и периодически в дальнейшем. Если во время лечения возникла кардиотоксичность, необходимо пересмотреть баланс показателя польза / риск продолжения терапии препаратом Пиксуври®.
вторичная малигнизация
Развитие гематологических малигнизаций, таких как вторичный острый миелоидный лейкоз (ОМЛ) или миелодиспластический синдром (МДС), является общепризнанным риском, связанным с применением антрациклинов и других ингибиторов топоизомеразы II. Вторичный рак, в том числе ОМЛ и МДС, может возникнуть во время или после лечения Пиксуври®.
инфекция
При проведении клинических исследований сообщалось о развитии инфекций, в том числе пневмонии, воспаления жировой ткани, бронхита и сепсиса (см. Раздел «Побочные реакции»). Инфекции были связаны с последующей госпитализацией, возникновением септического шока и смертью. Пациенты с нейтропенией более уязвимы к инфекциям, при этом в ходе клинических исследований не наблюдалось повышения частоты атипичных, тяжелых для лечения инфекций, таких как системные грибковые инфекции или инфекции, вызванные условно-патогенными организмами, такими как Pneumocystis jiroveci .
Пиксуври® не следует назначать пациентам с активной инфекцией, инфекцией тяжелой степени или пациентам, в анамнезе которых рецидивирующие или хронические инфекции, или при наличии состояний, которые в дальнейшем могут развиться до серьезных инфекций.
Синдром лизиса опухоли
Пиксантрон может вызвать гиперурикемию в результате экстенсивного катаболизма пуринов, сопровождающий вызванный лекарственным средством быстрый лизис опухолевых клеток (синдром лизиса опухоли), и может привести к электролитного дисбаланса, который, в свою очередь, может вызвать поражение почек. После лечения у пациентов с высоким риском возникновения лизиса опухоли (повышенный уровень лактатдегидрогеназы, большой объем опухоли, высокий исходный уровень мочевой кислоты или фосфатов в сыворотке крови) необходимо провести мониторинг уровня мочевой кислоты, калия, кальция фосфата и креатинина в крови. Гидратация, заложенные мочи и профилактика с применением аллопуринола или других средств для предотвращения гиперурикемии могут свести к минимуму возможные осложнения синдрома лизиса опухоли.
иммунизация
Проведение иммунизации может оказаться неэффективным при терапии препаратом Пиксуври®. Проводить иммунизацию живыми вирусными вакцинами противопоказано из-за иммуносупрессию, сопровождающий терапию лекарственным средством Пиксуври® (см. Раздел «Противопоказания»).
экстравазация
В случае экстравазации необходимо немедленно прекратить введение препарата и начать его введение в другую вену. Пиксуври® не имеет свойств вызвать гнойные образования на коже, минимизирует риск возникновения местной реакции вследствие экстравазации.
Предупреждение реакций фоточувствительности
Учитывая данные доклинических исследований in vitro и in vivo светочувствительность является потенциальным риском, но в ходе клинических исследований не сообщалось о подтвержденных случаях реакций фоточувствительности. В качестве меры пресечения пациенты должны быть проинформированы о необходимости следовать рекомендациям по защите от солнца, в том числе носить одежду, защищающую от солнца, и использовать солнцезащитный крем. Поскольку большинство реакций фоточувствительности, вызванных лекарственными средствами, вызванные излучением с длинами волны диапазона УФ-А, рекомендуется использование солнцезащитного крема, который эффективно поглощает УФ-А лучи.
Пациенты на бессолевой диете
Это лекарственное средство содержит около 1000 мг (43 ммоль) натрия в одной дозе после разведения. Это следует учитывать при применении препарата пациентам, соблюдающим диету с контролем содержания натрия.
Применение в период беременности или кормления грудью
Женщины репродуктивного возраста
Женщинам репродуктивного возраста и их партнерам следует избегать беременности.
Женщины и их партнеры должны использовать эффективные средства контрацепции во время лечения и до 6 месяцев после его завершения.
беременность
Данные по применению пиксантрону беременным женщинам отсутствуют. Исследования на животных репродуктивной токсичности.
Применение Пиксуври® беременным и женщинам репродуктивного возраста, которые не используют средства контрацепции, не рекомендуется.
кормлению грудью
Неизвестно, проникает пиксантрон или его метаболиты в грудное молоко.
Невозможно исключить риск для новорожденных / младенцев.
Во время лечения Пиксуври® кормления грудью следует прекратить.
фертильность
В ходе экспериментальных исследований после повторных применений лекарственного средства Пиксуври® в низкой дозе 0,1 мг / кг / сут у животных была обнаружена атрофия яичек. У людей этот эффект не изучался. Подобно другим препаратам общего класса ДНК-повреждающих средств, Пиксуври® теоретически может вызывать нарушения фертильности. Пока влияние на фертильность не подтвержден, мужчинам рекомендуется использовать методы контрацепции (преимущественно барьерные) во время лечения и в течение 6 месяцев после его завершения. Во избежание длительного бесплодия, следует рассмотреть возможность хранения спермы в банке спермы.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Неизвестно, влияет лекарственное средство Пиксуври® на способность управлять автотранспортом и работать с механизмами.
Способ применения Пиксуври и дозы
Пиксуври® должен назначать врач, имеющий опыт применения противоопухолевых средств и у которого есть возможность проводить регулярный мониторинг клинических, гематологических и биохимических параметров во время и после лечения.
дозировка
Рекомендуемая доза пиксантрону составляет 50 мг / м2 с применением в 1-й на 8-й и 15 дни каждого 28-дневного курса с возможностью проведения до 6 курсов.
Важно обратить внимание на то, что в странах ЕС рекомендуемая доза выражена в форме основы действующего вещества (пиксантрон). Расчет индивидуальной дозы для пациента должна базироваться на концентрации восстановленного раствора, содержащего 5,8 мг / мл пиксантрону, и рекомендуемой дозы 50 мг / м2. В некоторых исследованиях и публикациях рекомендуемая доза определена в форме соли (пиксантрону дималеат).
Дозу необходимо откорректировать до начала каждого курса лечения, учитывая наименьшие значения гематологических показателей или максимальную токсичность предыдущего курса терапии. Необходимую дозу Пиксуври® (мг) следует определять по площади поверхности тела пациента (ППТ). ППТ нужно определять по установленным стандартам для расчета ППТ с учетом массы тела пациента, измеренной в 1-й день каждого курса лечения.
Пациентам с ожирением Пиксуври® следует назначать с осторожностью, поскольку данные по расчету дозы препарата на основе ППТ для этой группы больных являются очень ограниченными.
Рекомендации по коррекции дозы
Изменение дозирования и интервал времени до следующих вводов препарата необходимо устанавливать с учетом клинической оценки в зависимости от степени и продолжительности миелосупрессии. В последующих курсах предыдущую дозу обычно можно повторить, если уровень лейкоцитов и тромбоцитов вернулся в приемлемых показателей.
Если в 1-й день любого курса терапии абсолютное количество нейтрофилов (АКН) составляет <1,0 × 109 / л или количество тромбоцитов <75 × 109 / л, рекомендуется отложить лечение, пока АКН не достигнет уровня ≥ 1,0 × 109 / л, а тромбоциты - ≥ 75 × 109 / л.
В таблицах 3 и 4 представлены рекомендации по коррекции дозы на 8-й и 15-й дни каждого 28-дневного курса.
Таблица 3
Коррекция дозы по признакам гематологической токсичности на 8-й и 15-й дни каждого курса
степень токсичности | количество тромбоцитов | Абсолютное количество нейтрофилов | коррекция дозы |
1—2 | НМН* — 50 × 109/л | НМН — 1,0 × 109/л | Никаких изменений в дозе или схеме лечения |
3 | <50—25 × 109 / л | 1,0—0,5 × 109/л | Отложить лечение до восстановления уровня тромбоцитов в ≥ 50 × 109 / л и АКН ** ≥ 1,0 × 109 / л |
4 | <25 × 109 / л | <0,5 × 109 / л | Отложить лечение до восстановления уровня тромбоцитов в ≥ 50 × 109 / л и АКН ** ≥ 1,0 × 109 / л. Уменьшение на 20% |
* НМН - нижняя граница диапазона нормы;
** АКН - абсолютное количество нейтрофилов.
Таблица 4
Коррекция лечения по признакам негематологической токсичности
токсичность | коррекция |
Любая вызванная препаратом некардиальных токсичность 3 или 4 степени, кроме тошноты или рвоты | Отложить лечение до восстановления состояния пациента до 1 степени токсичности. Уменьшение на 20% |
Любая кардиоваскулярная токсичность 3 или 4 степени по классификации NYHA * или стойкое снижение фракции выброса левого желудочка ** | Отложить лечение и контролировать состояние пациента к восстановлению показателей. Рассмотреть возможность прекращения лечения в случае постоянного снижения фракции выброса левого желудочка ** до уровня ≥ 15% от начального значения |
* NYHA - Нью-Йоркская кардиологическая ассоциация;
** фракции выброса левого желудочка - фракция выброса левого желудочка.
Особые категории больных
Пациенты пожилого возраста
Особых требований по коррекции дозы для пациентов пожилого возраста (≥ 65 лет) нет.
Нарушение функции почек
Безопасность и эффективность применения препарата Пиксуври® пациентам с нарушением функции почек не установлены. Пациенты с уровнем креатинина плазмы крови, в 1,5 раза выше верхней границы нормы (ВМН), не включались в рандомизированного исследования. Таким образом, Пиксуври® следует применять с осторожностью пациентам с нарушением функции почек.
Пациенты с нарушением функции печени
Безопасность и эффективность применения препарата Пиксуври® пациентам с нарушением функции печени не установлены. Пиксуври® следует применять с осторожностью пациентам с нарушением функции печени легкой и средней степени. Не рекомендуется назначать Пиксуври® пациентам с нарушением экскреторной функции печени тяжелой степени (см. Раздел «Противопоказания»).
Пациенты с неудовлетворительным общим состоянием
В настоящее время информация о безопасности и эффективности применения препарата Пиксуври® пациентам с неудовлетворительным общим состоянием (по шкале оценки функционального состояния человека, разработанной Восточной объединенной онкологической группой (ECOG)> 2) отсутствует. Лечение таких пациентов следует проводить с осторожностью.
способ применения
Пиксуври® применяют только внутривенно. Безопасность интратекального применения препарата не установлена.
Пиксуври® предназначен для ввода путем медленной инфузии в течение минимум 60 минут с использованием инфузионной системы со встроенным фильтром только после восстановления (растворения) в 5 мл 0,9% раствора натрия хлорида для инъекций (9 мг / мл) и дальнейшего разведения в конечного объема 250 мл тем самым растворителем.
Восстановление (растворение) и разведения лекарственного средства
Необходимо восстановить (растворить) в асептических условиях содержание каждого флакона (29 мг пиксантрону) в 5 мл 0,9% раствора натрия хлорида для инъекций (9 мг / мл). Лиофилизированный порошок должен полностью раствориться с помощью перемешивания в течение 60 секунд. В результате образуется темно-синий раствор с концентрацией пиксантрону 5,8 мг / мл.
Далее в асептических условиях отбирают объем, необходимый для назначенной дозы (на основе концентрации 5,8 мг / мл), и переносят в емкость для инфузий объемом 250 мл с 0,9% раствором натрия хлорида для инъекций (9 мг / мл). Конечная концентрация пиксантрону в инфузионном растворе должна быть менее 580 мкг / мл по расчету на основе отобранной количества восстановленного лекарственного средства. Совместимость с другими растворителями не определена. После переноса раствора содержимое емкости для инфузии тщательно перемешивают. Имеет образоваться прозрачный раствор темно-синего цвета.
При введении разбавленного раствора препарата Пиксуври® следует использовать мембранные фильтры с полиэфирсульфона с размером пор 0,2 мкм.
Дети
Безопасность и эффективность применения препарата Пиксуври® детям (в возрасте до 18 лет) не установлены. Данные отсутствуют.
Передозировка
О случаях передозировки лекарственным средством Пиксуври® не сообщалось.
В клинических исследованиях повышенных доз препарата применялись одноразовые дозы пиксантрону до 158 мг / м2, при этом не наблюдалось признаков дозозависимой.
В случае передозировки рекомендуется поддерживающая терапия.
Побочные эффекты
Резюме профиля безопасности
Безопасность препарата Пиксуври® оценивали с участием 407 пациентов.
Наиболее частой побочной реакцией является угнетение функции костного мозга, в частности линий нейтрофилов. Хотя частота возникновения угнетения функции костного мозга тяжелой степени с клиническими последствиями является относительно низкой, у пациентов, получавших препарат Пиксуври®, проводили тщательный и частый мониторинг количества клеток крови, особенно на наличие нейтропении. Частота инфекций тяжелой степени была низкой; оппортунистических инфекций, связанных с нарушением функции иммунной системы, не наблюдалось. Хотя частота возникновения кардиотоксичности, что проявляется в виде хронической сердечной недостаточности, меньше по сравнению с ожидаемой для подобных лекарственных средств, таких как другие антрациклины, рекомендуется контроль фракции выброса левого желудочка с помощью радионуклидной ангиографии (MUGA) или эхокардиографии для оценки субклинических проявлений кардиотоксичности. Опыт применения пиксантрону ограничивается информацией о пациентах с ФВЛЖ ≥ 45%, при этом у большинства пациентов этот показатель ≥ 50%. Опыт применения лекарственного средства Пиксуври® пациентам с более выраженными кардиальными нарушениями ограничен, его следует принимать во внимание только в контексте клинического исследования. Другие побочные реакции, как тошнота, рвота и диарея, как правило, были легкой степени, нечастыми, обратимыми, контролируемыми и ожидаемыми для пациентов, которые лечатся цитотоксическими средствами. Влияние на функцию печени или почек был минимальный или вовсе отсутствует. его следует принимать во внимание только в контексте клинического исследования. Другие побочные реакции, как тошнота, рвота и диарея, как правило, были легкой степени, нечастыми, обратимыми, контролируемыми и ожидаемыми для пациентов, которые лечатся цитотоксическими средствами. Влияние на функцию печени или почек был минимальный или вовсе отсутствует. его следует принимать во внимание только в контексте клинического исследования. Другие побочные реакции, как тошнота, рвота и диарея, как правило, были легкой степени, нечастыми, обратимыми, контролируемыми и ожидаемыми для пациентов, которые лечатся цитотоксическими средствами. Влияние на функцию печени или почек был минимальный или вовсе отсутствует.
Перечень побочных реакций
Информация о побочных реакциях, о которых сообщалось при применении лекарственного средства Пиксуври®, полученная в результате анализа окончательных данных всех завершенных исследований. Побочные реакции представлены в таблице 5 по системам органов (терминология MedDRA) и по частоте возникновения: очень часто (≥ 1/10); часто (≥ 1/100, <1/10); нечасто (≥ 1/1000, <1/100) редко (≥ 1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (не может быть определена по имеющимся данным). В рамках каждой из групп, сформированных по частоте, нежелательные реакции расположены в порядке уменьшения их серьезности.
Таблица 5
система органов | Частота | побочная реакция |
Инфекции и инвазии | Часто | Инфекция на фоне нейтропении, инфекция дыхательных путей, инфекция |
Нечасто | Бронхит, кандидоз, воспаление жировой ткани, опоясывающий лишай, менингит, инфекционное поражение ногтей, грибковая инфекция полости рта, герпес полости рта, пневмония, сальмонеллезной гастроэнтерит, септический шок | |
Новообразования доброкачественные, злокачественные и неопределенные (включая кисты и полипы) | Нечасто | Прогрессирование новообразований, вторичная малигнизация, в том числе ОМЛ и МДС |
Со стороны системы крови и лимфатической системы * | очень часто | Нейтропения, лейкопения, лимфопения, анемия, тромбоцитопения |
Часто | Фебрильная нейтропения, нарушения со стороны системы крови | |
Нечасто | Недостаточность функции костного мозга, эозинофилия | |
Со стороны иммунной системы | Нечасто | Повышенная чувствительность к лекарственному средству |
Со стороны обмена веществ и метаболизма | Часто | Анорексия, гипофосфатемия |
Нечасто | Гиперурикемия, гипокальциемия, гипонатриемия | |
Со стороны психики | Нечасто | Тревожность, бессонница, нарушения сна |
Со стороны нервной системы | Часто | Нарушение вкуса, парестезии, головная боль, сонливость |
Нечасто | Головокружение, вялость | |
Со стороны органов зрения | Часто | конъюнктивит |
Нечасто | Сухость глаз, кератит | |
Со стороны органов слуха и вестибулярного аппарата | Нечасто | Головокружение |
Со стороны сердца * | Часто | Дисфункция левого желудочка, кардиальные нарушения, застойная сердечная недостаточность, блокада ножки пучка Гиса, тахикардия |
Нечасто | аритмия | |
Со стороны сосудов | Часто | Бледность, обесцвечивание вен, артериальная гипотензия |
Нечасто | Со стороны вен | |
Со стороны дыхательной системы, органов грудной клетки и средостения | Часто | Диспное, кашель |
Нечасто | Плевральный выпот, пневмонит, ринорея | |
Со стороны желудочно-кишечного тракта | очень часто | Тошнота, рвота |
Часто | Стоматит, диарея, запор, боль в абдоминальной области, сухость во рту, диспепсия | |
Нечасто | Эзофагит, парестезии полости рта, ректальное кровотечение | |
Со стороны пищеварительной системы | Нечасто | Гипербилирубинемия |
Со стороны кожи и подкожной клетчатки * | очень часто | Обесцвечивание кожи, алопеция |
Часто | Эритема, заболевания ногтей, зуд | |
Нечасто | Ночная потливость, петехии, макулезно сыпь, изъязвление кожи | |
Со стороны опорно-двигательной системы и соединительной ткани | Часто | Боль в костях |
Нечасто | Артралгия, артрит, боли в спине, мышечная слабость, боль в груди при заболеваниях опорно-двигательного аппарата, костно-мышечная скованность, боль в шее, боль в конечностях | |
Со стороны мочевыделительной системы | очень часто | хроматурия |
Часто | Протеинурия, гематурия | |
Нечасто | олигурия | |
Со стороны репродуктивной системы и молочных желез | Нечасто | Спонтанная эрекция у мужчин |
Общие нарушения и реакции в месте введения | очень часто | астения |
Часто | Усталость, воспаления слизистой оболочки, пирексия, боль в груди, отек | |
Нечасто | Озноб, ощущение холода в месте инъекции, местные реакции | |
Результаты лабораторных исследований | Часто | Повышение уровня АлАТ, АсАТ, щелочной фосфатазы и креатинина в крови |
Нечасто | Повышение уровня билирубина в моче, фосфора и мочевины в крови, гамма-глутамилтрансферазы, увеличение количества нейтрофилов, снижение массы тела |
* Побочные реакции, описанные ниже.
Описание некоторых побочных реакций
Гематологическая токсичность и осложнения нейтропении
Наиболее частыми токсическими проявлениями были гематологические, но в целом они легко контролировались с помощью иммуностимуляторов и при необходимости трансфузией. В рандомизированном исследовании у пациентов, получавших препарат Пиксуври®, чаще возникала нейтропения 3-го и 4-й степени, однако в большинстве случаев она была неосложненной, некумулятивной, а частота развития связанной с ней фебрильной нейтропении или инфекций была низкой. Важно отметить, что необходимости в регулярной поддержке фактора роста не было и трансфузии эритроцитов и тромбоцитов проводились нечасто (см. Раздел «Особенности применения»).
кардиотоксичность
Во время проведения исследования PIX301 снижение фракции выброса наблюдалось у 13 пациентов (19,1%) в группе лечения Пиксуври®. В 11 из них эти эпизоды были 1-го и 2-й степени тяжести, а у 2 пациентов - 3-й степени; эти явления имели временный характер и не зависели от дозы препарата. Случаи сердечной недостаточности (согласно терминологии MedDRA - сердечная недостаточность и застойная сердечная недостаточность) возникли у 6 пациентов (8,8%), принимавших Пиксуври® (у 2 пациентов зарегистрировано первое и второе степени тяжести, в 1 - 3 -й степени и в 3 - пятый степень). У 3 пациентов (4,4%) при применении лекарственного средства Пиксуври® наблюдались тахикардия, аритмия, синусовая тахикардия или брадикардия.
Рекомендуется проводить оценку функции сердца в начале лечения методом радионуклидной ангиографии (MUGA) или эхокардиографии, особенно пациентам с факторами повышенного риска развития кардиотоксичности. Пациентам с такими факторами риска, как предварительное применение высоких кумулятивных доз антрациклинов или при наличии тяжелого сердечного заболевания в анамнезе следует проводить повторные измерения фракции выброса левого желудочка путем радионуклидной ангиографии (MUGA) или эхокардиографии (см. Раздел «Особенности применения»).
Другие распространенные токсические реакции
Обесцвечивание кожи и хроматурия известны побочными эффектами применения препарата Пиксуври®, вызванных цветом действующего вещества (синий). Обесцвечивание кожи обычно исчезает в период от нескольких дней до нескольких недель после вывода лекарственного средства из организма.
Отчет о подозреваемых побочные реакции
Отчет о подозреваемых побочные реакции на лекарственное средство, зарегистрированные в послерегистрационный период, важно. Это позволяет вести непрерывный мониторинг соотношения польза / риск применения препарата. Специалисты в области здравоохранения обязаны сообщать через национальную систему отчетности о любых случаях подозреваемых побочных реакций.
Срок годности Пиксуври
Невидкупорений флакон
5 лет.
Восстановленный (растворенный) и разбавленный раствор
Химическая и физическая стабильность раствора сохраняются в течение 24 часов при его хранении в стандартных полиэтиленовых пакетах для инфузий при комнатной температуре (15-25 ° С) и воздействии дневного света.
С микробиологической точки зрения препарат следует использовать немедленно. Если препарат не применять немедленно, ответственность за продолжительность и условия хранения готового к применению раствора несет медицинский персонал, ответственный за его введение, и этот период не должен превышать 24 ч при температуре 2-8 ° С, если только восстановления (растворения) и разведения осуществлялись в контролируемых и валидизированных асептических условиях.
Условия хранения Пиксуври
Хранить в холодильнике при температуре от 2 до 8 ○ С.
Хранить флакон во внешней упаковке для защиты от света.
Хранить в недоступном для детей месте.
Несовместимость.
Это лекарственное средство не следует смешивать с другими лекарственными средствами, кроме указанных в разделе «Способ применения и дозы».
Упаковка
По 1 флакону, изготовленном из стекла типа I, закупоренной серой бутилкаучуковой пробкой и алюминиевым обжимным колпачком «Flip-Off®» с пластиковой крышкой красного цвета, содержащий 50 мг пиксантрону дималеату, что эквивалентно 29 мг пиксантрону, в коробке из картона упаковочного.
Категория отпуска
По рецепту.
Производитель
Лаборатории Сервье Индастри / Les Laboratoires Servier Иndustrie.
Местонахождение производителя
905 рут де Саран, 45520 Жиди, Франция / 905 route de Saran, 45520 Gidy, France.
Заявитель.
ЛЕ Лаборатуар СЕРВЬЕ / Les Laboratoires Servier.
Местонахождение заявителя.
50, рю Карно, 92284 Сюрен Седекс, Франция / 50, rue Carnot, 92284 Suresnes Сedex, France.
Представитель заявителя в Украине.
ООО «Сервье Украина».
Адрес представителя заявителя.
Ул. Бульварно-Кудрявская, д. 24 м. Киев, 01054, Украина,
тел.: (044) 490 3441, факс: (044) 490 3440.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Пиксуври только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Бакстер Онколоджи ГмбХ
| Тип данных | Сведения из реестра |
| Торговое наименование: | Пиксуври |
| Производитель: | Бакстер Онколоджи ГмбХ |
| Форма выпуска: | порошок для приготовления концентрата для приготовления раствора для инфузий, по 29 мг во флаконах № 1 |
| Регистрационное удостоверение: | UA/16852/01/01 |
| Дата начала: | 27.07.2018 |
| Дата окончания: | 27.07.2023 |
| МНН: | Pixantrone |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон содержит 50 мг пиксантрону дималеату, что эквивалентно 29 мг пиксантрону; / 1 мл восстановленного раствора содержит пиксантрону дималеату эквивалентно 5,8 мг пиксантрону |
| Фармакологическая группа: | Антинеопластичес средства, антрациклины и родственные соединения. |
| Код АТХ: | L01DB11 |
| Заявитель: | ЛЕ Лаборатуар СЕРВЬЕ |
| Страна заявителя: | Франция |
| Адрес заявителя: | 50, рю Карно, 92284 Сюрен Седекс, Франция |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L01 | Противоопухолевые препараты |
| L01D | Цитотоксические антибиотики и родственные препараты |
| L01DB | Антрациклины и родственные соединения |
| L01DB11 | Пиксантрон |