- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Привиджен инструкция по применению
Официальная инструкция лекарственного препарата Привиджен раствор 25 мл, 50 мл, 100 мл, 200 мл, 400 мл. Описание и применение Prividzhen, аналоги и отзывы. Инструкция Привиджен раствор утвержденная компанией производителем.
Состав
действующее вещество: Нитап normal immunoglobulin for intravenous administration (IVIg).
1 мл: Действующее вещество 100 мг белка человеческой плазмы содержит не менее 98% (10% раствор) IgG;
Вспомогательные вещества: L-пролин, вода для инъекций. Белок человеческой плазмы содержит минимум> 98% иммуноглобулина G (IgG). IgG распределение (приблизительные значения) подкласса: IgG и 69%, IgG? 26%, IgG3 3% IgG4 2%. Максимальное содержание IgA - 25 мкг / мл. Титр изоаглютинину составляет 1: 8 для анти-А антител и 1: 4 для анти-В антител (медиана, измеренная тестом прямой агглютинации согласно Европейской фармакопеи.
Лекарственная форма
Раствор для инфузий для внутривенного введения.
Основные физико-химические свойства: от прозрачного до слегка опалесцирующий, бесцветный или слегка желтоватый раствор. Осмолярность составляет 320 мосмоль / кг и, следовательно, является изотонический.
Фармакологическая группа
Иммуноглобулин человека нормальный для внутривенного введения.
Код ATX J06B А02.
Фармакологические свойства
Фармакологические.
Механизм действия Соответствующее дозирования Привиджен может восстановить нормальные значения, когда уровень IgG низкий. Механизм действия по терапевтическим показаниям, кроме заместительной терапии, еще не до конца изучен, но включает иммуномодулирующие эффекты. Производственный процесс Привиджену включает следующие этапы: преципитация фракции IgG из плазмы этанолом, с последующим фракционированием октановым кислоты и инкубацией рН4. Следующие этапы очистки включают Further purification steps include глубинную фильтрацию, хроматографию, имуноаффинну хроматографии для специфического удаления антител групп крови А и В (изоагглютинины) и стадия фильтрации, которая может отделять частицы размером до 20 нм.
Привиджен преимущественно содержит иммуноглобулин G (IgG) с широким спектром функционально интактных антител против инфекционных агентов. Функции Fc, и Fab молекул IgG сохраняются. Способность Fab областей связывать антигены была продемонстрирована биохимическими и биологическими методами. Функция Fc была протестирована с помощью активации комплемента и активации лейкоцитов, опосредованной рецептором Fc. Угнетение активации комплемента, вызванного иммунным комплексом ( «очищение», противовоспалительное функция IVIgs) сохраняется в Привиджен.
Привиджен не влечет к неспецифической активации комплемента или прекалликреин. Привиджен содержит антитела к иммуноглобулина G, которые присутствуют в средней популяции. Он производится из плазмы менее 1000 доноров. Распределение подкласса IgG примерно соответствует распределению в необработанной человеческой плазме. Согласно Европейской Фармакопеи, титр анти-А изоаглютинину при производстве иммуноглобулинов для внутривенного введения должны быть не боль нидерл 1:64. Титр изоаглютинину Привиджену составляет 1: 8 для анти-А и 1: 4 для анти-В (среднее значение 149 серий, рассчитанное в соответствии с теста агглютинацию в соответствии с Европейской
Фармакопеи. Клиническая эффективность Безопасность и клиническая эффективность Привиджену была продемонострована в 6 проспективных открытых, одиночных, многоцентровых исследования, проведенные в Европе (исследования ИТР, ВО и ХЗДП), США (ПОД исследования) и многонациональном (исследование ХЗДП). Дополнительные данные по безопасности и эффективности были собраны в проспективном, открытом, одиночном, многоцентровое исследование с пациентами с ПИД в США. Синдромы первичного иммунодефицита (ПИД) В главном исследовании, 80 пациентов в возрасте от 3 до 69 лет с синдромом первичного иммунодефицита получали инфузию Привиджену каждые 3 - 4 недели в течение максимум одного года при среднем дозировке между 200 и 888 мг / кг массы тела. Это позволило достичь постоянного уровня IgG в течение всего периода лечения со средними концентрациями от 8,84 г / л до 10,27 г / л. Частота острых серьезных бактериальных инфекций (aSBI) составляла 0,08 на пациента в год (верхний доверительный интервал 97,5% составлял 0,182). Во время расширенного исследования ПОД с общим количеством 55 пациентов (45 из которых уже проходили лечение в основном исследовании и 10 из них были недавно набранные), дозы Привиджен вводили, как и в основном исследовании.
Результаты основного исследования были подтверждены для средних уровней IgG (9,31 г / л до 11,15 г / л), а также показателя aSBI (0,018 пациента в год с верхним доверительным интервалом 97,5% составляет 0,098). Первичный иммунный тромбоцитопения (ИТП) В исследовании ИТР приняли участие 57 пациентов с хронической ИТП в возрасте от 15 до 69 лет. В начале исследования количество их тромбоцитов составляла 20 х 109 / л. После введения Привиджен в дозе 1 г / кг массы тела в течение двух дней подряд количество тромбоцитов возросла до менее 50 х Ю9 / л в 80,7% пациентов в течение 7 дней после первой инфузии. В 43% пациентов это увеличение было достигнуто даже за сутки до второй инфузии.
Среднее время достижения этого количества тромбоцитов составил 2,5 дня. У пациентов, которые отвечали на лечение, количество тромбоцитов оставалась на уровне> 50 х Ю9 / л средней продолжительностью 15,4 дня. Во втором исследовании ИТР 57 пациентов с ИТП (начальное количество тромбоцитов (исходное значение) <30 * 109 / л) в возрасте от 18 до 65 лет получали дозу Привиджен 1 г / кг массы тела. На третий день лечения пациенты могли получать вторую дозу 1 г / кг массы тела. Однако у пациентов с количеством тромбоцитов ниже значения <50 х 109 / л на 3 день эта доза была обязательной. В 42 пациентов (74%) количество тромбоцитов возросла по меньшей мере один раз в течение 6 дней до значения> 50 х 109 / л после первой инфузии ".
Вторая доза у пациентов с количеством тромбоцитов> 50 х 109 / л после первой инфузии имела соответствующую дополнительную пользу в виде более высокого пикового числа тромбоцитов (медиана 261,5 х Ю9 / л [диапазон: 130-738 х Ю9 / л]) и более устойчивое увеличение количества тромбоцитов (медиана 14,0 дней [диапазон: 8-28 дней]) по сравнению с разовой инфузии (средний пик количества тромбоцитов 171,0 х] 09 / л [диапазон: 22-516 х 109 / л], со средним продолжительностью увеличение 13,0 дней [диапазон от 3 до ЗО дней]). После обязательной второй дозы у пациентов с количеством тромбоцитов <50 х 109 / л после первой дозы у 30% пациентов выявлено ответ тромбоцитов в крови 50 х 109 / л. Хроническая воспалительная демислинизуюча полинейропатия (ХЗДП) В первом исследовании ХЗДП было проведено многоцентровое открытое исследование PRIMA (исследование влияния Привиджену на подвижность и анатомии).
Далее сопровождалось 6 поддерживающих доз 1 г / кг массы тела, распределенных в течение 1-2 дней каждые 3 недели. У пациентов, подвергшихся лечению, IVIg отменяли к лечению Привидженом, пока не было подтверждено ухудшение клинических симптомов по шкале INCAT (Зажигательная невропатия причины и лечение). По этой 10-балльной шкале INCAT клиническое значение улучшило минимум на 1 балл в 17/28 пациентов (60,7%, 95% доверительный интервал 42,41,76,4) между начальным показателем и 25 неделей лечения. 9 пациентов ответили на лечение даже после введения начальной дозы на 4 недели лечения, и 16 пациентов на 10 неделе лечения. Во втором клиническом исследовании, проспективном, многоцентровом, рандомизированном плацебо-контролируемом PATH исследовании, 207 пациентов с ХЗДП получали лечение Привидженом (фаза перед рандомизации).
Затем все пациенты получали начальную дозу 2 г / кг массы тела Привиджен с последующим до 4 поддерживающих доз 1 г / кг массы тела Привиджену каждые 3 недели в течение общего периода до 13 недель. Клиническое улучшение симптомивХЗДП наблюдалось у 91% пациентов (188 пациентов) до 13 недели, по крайней мере один из следующих критериев: регрессия на 1 балл за скорректированной шкале INCAT, «Общая сумма состоит из заполнения Раш» Значение шкалы инвалидности '(IRODS), повышена на> 4 балла, среднее увеличение силы сцепления на> 8 кПа или увеличение общей оценки Медицинского совета (MRC) на> 3 балла. В целом наблюдалось улучшение 91% пациентов (188 пациентов) до 13 недель, по крайней мере один из вышеупомянутых критериев. Согласно скорректированной шкалы INCAT, уровень ответы до 13 недели составил 72,9% (151 из 207 пациентов).
В общем 43 из 207 пациентов достигли лучшего клинического статуса ХЗДП, чем начало исследования, согласно скорректированной шкалы INCAT. Профиль эффективности и безопасности в исследованиях PRIMA и PATH для пациентов с ХЗДП был сопоставимым в целом. Среднее улучшение симптомов ХЗДП у пациентов в конце лечения, определенное по скорректированной шкале INCAT, составило 1,4. используя скорректированную шкалу INCAT в исследовании PRIMA (1,8 баллов для пациентов, предварительно получали IVIg) и 1,2 балла в исследовании PATH по сравнению с началом лечения. Вторичные конечные точки (IRODS, прочность сцепления и MRC) подтвердили результаты первичного измерения эффективности. Фармакокинетика Абсорбция Нормальный иммуноглобулин человека быстро и полностью попадает в кровоток пациента после введения.
Вивидення IgG и IgG-комплексы разрушаются клетками ретикулоэндотелиальной системы. Период полувыведения из организма может отличаться от пацинта к пациенту. Фармакокинетические параметры Привиджен были установлены в двух клинических исследованиях на пациентах с синдромом первичного иммунодефицита (см. Раздел «Фармакологические свойства»). 25 пациентов (от 13 до 69 лет) в главном исследовании и 13 пациентов (между 9 и 59 годами) в расширенном исследовании были привлечены к фармакокинетичинихл исследований (см. Следующую таблицу).
фармакокинетические параметры
Привиджену у пациентов с синдромом первичного иммунодефицита приведены в таблице
Период полувыведения у пациентов с синдромом первичного иммунодефицита составлял 36,6 дней в основном исследовании и 31,1 дня - в продленном исследовании.
доклинические данные
Безопасность Привиджену была исследована в нескольких доклинических исследованиях, с особым акцентом на исследовании вспомогательного L-пролина. L-пролин - это физиологическая несущественная аминокислота. Исследования на крысах с суточной дозой L-пролина 1450 мг / кг массы тела не обнаружили доказательств тератогенности или эмбриотоксичности. Исследование генотоксичности с L- пролином были без патологических результатов. Несколько опубликованных исследований по поводу гиперпролинемии обнаружили возможный риск при длительном применении высоких суточных доз L-пролина с точки зрения развития мозга у совсем молодых крыс. Однако подобных побочных реакций в подобных исследованиях клинического применения Привиджену не обнаружено.
Дополнительные фармакологические исследования безопасности с использованием L-пролина на взрослых и несовершеннолетних крыс не обнаружили никаких признаков поведенческих расстройств. Иммуноглобулины - природные компоненты человеческого организма. У животных тесты на острую токсичность, хроническую токсичность и эмбриофетальной токсичность иммуноглобулинов не является прогнозируемыми, в результате взаимодействия между иммуноглобулинами разнородных видов и индукции антител к гетерологичных белков. В местных исследованиях толерантности на кроликов с внутривенным, паравенним, внутриартериальным и подкожным введением Привиджену хорошо переносился.
Клинические характеристики
Привиджен Показания
Заместительная терапия при:
- синдромы первичного иммунодефицита (ПИД) такие как: врожденная агаммаглобулинемия или гипогаммаглобулинемия общий вариабельный иммунодефицит (СВОД) тяжелый комбинированный иммунодефицит (ТКИД) Синдром Вискона-Олдрича - вторичные иммунные дефекты (ОТ) у пациентов с тяжелыми или повторяющимися инфекциями, неэффективным антимикробным лечением или подтвержденным недостаточным количеством антител от прививок (ДНСА *) или уровней IgG в сыворотке крови <4 г / л. ДНСА = несостоятельность достижения по крайней мере двукратного повышения титра IgG против пневмококкового полисахарида и вакцин против полипептидных антигенов (ДНСА = доказана специфическая недостаточность антител). Иммуномодуляция Первичная идиопатическая тромбоцитопения (ИТП) у детей и взрослых с высоким риском кровотечения или перед хирургическим вмешательством для коррекции количества тромбоцитов. - Синдром Гийена-Барре - Болезнь Кавасаки - хроническая воспалительная демиелинизирующая полирадикулонейропатия. - мультифокальная моторная нейропатия.
Аллогенная трансплантация костного мозга.
Противопоказания
Гиперчувствительность к любому из компонентов препарата (см. Р. «Состав»). Гиперчувствительность к гомологичных иммуноглобулинов. особенно в очень редких случаях дефицита IgA, когда пациент имеет антитела к IgA. Гиперпролинемии I или II типа. Гиперпролинемии - очень редкое заболевание, которое поражает только отдельные семьи во всем мире.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Живые ослабленные противовирусные вакцины Введение иммуноглобулина в течение периода от 6 недель и до 3 месяцев может повлиять на эффективность живых ослабленных вакцин против таких вирусов, как корь, краснуха, паротит и ветряная оспа. После введения этого препарата вакцинация живыми ослабленными противовирусными вакцинами возможна через 3 месяца. В случае кори ослабление эффективности может храниться до 1 года. Таким образом, пациентам, которые получают вакцину против кори, следует проверять состояние антител. Хотя не существует соответствующих исследований взаимодействия детей и подростков, взаимодействия, аналогичные тем, которые у взрослых, следует ожидать с живыми вакцинами. Влияние на методы диагностики После введения иммуноглобулинов временный подъем различных пассивно перенесенных антител в крови пациента может привести к ложноположительных результатов серологических тестов.
Особенности применения
Предостережение относительно введения препарата
Определенные тяжелые побочные реакции могут быть связаны со скоростью инфузии. Обязательно нужно соблюдать скорости инфузии, рекомендованной в разделе «Способ введения и дозы». Пациентов необходимо контролировать в течение всей продолжительности инфузии и после нее тщательно следить за появлением симптомов любого типа.
Определенные побочные реакции могут возникать чаще в таких случаях: - высокая скорость инфузии - пациенты с гипо- или агаммаглобулинемией с дефицитом IgA или без него, - пациенты, которые получают иммуноглобулин человека впервые или. в редких случаях, при переключении препаратов иммуноглобулина или после длительного перерыва в лечении. Возможных осложнений часто можно избежать, если обеспечить: - пациенты не «гиперчувствительные к иммуноглобулина человека» - сначала давая им препарат в виде медленной инъекции (0,3 мл / кг МТ / ч,) - пациентов тщательно контролируют на наличие симптомов любой какого типа в течение всей продолжительности инфузии, в частности, пациентов, сначала получали человеческий иммуноглобулин после перехода с другого препарата иммуноглобулина, или перенесших длительный перерыв в лечении,
По другим пациентами следует наблюдать в течение по крайней мере 20 минут после введения. Если возникает побочная реакция, необходимо уменьшить скорость инфузии или инфузии прекратить. Необходимое лечение зависит от характера и тяжести побочных ре & ии ". . Если возникают симптомы шока, необходимо применять стандартные медицинские процедуры лечения шока. Более высокую скорость побочных реакций можно ожидать при более высоких дозах. Поэтому для каждого отдельного пациента следует искать самую низкую эффективную дозу и следует устанавливать тщательный режим наблюдения.
У всех пациентов лечение IVIg требует адекватной гидратации перед началом инфузии IVIg. Повышенная чувствительность Настоящие реакции гиперчувствительности редки. Они могут возникать у пациентов с антителами к IgA. У пациентов с селективным дефицитом IgA без нарушения других классов Ig, IVIg не следует применять для замены Ig. Редко человеческий иммуноглобулин может вызвать падение артериального давления с анафилактической реакцией даже у пациентов, ранее переносили лечение.
Гемолитическая анемия Продукты IVIg могут содержать антитела к антигенам группы крови. Как гемолизинами, такие антитела могут повлечь связывания in vivo иммуноглобулинов с эритроцитами. Это может привести к положительной прямой антиглобулиновая реакции (тест Кумбса) и, редко, к гемолизу. После лечения IVIg может возникнуть гемолитическая анемия через усиленную секвестрацию эритроцитов. В связи с гемолизом сообщалось о единичных случаях нарушения функции почек / почечной недостаточности или диссеминированной внутрисосудистой коагуляции.
Следующие факторы риска связаны с развитием гемолиза: высокие дозы, которые вводятся в виде однократной дозы или в разделенных дозах в течение нескольких дней (разделение введение IVIg на несколько разовых доз не подходит для предотвращения возможного гемолиза, поскольку период полувыведения иммуноглобулинов находится в порядке 3 4 недель) группы крови А, В или АВ; сопутствующее первичное воспалительное заболевание. Поскольку часто сообщалось о гемолиз у пациентов группы крови А, В или АВ, одновременно получали высокие дозы IVIg для НЕ первичных синдромов иммунодефицита (ПОД) рекомендуется повышенная бдительность. О заместительной терапии у пациентов с ПИД редко сообщается о гемолиз.
Значительно повышен риск клинически значимого гемолиза существует у пациентов с группой крови А, В или АВ, кумулятивно получая> (1-) 2 г / кг MT IVIg с высоким титром изоаглютинину. Сообщалось лишь о редких случаях гемолиза при применении препаратов IVIg со средним титром анти-А <1:16 (измеряется с помощью теста прямой агглютинации согласно Ph.Eur.). Привиджен имеет средний титр анти-А 1: 8 (см. Раздел «Фармакологические свойства / фармакодинамика»). Реципиентов IVIg следует контролировать на предмет клинических признаков и симптомов гемолиза.
Если признаки и / или симптомы гемолиза оказываются во время инфузии IVIg или после него, лечащий врач должен рассмотреть вопрос о прерывании лечения IVIg (см. Также раздел «Побочные реакции»). Синдром асептического менингита (САМ) Случаи САМ случались во время лечения внутривенным иммуноглобулином. Прекращение лечения привело к ремиссии САМ без последствий в течение нескольких дней. Синдром обычно возникает в течение нескольких часов до 2 дней после начала лечения IVIg. Тесты на спинномозговую жидкость часто положительные при плеоцитоз до нескольких тысяч клеток на мм3 (преимущественно гранулоциты) и при повышенном уровне белка до нескольких сотен мг / дл.
САМ может возникать чаще при высокодозной лечении внутривенными иммуноглобулинами (2 г / кг BW). Тромбоэмболия Существуют клинические данные о взаимосвязи между введением IVIg и тромбоэмболических осложнений, такими как инфаркт миокарда, острое нарушение мозгового кровообращения (включая инсульт), эмболия легких и глубокий тромбоз вен, которые, возможно, связаны с относительным увеличением вязкости крови из-за большого поступления иммуноглобулина у пациентов с таким риском. Следует соблюдать осторожность при назначении IVIg и его введение пациентам с ожирением и пациентам с предварительно существующими факторами риска тромботических осложнений (такими как пожилой возраст. Артериальная гипертензия, цукфвий диабет и наличие в анамнезе заболеваний или тромботических осложнений, приобретенные или наследственные тромбофилических нарушения, длительные периоды иммобилизации,
Пациентам с риском тромбоэмболических побочных реакций препараты IVIg следует назначать с минимальной скоростью введения и в наименьшей эффективной дозе Острая почечная недостаточность Сообщается о случаях острой почечной недостаточности у пациентов, получавших терапию I VIg. В большинстве случаев были идентифицированы факторы риска, такие как предварительно существующая почечная недостаточность, сахарный диабет, гиповолемия, избыточная масса тела, сопутствующая терапия нефротоксичными лекарственными средствами или возраст более 65 лет. В случае почечной недостаточности следует рассмотреть возможность прекращения введения I VIg. Сообщение о почечной дисфункции и острую почечную недостаточность связанные с использованием многих лицензированных препаратов IVIg, содержащих различные вспомогательные вещества, такие как сахароза, глюкоза и мальтоза.
Особенно велика доля от общего количества касается препаратов, содержащих сахарозу в качестве стабилизатора. Для пациентов с таким риском можно рассмотреть применение препаратов IVIg, не содержащие сахарозы. Привиджен не содержит сахарозы, глюкозы или мальтозы. Пациентам с риском острой почечной недостаточности препараты IVIg следует назначать с минимальной скоростью введения и в наименьшей (эффективной) дозе. Синдром острого посттрансфузионного поражения легких (СГПУЛ) Сообщалось о некардиогенный отек легких (синдром острого посттрансфузионного поражения легких (СГПУЛ)) у пациентов, которым вводили иммуноглобулин. СГПУЛ характеризуется тяжелым затруднением дыхания, отеком легких, гипоксемией, нормальной функцией левого желудочка и лихорадкой, обычно возникает в течение 1 - 6:00 после трансфузии.
Пациентам с СГПУЛ можно применять кислородную терапию с должным дополнительной вентиляцией легких. Информация о безопасности передачи микроорганизмов Привиджен производится из плазмы человека. Стандартные меры по предотвращению инфекций, которые могут быть следствием использования лекарственных препаратов, изготовленных из крови или плазмы человека, включают отбор доноров, обследование индивидуальных донаций и пулов плазмы на конкретные маркеры инфекционности и внедрение эффективных производственных шагов для инактивации / устранение вируса. Тем не менее, возможность передачи инфекционных агентов не может быть полностью исключена при назначении лекарственных средств, изготовленных из крови человека или плазмы. Это касается неизвестных, или вирусов и других возбудителей болезней, появившихся только.
Предпринимаемые, считаются эффективными по оболочечных вирусов, таких как ВИЧ (вирус иммунодефицита человека), HBV (вирус гепатита В), HCV (вирус гепатита С). Предпринимаемые, могут иметь ограниченную эффективность по безоболочных вирусов таких как HAV (вирус гепатита А) и парвовирус В19. Накопленный клинический опыт убедительно свидетельствует об отсутствии передачи вируса гепатита А или парвовируса В19 при применении препаратов иммуноглобулина человека; кроме того, предполагают, что содержание антител имеет важное значение для повышения вирусной безопасности. Настоятельно рекомендуется каждый раз при введении пациенту Привиджен записывать название и номер серии препарата для того, чтобы можно было проследить связь между состоянием пациента и введением препарата конкретной серии.
Дети и подростки
Ограничены доступные данные о педиатрических пациентов указывают на то, что одинаковые предупреждения, меры безопасности и факторы риска в равной степени относятся детей и подростков. Привиджен следует применять детям и подросткам с соответствующей осторожностью и при строгом соблюдении указанных предупреждений.
Применение в период беременности или кормления грудью
беременность
Безопасность применения этого лекарственного средства беременным женщинам не была установлена в контролируемых клинических исследованиях, поэтому его следует назначать с осторожностью беременным и кормящим грудью. Препараты IVIg проникают через плаценту, особенно во время третьего триместра беременности. Клинический опыт применения иммуноглобулинов свидетельствует о том. что при их введении не предвидится вредного влияния на течение беременности, на развитие плода или новорожденного. Исследования на животных по опомижнои вещества L-пролина показывает отсутствие прямой или косвенной токсичности по беременности, эмбрионального развития и развития плода.
кормление грудью
Иммуноглобулины выделяются с грудным молоком и могут способствовать защите новорожденного от микроорганизмов, которые проникают через слизистую оболочку.
Способность к оплодотворению
Клинический опыт применения иммуноглобулинов свидетельствует о том, что при их введении не предвидится вредного влияния на способность к оплодотворению.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Привиджен имеет незначительное влияние на способность управлять транспортным средством или другими механизмами. Возможность управлять автомобилем или управлять машинами может быть ослаблена определенными побочными действиями Привиджен. Пациенты, у которых возникают побочные реакции при лечении, должны подождать некоторое время, пока они исчезнут, перед тем как управлять транспортным средством или работать с механизмами.
Способ применения Привиджен и дозы
Привиджен нужно вводить. Инфузии Привиджен вводить с начальной скоростью 0,3 мл / кг / ч (примерно в течение ЗО минут). Если препарат хорошо переносится пациентом (, то скорость введения можно постепенно увеличить до максимально возможной 4,8 мл / кг / ч. У пациентов с синдромами иммунодефицита и хорошей переносимостью заместительной терапии Привидженом скорость инфузии может постепенно увеличиваться до максимального значения 7,2 мл / кг / ч. Дозы Дозировка и интервалы между введением зависят от показаний.
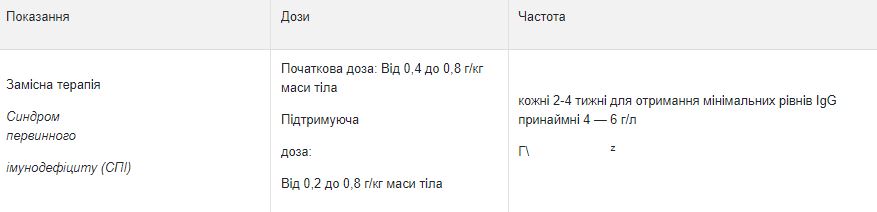
В заместительной терапии дозу следует подбирать индивидуально в зависимости от клинического ответа. Последующие дозы приведены в качестве рекомендации. Для обеспечения прослеживаемости биологически изготовленных лекарственных средств рекомендуется задокументировать название препарата и номер партии для каждого лечения. Заместительная терапия при синдромах первичного иммунодефицита: Необходимо выбрать схему дозирования, при которой достигается минимальный уровень IgG (определение уровня IgG в сыворотке крови непосредственно перед последующей инфузией) не менее от 5 до 6 г / л. После начала лечения нужны от 3 до 6 месяцев до достижения устойчивой концентрации.
Рекомендованная начальная доза составляет 0,4-0.8 г / кг массы тела а затем не менее 0,2 г / кг массы тела каждые 3-4 недели. Доза, необходимая для поддержания уровня IgG от 5 до 6 г / л, составляет от 0,2 до 0,8 г / кг / месяц. После достижения устойчивой концентрации интервал дозирования составляет 3-4 недели. Для установления необходимой дозы и правильного интервала дозирования следует определить минимальный уровень IgG.
Терапия при вторичном иммунодефиците рекомендуемая доза от 0,2 до 0,4 г / кг массы тела каждые 3 4 недели. Необходимо измерить и оценить минимальные уровни IgG и их связь с заболеваемостью инфекцию. Дозу адаптировать при необходимости для достижения оптимальной защиты от инфекций. Увеличение дозы может понадобиться пациентам с устойчивыми инфекциями; возможно снижение дозы, если пациент остается без инфекций. Первичная идиопатическая тромбоцитопения Для лечения острого эпизода в первый день вводят от 0,8 до 1 г / кг массы тела, дозу можно повторно вводить один раз в течение 3 дней альтернативно 0,4 г / кг массы тела ежедневно в течение 2 - 5 дней. В случае второго снижение количества тромбоцитов, лечение можно повторить (см. Также разделы «Фармакологические свойства», «Побочные» Синдром Гийена-Барре 0,4 г / кг / день в течение 5 дней.
Пациенты должны получать сопутствующую терапию ацетилсалициловой. Хроническая воспалительная демиелинизирующая полирадикулонейропатия (ХЗДП) рекомендуемая начальная доза составляет 2 г / кг массы тела, разделенная на несколько доз, вводится от 2 до 5 дней подряд. Затем каждые 3 недели поддерживающие дозы в виде 1 г / кг массы тела вводят в один день, или распределяют в течение 2 дней подряд. При длительном лечении, более 25 недель, руководствуются ответом на поддерживающую терапию. Самую низкую эффективную поддерживающую дозу и режим дозирования следует регулировать в соответствии с индивидуальным течения заболевания.
Мультифокальная моторная нейропатия Начальная доза 2 г / кг массы тела в течение 2-5 дней подряд. Поддерживающая доза 1 г / кг массы тела каждые 2-4 недели или 2 г / кг массы тела каждые 4-8 недель. Если через 6 месяцев определено недостаточную реакцию на лечение, лечение следует прекратить. Если лечение является эффективным., Необходимость длительного лечения должна оцениваться врачом, основываясь на реакции пациента. Дозировка и интервалы, необходимо адаптировать к индивидуальному течения заболевания.
Аллогенная трансплантация костного мозга Нормальный иммуноглобулин человека может быть частью схемы лечения и применяться после трансплантации. Для лечения инфекций и профилактики гомологической болезни (реакция «трансплантат против хозяина») дозу подбирают индивидуально. Начальная доза обычно составляет 0,5 г / кг / неделю, препарат в этой дозе следует назначать за 7 дней до трансплантации. Продолжать применение в течение 3 месяцев после трагсплантации. В случае устойчивого дефицита синтеза антител рекомендуется применять дозу 0,5 г / кг / месяц к восстановлению и нормализации концентрации антител. Рекомендуемые дозы приведены в Таблице:
Пациенты детского возраста:
В III фазе основного исследования пациенты с синдромом первичного иммунодефицита (СПИ) (количество пациентов 80), 19 пациентов в возрасте от 3 до и 1 лет и 15 пациентов в возрасте старше 12 лет, включая 18 летних. В расширенном исследовании пациентов с СПИ (количество пациентов 55) было 13 пациентов в возрасте от 3 до 11 лет и 11 в возрасте от 12 до 18 лет, включая. В клиническом исследовании 57 пациентов с хронической первичной иммунной тромбоцитопении (ИТП) лечились 2 пациента (15 и 16 лет). В трех исследованиях не нужно было корректировать дозу для детей.
У детей с хронической воспалительной демиелинизирующей полинейропатией (ХЗДП) литературные данные свидетельствуют, что внутривенные иммуноглобулины эффективны. Однако нет данных о Привиджен. Инструкция по применению Привиджен это готовый к использованию раствор. Препарат должен быть комнатной температуры или температуры тела перед введением. Для введения следует использовать стандартный набор для инфузий с интегрированным фильтром. Крышку флакона всегда следует пробить в ее центре, в пределах обозначенной области. При необходимости Привиджен можно развести 5% раствором глюкозы в асептических условиях. Привиджен не следует смешивать с физиологическим солевым раствором. Однако промывание инфузионных пробирок физиологическим солевым раствором разрешено. Раствор должен быть прозрачным или слегка опалесцирующий. Растворы с видимым помутнение или осадком, не следует использовать.
Дети
Лекарственное средство применяют в соответствии с рекомендациями указанных в разделе «Способ применения и дозы».
Передозировка
Передозировка может привести к гиперволемии и повышению вязкости крови, особенно у пациентов с риском, включая пожилых пациентов или пациентов с нарушением функции сердца или почек.
Побочные эффекты
Обзор профиля безопасности
При внутривенном введением иммуноглобулина человека могут возникать редкие побочные реакции, такие как озноб, головная боль, головокружение, лихорадка, рвота, аллергические реакции, тошнота, артралгия, низкое артериальное давление и умеренная боль в спине. Редко иммуноглобулин человека может вызвать реакции гиперчувствительности с внезапным падением артериального давления или даже анафилактическим шоком в отдельных случаях, даже когда пациент не проявлял гиперчувствительности к предыдущим приложений. Наблюдали случаи обратного асептического менингита и редкие случаи переходных кожных реакций (включая кожный красная волчанка - неизвестная частота) с применением человеческого иммуноглобулина. У пациентов с группами крови А, В и АВ наблюдались гемолитические реакции. В редких случаях гемолитическая анемия, требующая переливания,
Наблюдалось повышение уровня креатинина в сыворотке крови и / или острая почечная недостаточность. Очень редко случаются связанные с трансфузией острая легочная недостаточность, тромбоэмболические эпизоды, такие как инфаркт миокарда, нарушение мозгового кровообращения (инсульт), легочная эмболия и тромбоз глубоких вен. Список побочных реакций С Привиджен было проведено шесть клинических исследований, которые включали пациентов с первичным иммунодефицитом (ПИД), первичной иммунной тромбоцитопении (ИТП) и хронической воспалительной демиелинизирующей полинейропатией (ХЗДП). В основное исследование ПОД было включено 80 пациентов, получавших ликувашя Привиджен. Из них 72 завершили двенадцать месяцев лечения. В расширенном исследования ПОД было включено 55 пациентов, получавших лечение Привиджен. В двух исследованиях ИТР были включены 57 пациентов.
Перечень побочных реакций, представлен в таблице, соответствует классификации системы органов MedDRA с частота возникновения побочных реакций, оценивается в соответствии со следующими условных обозначений: очень часто (> 1/10); часто (> 1/100 до <1/10); редкие (от> 1/1000 до <1/100); жидкие (от> 1/10000 до <1/1000); очень редко (<1/10000) неизвестные (невозможно оценить, исходя из существующих данных).
Инфекции и инвазии: нечасто Асептический менингит Со стороны крови и лимфатической системы Часто: анемия, гемолиз (включая гемолитической анемии), снижение гемоглобина, положительный тест Кумбса, снижение эритроцитов, снижение гематокрита, повышение уровня лактатдегидрогеназы в крови), лейкопения нечасто Анизоцитоз (включая микроцитоз), тромбоцитоз единичных случаях Снижение числа нейтрофилов Со стороны иммунной системы часто: гиперчувствительность единичных случаях анафилактический шок Со стороны нервной системы: очень часто головная боль (39%) (включая синусовый головная боль, мигрень, дискомфорт в голове , головная боль в напряжении) Часто легкая головная боль (включая головокружение (вертиго)) нечасто сомнолентность, тремор, дистестезия Со стороны сердца: нечасто учащенное сердцебиение, тахикардия Со стороны сосудов: Часто гипертензия,покраснение (включая приливы, гиперемия, ночная потливость), снижение артериального давления нечасто тромбоэмболические явления (включая легочную эмболию), васкулит (включая периферические окклюзионные заболевания) единичных случаях трансфузионную острое поражение легких со стороны дыхательной системы, органов грудной клетки и средостения: часто : Диспнея (включая боль в груди, напряжение в груди / горле, болезненное дыхание) единичных случаях Дыхательная недостаточность Со стороны желудочно-кишечного тракта: очень часто тошнота (10.1%) часто блевать, диарея, боль в животе гепатобилиарной системы :: часто : Гипербилирубинемия, повышение аланиновои аминотрансферазы, повышение АсАТ Со стороны кожи и подкожной клетчатки: Часто заболевания кожи (включая сыпь, зуд, крапивница, макулопапулезная сыпь, эритема,шелушение кожи) Со стороны костно-мышечных и соединительной ткани: часто: миалгия (включая мышечные спазмы, недвижимость, боль в опорно-двигательном аппарате Со стороны почек и мочевыделительной системы: нечасто протеинурия, повышение уровня креатинина в крови Единичные случаи : острая почечная недостаточность Общие нарушения и состояния в месте введения: очень часто боль (19%) (включая боль в спине, боль в груди, including back pain, limb pain, артралгия, боль в шее, боль лица), лихорадка (17 %) (включая озноб), гриппоподобные состояния (14.7%) (включая нософарингит, фаринголарингеальний боль, волдыри ротоглотки, сжатие горла) Часто утомляемость, астения (включая мышечную слабость) нечасто боль в месте введения Для получения информации о вирусной безопасность и дальнейшие сведения о серьезных побочных реакций и факторов риска: см.Раздел «Взаимодействие и другие виды взаимодействий».
Срок годности Привиджен
С года. Срок годности после вскрытия: Привиджен предназначен для одноразового использования. Поскольку раствор не содержит консервантов, Привиджен следует утилизировать / использовать для инфузии можно скорее после открытия флакона.
Условия хранения Привиджен
Не хранить при температуре выше 25 ° С. Не замораживать. Хранить во флаконе в картонной коробке для защиты от света. Хранить в недоступном для детей месте.
несовместимость
Это лекарственное средство не следует смешивать с другими лекарственными средствами или даже физиологическим солевым раствором. Исключение: разведение 5% раствором глюкозы.
Упаковка
По 25 мл, 50 мл, 100 мл, 200 мл или 400 мл раствора для инфузий во флаконе. По 1 флакону в картонной коробке.
Категория отпуска
По рецепту.
Производитель
CSL Bering AG.
Местонахождение производителя
Ванкдорфштрассе 10, Берн, 3014, Швейцария.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Привиджен только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- ЦСЛ Беринг АГ
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
Привиджен и Алкоголь?
Ваше состояние само по себе может ухудшаться после приема спиртного, так как алкоголь расширяет сосуды и вызывает отечность. Не рекомендуем принимать алкоголь в течение всего курса приема препарата Привиджен, а также несколько дней после завершения лечения.
| Тип данных | Сведения из реестра |
| Торговое наименование: | Привиджен |
| Производитель: | ЦСЛ Беринг АГ |
| Форма выпуска: | раствор для инфузий 100 мг / мл (10%), по 25 мл, 50 мл, 100 мл, 200 мл, или 400 мл во флаконах, по 1 флакону в картонной коробке |
| Регистрационное удостоверение: | UA/18357/01/01 |
| Дата начала: | 07.10.2020 |
| Дата окончания: | 10.07.2025 |
| МНН: | Immunoglobulins, normal human, for intravascular adm. |
| Условия отпуска: | по рецепту |
| Состав: | 100 мг белка человеческой плазмы содержит не менее 98% (10% раствор) IgG |
| Фармакологическая группа: | Иммуноглобулин человека нормальный для внутривенного введения. |
| Код АТХ: | J06BA02 |
| Заявитель: | ЦСЛ Беринг АГ |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Ванкдорфштрассе 10 3014, Берн, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| J | Противомикробные средства для системного применения |
| J06 | Лечебные сыворотки и иммуноглобулины |
| J06B | Иммуноглобулины |
| J06BA | Иммуноглобулин человека нормальный |
| J06BA02 | Иммуноглобулин человека нормальный для в / в введения |