- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/17376/01/01 закончился 26.04.2024
Лемтрада инструкция по применению
Официальная инструкция лекарственного препарата Лемтрада концентрат 1,2 мл. Описание и применение Lemtrada, аналоги и отзывы. Инструкция Лемтрада концентрат утвержденная компанией производителем.
Состав
действующее вещество : алемтузумаб;
1,2 мл концентрата содержит алемтузумаб 12 мг.
1 флакон содержит 12 мг алемтузумаб;
Вспомогательные вещества: натрия фосфат (E 339) трилон Б дигидрат; калия хлорид (E 508) калия дигидрофосфат (E 340) полисорбат 80 (E 433) натрия хлорид, вода для инъекций.
Лекарственная форма
Концентрат для приготовления раствора для инфузий.
Основные физико-химические свойства: прозрачный концентрат от бесцветного до слегка желтого цвета, pH 7,0-7,4.
Фармакологическая группа
Иммунодепрессанты, селективные иммунодепрессанты. Алемтузумаб.
Код АТХ L04A A34.
Фармакологические свойства
Фармакологические.
Механизм действия. Алемтузумаб является гуманизированным моноклональное антитело, полученным по технологии рекомбинантной ДНК и нацеленным на гликопротеин CD52, который находится на поверхности клетки и имеет молекулярную массу 21-28 кД. Алемтузумаб представляет собой антитело класса IgG1 каппа с человеческими вариабельными каркасными и константными участками и участками, которые определяют комплиментарность, полученными от мышиного моноклонального антитела (производимого в организме крысы). Приблизительная молекулярная масса антитела составляет 150 кД.
Алемтузумаб связывается с CD52 - антиген клеточной поверхности, который в высоких концентрациях присутствует на лимфоцитах T (CD3 +) и B (CD19 +) и в низких концентрациях - на естественных клеток-киллеров, моноцитах и макрофагах. CD52 оказывается в незначительных концентрациях или не проявляется совсем на нейтрофилах, плазмоцитах и стволовых клетках костного мозга. Действие Алемтузумаб реализуется через антителозависимую цитолиз клеток и комплементопосередкований лизис после поверхневоклитинного связывания с Т- и В-лимфоцитами.
Механизм, за счет которого препарат Лемтрада обеспечивает свои терапевтические эффекты при рассеянном склерозе (РС), пока точно не выяснен. Однако исследования указывают на наличие иммуномодулирующих эффектов путем элиминации и репопуляции лимфоцитов, в том числе:
- изменения в количестве, соотношении и свойствах некоторых подгрупп лимфоцитов после применения препарата
- увеличение количества регуляторных подгрупп Т-клеток;
- увеличение количества Т- и В-лимфоцитов памяти;
- преходящий влияние на компоненты врожденного иммунитета (т.е. на нейтрофилы, макрофаги, NK-клетки).
Изменение количества циркулирующих В- и Т-клеток под действием препарата Лемтрада и их дальнейшая репопуляции могут уменьшать потенциал для рецидива заболевания, в конечном счете замедляет прогрессирование заболевания.
Фармакодинамические эффекты. Препарат Лемтрада уменьшает уровни циркулирующих Т- и В-лимфоцитов после каждого курса лечения, при этом низкие уровни этих клеток отмечаются через 1 месяц после курса лечения (это соответствовало самый ранний временной точке при выполнении оценок после лечения в исследованиях III фазы). Со временем происходит репопуляции лимфоцитов, при этом восстановление уровней В-клеток, как правило, происходит в пределах 6 месяцев. Уровни CD3 + и CD4 + лимфоцитов увеличиваются до нормальных медленнее, но обычно они не возвращаются к исходным уровням через 12 месяцев после лечения. Примерно у 40% пациентов общее содержание лимфоцитов достигал нижней границы нормы (НМН) через 6 месяцев после каждого курса лечения, и примерно у 80% пациентов общее содержание лимфоцитов достигал НМН через 12 месяцев после каждого курса лечения.
Нейтрофилы, моноциты, эозинофилы, базофилы и естественные клетки-киллеры испытывают лишь преходящих изменений под действием препарата Лемтрада.
Клиническая эффективность и безопасность. Безопасность и эффективность Алемтузумаб при РС оценивались в 3 рандомизированных слепых оценщика, клинических исследованиях с использованием активного препарата сравнения и 1 неконтролируемом, слепому для оценщика, расширенном исследовании с участием пациентов с рецидивирующим-ремитирующим рассеянным склерозом (РРРС).
В таблице 1 представлена информация о дизайне исследований / демографические данные пациентов (исследование 1, 2, 3 и 4).
Таблица 1
Название исследования | Исследование 1 CAMMS323 | Исследование 2 CAMMS32400507 | Исследование 3 CAMMS223 |
Дизайн исследования | Контролируемое, рандомизированное, слепое для оценщика | Контролируемое, рандомизированное, слепое для оценщика и слепое по дозы | Контролируемое, рандомизированное, слепое для оценщика |
анамнез заболевания | Пациенты с активным РС, определялось как минимум 2 рецидивы за последние 2 года | Пациенты с активным РС, определялось как минимум 2 рецидивы за последние 2 года или наличие 1 или нескольких очагов поражения, которые накапливают контраст | |
продолжительность | 2 года | 3 года ‡ | |
Популяция участников исследования | Пациенты, ранее не получавших лечения | Пациенты, у которых отмечалась неудовлетворительная ответ на ранее проводимую терапию * | Пациенты, ранее не получавших лечения |
выходные характеристики | |||
Средний возраст (годы) | 33 | 35 | 32 |
Средняя / медианная продолжительность заболевания | 2,0 / 1,6 года | 4,5 / 3,8 года | 1,5 / 1,3 года |
Средняя продолжительность ранее проводимой терапии РС (с использованием ≥ 1 препарата) | не проводилась | 36 месяцев | не проводилась |
% Пациентов, которые ранее получили ≥ 2 курсов лечения РС | не применимы | 28% | не применимы |
Среднее количество баллов по шкале EDSS (Расширенная шкала степени инвалидизации) на исходном уровне | 2,0 | 2,7 | 1,9 |
исследование 4 | |||
Название исследования | CAMMS03409 | ||
Дизайн исследования | Неконтролируемое, слепое для оценщика, расширенное исследование | ||
Популяция участников исследования | Пациенты, которые принимали участие в исследованиях CAMMS223, CAMMS323 или CAMMS32400507 (см. Исходные характеристики выше) | ||
Продолжительность расширенной фазы | 4 года | ||
* Определялись как пациенты, у которых наблюдался менее 1 рецидив во время лечения интерфероном бета или глатирамера ацетатом после получения такой терапии в течение не менее 6 месяцев.
‡ Первичная конечная точка исследования оценивалась через 3 года. Дополнительное наблюдение дало данные для периода с медианой продолжительности 4,8 года (с максимальным сроком наблюдения 6,7 года).
В таблице 2 показаны результаты, полученные в исследованиях 1 и 2.
Таблица 2.
Название исследования | исследование 1 CAMMS323 (CARE-MS I) | Исследование 2 CAMMS32400507 (CARE-MS II) | ||
Клинические конечные точки | Лемтрада 12 мг (N = 376) | ИФН-бета-1а п / к (N = 187) | Лемтрада 12 мг (N = 426) | ИФН-бета-1a п / к (N = 202) |
частота рецидивив1 Годовая частота рецидивов (РЧР) (95% ДИ) | 0,18 (0,13, 0,23) | 0,39 (0,29, 0,53) | 0,26 (0,21, 0,33) | 0,52 (0,41, 0,66) |
Отношение частот (95% ДИ) | 0,45 (0,32, 0,63) 54,9 (р <0,0001) | 0,51 (0,39, 0,65) 49,4 (р <0,0001) | ||
Инвалидизация1 (подтверждено ухудшение степени инвалидизации [ППИ]) 2 | 8,0% (5,7, 11,2) | 11,1% (7,3, 16,7) | 12,7% (9,9, 16,3) | 21,1% (15,9, 27,7) |
Отношение рисков (95% ДИ) | 0,70 (0,40, 1,23) (p = 0,22) | 0,58 (0,38, 0,87) (p = 0,0084) | ||
Пациенты, не имели рецидивов в течение 2 лет (95% ДИ) | 77,6% (72,9, 81,6) (р <0,0001) | 58,7% (51,1, 65,5) | 65,4% (60,6, 69,7) (р <0,0001) | 46,7 (39,5, 53,5) |
Изменение количества баллов по шкале EDSS по сравнению с исходным уровнем через 2 роки3 (95% ДИ) | -0,14 (-0,25, -0,02) (p = 0,42) | -0,14 (-0,29, 0,01) | -0,17 (-0,29, -0,05) (р <0,0001) | 0,24 (0,07, 0,41) |
МРТ конечные точки (0-2 года) | ||||
Медиана изменения в% объема очагов поражений на Т2-взвешенных МРТ изображениях | -9,3 (-19,6, -0,2) (р = 0,31) | -6,5 (-20,7, 2,5) | -1,3 (p = 0,14) | -1,2 |
Количество пациентов с новыми очагами поражения или с увеличением очагов поражений на Т2-взвешенных изображениях через 2 года | 48,5% (p = 0,035) | 57,6% | 46,2% (р <0,0001) | 67,9% |
Количество пациентов с очагами поражений, которые накапливают гадолиний, через 2 года | 15,4% (p = 0,001) | 27,0% | 18,5% (р <0,0001) | 34,2% |
Количество пациентов с новыми очагами поражений, гипоинтенсивнимы на Т1-взвешенных изображениях, через 2 года | 24,0% (p = 0,055) | 31,4% | 19,9% (р <0,0001) | 38,0% |
Медиана изменения в% паренхимальнои доли головного мозга | -0,867 (р <0,0001) | -1,488 | -0,615 (p = 0,012) | -0,810 |
1 Составляющими первичной конечной точки были РЧР и ППИ. Исследование признавалось успешным, если была достигнута хотя бы одна из этих двух составляющих первичной конечной точки.
2 ППИ определялось как увеличение показателей хотя бы по одному пункту Расширенной шкалы степени инвалидизации (EDSS) на ≥ 1,0 балл по сравнению с исходными значениями оценки по шкале EDSS (для пациентов с исходными значениями оценки по шкале EDSS на уровне 0 учитывалось увеличение на 1 5 балла), которое содержалось в течение 6 месяцев.
3 Оценивалось с использованием смешанной модели для повторных измерений.
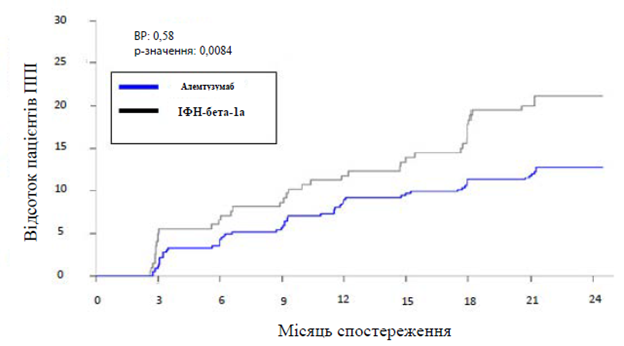
Рис. Время до подтвержденного ухудшения инвалидизации (в течение ≥ 6 месяцев) в исследовании 2.
Тяжесть рецидива.
В исследовании влияния лечения на частоту рецидивов вспомогательные анализы, проведенные в рамках исследования 1 (CAMMS323), показали, что применение препарата Лемтрада в дозе 12 мг / сут приводило к статистически значимо меньшего количества пациентов, у которых были тяжелые рецидивы (снижение на 61%, p = 0,0056), и к статистически значимо меньшего количества рецидивов, которые обусловливали необходимость применения стероидных препаратов (снижение на 58%, p <0,0001) по сравнению с группой применения IFNB-1a.
Вспомогательные анализы, проведенные в рамках исследования 2 (CAMMS32400507), показали, что применение препарата Лемтрада в дозе 12 мг / сут приводило к статистически значимо меньшего количества пациентов, у которых были тяжелые рецидивы (снижение на 48%, p = 0,0121), и к статистически значимо меньшего количества рецидивов, которые обусловливали необходимость применения стероидных препаратов (снижение на 56%, p <0,0001) или госпитализации (снижение на 55%, p = 0,0045) по сравнению с группой применения IFNB-1a.
Подтверждено уменьшение степени инвалидизации (ПЗИ)
Время до наступления ПЗИ определялся как уменьшение показателей хотя бы по одному пункту шкалы EDSS на ≥ 2 балла по сравнению с исходными значениями оценки по шкале EDSS, которое содержалось в течение по крайней мере 6 месяцев. ПЗИ является показателем устойчивого уменьшения степени инвалидизации. В исследовании 2 ПЗИ достигли 29% пациентов, получавших препарат Лемтрада, тогда как в группе применения п IFNB-1a этой конечной точки достигли лишь 13% пациентов. Это различие было статистически значимым (р = 0,0002).
В исследовании 3 (исследования II фазы CAMMS223) оценивали безопасность и эффективность препарата Лемтрада у пациентов с РРРС течение 3 лет. На время включения в исследование у пациентов показатель по шкале EDSS составлял 0-3,0 балла, были как минимум 2 клинические эпизоды РС в предыдущие 2 года и ≥ 1 очаг поражения, которое накапливало гадолиний. Пациенты ранее не получали никакой терапии по поводу РС. Пациенты получали препарат Лемтрада в дозе 12 мг / сут (N = 108) или 24 мг / сут (N = 108), который вводился один раз в сутки в течение 5 дней в месяц 0 и в течение 3 дней в месяц 12 или подкожные др ' инъекции IFNB-1a в дозе 44 мкг (N = 107), который вводился три раза в неделю в течение 3 лет. 46 пациентов получили третий курс лечения Лемтрада в дозе 12 мг / сут или 24 мг / сут в течение 3 дней в месяц 24.
Через 3 года лечения Лемтрада уменьшило риск ППИ, что содержалось в течение 6 месяцев, на 76% (отношение рисков 0,24 [95% ДИ: 0,110, 0,545], p <0,0006) и уменьшило РЧР на 67% (отношение частоты 0,33 [95% ДИ: 0,196, 0,552], p <0,0001) по сравнению с подкожными инъекциями IFNB-1a. Применение препарата Лемтрада в дозе 12 мг / сут приводило к статистически значимо ниже показателей по шкале EDSS (улучшение по сравнению с исходным уровнем) в течение 2 лет наблюдения по сравнению с IFNB-1a (p <0,0001).
В подгруппе пациентов с РРРС с 2 или более рецидивами в течение предыдущего года и менее 1 очагом поражения, которое накапливало гадолиний в Т1-взвешенном режиме, на исходном уровне летняя частота рецидивов составила 0,26 (95% ДИ: 0,20, 0,34 ) в группе лечения Лемтрада (n = 205) и 0,51 (95% ДИ: 0,40, 0,64) в группе лечения IFNB-1a (n = 102) (p <0,0001). Этот анализ включил данные только исследований III фазы (CAMMS324 и CAMMS323) из-за различий в методах считывания данных МРТ между исследованиями II фазы и исследованиями III фазы. Эти результаты были получены при анализе post hoc и имеют интерпретироваться с осторожностью.
Долгосрочные данные по эффективности
Исследование 4 было исследованием III фазы, многоцентровым, открытым, слепым для оценщика, расширенным по оценке эффективности и безопасности, которое включало пациентов с РРРС, участвовавших в исследованиях 1, 2 и 3 (ранее проведенные исследования II и III фаз), с целью определение долгосрочной эффективности и безопасности препарата Лемтрада. Это исследование обеспечило получение данных по эффективности и безопасности препарата в период, медиана продолжительности которого составляла 6 лет, начиная с момента включения в исследование 1 и 2. Пациенты в этом расширенном исследовании (исследование 4) могли при необходимости получать дополнительный (-и) курс ( и) лечения Лемтрада при задокументированном возобновлении активности заболевания, которое определялось как возникновение ≥ 1 рецидива РС и / или появления ≥ 2 новых или увеличение ≥ 2 существующих очагов поражения в головном или спинном мозге по результатам магнитно-резонансной томографии (МРТ). Дополнительный (-и) курс (ы) лечения Лемтрада предназначался (лись) в дозе 12 мг / сут в течение 3 последовательных дней (общая доза - 36 мг) не ранее чем через 12 месяцев после предыдущего курса лечения.
91,8% пациентов, получавших препарат Лемтрада в дозе 12 мг в исследованиях 1 и 2, были включены в исследование 4. 82,7% этих пациентов завершили исследование. Примерно половина (51,2%) пациентов, изначально получавших препарат Лемтрада в дозе 12 мг / сут в исследованиях 1 и 2 и которые были включены в исследование 4, получили только эти начальные 2 курса лечения Лемтрада и не получали никаких других препаратов, хворобомодификуючои терапии в течение 6 лет наблюдения.
46,6% пациентов, изначально получавших препарат Лемтрада в дозе 12 мг / сут в исследованиях 1 и 2, получили дополнительные курсы при задокументированных доказательствах активации течения РС (рецидива и / или изменения на МРТ) и согласно решению лечащего врача при назначении повторного курса лечения. Ни одна из характеристик в начале исследования не позволяла идентифицировать пациентов, которые позже получали один или более дополнительных курсов лечения.
В течение 6 лет после начального лечения Лемтрада пациенты, по которым продолжалось наблюдение, демонстрировали одинаковые частоты рецидивов РС, образование очагов поражения в головном мозге по данным МРТ и потерь тканей головного мозга, согласовывалось с эффектами лечения Лемтрада во время исследований 1 и 2, а также преимущественно стабильные или лучшие показатели степени инвалидизации. С учетом периода наблюдения в исследовании 4, пациенты, которые изначально получали препарат Лемтрада в исследованиях 1 и 2, соответственно имели РЧР 0,17 и 0,23, ППИ было отмечено в 22,3% и 29,7%, а ПЗИ достигли 32 , 7% и 42,5%. Ежегодно в рамках исследования 4 пациента с обеих основных исследований продолжали демонстрировать низкий риск образования новых очагов поражения на T2-взвешенных изображениях (от 27,4% до 33,2%) или очагов поражения,
У пациентов, получивших один или два дополнительных курса лечения препаратом Лемтрада, было отмечено улучшение со стороны частоты рецидивов, активности заболевания по данным МРТ и среднего количества баллов по показателю степени инвалидизации после первого или второго повторного курса лечения Лемтрада (курсы 3 и 4) по сравнению с результатами в предыдущем году. У этих пациентов РЧР снизилась с 0,79 в году, который предшествовал курса 3, до 0,18 м году после этого курса, а среднее количество баллов по результатам оценки по шкале EDSS - с 2,89 до 2,69. Процент пациентов с образованием новых или увеличением уже существующих очагов поражения на T2-взвешенных изображениях снизился с 50,8% в году, который предшествовал курса 3, до 35,9% в году после этого курса, а для очагов поражения, которые накапливают гадолиний, это снижение было с 32,2% до 11,9%. Подобные улучшения со стороны РЧР, среднего количества баллов по результатам оценки по шкале EDSS и очагов поражения на T2-взвешенных изображениях и очагов поражения, которые накапливают гадолиний, наблюдались и после курса 4 по сравнению с предыдущим годом. Эти улучшения сохранялись и в дальнейшем, однако нельзя сделать четких выводов о долгосрочной эффективности лечения (например, через 3 и 4 года после дополнительных курсов лечения), поскольку многие пациенты завершили свое участие в исследовании к достижению этих временных точек.
Польза и риски 5 и более курсов лечения пока не установлены.
иммуногенность
Как и другие белковые лекарственные средства, этот препарат является потенциально иммуногенных. Существующие данные указывают на наличие определенного процента пациентов, у которых были получены положительные результаты анализов на антитела к Алемтузумаб при использовании иммуноферментного анализа (ИФА) с последующим подтверждением с помощью метода конкурентного связывания. Образцы, для которых были получены положительные результаты, дополнительно оценивались на наличие ингибирования in vitroс помощью метода проточной цитометрии. В клинических исследованиях РС у пациентов брали образцы сыворотки крови через 1, 3 и 12 месяцев после каждого курса лечения с целью определения наличия антител к Алемтузумаб. Примерно у 85% пациентов, получавших препарат Лемтрада, в ходе исследования было получено положительные результаты о наличии антител к Алемтузумаб, при этом в ≥ 90% из этих пациентов также было получено положительных результатах анализа на наличие антител, которые ингибувалы связывания Алемтузумаб in vitro. У пациентов, у которых вырабатывались антитела к Алемтузумаб, это происходило в пределах 15 месяцев после первичного применения препарата. Во время 2 курсов лечения не было отмечено никакой связи между наличием антител к Алемтузумаб или ингибирующих антител к Алемтузумаб и снижением эффективности препарата, изменениями в его фармакодинамици или возникновением нежелательных реакций, в том числе ассоциированных с инфузиями. Высокие титры антител к Алемтузумаб, которые наблюдались у некоторых пациентов, ассоциировались с неполной элиминацией лимфоцитов после третьего или четвертого курса лечения, однако не было отмечено четкого влияния антител к Алемтузумаб на клиническую эффективность и профиль безопасности препарата Лемтрада.
Данные о частоте образование антител в значительной мере зависят от чувствительности и специфичности анализа. Кроме того, полученные данные относительно частоты положительных результатов анализа на наличие антител (в том числе ингибирующих антител) могут влиять различные факторы, такие как методология анализа, особенности обращения с образцами, время отбора образцов, сопутствующие лекарственные средства и основное заболевание. В связи с этим сравнения частоты образования антител к препарату Лемтрада с частотой образование антител к другим лекарственным средствам может быть некорректным.
Пациенты детского возраста
Европейское агентство лекарственных средств освободило производителя от обязательства предоставить результаты исследований применения Алемтузумаб детям от рождения до менее 10 лет для лечения рассеянного склероза (информация по применению препарата у детей приведена в разделе «Способ применения и дозы»).
Европейское агентство лекарственных средств предоставило производителю отсрочка по обязательство предоставить результаты исследований по изучению применения препарата Лемтрада в одной или в нескольких подгруппах педиатрической популяции при РРРС (информация по применению препарата у детей приведена в «Способ применения и дозы»).
Фармакокинетика.Фармакокинетические свойства Алемтузумаб оценивались всего в 216 пациентов с РРРС, получавших препарат в виде внутривенных инфузий в дозе или 12 мг / сут, или 24 мг / сут в течение 5 дней подряд, а в дальнейшем - в течение 3 последовательных дней через 12 месяцев после начального курса лечения. Концентрации в сыворотке крови росли с каждой последующей дозой в течение курса лечения, при этом самые высокие концентрации отмечались после последней инфузии в рамках курса лечения. Применение препарата в дозе 12 мг / сут приводило к средней Cmax 3014 нг / мл в день 5 начального курса лечения и 2276 нг / мл в день 3 второго курса лечения. Альфа-фаза периода полувыведения составляла примерно 4-5 дней и была сопоставимой между различными курсами лечения,
Алемтузумаб является белком, ожидаемым путем метаболизма для которого является расщепление до мелких пептидов и отдельных аминокислот широким диапазоном протеолитических ферментов. Классические исследования биотрансформации не проводились.
Учитывая доступные данные нельзя сделать определенных выводов о влиянии расовой принадлежности и пола пациента на фармакокинетику Алемтузумаб. Фармакокинетика Алемтузумаб не изучалось у пациентов в возрасте от 55 лет.
Доклинические данные по безопасности
Канцерогенез и мутагенез
Пока не проводилось никаких исследований канцерогенного или мутагенного потенциала Алемтузумаб.
Фертильность и репродукция
Введение Алемтузумаб в дозах до 10 мг / кг / сут в течение 5 последовательных дней (увеличение уровня AUC в 7,1 раз по сравнению с применением рекомендованной суточной дозы) не оговаривали никакого влияния на фертильность и репродуктивные функции у самцов трансгенных мышей huCD52. Количество нормальных сперматозоидов значимо уменьшилась (<10%) по сравнению с контрольными животными, а процент аномальных сперматозоидов (с отключенными головками или без головок) значимо увеличился (до 3%). Однако эти изменения не влияли на фертильность и поэтому не были расценены как неблагоприятные.
У самок мышей, получавших алемтузумаб внутривенно в дозе до 10 мг / кг / сут (увеличение уровня AUC в 4,7 раза по сравнению с применением рекомендованной суточной дозы) в течение 5 последовательных дней перед объединении с самцами мышей дикого типа, среднее количество желтых тел и участков имплантации на мышь значимо уменьшалось по сравнению с животными, получавшими плацебо. У беременных мышей, которым препарат вводился в дозе 10 мг / кг / сут, наблюдалось снижение набора массы тела во время беременности по сравнению с контрольными животными, получавшими плацебо.
В исследовании репродуктивной токсичности препарата у беременных мышей, получавших алемтузумаб внутривенно в дозе до 10 мг / кг / сут (увеличение уровня AUC в 2,4 раза по сравнению с применением рекомендованной дозы 12 мг / сут) в течение 5 дней подряд во время беременности, наблюдалось значимое увеличение количества самок, у которых все эмбрионы / плоды погибли или получили резорбции, вместе с сопутствующим снижением количества самок с жизнеспособными плодами. При применении препарата в дозах до 10 мг / кг / сут не было отмечено никаких пороков развития или вариантных отклонений от нормы со стороны внешних тканей, мягких тканей или скелетных тканей.
Во время беременности и после рождения потомства было отмечено проникновения препарата через плаценту и потенциальная фармакологическая активность Алемтузумаб. В исследованиях на мышах в приплода, что подвергался воздействию Алемтузумаб во время внутриутробного развития при его применении в дозах 3 мг / кг / сут в течение 5 последовательных дней (увеличение уровня AUC в 0,6 раза по сравнению с применением рекомендованной дозы 12 мг / сут) наблюдались изменения со стороны количества лимфоцитов. При применении Алемтузумаб в дозах до 10 мг / кг / сут не было отмечено никаких нарушений когнитивного, физического и полового развития у потомства, подвергался воздействию Алемтузумаб во время грудного вскармливания.
Клинические характеристики
Лемтрада Показания
Препарат Лемтрада показан как лекарственное средство, модифицирует течение заболевания, для монотерапии взрослых с высокоактивным рецидивирующим-ремитирующим рассеянным склерозом (РРРС), которые относятся к следующим группам:
- пациенты, у которых заболевание остается высокоактивным, несмотря на полный и надлежащий курс терапии по крайней мере одним лекарственным средством, модифицирует течение заболевания, или
- пациенты с быстропрогрессирующим тяжелым рецидивирующим-ремитирующим рассеянным склерозом, который определяется как 2 или более инвалидизирующие рецидивы в течение одного года, с 1 или более очагом поражения, которое накапливает гадолиний, на МРТ головного мозга или с существенным увеличением общего объема очагов поражения в Т2- взвешенном режиме по сравнению с данными предыдущей недавно выполненной МРТ.
Противопоказания
Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, входящих в состав препарата.
Вирус иммунодефицита человека (ВИЧ).
Тяжелая активная инфекция (до полного выздоровления пациента).
Неконтролируемая артериальная гипертензия.
Наявнистьрозшарування стенок артерий головы и шеи в анамнезе.
Наличие инсульта в анамнезе.
Наличием стенокардии или инфаркта миокарда в анамнезе.
Известная коагулопатия или одновременное получение антитромбоцитарной или антикоагулянтной терапии.
Другие сопутствующие аутоиммунные заболевания (кроме РС).
Особые меры безопасности.
Содержимое флакона перед введением необходимо осмотреть на наличие посторонних частиц и изменения цвета. Нельзя использовать препарат при наличии посторонних частиц или ненадлежащего окраску.
Не встряхивать флаконы перед использованием.
Для введения отбирают 1,2 мл препарата Лемтрада из флакона в шприц с использованием асептической методики. Вводят препарат в 100 мл раствора натрия хлорида концентрацией 9 мг / мл (0,9%) для инфузий или раствора глюкозы (5%) для инъекций. Это лекарственное средство нельзя разводить другими растворителями. Для перемешивания раствора следует осторожно переворачивать пакет.
Необходимо соблюдать осторожность для обеспечения стерильности приготовленного раствора. Разведенный препарат рекомендуется использовать немедленно. Каждый флакон препарата предназначен только для разового использования.
Любые остатки неиспользованного лекарственного средства или отходы необходимо уничтожить соответствии с местными требованиями.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Пока не проводилось никаких формальных исследований лекарственного взаимодействия при применении препарата Лемтрада в рекомендованных дозах пациентам с РС. В одном контролируемом клиническом исследовании РС пациентам, которые недавно получали интерферон бета и глатирамера ацетат, нужно было прекратить лечение этими препаратами за 28 дней до начала лечения Лемтрада.
Особенности применения
Не рекомендуется применять препарат Лемтрада пациентам с неактивным заболеванием и у пациентов, заболевание которых является стабильным на их текущей терапии.
Пациентам, которые лечатся препаратом Лемтрада, нужно выдать Инструкцию по применению лекарственного средства, Карточку-памятник пациента и Рекомендации для пациента. До начала лечения пациентам необходимо предоставить информацию о рисках и пользу применения препарата и о необходимости проходить обследование после начала лечения и до завершения минимум 48-месячного срока после последней инфузии второго курса лечения Лемтрада. В случае назначения дополнительного курса лечения период наблюдения для оценки безопасности должно быть продлен до завершения минимум 48-месячного срока после последней инфузии препарата.
аутоиммунные реакции
Лечение этим ликаським средством может привести к образованию аутоантител и к увеличению риска возникновения аутоиммунной-опосредованных состояний, которые могут быть серьезными и угрожающими жизни. Уведомлены аутоиммунные заболевания включают расстройства со стороны щитовидной железы, иммунную тромбоцитопеническая пурпура (ИТП), нефропатии (например, синдром Гудпасчера - заболевание с образованием антител к базальной мембране почечных клубочков), аутоиммунный гепатит (АИГ) и приобретенную гемофилией А.В период послерегистрационного применения после лечения Лемтрада отмечались случаи множественных аутоиммунных расстройств. У пациентов, у которых отмечены аутоиммунные реакции, необходимо провести оценку по другим аутоиммунным-опосредованных состояний. Пациенты и врачи должны быть проинформированы о возможном позднее возникновения аутоиммунных расстройств после 48-месячного периода мониторинга.
Приобретенная гемофилия А
Как в рамках клинических исследований, так и в периоде послерегистрационного применения данного лекарственного средства сообщалось о случаях приобретенной гемофилии А (с образованием антител к фактору свертывания крови VIII). Как правило, при этом у пациентов наблюдаются спонтанные подкожные гематомы и большие синяки, хотя также могут отмечаться гематурия, носовые, желудочно-кишечные или другие виды кровотечений. У всех пациентов с наличием таких симптомов необходимо выполнить анализ коагулограммы, в том числе определение активированного частичного тромбопластинового времени (АЧТВ). Пациенты должны быть проинформированы о признаках и симптомах приобретенной гемофилии А, а также уведомлены о необходимости немедленного обращения за медицинской помощью в случае появления каких-либо из этих симптомов.
Иммунная тромбоцитопеническая пурпура (ИТП)
Серьезные случаи ИТР наблюдались у 12 (1%) пациентов, получавших лечение при контролируемых клинических исследований РС (что соответствует годовой частоте 4,7 случая / 1000 пациенто-лет). В течение периода последующего наблюдения, медиана которого составила 6,1 года (при этом максимальный срок наблюдения был 12 лет), наблюдалось дополнительных 12 серьезных случаев ИТР (совокупная годовая частота - 2,8 случаев / 1000 пациенто-лет). У одного пациента развилась ИТР, которая оставалась нераспознанной, пока еще не была в требование ежемесячного контроля показателей крови, и этот пациент умер от внутримозгового кровоизлияния. В 79,5% случаев развитие ИТР наблюдался в пределах 4 лет после первого применения препарата. Однако в некоторых случаях ИТР возникала на несколько лет позже.Из симптомов ИТР могут наблюдаться такие (без ограничений перечисленным): повышенная склонность к образованию синяков, петехии, спонтанные кровотечения на коже и слизистых оболочках (например носовое кровотечение, кровохарканье), усиление менструальных кровотечений (по сравнению с обычными) или нерегулярность менструальных кровотечений. Кровохарканье также может свидетельствовать о заболевании с образованием антител к базальной мембране почечных клубочков (см. Ниже), поэтому необходимо провести надлежащую дифференциальную диагностику. Следует напомнить пациентам о необходимости отслеживать симптомы, которые могут в них возникать, и немедленно обращаться за медицинской помощью в случае каких-либо причин для тревоги.
Прежде чем начинать лечение препаратом, необходимо выполнить развернутый анализ крови с подсчетом лейкоцитарной формулы и повторять его каждый месяц на фоне лечения и до завершения минимум 48-месячного срока после последней инфузии препарата. После этого анализы следует выполнять с учетом клинических данных, которые могут свидетельствовать о возникновении ИТР. В случае подозрения на ИТР необходимо немедленно выполнить развернутый анализ крови.
При подтверждении развития ИТР показано неотложное надлежащее лечение, в том числе немедленное направление пациента к специалисту. Результаты клинических исследований РС продемонстрировали, что соблюдение требований по мониторирование показателей крови и обучения пациентов относительно появления и симптомов ИТР обеспечивает раннее выявление и лечение ИТР, при этом большинство случаев отвечают на медикаментозную терапию первой линии.
нефропатии
Нефропатии, в том числе заболевания с образованием антител к базальной мембране почечных клубочков (анти-БМК), наблюдались у 6 (0,4%) пациентов в клинических исследований РС при применении препарата в период последующего наблюдения, медиана которого составила 6,1 года (при этом максимальный срок наблюдения был 12 лет), и обычно развивались в пределах 39 месяцев после последнего применения препарата Лемтрада. Во время клинических исследований было зарегистрировано 2 случая заболевания с образованием анти-БМК. Оба эти случаи были серьезными, оказывались на ранних сроках благодаря клиническом и лабораторном мониторингу и после лечения завершились благоприятно.
Клинические проявления нефропатии могут включать повышение уровня креатинина в сыворотке крови, гематурия и / или протеинурия. Хотя в клинических исследованиях таких случаев не наблюдалось, при заболевании с образованием анти-БМК может возникать альвеолярная кровотечение, манифестирует в виде кровохарканье. Кровохарканье также может свидетельствовать о ИТР или о приобретенной гемофилией А (см. Выше), поэтому необходимо провести надлежащую дифференциальную диагностику. Следует напомнить пациентам о необходимости отслеживать симптомы, которые могут в них возникать, и немедленно обращаться за медицинской помощью в случае каких-либо причин для тревоги. Заболевания с образованием анти-БМК может приводить к почечной недостаточности, которая будет требовать диализа и / или трансплантации почки, если не применить немедленные терапевтические мероприятия, и может быть опасным для жизни, если останется нелеченным.
Прежде чем начинать лечение препаратом, необходимо определить уровень креатинина в сыворотке крови и повторять этот анализ ежемесячно на фоне лечения и до завершения минимум 48-месячного срока после последней инфузии препарата. Прежде чем начинать лечение препаратом, необходимо выполнить общий анализ мочи с микроскопией осадка мочи и повторять его каждый месяц на фоне лечения и до завершения минимум 48-месячного срока после последней инфузии препарата. Выявление клинически значимых изменений уровня креатинина в сыворотке крови по сравнению с исходными уровнями, гематурии неясного происхождения и / или протеинурии требует немедленного обследования о наличии нефропатии, в том числе безотлагательного направления пациента к специалисту.Раннее выявление и лечение нефропатий может снизить риск неблагоприятных клинических последствий. После этого анализы следует выполнять с учетом клинических данных, которые могут свидетельствовать о возникновении нефропатии.
Со стороны щитовидной железы
Эндокринные нарушения со стороны щитовидной железы, в том числе аутоиммунные нарушения со стороны щитовидной железы, наблюдались в 36,8% пациентов, получавших препарат Лемтрада в дозе 12 мг в ходе клинических исследований РС, где медиана продолжительности периода наблюдения составила 6,1 года ( с максимальным сроком наблюдения 12 лет) после первого применения Лемтрада. Частота нежелательных явлений со стороны щитовидной железы была выше у пациентов, у которых отмечались нарушения со стороны щитовидной железы в анамнезе, как в группе применения препарата Лемтрада, так и в группе применения интерферона бета 1a (IFNB-1a). Зарегистрированные аутоиммунные нарушения со стороны щитовидной железы включали гипертиреоз и гипотиреоз. Большинство случаев были легкой или средней степени тяжести. Серьезные эндокринные нежелательные явления развились у 4,4% пациентов, при этом такие явления, как базедова болезнь (также известная как болезнь Грейвса), гипертиреоз, гипотиреоз, аутоиммунный тиреоидит и зоб, наблюдались в более чем 1 пациента. Большинство нежелательных явлений со стороны щитовидной железы лечились с помощью стандартных медикаментозных вмешательств, однако некоторым пациентам было необходимо хирургическое вмешательство. У пациентов, у которых в послерегистрационный период развился аутоиммунный тиреоидит, подтвержденный биопсией, ранее были зарегистрированы аутоиммунные нарушения со стороны щитовидной железы. однако некоторым пациентам было необходимо хирургическое вмешательство. У пациентов, у которых в послерегистрационный период развился аутоиммунный тиреоидит, подтвержденный биопсией, ранее были зарегистрированы аутоиммунные нарушения со стороны щитовидной железы. однако некоторым пациентам было необходимо хирургическое вмешательство. У пациентов, у которых в послерегистрационный период развился аутоиммунный тиреоидит, подтвержденный биопсией, ранее были зарегистрированы аутоиммунные нарушения со стороны щитовидной железы.
Прежде чем начинать лечение препаратом, необходимо выполнить анализы по оценке функции щитовидной железы, такие как определение уровней тиреотропного гормона, и повторять их каждые 3 месяца на фоне лечения и до завершения 48-месячного срока после последней инфузии препарата. После этого анализы следует выполнять с учетом клинических данных, которые могут свидетельствовать о возникновении нарушений функции щитовидной железы, при беременности.
Заболевания щитовидной железы представляют собой особый риск для беременных женщин (см. Раздел «Применение в период беременности или кормления грудью»).
В клинических исследованиях нежелательные явления со стороны щитовидной железы возникали у 74% пациентов с положительными результатами определения антител к тиреоидной пероксидазе (ТПО) на исходном уровне по сравнению с 38% пациентов с отрицательными результатами определения этих антител на исходном уровне. Подавляющее большинство (примерно 80%) пациентов, у которых после лечения возникали побочные эффекты со стороны щитовидной железы, имели отрицательные результаты определения антител к ТПО на исходном уровне. Таким образом, нежелательная реакция со стороны щитовидной железы может возникнуть у пациентов независимо от статуса о наличии антител к ТПО к лечению препаратом, поэтому необходимо периодически выполнять все необходимые анализы, как описано выше.
цитопении
Во время клинических исследований РС наблюдались редкие случаи подозреваемых аутоиммунных цитопении, таких как нейтропения, гемолитическая анемия и панцитопения. Необходимо выполнять развернутые анализы крови (см. Выше в разделе о ИТП) для мониторинга цитопении, в том числе нейтропении. При подтверждении развития цитопении показано неотложное надлежащее лечение, в том числе направление пациента к специалисту.
Аутоиммунный гепатит и поражения печени
У пациентов, получавших препарат Лемтрада, наблюдались случаи аутоиммунного гепатита (в т.ч. летального или так, что требовал трансплантации печени) и поражения печени, связанного с инфекциями (см. Раздел «Противопоказания»). Необходимо контролировать функцию печени до начала терапии лекарственным средством и ежемесячно до конца не менее 48-месячного срока после последней инфузии препарата. Пациентов необходимо проинформировать о риске аутоиммунного гепатита, поражения печени и о соответствующих симптомы.
Гемофагоцитарный лимфогистиоцитоз (ГЛГ)
В ходе послерегистрационного применения лекарственного средства у пациентов, получавших препарат Лемтрада, наблюдались случаи ГЛГ (в том числе летальные). ГЛГ опасным для жизни синдромом патологической иммунной активации, характеризуется клиническими признаками и симптомами чрезвычайно выраженного системного воспаления. ГЛГ проявляется повышением температуры тела, гепатомегалией и цитопениями. Он ассоциируется с высокими уровнями смертности при отсутствии раннего диагностирования и лечения. Отмечалось, что симптомы возникают в пределах от нескольких месяцев до четырех лет после начала лечения. Пациентов следует проинформировать о симптомах ГЛГ и о времени их появления. У пациентов, у которых возникли ранние проявления патологической иммунной активации, необходимо немедленно выполнить оценку состояния и рассмотреть вероятный диагноз ГЛГ.
Ассоциированные с инфузиями реакции (АИР)
В клинических исследованиях ассоциированные с инфузиями реакции (АИР) определялись как любое нежелательное явление, которое возникает во время или в пределах 24 часов после инфузии препарата Лемтрада. Большинство этих явлений может быть обусловлена высвобождением цитокинов во время инфузии.У большинства пациентов, получавших препарат Лемтрада во время клинических исследований РС, наблюдались АИР легкой или средней степени тяжести во время или в пределах 24 часов после введения препарата Лемтрада в дозе 12 мг. Частота АИР во время первого курса лечения была выше по сравнению со следующими курсами. Учитывая все доступные данные по дальнейшему наблюдению, в том числе пациентов, которые получали дополнительные курсы лечения, наиболее частыми АИР были головная боль, сыпь, пирексия, тошнота, крапивница, зуд, бессонница, озноб, гиперемия, повышенная утомляемость, одышка , дисгевзия, ощущение дискомфорта в грудной клетке, генерализованное высыпание, тахикардия, брадикардия, диспепсия, головокружение и боль. Серьезные реакции возникали у 3% пациентов и включали головную боль, пирексия, крапивницу, тахикардию, фибрилляцию предсердий, тошноту, чувство дискомфорта в грудной клетке и артериальной гипотензии. Клинические проявления анафилаксии могут быть подобными клинических проявлений ассоциированных с инфузиями реакций, но склонны быть более тяжелыми или потенциально опасными для жизни. Реакции, обусловленные анафилаксией, регистрировались редко по сравнению с ассоциированными с инфузиями реакциями.
Для ослабления эффектов инфузионных реакций у пациентов рекомендуется выполнять премедикацию (см. Раздел «Способ применения и дозы»).
Большинство пациентов в контролируемых клинических исследованиях получали антигистаминные средства и / или антипиретики перед хотя бы одной инфузии препарата Лемтрада. АИР могут возникать у пациентов несмотря на премедикацию. Рекомендуется осуществлять наблюдение за пациентами для возникновения инфузионных реакций во время и в течение не менее 2:00 после инфузии препарата Лемтрада. При необходимости может быть целесообразным более длительное наблюдение (госпитализация). В случае возникновения тяжелых инфузионных реакций инфузию следует немедленно прекратить. Должны быть доступны средства для лечения анафилаксии и других серьезных реакций (см. Ниже).
Другие серьезные реакции, связанные по времени с инфузией препарата Лемтрада
В ходе послерегистрационного применения лекарственного средства отмечались случаи редких, серьезных, иногда летальных и непредсказуемых побочных эффектов со стороны различных систем органов. В большинстве случаев время до начала такой реакции был в пределах 1 ̶ 3 дней после инфузии препарата Лемтрада. Реакции возникали после любой дозы лекарственного средства, а также после второго курса. Пациентов необходимо проинформировать о признаках и симптомах этих поражений и о времени появления этих явлений. Пациентам следует рекомендовать немедленно обращаться за медицинской помощью в случае возникновения каких-либо из этих симптомов. Пациенты должны быть проинформированы о вероятности позднего появления таких явлений.
геморрагический инсульт
Несколько пациентов с задокументированы случаями геморрагического инсульта были в возрасте до 50 лет, не имели в анамнезе артериальной гипертензии, геморрагических расстройств и не принимали антикоагулянты или ингибиторы тромбоцитов. У некоторых пациентов перед развитием геморрагии отмечалось повышение артериального давления по сравнению с его исходным уровнем.
Ишемия миокарда и инфаркт миокарда
Несколько пациентов с задокументированы случаями этих расстройств были в возрасте до 40 лет и не имели факторов риска возникновения ишемической болезни сердца. Было отмечено, что в некоторых из этих пациентов во время инфузии лекарственного средства временно менялись по сравнению с нормальными показателями АД и / или частота сердечных сокращений.
Расслоение стенок артерий головы и шеи
Случаи расслоений стенок артерий головы и шеи, в том числе множественных расслоений, отмечались как в первые дни после выполнения инфузии лекарственного средства Лемтрада, так и в более поздние сроки в пределах первого месяца после инфузии.
Альвеолярная легочное кровотечение
Задокументированы случаи этого расстройства, связанного во времени с применением лекарственного средства не были связаны с анти-БМК заболеванием (синдром Гудпасчера).
тромбоцитопения
Задокументированы случаи тромбоцитопении возникали в первые дни после выполнения инфузии лекарственного средства (в отличие от ИТП). Она часто исчезала самостоятельно и была относительно легкой, хотя во многих случаях тяжесть и клинические последствия были неизвестны.
Инструкции по проведению инфузий, направленные на уменьшение риска развития серьезных реакций, связанных по времени с инфузией лекарственного средства Лемтрада
- Оценки, которые необходимо выполнить перед проведением инфузии
- Необходимо выполнить оценку исходных показателей ЭКГ и основных показателей жизнедеятельности, в том числе определение частоты сердечных сокращений и артериального давления.
- Необходимо выполнить лабораторные анализы (развернутый общий анализ крови с подсчетом лейкоцитарной формулы, определение уровня трансаминаз в сыворотке крови, определение уровня креатинина в сыворотке крови, анализ для оценки функции щитовидной железы и общий анализ мочи с микроскопией осадка мочи).
- Во время инфузии
- Необходимо выполнять постоянный / частый (как минимум ежечасный) контроль частоты сердечных сокращений, артериального давления и общего клинического состояния пациентов.
- Инфузию необходимо прекратить:
- В случае возникновения тяжелого нежелательного явления.
- Если у пациента отмечаются клинические симптомы, свидетельствующие о развитии серьезного нежелательного явления, связанного с инфузией (ишемии миокарда, геморрагического инсульта, расслоение стенок артерий головы и шеи или альвеолярной легочного кровотечения).
- Инфузию необходимо прекратить:
- Необходимо выполнять постоянный / частый (как минимум ежечасный) контроль частоты сердечных сокращений, артериального давления и общего клинического состояния пациентов.
- После инфузии
- Рекомендуется осуществлять наблюдение за пациентами для возникновения инфузионных реакций в течение не менее 2:00 после инфузии лекарственного средства Лемтрада. Пациенты, у которых отмечаются клинические симптомы, свидетельствующие о развитии серьезного нежелательного явления, связанного по времени с инфузией (ишемии миокарда, геморрагического инсульта, расслоение стенок артерий головы и шеи или альвеолярной легочного кровотечения), необходимо осуществлять тщательный надзор до полного исчезновения таких симптомов. При необходимости может быть целесообразным более длительное наблюдение (госпитализация). Необходимо проинформировать пациентов о возможности более позднего возникновения ассоциированных с инфузиями реакций и проинструктировать их о необходимости сообщить врачу о своих симптомах и обратиться за соответствующей медицинской помощью.
Уровне тромбоцитов следует определять сразу же после инфузии в день 3 и 5 первого инфузионного курса, а также сразу после инфузии в день 3 любого из следующих курсов. В случае клинически значимой тромбоцитопении необходимо осуществлять за пациентом надзор к ее исчезновению. Следует взвесить целесообразность направления пациента на лечение к гематологу.
инфекции
В контролируемых клинических исследованиях РС продолжительностью до 2 лет инфекции возникали у 71% пациентов, получавших препарат Лемтрада в дозе 12 мг, по сравнению с 53% пациентов, получавших подкожные инъекции интерферона бета 1a [IFNB-1a] (44 мкг 3 раза в неделю), и они были в основном легкой или средней степени тяжести. К инфекциям, которые у пациентов, получавших препарат Лемтрада, наблюдались чаще, чем у пациентов, получавших IFNB-1a, принадлежали назофарингит, инфекция мочевыводящих путей, инфекция верхних дыхательных путей, синусит, оральный герпес, грипп и бронхит. Серьезные инфекции в контролируемых клинических исследованиях РС возникали в 2,7% пациентов, получавших препарат Лемтрада, по сравнению с 1% пациентов, получавших IFNB-1a. Серьезные инфекции в группе приема препарата Лемтрада включали аппендицит, гастроэнтерит, пневмонию, опоясывающий герпес и инфекцию зубов. Инфекции, как правило, имели типичную продолжительность и излечивались стандартными медикаментозными средствами.
Совокупная годовая частота инфекций составляла 0,99 при медиане продолжительности периода наблюдения 6,1 года (с максимальным сроком наблюдения 12 лет) после первого применения Лемтрада по сравнению с 1,27 в контролируемых клинических исследованиях.
В клинических исследованиях серьезные инфекции, вызванные вирусом ветряной оспы, в том числе первичная ветряная оспа и реактивация вируса ветряной оспы, у пациентов, получавших препарат Лемтрада в дозе 12 мг, наблюдались чаще (0,4%), чем у пациентов, получавших IFNB-1a (0%). Также у пациентов, получавших препарат Лемтрада в дозе 12 мг, регистрировались случаи (2%) инфекции шейки матки, вызванные вирусом папилломы человека (ВПЧ), в том числе дисплазии шейки матки и аногенитальные бородавки. Пациенткам женского пола рекомендуется ежегодно выполнять скрининг на ВПЧ.
Цитомегаловирусной инфекции (ЦМВ), включая случаи реактивации ЦМВ, были зарегистрированы у пациентов, получавших препарат Лемтрада. Большинство случаев наблюдалось в течение 2 месяцев приема Алемтузумаб. Перед началом терапии можно оценить иммунологический (серологический) состояние в соответствии с местными рекомендаций.
У пациентов, получавших препарат Лемтрада, отмечались случаи инфицирования, включая реактивации вируса Эпштейна ̶ Барр (ВЭБ), тяжелые и иногда фатальные случаи гепатита, вызванного ВЭБ.
В контролируемых клинических исследованиях сообщалось о случаях туберкулеза у пациентов, получавших препарат Лемтрада или IFNB-1a. Случаи активного и латентного туберкулеза, в том числе несколько случаев диссеминированного туберкулеза, наблюдались в 0,3% пациентов, получавших препарат Лемтрада, чаще - в эндемичных по этому заболеванию регионах. До начала применения препарата у всех пациентов необходимо проверить наличие активной или неактивной (латентной) туберкулезной инфекции в соответствии с местными установок.
У пациентов, получавших препарат Лемтрада, регистрировались случаи листериоза / листериозного менингита, а как правило, в пределах 1 месяца после инфузии препарата Лемтрада. Для снижения риска инфекции у пациентов, получающих препарат Лемтрада, необходимо избегать потребления мяса, которое не подвергалось кулинарной обработке или кулинарная обработка которого была недостаточной, мягких сыров и непастеризованных молочных продуктов в течение 2 недель до, во время и в течение минимум 1 месяца после инфузии препарата Лемтрада.
В контролируемых клинических исследованиях РС поверхностные грибковые инфекции, особенно оральный и вагинальный кандидоз у пациентов, получавших препарат Лемтрада, наблюдались чаще (12%), чем у пациентов, получавших IFNB-1a (3%).
Сообщалось о случаях пневмонита у пациентов, получавших инфузии препарата Лемтрада. Большинство таких случаев возникали в течение первого месяца после лечения Лемтрада. Пациентов следует проинформировать о необходимости сообщать о симптомах пневмонита, к которым могут принадлежать одышка, кашель, свистящее дыхание, боль в грудной клетке или ощущение сжатия в грудной клетке и кровохарканье.
Для пациентов с тяжелыми активными инфекциями следует отложить начало терапии препаратом Лемтрада к выздоровлению. Пациентов, получающих препарат Лемтрада, следует проинструктировать о необходимости сообщать врачу о симптомах инфекций.
Необходимо начать профилактическое применение перорального антигерпетические препарата с первого дня лечения Лемтрада и продолжать его в течение не менее 1 месяца после каждого курса лечения. Во время клинических исследований пациентам назначался цикловир в дозе 200 мг дважды в сутки или эквивалентный препарат.
Препарат Лемтрада не предназначалась для лечения РС одновременно с противоопухолевыми или иммуносупрессивными препаратами или после их применения. Как и при применении других иммуномодуляторов, необходимо принимать во внимание потенциальное влияние комбинации этих препаратов на иммунную систему пациента при рассмотрении вопроса о назначении препарата Лемтрада. Одновременное применение препарата Лемтрада с любыми из таких препаратов может увеличивать риск иммуносупрессии.
Сейчас отсутствуют данные о связи между применением препарата Лемтрада и реактивацией вируса гепатита В (ВГВ) или вируса гепатита С (ВГС), поскольку пациенты с признаками активной или хронической инфекции, вызванной этими вирусами, исключались из клинических исследований. Следует рассмотреть возможность проведения скрининга среди пациентов с высоким риском инфекции ВГВ и / или ВГС до начала применения препарата Лемтрада, а при назначении препарата Лемтрада пациентам, которые были идентифицированы как носители ВГВ и / или ВГС, следует соблюдать осторожность, поскольку эти пациенты могут иметь повышенный риск развития необратимого поражения печени, связанного с потенциальной реактивацией вируса в результате уже существующего у них состояния инфицированности вирусом.
Острый акалькульозний холецистит
Препарат Лемтрада может увеличивать риск развития острого акалькульозного (без формирования камней) холецистита. В контролируемых клинических исследованиях у 0,2% пациентов с РС, получавших препарат Лемтрада, развился острый акалькульозний холецистит, по сравнению с 0% пациентов, получавших INFB-1a. В ходе послерегистрационного применения препарата поступали сообщения о дополнительных случаи острого акалькульозного холецистита у пациентов, получавших препарат Лемтрада. Время до появления симптомов варьировал от менее 24 часов до 2 месяцев после инфузии препарата Лемтрада. Большинство пациентов получали консервативное лечение антибиотиками и выздоровели без хирургического вмешательства, хотя у некоторых пациентов была выполнена холецистэктомия. К симптомам острого акалькульозного холецистита относятся боли в животе, болезненность при пальпации живота, повышение температуры тела, тошнота и рвота. Острый акалькульозний холецистит является состоянием, которое может ассоциироваться с высокой заболеваемостью и смертностью при отсутствии ранней диагностики и лечения. В случае подозрения на острый акалькульозний холецистит необходимо безотлагательно выполнить оценку состояния пациента и назначить необходимое лечение.
злокачественные заболевания
Как и при применении других иммуномодуляторов, необходимо соблюдать осторожность в начале лечения Лемтрада пациентов с предварительно существующими и / или текущими злокачественными заболеваниями. Пока неизвестно, обусловливает применение препарата Лемтрада повышенный риск развития злокачественных заболеваний щитовидной железы, поскольку аутоиммунные реакции со стороны щитовидной железы сами по себе могут быть фактором риска развития злокачественных заболеваний щитовидной железы.
контрацепция
У мышей во время гестации и после рождения потомства наблюдалось проникновение препарата Лемтрада через плаценту и потенциальная фармакологическая активность. Женщинам репродуктивного возраста необходимо использовать эффективные контрацептивные средства во время лечения и в течение 4 месяцев после курса лечения Лемтрада ( см. Раздел «Применение в период беременности или кормления грудью»).
вакцины
Рекомендуется, чтобы пациенты завершили все процедуры иммунизации, необходимые по местным требованиям, не позднее чем за 6 недель до начала терапии препаратом Лемтрада. Способность организма к иммунного ответа на любые вакцины после лечения Лемтрада пока не изучалась.
Безопасность иммунизации живыми вирусными вакцинами после курса лечения Лемтрада не изучали формально в контролируемых клинических исследованиях у пациентов с РС, поэтому такие вакцины не следует назначать пациентам с РС, которые недавно получали курс лечения Лемтрада.
Анализы на наличие антител к вирусу ветряной оспы / вакцинация против вируса ветряной оспы. Как и при применении любого иммуномодулирующего лекарственного средства, перед началом курса лечения Лемтрада у пациентов, которые не болели ветряной оспой но не вакцинировались против вируса ветряной оспы (ВОВ), необходимо выполнить анализ по определению антител к ВОВ. У пациентов с отрицательными результатами анализов на такие антитела следует рассмотреть возможность выполнения вакцинации против ВОВ перед началом лечения Лемтрада. Чтобы обеспечить полный эффект вакцинации против ВОВ, лечения Лемтрада следует отложить на срок 6 недель после вакцинации.
Рекомендуемые лабораторные анализы для мониторинга пациентов
Клинические обследования и лабораторные анализы следует выполнять с регулярной частотой до истечения срока по крайней мере 48 месяцев после последнего курса лечения Лемтрада с целью осуществления мониторинга ранних признаков аутоиммунных заболеваний:
- развернутый анализ крови с подсчетом лейкоцитарной формулы, определение уровня трансаминаз в сыворотке крови и определение уровня креатинина в сыворотке крови (перед началом лечения и ежемесячно в дальнейшем)
- общий анализ мочи с микроскопией осадка мочи (перед началом лечения и ежемесячно в дальнейшем)
- анализ для оценки функции щитовидной железы, например определение уровня тиреотропного гормона (перед началом лечения и каждые 3 месяца в дальнейшем).
Информация по применению Алемтузумаб до получения торговой лицензии на препарат Лемтрада за пределами исследований, спонсируемых компанией
Приведенные ниже побочные реакции были идентифицированы в регистрации препарата Лемтрада, при применении Алемтузумаб для лечения В-клеточного хронического лимфоцитарного лейкоза (В-ХЛЛ), а также для лечения других расстройств, как правило, в более высоких дозах (например, 30 мг) и с большей частотой введения препарата, чем это рекомендовано для лечения РС. Поскольку об этих реакции сообщалось в добровольном порядке, а популяция пациентов была неопределенной численности, не всегда можно достоверно оценить их частоту или установить наличие причинно-следственной связи с применением Алемтузумаб.
аутоиммунное заболевание
У пациентов, получавших алемтузумаб, регистрировались аутоиммунные расстройства, такие как нейтропения, гемолитическая анемия (в том числе один летальный случай), приобретенная гемофилия, заболевания с образованием анти-БМК и заболевания щитовидной железы. У пациентов без РС, получавших алемтузумаб, регистрировались серьезные и иногда летальные аутоиммунные расстройства, такие как аутоиммунная гемолитическая анемия, аутоиммунная тромбоцитопения, апластическая анемия, синдром Гийена-Барре и хроническая воспалительная демиелинизирующая полирадикулонейропатия. У онкологических пациентов, получавших алемтузумаб, регистрировались случаи получения положительных результатов теста Кумбса. У одного онкологического пациента, получавшего алемтузумаб, было зарегистрировано летальную реакцию «трансплантат против хозяина», ассоциированную с трансфузией.
Ассоциированные с инфузиями реакции
У пациентов без РС, получавших алемтузумаб в более высоких дозах и с большей частотой введения препарата, чем используется при РС, наблюдались серьезные и иногда летальные АИР, в том числе бронхоспазм, гипоксия, обмороки, легочные инфильтраты, острый респираторный дистресс-синдром, остановка дыхания, инфаркт миокарда, аритмии, острая сердечная недостаточность и остановка сердца. Также сообщалось о случаях возникновения тяжелой анафилаксии и других реакций гиперчувствительности, в том числе анафилактического шока и ангионевротического отека.
Инфекционные и паразитарные заболевания
У пациентов без РС, получавших алемтузумаб в более высоких дозах и с большей частотой введения препарата, чем используется при РС, наблюдались серьезные и иногда летальные вирусные, бактериальные, протозойные и грибковые инфекции, в том числе вызванные реактивацией латентных инфекций. У пациентов с B-ХЛЛ, как при применении Алемтузумаб, так и без него, наблюдались случаи прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). Частота возникновения ПМЛ у пациентов с В-ХЛЛ, которые получали алемтузумаб, была не выше, чем фоновая частота.
Со стороны крови и лимфатической системы
У пациентов без РС наблюдались тяжелые геморрагические реакции.
Со стороны сердца
У пациентов без РС, получавших алемтузумаб и ранее лечились потенциально кардиотоксическими средствами, наблюдались случаи развития застойной сердечной недостаточности, кардиомиопатии и снижение фракции выброса.
Лимфопролиферативными расстройства, ассоциированные с вирусом Эпштейна-Барр
За пределами исследований, спонсируемых компанией, наблюдались случаи лимфопролиферативных расстройств, ассоциированных с вирусом Эпштейна-Барр.
Препарат Лемтрада содержит натрий и калий
Это лекарственное средство содержит менее 1 ммоль калия (39 мг) на одну инфузию, то есть он практически не содержит калия.
Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на одну инфузию, то есть он практически не содержит натрия.
Применение в период беременности или кормления грудью
Женщины репродуктивного возраста
Спустя примерно 30 дней после каждого курса терапии концентрации препарата в сыворотке крови были низкими или не проявлялись. Учитывая это женщины из репродуктивного возраста имеют использовать эффективные контрацептивные средства во время курса лечения Лемтрада и в течение 4 месяцев после каждого курса лечения.
беременность
Данные по применению Алемтузумаб беременным женщинам пока ограничены. Препарат Лемтрада следует назначать беременным женщинам только в случаях, когда потенциальная польза превышает потенциальный риск для плода.
Известно, что IgG человека проникает через плацентарный барьер; алемтузумаб также может проникать через плацентарный барьер и поэтому потенциально может обусловливать риск для плода. В ходе исследований на животных было показано токсическое действие на репродуктивную функцию (см. Раздел «Доклинические данные по безопасности»). Неизвестно, может ли алемтузумаб нанести вред плоду при применении беременным женщинам или может он влиять на репродуктивную функцию.
Заболевания щитовидной железы (см. Раздел «Со стороны щитовидной железы») обусловливает особые риски у беременных женщин. Без лечения гипотиреоза во время беременности отмечается повышенный риск выкидышей и нарушений развития плода, таких как задержка умственного развития и карликовость. У женщин с болезнью Грейвса антитела к рецепторам тиреотропного гормона беременной могут попадать в развивающегося плода внутриутробно, и приводить к транзиторной болезни Грейвса у новорожденного ребенка.
грудное вскармливание
Алемтузумаб проявляли в молоке самок мышей во время периода лактации и в организме их приплода.
Неизвестно, выводится алемтузумаб в грудное молоко. Риск для новорожденных / младенцев, находящихся на грудном вскармливании, исключить нельзя. В связи с этим грудное вскармливание следует прекратить при каждом курса лечения Лемтрада и в течение 4 месяцев после последней инфузии каждого курса лечения . Однако польза от переданного через грудное молоко иммунитета может перевешивать риски потенциального попадания Алемтузумаб в организм новорожденных / младенцев, находящихся на грудном вскармливании.
фертильность
Надлежащие клинические данные по безопасности о влиянии препарата Лемтрада на фертильность отсутствуют. В одном субдослидженни, в котором приняли участие 13 пациентов мужского пола, получавших препарат Лемтрада (в дозе или 12 мг, 24 мг), не было обнаружено никаких доказательств аспермии, азооспермии, устойчивого снижения числа сперматозоидов, нарушений подвижности сперматозоидов или увеличение нарушений морфологии сперматозоидов.
Известно, что белок CD52 присутствует в тканях репродуктивных органов у людей и у грызунов. Данные исследований на животных показали определенные эффекты препарата по фертильности у гуманизированных мышей (см. Раздел «Доклинические данные по безопасности»), однако потенциальное воздействие на фертильность у людей во время периода применения препарата пока неизвестен учитывая доступные на сегодня данные.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Препарат Лемтрада обусловливает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами. У большинства пациентов возникают АИР, которые развиваются во время введения препарата Лемтрада или в пределах 24 часов после этого. Некоторые из АИР (например головокружение) могут временно влиять на способность пациента управлять транспортными средствами или работать с другими механизмами, и поэтому необходимо соблюдать осторожность, пока эти явления не исчезнут.
Способ применения Лемтрада и дозы
Лечение препаратом Лемтрада следует начинать и проводить только под наблюдением невролога, который имеет опыт лечения пациентов с рассеянным склерозом (РС в больнице, где обеспечена возможность проведения интенсивной терапии.
При этом должны быть доступны специалисты и оборудование, необходимые для своевременной диагностики и оказания медицинской помощи при нежелательных реакциях, особенно при ишемии миокарда и инфаркте миокарда, цереброваскулярных нежелательных реакциях, аутоиммунных состояниях и инфекциях.
Должны быть доступны средства для лечения синдрома высвобождения цитокинов, реакций гиперчувствительности и / или анафилактических реакций.
Пациентам, получающим лечение препаратом Лемтрада, следует выдать Карточку-памятник пациента и Рекомендации для пациента, а также предоставить информацию о рисках применения препарата Лемтрада (см. Также Инструкцию по применению лекарственного средства).
дозировка
Рекомендуемая доза Алемтузумаб составляет 12 мг / сут и вводится путем внутривенной инфузии в 2 курсах начального лечения с применением еще до 2 дополнительных курсов лечения при необходимости.
Начальное лечение в 2 курсах
- Первый курс лечения 12 мг / сут в течение 5 последовательных дней (общая доза - 60 мг).
- Второй курс лечения 12 мг / сут в течение 3 последовательных дней (общая доза - 36 мг), которые вводятся через 12 месяцев после первого курса лечения.
При необходимости может быть рассмотрена целесообразность применения еще до 2 дополнительных курсов лечения (см. «Фармакологические свойства / Фармакологические» )
- Третий или четвертый курс 12 мг / сут в течение 3 последовательных дней (общая доза - 36 мг), которые вводятся через 12 месяцев после предыдущего курса лечения (см. Разделы «Фармакологические свойства / Фармакологические», «Показания»).
Если какая-то доза была пропущена, ее можно вводить в тот же день, что и запланированная на этот день дозу.
Наблюдение за пациентами
Лечения рекомендуется осуществлять с применением 2 начальных курсов лечения и при необходимости до 2 дополнительных курсов лечения (см. Раздел «Дозировка»), при этом за состоянием пациентов необходимо наблюдать для оценки безопасности от начала лечения и в течение по крайней мере 48 месяцев после последней инфузии второго курса лечения. Если назначается дополнительный третий или четвертый курс лечения, следует продолжить наблюдение для оценки безопасности в течение по крайней мере 48 месяцев после последней инфузии препарата (см. Раздел «Особенности применения»).
премедикация
Пациенты должны получить премедикацию ГКС непосредственно перед введением препарата Лемтрада в каждый из первых 3 дней любого курса лечения. Во время клинических исследований пациенты получали премедикацию метилпреднизолоном в дозе 1000 мг в первые 3 дня каждого курса лечения Лемтрада.
Также может быть рассмотрена возможность премедикации антигистаминными и / или жаропонижающее препаратами перед введением препарата Лемтрада.
Всем пациентам необходимо назначить пероральные средства для профилактики герпеса, прием которых начинается в первый день каждого курса лечения и продолжается в течение не менее 1 месяца после окончания лечения Лемтрада (см. Также раздел «Особенности применения / Инфекции»). Во время клинических исследований пациентам назначался ацикловир в дозе 200 мг дважды в сутки или эквивалентный препарат.
Особые категории пациентов
Пациенты пожилого возраста
В клинические исследования этого препарата не включали пациентов старше 61 год. На сегодняшний день не установлено, у этих пациентов наблюдаются какие-то различия в ответе на препарат по сравнению с пациентами более молодого возраста.
Почечная или печеночная дисфункция
Препарат Лемтрада не изучали у пациентов с нарушениями функции почек или печени.
Пациенты детского возраста
Безопасность и эффективность применения препарата Лемтрада детям с РС в возрасте от 0 до 18 лет пока не установлены. Значимый опыт применения Алемтузумаб детям от рождения до менее 10 лет для лечения рассеянного склероза пока отсутствует. Данные по этому поводу отсутствуют.
способ применения
Препарат Лемтрада нужно разводить непосредственно перед инфузией. Разведенный раствор вводится путем внутривенной инфузии продолжительностью примерно 4:00.
Инструкции по разведению этого лекарственного средства перед введением приведены в разделе «Особые меры безопасности».
Дети
Безопасность и эффективность применения препарата Лемтрада детям с РС в возрасте от 0 до 18 лет пока не установлены. Значимый опыт применения Алемтузумаб детям от рождения до 10 лет для лечения рассеянного склероза пока отсутствует. Данные по этому поводу отсутствуют.
Передозировка
В контролируемых клинических исследованиях 2 пациента с РС случайно получили до 60 мг Лемтрада (т.е. полную дозу для начального курса лечения) в одной инфузии и у них возникли серьезные реакции (головная боль, сыпь, а также или артериальная гипотензия, или синусовая тахикардия). Дозы препарата Лемтрада, выше тех, которые оценивались в клинических исследованиях, могут увеличивать интенсивность ассоциированных с инфузиями нежелательных реакций и / или иммунных эффектов препарата.
Антидот для лечения передозировки Алемтузумаб неизвестен. Лечение заключается в отмене этого лекарственного средства и назначении поддерживающей терапии.
Побочные эффекты
Сводный профиль безопасности по результатам клинических исследований. Популяция пациентов, которая использовалась для оценки безопасности в совокупном анализе данных клинических исследований РС с медианой продолжительности наблюдения 6,1 года (и максимальным сроком наблюдения 12 лет), составляла в целом 1486 пациентов, получавших препарат Лемтрада (в дозе 12 мг или 24 мг ), что обеспечило 8635 пациенто-лет наблюдения для оценки безопасности.
Наиболее важными побочными эффектами являются аутоиммунные реакции (ИТР, нарушения со стороны щитовидной железы, нефропатии, цитопении), АИР и инфекции (см. Раздел «Особенности применения»).
Наиболее частыми нежелательными реакциями при применении препарата Лемтрада (которые наблюдались у ≥ 20% пациентов) были высыпания, головная боль, пирексия и инфекции дыхательных путей.
Табличный перечень нежелательных реакций. Приведенная ниже таблица 3 составлена на основе сводных данных по безопасности, полученных от всех пациентов, которым применяли препарат Лемтрада в дозе 12 мг, по результатам всех доступных данных наблюдения в рамках клинических исследований. Нежелательные реакции перечислены в соответствии с категориями «Система-Орган-класс» (SOC) и терминов, имеют преимущество, Медицинского словаря для регуляторной деятельности (MedDRA). Частота развития нежелательных явлений определялась с учетом следующих условий: очень часто (≥ 1/10); часто (от ≥ 1/100 до <1/10); нечасто (от ≥ 1/1000 до <1/100); редко (от ≥ 1/10 000 до <1/1000); очень редко (<1/10 000) частота неизвестна (нельзя оценить на основе доступных данных). В пределах каждой частотной группы нежелательные реакции представлены в порядке уменьшения серьезности.
Таблица 3
Нежелательные реакции, которые наблюдались в исследованиях 1, 2, 3 и 4 у пациентов, получавших препарат Лемтрада в дозе 12 мг, и в ходе послерегистрационного надзора
Система-Орган-класс | очень часто | Часто | Нечасто | редко | частота неизвестна |
Инфекционные и паразитарные заболевания | Инфекции верхних дыхательных путей, инфекции мочевыводящих путей, инфекция, вызванная вирусом герпеса 1 | Инфекции, вызванные вирусом ветряной оспы 2, инфекции нижних дыхательных путей, гастроэнтерит, оральный кандидоз, вульвовагинальных кандидоз, грипп, инфекция уха, пневмония, вагинальная инфекция, инфекция зуба | Онихомикоз, гингивит, грибковая инфекция кожи, тонзиллит, острый синусит, флегмона, пневмонит, туберкулез, цитомегало-вирусные инфекции | Листериоз / листериозный менингит, инфекция (включая реактивации) вируса Эпштейна ̶ Барр (ВЭБ) | |
Доброкачественные, злокачественные и неуточненные новообразования (в т.ч. кисты и полипы) | папиллома кожи | ||||
Со стороны крови и лимфатической системы | Лимфопения, лейкопения, в том числе нейтропения | Лимфаденопатия, иммунная тромбоцитопеническая пурпура, тромбоцитопения, анемия, снижение гематокрита, лейкоцитоз | Панцитопения, гемолитическая анемия, приобретенная гемофилия А | Гемофа-гоцитар ный лимфогис-тиоцитоз (ГЛГ) | |
Со стороны иммунной системы | Синдром высвобождения цитокинов *, гиперчувствительность (в том числе анафилаксия) * | ||||
эндокринные расстройства | Базедова болезнь, гипертиреоз, гипотиреоз | Аутоиммунный тиреоидит (в том числе подострый тиреоидит), зоб, положительные результаты анализа на антитела к компонентам щитовидной железы | |||
Метаболические и алиментарные расстройства | снижение аппетита | ||||
Со стороны психики | Бессонница *, тревога, депрессия | ||||
Со стороны нервной системы | Головная боль* | Рецидив РС, головокружение *, гипестезия, парестезии, тремор, дисгевзия * мигрень * | Нарушение чувствительности, гиперестезия, головная боль напряжения | Геморагич ный инсульт **, расслоений ния стенок артерий головы и шеи ** | |
Со стороны органов зрения | Конъюнктивит, эндокринная офтальмопатия, нечеткость зрения | диплопия | |||
Со стороны органов слуха и равновесия | Головокружение | Боль в ушах | |||
Со стороны сердца | тахикардия * | Брадикардия *, усиленное сердцебиение * | Фибрилляция предсердий * | Ишемия миокарда **, инфаркт миокарда ** | |
Со стороны сосудов | гиперемия * | Артериальная гипотензия *, артериальная гипертензия * | |||
Со стороны дыхательной системы, органов грудной клетки и середостин ния | Одышка *, кашель, носовое кровотечение, икота, боли в ротоглотке, бронхиальная астма | Ощущение сжатия в горле *, раздражение горла | Альвеолярная легочное кровотечение ** | ||
Со стороны желудочно-кишечного тракта | тошнота * | Боль в животе, рвота, диарея, диспепсия *, стоматит | Запор, гастроэзофагеальная рефлюксная болезнь, кровоточивость десен, сухость во рту, дисфагия, желудочно-кишечные расстройства, гематохезия | ||
Гепатобили-арные расстройства | Повышение уровня аспартатаминотрансферазы, повышение уровня аланинаминотрансферазы | Холецистит (в том числе акалькульозний холецистит и острый акалькульозний холецистит) | Аутоиммунных ный гепатит, гепатит (ассоциированный с инфекцией вируса Эпштейна ̶ Барр (ВЭБ)) | ||
Со стороны кожи и подкожной клетчатки | Крапивница *, сыпь *, зуд * генерализованное высыпание * | Эритема *, экхимозы, алопеция, гипергидроз, акне, очаги поражения кожи, дерматит | Волдыри, ночная потливость, отек лица, экзема | ||
Со стороны опорно-двигательного аппарата и соединительной ткани | Миалгия, мышечная слабость, артралгия, боль в спине, боль в конечностях, мышечные спазмы, боль в шее, мышечно-скелетные боли | Скованность опорно-двигательного аппарата, дискомфорт в конечностях | |||
Со стороны почек и мочевыводящих путей | Протеинурия, гематурия | Нефролитиаз, кетонурия, нефропатии (в том числе заболевания с образованием анти-БМК) | |||
Со стороны репродуктив ной системы и молочных желез | Меноррагия, нерегулярные менструации | Дисплазия шейки матки, аменорея | |||
Общие нарушения и реакции в месте применения препарата | Пирексия * повышенная втомлюва ность *, озноб * | Дискомфорт в грудной клетке * боль *, периферические отеки, общая слабость, гриппоподобное заболевания, общее недомогание, боль в месте инфузии | |||
Изменения по результатам обследований | Повышение уровня креатинина в крови | Снижение массы тела, увеличение массы тела, уменьшение содержания эритроцитов, положительные результаты бактериального теста, повышение уровня глюкозы в крови, увеличение среднего объема эритроцитов | |||
Травмы, отравления и процедурные осложнения | Убой, связанные с инфузиями реакции |
1 К инфекций, вызванных вирусом герпеса, принадлежат (по срокам, которые имеют преимущество): оральный герпес простой герпес генитальный герпес инфекция, вызванная вирусом герпеса; простой генитальный герпес герпетический дерматит простой офтальмогерпес; положительные результаты серологического анализа на простой герпес.
2 К инфекций, вызванных вирусом ветряной оспы, принадлежат (по срокам, которые имеют преимущество): опоясывающий герпес кожный распространенный опоясывающий герпес опоясывающий офтальмогерпес; офтальмогерпес; нейроинфекция, вызванная вирусом опоясывающего герпеса; менингит, вызванный вирусом опоясывающего герпеса.
Описание отдельных нежелательных реакций. Сроки, отмеченные звездочкой (*) в таблице 3, включают в себя нежелательные реакции, о которых сообщали как о ассоциированные с инфузиями реакции.
Сроки, отмеченные двумя звездочками (**) в таблице 3, включают в себя нежелательные реакции, которые наблюдались в послерегистрационный период и которые в большинстве случаев начинались в пределах 1 ̶ 3 дней после инфузии препарата Лемтрада после введения любой его дозы в ходе курса лечения.
нейтропения
Сообщалось о случаях тяжелой (в том числе летальной) нейтропении, которая возникала в пределах 2 месяцев после инфузии препарата Лемтрада.
Профиль безопасности по результатам длительного последующего наблюдения. По своему типу нежелательные реакции, в том числе по своей серьезностью и тяжестью, которые наблюдались у пациентов групп лечения Лемтрада по результатам всех доступных данных последующего наблюдения, в том числе у пациентов, получавших дополнительные курсы лечения, были подобны нежелательных реакций, наблюдавшихся в исследованиях с активным контролем. Частота АИР во время первого курса лечения была выше по сравнению со следующими курсами.
У пациентов, за которыми продолжали наблюдение после контролируемых клинических исследований и не получавших никаких дополнительных курсов лечения Лемтрада после начальных 2 курсов лечения, частота (количество событий на пациенто-год) большинства нежелательных реакций годами 3-6 была сравнимой с такой частотой в течение лет 1 и 2 или ниже нее. Частота нежелательных реакций со стороны щитовидной железы была самой течение третьего года и в дальнейшем снижалась.
Сообщение о подозреваемых нежелательные реакции.
Это лекарственное средство подлежит дополнительному мониторинга. Это позволит быстро идентифицировать новую информацию по безопасности. Сообщение о подозреваемых побочные реакции после регистрации лекарственного средства является важной процедурой. Это позволяет продолжать мониторинг соотношения польза / риск для этого лекарственного средства. Медицинских работников просят сообщать обо всех подозреваемых побочные реакции через национальную систему фармаконадзора.
Срок годности Лемтрада
Концентрат 3 года.
Разведенный раствор : продемонстрировано, что готов к использованию препарат остается химически и физически стабильным в течение 8:00 при температуре 2-8 ° C. С микробиологической точки зрения препарат рекомендуется использовать немедленно. Если он не используется сразу же, пользователь отвечает за сроки и условия его хранения до начала использования, которые не должны превышать 8:00 при температуре 2-8 ° C, при условии обеспечения защиты от света.
Условия хранения Лемтрада
Хранить в холодильнике (при температуре 2-8 ° C). Не замораживать. Не встряхивать. Хранить флакон во внешней картонной упаковке с целью его защиты от света. Хранить в недоступном для детей месте и вне поля их зрения.
Несовместимость.
Исследование совместимости не проводились, поэтому не рекомендуется смешивать это лекарственное средство с другими лекарственными средствами, кроме указанных в разделе «Особые меры безопасности».
Упаковка
№1: по 1,2 мл во флаконе; по 1 флакону в картонной коробке.
Категория отпуска
По рецепту.
Производитель
- Джензайм ЛИМИТЕД.
- Джензайм Iрланд Лимитед.
Местонахождение производителя
- 37 ХОЛЛАНДС РОУД, Хаверхилл, СВ9 8PU, Великобритания.
- Индустриальный парк IDA, Old Kilmeaden Road, Уотерфорд, Ирландия.
Заявитель.
ООО «Санофи-Авентис Украина», Украина.
Местонахождение заявителя.
Украина, 01033, г.. Киев, ул. Жилянская, 48-50.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Лемтрада только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Джензайм Лимитед
Лемтрада и Алкоголь?
Ваше состояние само по себе может ухудшаться после приема спиртного, так как алкоголь расширяет сосуды и вызывает отечность. Не рекомендуем принимать алкоголь в течение всего курса приема препарата Лемтрада, а также несколько дней после завершения лечения.
| Тип данных | Сведения из реестра |
| Торговое наименование: | Лемтрада |
| Производитель: | Джензайм Лимитед |
| Форма выпуска: | концентрат для приготовления раствора для инфузий 12 мг / 1,2 мл № 1: по 1,2 мл во флаконе, по 1 флакону в картонной коробке |
| Регистрационное удостоверение: | UA/17376/01/01 |
| Дата начала: | 26.04.2019 |
| Дата окончания: | 26.04.2024 |
| МНН: | Alemtuzumab |
| Условия отпуска: | по рецепту |
| Состав: | 1,2 мл концентрата содержит Алемтузумаб 12 мг / 1 флакон содержит 12 мг Алемтузумаб |
| Фармакологическая группа: | Иммунодепрессанты, селективные иммунодепрессанты. Алемтузумаб. |
| Код АТХ: | L04AA34 |
| Заявитель: | ООО «Санофи-Авентис Украина» |
| Страна заявителя: | Украина |
| Адрес заявителя: | Украина, 01033, г.. Киев, ул. Жилянская, 48-50 |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L04 | Иммунодепрессанты |
| L04A | Иммунодепрессанты |
| L04AA | Селективные иммунодепрессанты |
| L04AA34 | Алемтузумаб |
