- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Луцентис инструкция по применению
Официальная инструкция лекарственного препарата Луцентис раствор 0,23 мл. Описание и применение Lutsentis, аналоги и отзывы. Инструкция Луцентис раствор утвержденная компанией производителем.
Состав
действующее вещество: ranibizumab;
1 мл раствора содержит 10 мг ранибизумаба;
Вспомогательные вещества: α, α-трегалозы дигидрат; L-гистидина гидрохлорид моногидрат, L-гистидин; полисорбат 20; вода для инъекций.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: прозрачный или слегка опалесцирующим раствор.
Фармакологическая группа
Средства, применяемые при сосудистых заболеваниях глаз. Антинеоваскуляризацонные средства.
Код АТХ S01L A04.
Фармакологические свойства
Фармакологические.
Ранибизумаб - фрагмент рекомбинантного гуманизированного моноклонального антитела против человеческого сосудистого эндотелиального фактора роста А (VEGF-A). Он имеет высокое сродство с изоформами VEGF-A (например VEGF110, VEGF121 и VEGF165) и, таким образом, предотвращает прикрепление VEGF-A к его рецепторам VEGFR-1 и VEGFR-2. Прикрепление VEGF-A к его рецепторам приводит к пролиферации эндотелиальных клеток и неоваскуляризации, а также проницаемости сосудов, что, как считается, способствует развитию неоваскулярной формы возрастной макулярной дегенерации (ВМД), патологической миопии и хориоидальной неоваскуляризации (ХНВ) или нарушение зрения, вызванного диабетическим макулярный отек или макулярный отек вследствие тромбоза вен сетчатки.
Лечение экссудативной ВМД
Клиническая безопасность и эффективность препарата Луцентис изучались в трех рандомизированных двойных слепых и плацебо или активно-контролируемом исследованиях с участием пациентов с неоваскулярной ВМД продолжительностью 24 месяца. Всего было зарегистрировано 1323 пациентов (879 активной и 444 контрольной групп).
Во время исследования FVF2598g (MARINA) пациенты с минимальными проявлениями классической ГТД или скрытыми неклассическими формами были рандомизированы в соотношении 1: 1: 1 для введения 1 раз в месяц препарата Луцентис в дозе 0,3 мг и 0,5 мг или плацебо. Всего было зарегистрировано 716 пациентов (238 - группа плацебо; 238 - Луцентис, 0,3 мг 240 - Луцентис 0,5 мг).
В ходе исследования FVF2587g (ANCHOR) пациенты с преимущественно классической формой ХНВ были рандомизированы в соотношении 1: 1: 1 для ежемесячного введения препарата Луцентис в дозе 0,3 мг, препарата Луцентис в дозе 0,5 мг фотодинамической терапии (ФДТ) вертепорфином ( в начале исследования и каждые 3 месяца спустя, если флуоресцентная ангиография свидетельствовала о сохранении или возврата проницаемости сосудов). Всего было зарегистрировано 423 пациента (143 - группа плацебо; 140 - Луцентис, 0,3 мг 140 - Луцентис 0,5 мг).
Результаты обоих исследований свидетельствуют, что дальнейшее лечение ранибизумабом может улучшить состояние у тех пациентов, которые потеряли ≥ 15 знаков остроты зрения с лучшей коррекции (ГЗНК) в первый год лечения.
Статистически значимое улучшение зрения по сообщениям пациентов наблюдалось в обоих исследованиях MARINA и ANCHOR при лечении ранибизумабом по сравнению с контрольной группой по опроснику Национального офтальмологического института (NEI VFQ-25).
Проведено рандомизированное плацебо-контролируемое исследование FVF3192g (PIER) для оценки применения препарата Луцентис пациентам со всеми формами неоваскулярной ВМД.
Пациенты были рандомизированы в соотношении 1: 1: 1 для инъекции препарата Луцентис в дозе 0,3 мг и 0,5 мг или инъекции плацебо 1 раз в месяц в течение 3 месяцев подряд с последующим введением дозы один раз каждые 3 месяца. Всего в исследовании было зарегистрировано 184 пациента. Начиная с 14-го месяца исследования, пациенты, получавшие плацебо, могли переходить на лечение ранибизумабом, а начиная с 19-го месяца разрешалось более частое введение препарата. Пациенты, получавшие лечения Луцентис в рамках исследования PIER, получили в среднем по 10 инъекций препарата.
После начального улучшения остроты зрения (после ежемесячного введения препарата) в среднем пациенты, получавшие препарат Луцентис один раз каждые три месяца, теряли остроту зрения, возвращаясь к базовой точки на 12-й месяц. Почти у всех пациентов (82%), получавших препарат Луцентис, острота зрения на 24-й месяц сохранена. Данные по некоторым пациентов, перешедших на лечение ранибизумабом после более чем одного года приема плацебо, показывают, что раннее начало лечения может ассоциироваться с лучшим сохранением остроты зрения.
Данные двух исследований (MONT BLANC, BPD952A2308 и DENALI, BPD952A2309), завершившихся после регистрации препарата, подтвердили эффективность препарата Луцентис, но не показывают дополнительного эффекта комбинированного применения вертепорфином (ФДТ препаратом Визудин) и препарата Луцентис сравнению с монотерапией препаратом Луцентис.
Лечение нарушения зрения вследствие диабетического макулярного отека (ДМН)
Эффективность и безопасность ЛУЦЕНТИС оценивались в ходе трех рандомизированных контролируемых исследований продолжительностью 12 месяцев. Всего в этих исследованиях принимали участие 868 пациентов (708 - в активной группе и 160 - в контрольной). В ходе фазы II исследования D2201 (RESOLVE) 151 пациент получал терапию ранибизумабом (6 мг / мл, n = 51, 10 мг / мл, n = 51) или плацебо (n = 49) в виде интравитреальных инъекций 1 раз в месяц . Среднее изменение ГЗНК от 1-го до 12-го месяца по сравнению с исходным уровнем составляла +7,8 (± 7,72) буквы в объединенной группе пациентов, получавших лечение ранибизумабом (n = 102), по сравнению с -0, 1 (± 9,77) буквы у пациентов, получавших плацебо. Среднее изменение ГЗНК на 12-м месяце от исходного уровня составляла 10,3 (± 9,1) буквы сравнению с -1,4 (± 14,2) буквы соответственно (p <0,0001 для различия между видами лечения).
В ходе III фазы исследования D2301 (RESTORE) 345 пациентов были рандомизированы в соотношении 1: 1: 1 для получения или ранибизумаба в дозе 0,5 мг в качестве монотерапии и плацебо-лазерной фотокоагуляции (n = 116), комбинированной терапии ранибизумабом в дозе 0, 5 мг и лазерной фотокоагуляции (n = 118) или инъекции плацебо и лазерной фотокоагуляции (n = 111).
240 пациентов, которые к тому завершили 12-месячное исследование RESTORE, были отобраны для участия в открытом многоцентровом 24-месячном продолжении исследования (RESTORE Extension). Пациенты получали инъекции ранибизумаба 0,5 мг pro re nata (PRN - при необходимости) в то же исследуемое глаз в исследовании D2301 (RESTORE).
Эффект совпадал в большинстве подгрупп на 12-м месяце. Однако у пациентов с достаточно хорошей исходной ГЗНК (> 73 букв) в случае отека желтого пятна с толщиной сетчатки в центральном участке <300 мкм не наблюдалось пользы от терапии ранибизумабом сравнению с лазерной фотокоагуляции.
Статистически значимое улучшение по сообщениям пациентов по отношению к большинству зрительных функций наблюдалось на фоне лечения ранибизумабом (с или без лазерной фотокоагуляции) по сравнению с контрольной группой согласно опросу Национального офтальмологического института (NEI VFQ-25). По другим показателям этого опроса различий между видами лечения не было установлено.
Профиль безопасности ранибизумаба при длительном лечении, наблюдавшийся в 24-месячном расширенном исследовании, соответствует известному профилю безопасности препарата Луцентис.
В исследовании фазы IIIb D2304 (RETAIN) 372 пациенты были рандомизированы в соотношении 1: 1: 1 для получения следующих препаратов:
- Ранибизумаб 0,5 мг с одновременной лазерной фотокоагуляции в режиме «treat-and-extend» (TE - «лечение и продолжение») (n = 121)
- Ранибизумаб 0,5 мг в виде монотерапии в режиме ТО (n = 128)
- Ранибизумаб 0,5 мг в виде монотерапии в режиме PRN (n = 123).
Во всех группах лечения ранибизумабом начинали со ежемесячных инъекций и продолжали, пока ГЗНК ни была стабильной в течение не менее трех ежемесячных оценок подряд. При TE Ранибизумаб применяли с интервалами 2-3 месяца. Во всех группах месячная терапия начиналась повторно после снижения ГЗНК вследствие прогрессирования ДМН и продолжалась до повторного достижения стабилизации ГЗНК.
После первых трех ежемесячных визитов количество плановых лечебных визитов, предусмотренных режимом ТО, составляла 13 по сравнению с 20 ежемесячными визитами, предусмотренными режимом PRN. В условиях применения обоих режимов более 70% пациентов поддерживали свой уровень ГЗНК с частотой визитов ≥ 2 месяца. В исследованиях ДМН улучшение ГЗНК сопровождалось уменьшением в динамике среднего показателя центральной пидпольовои толщины сетчатки (ЦПТС) во всех группах лечения.
Лечение нарушений зрения, обусловленных макулярной отеком, вызванным тромбозом вен сетчатки
Клиническую безопасность и эффективность препарата Луцентис у пациентов с нарушениями зрения, обусловленными макулярной отеком, вызванным тромбозом вен сетчатки, изучали в рандомизированных двойных слепых и контролируемых исследованиях BRAVO и CRUISE с участием пациентов с тромбозом ветвей вен сетчатки (n = 397) и тромбозом центральной ветви вен сетчатки (n = 392). В обоих исследованиях участникам делали инъекции ранибизумаба (0,3 мг или 0,5 мг) или плацебо. Через 6 месяцев пациентов группы плацебо-контроля переводили на Ранибизумаб в дозе 0,5 мг. В обоих исследованиях улучшение зрения сопровождалось постоянным и значительным уменьшением отека желтого пятна, на что указывала толщина сетчатки в центре.
Пациенты с тромбозом центральной вены сетчатки (исследование CRUISE и расширенное исследование HORIZON): через 2 года у пациентов, первые 6 месяцев получали плацебо, а в дальнейшем были переведены на Ранибизумаб, улучшение остроты зрения (~ 6 букв) не достигало уровня, подобного отмеченного у тех, кто принимал Ранибизумаб от начала исследования (~ 12 букв).
Статистически значимое улучшение по сообщениям пациентов по показателям подшкал оценки ближнего и дальнего зрения наблюдалось при лечении ранибизумабом по сравнению с контрольной группой в опросе Национального офтальмологического института (NEI VFQ-25).
Долговременная (24 месяца) клиническая безопасность и эффективность препарата Луцентис у пациентов с нарушением зрения, обусловленным макулярной отеком, вызванным тромбозом вен сетчатки, оценивались в ходе исследований BRIGHTER (тромбоз ветвей центральной вены сетчатки) и CRYSTAL (тромбоз центральной вены сетчатки). Во время обоих исследований пациентам применяли режим дозирования PRN ранибизумаба в дозе 0,5 мг, что устанавливался по индивидуальным критериям стабильности. BRIGHTER - рандомизированное активно-контролируемое исследование в трех группах для сравнения применения ранибизумаба в дозе 0,5 мг в качестве монотерапии или в комбинации с адъювантной лазерной фотокоагуляции сравнению с лазерной фотокоагуляции отдельно. Через 6 месяцев пациенты группы лазерной фотокоагуляции могли получать 0,5 мг ранибизумаба. CRYSTAL - несравнимых исследования применения ранибизумаба в дозе 0,5 мг в качестве монотерапии. В ходе исследования BRIGHTER Ранибизумаб в дозе 0,5 мг с адъювантной лазерной терапией продемонстрировал не выше эффективность по сравнению с применением ранибизумаба качестве монотерапии от исходного уровня до 24-го месяца (95% ДИ -2,8; 1,4).
Во время обоих исследований быстрое и статистически значимое уменьшение толщины сетчатки в центральном участке от исходного уровня наблюдалось через 1 месяц. Этот эффект сохранялся до 24-го месяца.
Эффект лечения ранибизумабом был аналогичным, несмотря на наличие ишемии сетчатки. В ходе исследования BRIGHTER у пациентов с ишемией (N = 46) или без нее (N = 133), получавших Ранибизумаб качестве монотерапии, среднее изменение от исходного уровня составляла +15,3 и +15,6 букв соответственно на двадцать четвёртый месяц .
Во время исследования CRYSTAL у пациентов с ишемией (N = 53) или без нее (N = 300), получавших Ранибизумаб качестве монотерапии, среднее изменение от исходного уровня составляла +15,0 и +11,5 букв соответственно.
Во время исследований BRIGHTER и CRYSTAL улучшения зрения со временем наблюдалось у всех пациентов, получавших 0,5 мг ранибизумаба качестве монотерапии, несмотря на длительность заболевания. У пациентов с длительностью заболевания <3 месяцев улучшение остроты зрения на 13,3 и 10,0 буквы наблюдалось на первом месяц и на 17,7 и 13,2 буквы на двадцать четвёртой месяц в ходе исследований BRIGHTER и CRYSTAL соответственно. Соответствующее увеличение остроты зрения у пациентов с длительностью заболевания ≥ 12 месяцев составил 8,6 и 8,4 буквы в указанных исследованиях. Следует рассмотреть возможность начала лечения при диагностировании заболевания.
Профиль долговременной безопасности ранибизумаба, наблюдавшийся в 24-месячных исследованиях, соответствует известному профилю безопасности препарата Луцентис.
Лечение нарушения зрения вследствие ХНВ, вторичной относительно патологической миопии (ПМ)
Клиническую безопасность и эффективность препарата Луцентис у пациентов с нарушением зрения в результате ХНВ при ПМ оценивали на основании данных, полученных в течение 12 месяцев в ходе проведения рандомизированного двойного слепого контролируемого базового исследования F2301 (RADIANCE). 277 пациентов были рандомизированы в соотношении 2: 2: 1 в следующие группы:
• Группа I (Ранибизумаб по 0,5 мг, режим дозирования устанавливался по критериям «стабильности», которые определялись как отсутствие изменений в остроте зрения с лучшей коррекцией (ГЗНК) по сравнению с результатами двух предыдущих ежемесячных оценок).
• Группа II (Ранибизумаб по 0,5 мг, режим дозирования устанавливался по критериям «активности заболевания», которые определялись как нарушение зрения, связанное с интра- или субретинальном жидкостью или активным пропотеванием вследствие поражения ХНВ, что оценивалось с помощью оптической когерентной томографии (ОКТ) и / или флуоресцентной ангиографии (ФА).
• Группа III (ФДТ вертепорфином, пациентам было разрешено получать лечение ранибизумабом, начиная с 3-го месяца).
В группе II, где применяли рекомендованную дозу препарата, 50,9% пациентов нуждались в проведении 1 или 2 инъекций, 34,5% нуждались 3-5 инъекций и 14,7% нуждались 6-12 инъекций в течение 12- месячного периода исследования. 62,9% пациентов в группе II не нуждались инъекций в течение второго 6-месячного периода исследования.
Улучшение зрения сопровождалось уменьшением центральной толщины сетчатки.
Пациенты в группах применения ранибизумаба сообщали о преимуществах лечения по сравнению с применением ФДТ вертепорфином (р <0,05) по улучшению суммарной оценки и показателей некоторых подшкал (общий зрение, зрение на близком расстоянии, психическое здоровье и зависимость) в опросе Национального офтальмологического института (NEI VFQ-25).
дети
Безопасность и эффективность применения ранибизумаба детям не установлены.
Европейское агентство по лекарственным средствам отложило требование о предоставлении результатов исследований препарата Луцентис во всех подгруппах педиатрической популяции при неоваскулярной ВМД, нарушении зрения вследствие ДМН, нарушении зрения, обусловленном макулярной отеком, вызванным тромбозом вен сетчатки, и нарушении зрения вследствие ХНВ (см. Раздел «Способ применение »для получения информации о применении детям).
Фармакокинетика.
После ежемесячного интравитреального применения препарата Луцентис у пациентов с неоваскулярной ВМД концентрация ранибизумаба в сыворотке крови была, как правило, низкой, с максимальным уровнем (Cmax), ниже необходимую концентрацию, что ингибирует биологическую активность сосудистого эндотелиального фактора роста (VEGF) на 50% ( 11-27 нг / мл, как определено в исследовании клеточной пролиферации in vitro). Cmax была пропорциональна дозе в диапазоне доз 0,05-1,0 мг / глаз. Сывороточные концентрации у некоторых пациентов с ДМН показывают, что нельзя исключить несколько более высокую системную экспозицию по сравнению с экспозицией у пациентов с неоваскулярной ВМД. Сывороточные концентрации ранибизумаба у пациентов с тромбозом вен сетчатки были практически такими же или несколько выше по сравнению с соответствующими показателями у пациентов с неоваскулярной ВМД.
Согласно данным популяционной фармакокинетики и вывода ранибизумаба из сыворотки крови у пациентов с неоваскулярной ВМД, получавших препарат в дозе 0,5 мг средний период полувыведения ранибизумаба со стекловидного тела составляет приблизительно 9 дней. При ежемесячном интравитреальное введении препарата Луцентис в дозе 0,5 мг в глаза Cmax ранибизумаба в сыворотке наблюдается примерно через день после введения препарата и составляет 0,79-2,90 нг / мл, Cmin может составлять 0,07-0,49 нг / мл. Экспозиция ранибизумаба в сыворотке крови примерно в 90 000 раз ниже, чем в стекловидном теле.
Фармакокинетика в особых групп пациентов.
Пациенты с нарушением функции почек.
Не проводили исследований фармакокинетики препарата у больных с нарушением функции почек. При изучении фармакокинетики в популяции пациентов с неоваскулярной ВМД 68% (136 из 200) пациентов имели нарушения функции почек (46,5% - незначительные [50-80 мл / мин], 20% - умеренные [30-50 мл / мин], 1,5% - тяжелые [меньше 30 мл / мин]). У пациентов с тромбозом вен сетчатки 48,2% (253 из 525) имели нарушения функции почек (36,4% незначительное, 9,5% умеренное и 2,3% тяжелое). Уровень системного клиренса был несколько ниже, но клинически незначительное.
Пациенты с нарушением функции печени.
Не проводили исследований фармакокинетики препарата у больных с нарушением функции печени.
Клинические характеристики
Луцентис Показания
- Лечение неоваскулярной (экссудативной) возрастной макулярной дегенерации (ВМД).
- Лечение нарушения зрения при диабетическом макулярной отека (ДМН).
- Лечение нарушения зрения при макулярной отека, возникшего вследствие тромбоза вен сетчатки (тромбоз центральной вены сетчатки или тромбоз ветвей центральной вены сетчатки).
- Лечение нарушения зрения вследствие хориоидальной неоваскуляризации (ХНВ), вторичной относительно патологической миопии (ПМ).
Противопоказания
- Повышенная чувствительность к активному веществу или любому другому ингредиенту препарата.
- Активный / подозреваемый окулярный или периокулярных инфекционный процесс.
- Активный тяжелый интраокулярной воспалительный процесс.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследования взаимодействия не проводилось.
Информацию о адьюнктивного применения фотодинамической терапии вертепорфином и ЛУЦЕНТИС см. в разделе «Фармакологические».
Информацию о адьюнктивного применения лазерной фотокоагуляции и ЛУЦЕНТИС при ДМН и тромбозе ветвей центральной вены сетчатки см. в разделах «Способ применения и дозы» и «Фармакологические» .
В клинических исследованиях лечения ухудшения зрения вследствие ДМН результат относительно остроты зрения или центральной пидпольовои толщины сетчатки (ЦПТС) у пациентов, получавших лечение препаратом Луцентис, не зависел от одновременного лечения тиазолидинедионом.
Особенности применения
Реакции, связанные с интравитреальное инъекцией
Интравитреальные инъекции, включая инъекции препарата Луцентис, были ассоциированы с эндофтальмитом, интраокулярной воспалением, регматогенной отслойки сетчатки глаза, разрывом сетчатки глаза и ятрогенной травматической катарактой (см. Раздел «Побочные реакции»). Надлежащая асептическая техника проведения инъекций должна быть обязательной при введении препарата Луцентис. Кроме того, нужно следить за состоянием пациента в течение недели после проведения инъекции, чтобы начать своевременное лечение в случае развития инфекционного осложнения. Пациент должен знать о необходимости немедленно сообщать о появлении любых признаков, которые могут напоминать эндофтальмит или другие вышеперечисленные осложнения.
Повышение внутриглазного давления
Транзиторное повышение внутриглазного давления отмечали в течение 60 минут после инъекции, поэтому показатели внутриглазного давления и перфузии диска зрительного нерва следует проверить и соответственно скорректировать. Также проявляли устойчивое повышение внутриглазного давления (см. Раздел «Побочные реакции»).
билатеральная терапия
Некоторые данные по билатерально применения препарата Луцентис (включая применение в один и тот же день) свидетельствуют об отсутствии повышенного риска системных нежелательных явлений по сравнению с односторонним введением.
иммуногенность
Существует риск возникновения иммуногенности при применении препарата Луцентис. Поскольку у пациентов с ДМН возможно увеличение системной экспозиции, в этой популяции пациентов повышен риск развития гиперчувствительности. Пациентов также следует предупредить о необходимости сообщать об увеличении тяжести внутриглазной инфекции, может быть клиническим признаком образования внутриглазных антител.
Одновременное применение с другими препаратами анти VEGF (сосудистый эндотелиальный фактор роста)
Не следует одновременно применять Луцентис с другими препаратами анти-VEGF (сосудистый эндотелиальный фактор роста) (при введении препарата в системный кровоток или глаз).
Приостановление применения препарата Луцентис
Введение препарата можно прекращать и не возобновлять ранее следующего запланированного введения в случае:
- снижение остроты зрения при лучшей коррекции (ГЗНК) на ≥ 30 букв по сравнению с предыдущим обследованием остроты зрения;
- внутриглазного давления ≥ 30 мм рт. в .;
- разрыва сетчатки;
- субретинальном кровоизлияния, который достиг центра ямки сетчатки, или если размер кровоизлияния составляет ≥ 50% общей пораженного участка;
- выполненного или запланированного хирургического вмешательства на глазах в течение 28 дней до или после инъекции.
Разрыв пигментного эпителия сетчатки
Факторы риска, связанные с разрывом пигментного эпителия сетчатки после применения ингибиторов VEGF для лечения экссудативной ВМД, включают широкий и (или) высокое отслаивание пигментного эпителия сетчатки. В начале терапии ЛУЦЕНТИС следует быть осторожным пациентам с факторами риска разрывов пигментного эпителия сетчатки.
Регматогенне отслойка сетчатки или макулярные отверстия
Терапию следует отменить пациентам с регматогенной отслойки сетчатки или макулярной отверстиями 3-4-й степени.
Популяции, опыт применения препарата которым ограничен
Опыт применения у пациентов с ДМН в результате сахарного диабета I типа ограничен.
Луцентис не исследовали при применении пациентам, которым ранее вводились интравитреальные инъекции пациентам с активными системными инфекциями, с пролиферативной диабетической ретинопатией или пациентам с сопутствующими офтальмологическими заболеваниями, такими как отслойка сетчатки или макулярные отверстия. Также нет опыта лечения Луцентис пациентов с диабетом, у которых уровень гликозилированного гемоглобина HbA1c превышает норму более чем на 12%, и с неконтролируемой гипертензией. Врач должен учесть это при лечении таких пациентов.
Существует недостаточно данных, чтобы сделать вывод о действии препарата Луцентис у пациентов с тромбозом вен сетчатки, в которых наблюдается необратимая потеря зрительных функций вследствие ишемии.
Существуют некоторые данные относительно действия препарата Луцентис у пациентов с ПМ, которые не ответили на предыдущую фотодинамической терапии (ФДТ) вертепорфином. Хотя у пациентов с субфовеальнимы и юкстафовеальнимы поражениями наблюдался устойчивый эффект, данных для вывода о действии препарата Луцентис у пациентов с ПМ и екстрафовеальнимы поражениями недостаточно.
Системные эффекты после интравитреального применения
Системные побочные эффекты, в том числе позаочни кровоизлияния и артериальные тромбоэмболические явления, иногда наблюдались после интравитреальных инъекций ингибиторов VEGF.
Недостаточно данных о безопасности лечения пациентов с ДМН, макулярный отек вследствие тромбоза вены сетчатки и ХНВ, что является вторичной по отношению к ПМ, а также пациентов, имеющих в анамнезе инсульт или транзиторные ишемические атаки. При лечении таких пациентов необходимо проявлять осторожность (см. Раздел «Побочные реакции»).
Применение в период беременности или кормления грудью
Исследование применения ранибизумаба в период беременности не проводили, поэтому Ранибизумаб не следует применять в период беременности, за исключением случаев, когда потенциальная польза превышает риск для плода. Исследования на человекообразных обезьянах не свидетельствуют о прямой или опосредованный неблагоприятное влияние на течение беременности или развитие эмбриона / плода. Системная экспозиция ранибизумаба после очного применения низкая, но учитывая механизм действия Ранибизумаб необходимо рассматривать как потенциально тератогенным и эмбрио- / фетотоксического препарат. Женщинам, планирующим беременность и которым вводили Ранибизумаб, рекомендуется, чтобы между последним введением ранибизумаба и зачатием ребенка прошло не менее 3 месяца.
Женщинам репродуктивного возраста необходимо применять эффективные методы контрацепции в течение лечения.
Неизвестно, проникает ли препарат Луцентис в грудное молоко, поэтому кормление грудью не рекомендуется в период лечения.
Данные по фертильности отсутствуют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Лечение препаратом может вызвать временное нарушение зрения, что, в свою очередь, может влиять на способность управлять автотранспортом и другими механизмами (см. Раздел «Побочные реакции»).
Пациентам, отмечали нарушение зрения, не следует управлять автотранспортом и другими механизмами до исчезновения вышеуказанных временных симптомов.
Способ применения Луцентис и дозы
Введение препарата может выполнять только квалифицированный врач-офтальмолог, который имеет опыт проведения интравитреальных инъекций.
Рекомендуемая доза Луцентис 0,5 мг в виде однократной интравитреальное инъекции. Эта доза соответствует объему инъекции 0,05 мл. Интервал между приемами двух доз в один глаз должен составлять не менее 4 недели.
Лечение начинать с одной инъекции в месяц и продолжать, пока не будет достигнута максимальная острота зрения и / или не исчезнут признаки активности заболевания, то есть изменения остроты зрения и другие симптомы заболевания. Пациентам с экссудативной ВМД, ДМН и тромбозом вен сетчатки сначала может потребоваться три или более ежемесячных инъекций подряд.
Таким образом, регулярность мониторинга и интервалы между приемами препарата должен определять врач в зависимости от активности заболевания, оценивается на основе остроты зрения и / или анатомическими параметрами.
Если, по мнению врача, показатели остроты зрения или анатомические параметры указывают на отсутствие пользы от продолжения лечения для пациента, препарат Луцентис следует прекратить.
Мониторинг активности заболевания может включать клиническое обследование, функциональные пробы или визуализационные техники (например оптическую когерентную томографию или флуоресцентную ангиографию).
Если пациенты получают лечение по схеме «treat-and-extend» (лечение и продолжение), после достижения максимальной остроты зрения и / или отсутствии признаков активности заболевания интервалы между приемами препарата можно постепенно увеличивать до рецидива признаков активности заболевания или ухудшения зрения. Интервал между приемами препарата следует удлинять не более чем на две недели за один раз в случае экссудативной ВМД, и можно продолжать максимум на один месяц за один раз в случае ДМН. В случае тромбоза вен сетчатки интервалы между приемами препарата можно постепенно увеличивать, однако имеющиеся данные недостаточны, чтобы сделать окончательные выводы относительно продолжительности этих интервалов. В случае рецидива активности заболевания интервалы между приемами препарата следует соответственно сократить.
Лечение нарушения зрения вследствие ХНВ следует назначать индивидуально для каждого пациента на основании активности заболевания. Некоторые пациенты могут потребовать только одной инъекции в течение первых 12 месяцев другие пациенты могут потребовать более частого введения препарата, включая ежемесячные инъекции. Если лечение проводится по поводу ХНВ, что является вторичной по отношению к патологической миопии, многие пациенты могут потребовать только одной или двух инъекций в течение первого года (см. Раздел «Фармакологические»).
Применение Л уцентису и лазерной фотокоагуляции при ДМН и макулярной отека, вызванном тромбозом вен сетчатки
Был получен небольшой опыт введения препарата Луцентис одновременно с лазерной фотокоагуляции (см. Раздел «Фармакологические»). При применении в один и тот же день Луцентис нужно вводить минимум через 30 минут после лазерной фотокоагуляции. Луцентис можно применять пациентам, которым лазерную фотокоагуляцию проводили раньше.
Применение ЛУЦЕНТИС и фотодинамической терапии вертепорфином при ХНВ, вторичной относительно ПМ
Данных о сопутствующего применения препарата Луцентис и вертепорфином нет.
Информация о применении.
Одноразовый флакон только для интравитреального применения.
Поскольку объем, содержащийся во флаконе (0,23 мл), превышает рекомендованную дозу (0,05 мл), часть объема, содержащийся во флаконе, следует утилизировать к применению.
Перед применением препарат Луцентис нужно визуально проверить на наличие механических частиц или изменение цвета.
Введение препарата проводить в стерильных условиях, которые включают: дезинфекцию рук как при хирургическом вмешательстве, стерильные перчатки и салфетки, стерильный повикорозширювач (или эквивалент), стерильный инструмент для парацентезу (если требуется). Следует внимательно просмотреть аллергологический анамнез пациента перед выполнением интравитреальное инъекции (см. Раздел «Особенности применения»). Нужно продезинфицировать кожу вокруг глаз, веко и поверхность глаза. Соответствующее анестезию и бактерицидное средство широкого спектра действия необходимо определить к проведению инъекции согласно местной практикой.
Иглу для инъекций нужно ввести на 3,5-4 мм позади лимба в стекловидное тело, отклоняясь от горизонтального меридиана и направляя иглу в направлении к центру глазного яблока. Затем ввести 0,05 мл раствора; место прокола склеры нужно менять при последующих инъекциях.
Все компоненты стерильные и предназначены только для одноразового использования. Любой компонент, упаковка которого имеет повреждения или признаки открытия, не следует применять. Стерильность гарантируется только при условии целостности упаковки. Повторное использование может привести к инфицированию или других заболеваний / травм.
Для приготовления и интравитреального введения следует использовать такие медицинские изделия для одноразового применения:
- фильтровальная игла на 5 мкм (18G × 1½ ", 1,2 мм × 40 мм, в комплекте)
- стерильный шприц 1 мл (включая шприц с делением 0,05 мл не входит в упаковку препарата Луцентис)
- игла для инъекций (30G × ½ "; не входит в упаковку препарата Луцентис).
Во время приготовления раствора Луцентис для интравитреального введения следует придерживаться нижеследующей инструкции.
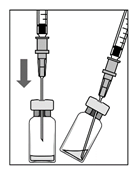
1. Внешнюю часть резиновой пробки продезинфицировать перед забором содержимого флакона.
2. Соединить фильтровальную иглу на 5 мкм (18G × 1½ ", 1,2 мм × 40 мм, 5 мкм) со шприцем 1 мл в асептических условиях. Нажать фильтровальной иглой в центр пробки флакона, пока игла не коснется дна флакона.
3. Убрать весь раствор из флакона, держа его вертикально и немного наклонив для удобства окончания забора.
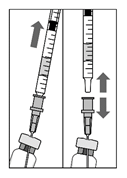
4. Убедиться, что поршень поднят достаточно, а флакон и игла пустые.
5. Оставить фильтровальную иглу во флаконе, отсоединив от нее шприц. Фильтровальную иглу следует утилизировать после забора раствора, ее используют для проведения интравитреальное инъекции.
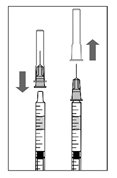
6. В асептических условиях плотно присоединить иглу для инъекции (30G × ½ ", 0,3 мм × 13 мм) к шприцу.
7. Осторожно снять колпачок иглы для инъекции так, чтобы не разъединить иглу со шприцем.
Примечание: снимая колпачок, придерживать за основу иглы.
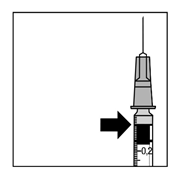
8. Тщательно вытеснить воздух из шприца и отрегулировать дозу на уровне 0,05 мл. Шприц готов для проведения инъекции.
Примечание: не протирать иглу для инъекции. Не тащить поршень назад.
После инъекции иглу не накрывать колпачком снова и не отсоединять ее от шприца. Использованный шприц выбросить вместе с иглой в контейнер для острых и режущих отходов или утилизировать в соответствии с местными требованиями.
Особые популяции пациентов
дисфункция печени
Применение ЛУЦЕНТИС не исследовалась у пациентов с нарушением функции печени. Однако для применения этой популяции никакие особые меры не нужны.
дисфункция почек
Для пациентов с нарушением функции почек коррекция дозы не требуется (см. Раздел «Фармакокинетика»).
Пациенты пожилого возраста
Пациентам пожилого возраста коррекция дозы не требуется. Опыт применения пациентам в возрасте от 75 лет с ДМН ограничен.
Дети
Безопасность и эффективность применения ранибизумаба детям и подросткам (до 18 лет) не установлены, поэтому препарат не применяют этой группе пациентов.
Передозировка
О случайной передозировке сообщалось в ходе клинических исследований экссудативной ВМД и постмаркетинговых исследований. Побочные реакции, чаще всего связаны с передозировкой - это повышение внутриглазного давления, транзиторная слепота, снижение остроты зрения, отек роговицы, боль роговицы и боль в глазу. При передозировке препарата следует проверить внутриглазное давление и провести соответствующее лечение, если врач считает нужным.
Побочные эффекты
Большинство побочных реакций, о которых сообщалось после применения препарата Луцентис, связанные с процедурой интравитреальное инъекции.
Наиболее частые побочные реакции, связанные с процедурой введения препарата, включали: боль в глазу, гиперемия глаза, повышение внутриглазного давления, воспаление стекловидного тела, отслойка стекловидного тела, кровоизлияния в сетчатку глаза, нарушение зрения, плавающие помутнения стекловидного тела, кровоизлияния в кон ' юнктивы, раздражение глаза, ощущение инородного тела в глазу, повышенное слезоотделение, блефарит, сухость глаз, зуд в глазу. Чаще всего сообщалось о таких неофтальмологични явления, как головная боль, ринофарингит и артралгия.
Менее частые, но более тяжелые побочные реакции включали эндофтальмит, слепоту, отслойка сетчатки глаза, разрыв сетчатки глаза и ятрогенную травматическое катаракту (см. Раздел «Особенности применения»).
Необходимо предупредить пациентов о возможных побочных реакций и необходимость обратиться к врачу в случае развития боли в глазу, повышенного дискомфорта в глазу, усиление покраснение глаза, нечеткости или ухудшение зрения, повышение количества маленьких частиц в поле зрения или увеличение чувствительности к свету.
Побочные эффекты, указанные ниже, наблюдались в клинических исследованиях. Побочные эффекты # подано по классам систем органов и частоте возникновения в соответствии с такой классификацией: очень часто (≥ 1/10), часто (от ≥ 1/100 до <1/10), нечасто (от ≥ 1/1000 до <1 / 100), редко (от ≥ 1/10000 до <1/1000), очень редко (<1/10000), неизвестной частоты (невозможно оценить частоту на основе имеющихся данных). В каждой группе по частоте побочные реакции приводятся в порядке убывания их серьезности.
Инфекции и инвазии | |
очень распространены | ринофарингит |
распространены | инфекция мочевых путей * |
Со стороны крови и лимфатической системы | |
распространены | анемия |
Со стороны иммунной системы | |
распространены | гиперчувствительность |
психические расстройства | |
распространены | тревожность |
Со стороны нервной системы | |
очень распространены | головная боль |
Со стороны органов зрения | |
очень распространены | воспаление стекловидного тела, отслойка стекловидного тела, кровоизлияния в сетчатку глаза, нарушение зрения, боль в глазу, плавающие помутнения стекловидного тела, кровоизлияния в конъюнктиву, раздражение глаза, ощущение инородного тела в глазу, повышенное слезоотделение, блефарит, сухость глаз, гиперемия глаза , зуд в глазу |
распространены | дегенерация сетчатки, нарушение функций сетчатки глаза, отслоение сетчатки глаза, разрыв сетчатки, отслойка пигментного эпителия сетчатки, отрыв пигментного эпителия сетчатки, снижение остроты зрения, кровоизлияния в стекловидное тело, нарушение функции стекловидного тела, увеит, ирит, иридоциклит, катаракта, субкапсулярная катаракта, помутнение задней капсулы, точечный кератит, поражения роговицы, воспаление передней камеры глаза, нечеткость зрения, кровоизлияние в месте инъекции, кровоизлияние в глаз, конъюнктивит, аллергический конъюнктивит, выделения из глаза, фотопсия, фотофобия, ощущение дискомфорта в глазу , отек век, боль в веке, гиперемия конъюнктивы |
нечасто | слепота, эндофтальмит, гипопион, гифема, кератопатия, спайки радужки, отложения на роговице, отек роговицы, образование стрий на роговице, боль в месте инъекции, раздражение в месте инъекции, патологическое чувство в глазу, раздражение века |
Со стороны дыхательной системы, органов грудной клетки и средостения | |
распространены | кашель |
Со стороны желудочно-кишечного тракта | |
распространены | тошнота |
Со стороны кожи и подкожных тканей | |
распространены | аллергические реакции (сыпь, крапивница, зуд, эритема) |
Со стороны костно-мышечной системы и соединительной ткани | |
очень распространены | артралгия |
обследование | |
очень распространены | повышение внутриглазного давления |
# Побочные эффекты определяли как нежелательные явления (не менее чем в 0,5% пациентов), которые случались с высокой частотой (не менее чем на 2%) у пациентов, получавших лечение препаратом Луцентис 0,5 мг, по сравнению с теми, кто получал контрольное лечение (плацебо или ФДТ вертепорфином). * Наблюдалось только у пациентов с ДМН. | |
Нежелательные реакции, связанные с классом препарата.
В исследованиях III фазы экссудативной ВМД общая частота неокулярних кровоизлияний, нежелательного явления, потенциально связанного с применением системных ингибиторов VEGF (сосудистого эндотелиального фактора роста), была несколько выше у пациентов, получавших Ранибизумаб.
Однако закономерности среди различных кровоизлияний не было. Существует теоретический риск появления артериальных тромбоэмболических осложнений после интравитреального введение ингибиторов VEGF, включая инсульт и инфаркт миокарда. В клинических исследованиях ЛУЦЕНТИС с участием пациентов с ВМД, ДМН, тромбозом вен сетчатки и ПМ наблюдалась низкая частота появления артериальных тромбоэмболических осложнений и не было существенных различий между группами, получавшими Ранибизумаб и контрольный препарат.
Предоставление сообщений о развитии подозреваемых нежелательных реакций.
Предоставление сообщений о развитии подозреваемых нежелательных реакций после регистрации лекарственного средства является важным. Это позволяет вести непрерывный мониторинг соотношения риск / польза лекарственного средства. Медицинских работников просят сообщать о развитии любых подозреваемых нежелательных реакций через национальную систему предоставления сообщений.
Срок годности Луцентис
3 года.
Условия хранения Луцентис
Хранить в холодильнике (от 2 до 8 ° С). Не замораживать.
Хранить в оригинальной упаковке в недоступном для детей месте.
Перед применением закрыт флакон может храниться при комнатной температуре (25 ° C) в течение до 24 часов.
Несовместимость.
Поскольку исследований несовместимости препарата не проводили, этот препарат нельзя смешивать с другими лекарственными средствами.
Упаковка
По 0,23 мл раствора для инъекций во флаконе № 1 в комплекте с иглой в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Новартис Фарма Штейн АГ /
Новартис Фарма Штейн АГ.
Местонахождение производителя
Шаффхаусерштрассе, 4332 Штейн, Швейцария /
Шаффхаузерштрассе, 4332 Штайн, Швейцария.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Луцентис только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- https://www.novartis.com/ - Новартис Фарма Штейн АГ
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Луцентис |
| Производитель: | Новартис Фарма Штейн АГ |
| Форма выпуска: | раствор для инъекций 10 мг / мл 0,23 мл во флаконе; по 1 флакону в комплекте с иглой в картонной коробке |
| Регистрационное удостоверение: | UA/9924/01/01 |
| Дата начала: | 30.08.2019 |
| Дата окончания: | 30.08.2024 |
| МНН: | Ranibizumab |
| Условия отпуска: | по рецепту |
| Состав: | 1 мл раствора содержит 10 мг ранибизумаба |
| Фармакологическая группа: | Средства, применяемые при сосудистых заболеваниях глаз. Антинеоваскуляризацийни средства. |
| Код АТХ: | S01LA04 |
| Заявитель: | Новартис Фарма АГ |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Лихтштрассе 35, 4056 Базель, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| S | Средства, действующие на органы чувств |
| S01 | Средства, применяемые в офтальмологии |
| S01L | Средства для применения при сосудистого глазных заболеваниях |
| S01LA | Антинеоваскуляризацийни средства |
| S01LA04 | Ранибизумаб |

