- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/16656/01/01, UA/16656/01/02 закончился 26.04.2023
Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) инструкция по применению
Официальная инструкция лекарственного препарата Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) порошок 100 од, 200 од.. Описание и применение Botoks kompleks botulinicheskogo toksina tipa A (ot Clostridium Botulinum), аналоги и отзывы. Инструкция Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) порошок утвержденная компанией производителем.
Состав
действующее вещество : ботулинический токсин типа А (от Clostridium botulinum ).
1 флакон содержит ботулинического токсина типа А (от Clostridium botulinum ) 100 или 200 единиц-Аллерган;
вспомогательные вещества : человеческий альбумин, натрия хлорид.
Лекарственная форма
Порошок для приготовления раствора для инъекций .
Основные физико - химические свойства : порошок белого цвета, который имеет вид тонкого слоя белого осадка на дне флакона, который трудно увидеть.
Фармакологическая группа
Миорелаксанты с периферическим механизмом действия. Ботулинический токсин.
Код ATX М03А Х01.
Фармакологические свойства
Фармакологические .
механизм действия
Ботулинический токсин типа А блокирует периферическое выделение ацетилхолина в пресинаптических холинергических нервных окончаниях путем расщепления SNAP-25, неотъемлемой части связывания и выделения ацетилхолина везикулами, расположенными в нервных окончаниях.
фармакодинамический
После инъекции происходит первичное быстрое связывание токсина поверхностными рецепторами определенных клеток. После этого происходит передача токсина через мембрану плазмы с помощью опосредованного рецепторами эндоцитоза. Затем токсин выделяется в цитозоль. Последний процесс сопровождается постепенным замедлением выделения ацетилхолина, клинические признаки проявляются в течение 2-3 дней, максимальный эффект можно увидеть через 5-6 недель после инъекций. Клинические данные показывают, что препарат БОТОКС® уменьшает боль и нейрогенное воспаление, а также повышает порог болевой чувствительности кожи к теплу в исследовании тройной сенсибилизации, вызванной капсайцина.
Восстановление после инъекции происходит в течение 12 недель, поскольку нервные окончания отрастают и восстанавливают связь с конечной пластинкой. После введения препарата, когда целью является подмышечные потовые железы у пациентов, которым ввели 50 единиц-Аллерган в каждую мышку, эффект после первой инъекции длится в среднем 7,5 месяцев. Однако в 27,5% пациентов эффект наблюдался в течение 1 года и более.
Восстановление симпатических нервных окончаний, иннервирующих потовые железы, после введения препарата препарата не изучалось.
Вследствие внутренней инъекции в детрузор препарат БОТОКС® действует на эфферентные пути деятельности детрузора путем сдерживания высвобождения ацетилхолина. Также препарат БОТОКС® может сдерживать афферентные нейротрансмиттеры и сенсорные пути.
Клиническая эффективность и безопасность .
Неврологические заболевания
Фокусное спастичность верхних конечностей, связанная с перенесенным инсультом
При проведении контролируемых и открытых неконтролируемых исследований доза составляла 200 - 240 единиц-Аллерган, которую разделяли для введения в определенные мышцы запястья и мышцы-сгибатели, на курс лечения. При проведении контролируемых исследований улучшение мышечного тонуса появилось в течение двух недель, а максимальный эффект, как правило, наблюдался в течение 4 - 6 недель. При проведении открытого неконтролируемого удлиненного исследования, большинство пациентов получили повторные введения после интервала 12 - 16 недель, когда воздействие на тонус мышцы уменьшался. Эти пациенты получали до 4 введений с максимальной суммарной дозой 960 единиц-Аллерган в течение 54 недель.
Фокусное спастичность нижних конечностей после перенесенного инсульта.
Эффективность и безопасность препарата БОТОКС® оценивались в рандомизированном мультицентровом двойном слепом плацебо-контролируемом исследовании, в котором приняли участие 468 пациентов после инсульта (233 пациентов в группе БОТОКС® и 235 пациентов в группе плацебо) со спастичностью лодыжки (оценка мышц лодыжки по модифицированной шкале Эшворт (MAS) не ниже 3 баллов), перенесших инсульт не менее чем за 3 месяца до проведения исследования. Препарат БОТОКС® 300 - 400 единиц-Аллерган или плацебо вводились внутримышечно в предусмотренные исследованием места, а именно мышцы gastrocnemius, soleus и tibialis posterior , и в выборочные мышцы, включали flexor hallucis longus, flexor digitorum longus, flexor digitorum brevis, extensor hallucis и rectus femoris .
Первичной контрольной точкой была среднее изменение по шкале оценки мышц лодыжки MAS относительно базового уровня на 4 и 6 неделю, а ключевой вторичной контрольной точкой была среднее изменение по шкале CGI (Оценка врачом реакции) на 4 и 6 неделю. Статистически и клинически достоверная разница была зарегистрирована между препаратом БОТОКС® и плацебо в отношении указанных в таблице 1 показателей.
У пациентов в возрасте ≥65 лет улучшение относительно базового уровня не наблюдалось в группе препарата БОТОКС® по сравнению с группой плацебо в первичной контрольной точке, которой была среднее изменение по шкале оценки мышц лодыжки MAS на 4 и 6 неделю.
Таблица 1.
показатели | БОТОКС® 300 - 400 единиц-Аллерган (Кол-во пациентов = 233) | Плацебо (Кол-во пациентов 235) |
Среднее изменение относительно базового уровня по шкале оценки мышц лодыжки MAS в мышце-сгибатели стопы | ||
Средний показатель на 4 и 6 неделю | -0,8* | -0,6 |
Шкала среднего общего клинического впечатления по оценке исследователей | ||
Средний показатель на 4 и 6 неделю | 0,9* | 0,7 |
Среднее изменение относительно базового уровня по шкале оценки мышц лодыжки MAS в мышце-сгибателя большого пальца ноги | ||
Средний показатель на 4 и 6 неделя для мышцы flexor hallucis longus | -1,02* | -0,6 |
Средний показатель на 4 и 6 неделя для мышцы flexor digitorum longus | -0,88 | - 0,77 |
Среднее изменение относительно базового уровня по шкале оценки мышц лодыжки MAS в мышце-сгибатели стопы у пациентов ≥ 65 лет | N = 60 | N = 64 |
Средний показатель на 4 и 6 неделю | -0,7 | -0,7 |
* Значительно отличается от плацебо (p <0,05)
Другое 3-фазовое двойное слепое плацебо-контролируемое рандомизированное мультицентровое клиническое исследование было проведено с участием взрослых пациентов после перенесенного инсульта (в среднем 6,5 года) со спастичностью нижних конечностей, поразила щиколотку. В общем были выборочно отобраны 120 пациентов для введения препарата БОТОКС® (58 человек) (общая доза - 300 единиц-Аллерган) или плацебо (62 человек). В исследовании принимали участие исключительно представители японской национальности с показателем ≥3 по модифицированной шкале Эшворт (MAS), в которых был инсульт за 6,5 года до проведения исследования.
Значительное улучшение состояния мышц лодыжки по шкале MAS при применении препарата БОТОКС® по сравнению с плацебо наблюдалось в первичной конечной точке относительно базового уровня, рассчитывалось по площади под кривой (AUC), а также во время индивидуальных посещений после инъекции через 4 6 и 8 недель. Доля респондентов (пациенты с улучшением минимум на 1 пункт) также была значительно больше, чем в группе плацебо.
Препарат БОТОКС® был также связан со значительным повышением функциональной дееспособности (вторичная конечная точка, без регулировки кратности) по шкале общего клинического впечатления (CGI) по сравнению с плацебо. Клинически достоверное улучшение по функциям и скоростью хода не было установлено по шкале оценки врача (PRS).
Результаты 3-фазового исследования указанные ниже.
Таблица 2
Первичные и вторичные конечные точки исследования эффективности
показатели | БОТОКС® (58 человек) | Плацебо (62 человека) | p-значение |
Средние показатели AUC по шкале MAS | |||
AUC (от 0 дня до 12 недели) | -8,5 | -5,1 | 0,006 |
Среднее изменение от базового уровня по шкале MAS | |||
базовый уровень | 3,28 | 3,24 | |
1 неделя | -0,61 | -0,52 | 0,222 |
4 неделя | -0,88 | -0,43 | <0,001 |
6 неделя | -0,91 | -0,47 | <0,001 |
8 неделя | -0,82 | -0,43 | <0,001 |
12 неделя | -0,56 | -0,40 | 0,240 |
Доля респондентов * | |||
1 неделя | 52,6% | 38,7% | 0,128 |
4 неделя | 67,9% | 30,6% | <0,001 |
6 неделя | 68,4% | 36,1% | <0,001 |
8 неделя | 66,7% | 32,8% | <0,001 |
12 неделя | 44,4% | 34,4% | 0,272 |
* Пациенты с улучшением минимум на 1 пункт от базового уровня по шкале MAS.
Наблюдалась устойчивая реакция на повторное введение препарата.
Хроническая мигрень .
Препарат БОТОКС® блокирует высвобождение нейротрансмиттеров, связанных с генезом боли. Механизм действия препарата БОТОКС® для ослабления симптомов хронической мигрени до конца не определен. Доклинические и клинические фармакодинамические исследования предполагают, что БОТОКС® подавляет периферическую сенсибилизации, таким образом, возможно, также замедляет основную сенсибилизации.
Основные результаты объединенного анализа эффективности после двух курсов лечения БОТОКС®, введенного с интервалом 12 недель, обнаружены в двух клинических испытаниях фазы 3 у пациентов с хронической мигренью, которые в течение первоначального 28-дневного периода имели не менее 4 эпизода и ≥ 15 дней главного боли (не менее 4:00 непрерывного головной боли) и не менее 50% дней головной боли, считаются днями мигрени / возможной мигрени), приведены в таблице 3.
Таблица 3
Среднее изменение относительно исходного уровня в неделю 24 | БОТОКС® (688 человек) | Плацебо (696 человек) | p-значение |
Количество дней головной боли | -8,4 | -6,6 | р <0,001 |
Количество дней умеренного / сильной головной боли | -7,7 | -5,8 | р <0,001 |
Количество дней мигрени / возможной мигрени | -8,2 | -6,2 | р <0,001 |
% Пациентов с уменьшением на 50% количества дней головной боли | 47 % | 35 % | р <0,001 |
Общая совокупная количество часов головной боли в дни головной боли | -120 | -80 | р <0,001 |
Частота возникновения эпизодов головной боли | -5,2 | -4,9 | p=0,009 |
Общие показатели теста на воздействие головной боли (HIT-6) | -4,8 | -2,4 | р <0,001 |
Хотя исследования не были направлены на определение разницы в подгруппах, можно проследить, что эффект от лечения был меньше в подгруппе пациентов мужского пола (188 человек) но не кавказского типа (137 человек), чем в общей популяции исследования.
Нарушение функции мочевого пузыря
Идиопатическая гиперактивность мочевого пузыря .
Было проведено два рандомизированных двойных слепых плацебо-контролируемых с параллельными группами мультицентровых исследования фазы 3 с участием пациентов с гиперактивным мочевым пузырем с симптомами недержания мочи, ургентного и учащенного мочеиспускания; продолжительность исследования - 24 недели. Было привлечено 1105 пациентов, не имевших достаточного адекватного эффекта от применения хотя бы одного антихолинергического средства (недостаточная реакция на лечение или неприемлемы побочные эффекты). Эти пациенты были рандомизированы в группы для получения препарата БОТОКС®, 100 единиц-Аллерган (557 человек) или плацебо (548 человек).
В обоих исследованиях значительные улучшения по сравнению с плацебо в основной переменной эффективности относительно начального уровня, который определялся частотой эпизодов недержания мочи в течение недели, наблюдались в пользу препарата БОТОКС®, 100 единиц-Аллерган, в основной промежуток эффективности на 12 неделе (5,49 в группе БОТОКС® и 5,39 в группе плацебо), учитывая процент «сухих» пациентов. С помощью шкалы предпочтений лечения было установлено, что в двух исследованиях количество пациентов, которые имели положительную реакцию на лечение (их состояние было определено как «намного улучшилось» или «улучшилось»), была значительно больше в группе, получавшей БОТОКС®, по сравнению с группой плацебо. Также по сравнению с группой плацебо наблюдалось значительное улучшение таких симптомов, как частота мочеиспускания, ургентнисть позывов к мочеиспусканию и ноктурия. Объем мочеиспускания за один акт был также значительно больше. Всего с 2-й недели наблюдалось значительное улучшение у пациентов с симптомами гиперактивного мочевого пузыря.
Лечение препаратом БОТОКС® связано со значительным улучшением по сравнению с группой плацебо по показателям качества жизни, обусловленными состоянием здоровья, были измерены по результатам анкеты качества жизни у пациентов с недержанием мочи (I-QOL), включая поведение уклонения, психологический влияние и социальное смущение, и по результатам анкеты Кинга (KHQ-King's Health Questionnaire), а также включая влияние невоздержание, ограничения роли, ограничения социальной активности, физические ограничения, личных взаимоотношений, эмоций, сна / энергии, измерения тяжести психологической адаптации.
Не было выявлено существенных различий в эффективности после лечения БОТОКС® между пациентами ≥65 лет и пациентами ≤65 лет.
Результаты объединенных базовых исследований указанные в таблице 4.
Таблица 4.
Первичные и вторичные конечные точки в начале исследования и отклонения от исходного уровня в объединенных базовых исследованиях
показатели | БОТОКС® 100 единиц-Аллерган (557 человек) | Плацебо (548 человек) | p-значение |
Частота эпизодов недержания мочи в день * Средний базовый уровень Среднее изменение на 2-й неделе Среднее изменение на 6-й неделе Среднее изменение на 12-й неделе | 5,49 -2,85 -3,11 -2,80 | 5,39 -1,21 -1,22 -0,95 | <0,001 <0,001 <0,001 |
Процент положительного ответа на лечение с применением шкалы предпочтений лечения (%) неделя 2 неделя 6 Неделя 12 а | 64,4 68,1 61,8 | 34,7 32,8 28,0 | <0,001 <0,001 <0,001 |
Частота эпизодов мочеиспускания в день количество Средний базовый уровень Среднее изменение на 2-й неделе Среднее изменение на 6-й неделе Среднее изменение на 12-м b недели | 11,99 -1,53 -2,18 -2,35 | 11,48 -0,78 -0,97 -0,87 | <0,001 <0,001 <0,001 |
Частота неотложных позывов к мочеиспусканию в день количество Средний базовый уровень Среднее изменение на 2-й неделе Среднее изменение на 6-й неделе Среднее изменение на 12-м b недели | 8,82 -2,89 -3,56 -3,30 | 8,31 -1,35 -1,40 -1,23 | <0,001 <0,001 <0,001 |
Показатель качества жизни по результатам анкеты качества жизни у пациентов с недержанием мочи (I-QOL) Средний базовый уровень Среднее изменение на 12-м bc недели | 34,1 +22,5 | 34,7 +6,6 | <0,001 |
Показатель качества жизни по результатам анкеты Кинга ( KHQ - King ' s Health Questionnaire ): Ограничение роли Средний базовый уровень Среднее изменение на 12-м bc недели | 65,4 -25,4 | 61,2 -3,7 | <0,001 |
Показатель качества жизни по результатам анкеты Кинга (KHQ): Ограничения социальной активности Средний базовый уровень Среднее изменение на 12-м bc недели | 44,8 -16,8 | 42,2 -2,5 | <0,001 |
* Процент «сухих» пациентов ( без недержание ) на неделе 12 составил 27,1% в группе препарата БОТОКС® и 8,4% в группе плацебо . Уменьшение случаев недержание на 75% и 50% от базового уровня наблюдалось в 46,0% и 60,5% в группе препарата БОТОКС® по сравнению с 17,7% и 31,0% в группе плацебо соответственно .
a Первичная конечная точка .
b Вторичная конечная точка .
c Предварительно установлена минимальная разница для общего числа (I-QOL) составляла +10 баллов и -5 баллов KHQ.
Средняя продолжительность ответа после лечения БОТОКС®, рассчитанная на основе требования пациентов на проведение повторного лечения, составила 166 дней (около 24 недель).
Средняя продолжительность реакции на препарат, рассчитанная на основе требования пациентов на проведение повторного лечения у пациентов, которые продолжили участвовать в новом открытом расширенном исследовании и получали только БОТОКС®, 100 единиц-Аллерган (438 человек), составила 212 дней (около 30 недель ).
Хотя исследовали лишь ограниченное в количество пациентов <40 лет (88, 8%), не кавказского типа (101 человек, 9,1%), мужчин (135 человек, 12,2%) в двух клинических исследованиях фазы 3, данные этих подгрупп были в пользу положительного эффекта от лечения. У мужчин по сравнению с женщинами чаще наблюдались такие побочные эффекты, как задержка мочи, неполное мочеиспускание, поллакиурия.
Таблица 5
Результаты по первичных конечных точек и изменения относительно базового уровня у мужчин в исследованиях (объединенные базовые исследования)
показатели | БОТОКС® 100 единиц-Аллерган (61 человек) | Плацебо (74 человека) | p-значение |
Частота задержки мочеиспускания в день количество Средний базовый уровень Среднее изменение на 12-й неделе | 5,61 -1,86 | 4,33 -1,23 | 0,612 |
Процент (%) положительного ответа на лечение с применением шкалы предпочтений лечения (пользы от лекарственного средства (ТВ) неделя 12 | 40,7 | 25,4 | 0,060 |
В общем 839 пациентов приняли участие в длительном расширенном открытом исследовании (738 женщин и 81 мужчина). По всем конечными показателями эффективности у пациентов наблюдалось постоянное улучшение во время повторного лечения. В подгруппе с 345 пациентов (316 женщин и 29 мужчин), дошедшие до 12 недели 3-го цикла лечения, среднее снижение частоты недержание мочи в день составило -3,07, -3,49, -3,49 на неделе 12 после первого, второго и третьего лечения БОТОКС®, 100 единиц-Аллерган соответственно. Соответствующий процент пациентов с положительным ответом на лечение по шкале предпочтений лечения составлял 63,6%, 76,9% и 77,3%. В основных клинических исследованиях у одного из 615 пациентов не было выявлено нейтрализующих антител. Во время базовых исследований фазы 3 и открытых расширенных исследований нейтрализующие антитела бело обнаружено в 0 с 954 пациентов (0,0%) при применении препарата БОТОКС®, 100 единиц-Аллерган, и у 3 из 260 пациентов (1,2%) после применения последовательно не менее одной дозы 150 единиц-Аллерган. У одного из этих трех пациентов клиническая польза от применения препарата наблюдалась и в дальнейшем. По сравнению с общим числом пациентов, которым вводили препарат БОТОКС®, у пациентов с выявленными нейтрализующими антителами целом наблюдалась меньшая продолжительность реакции, поэтому препарат им вводился чаще. У одного из этих трех пациентов клиническая польза от применения препарата наблюдалась и в дальнейшем. По сравнению с общим числом пациентов, которым вводили препарат БОТОКС®, у пациентов с выявленными нейтрализующими антителами целом наблюдалась меньшая продолжительность реакции, поэтому препарат им вводился чаще. У одного из этих трех пациентов клиническая польза от применения препарата наблюдалась и в дальнейшем. По сравнению с общим числом пациентов, которым вводили препарат БОТОКС®, у пациентов с выявленными нейтрализующими антителами целом наблюдалась меньшая продолжительность реакции, поэтому препарат им вводился чаще.
Недержание мочи в результате нейрогенной гиперактивности детрузора .
Базовые клинические исследования фазы 3
Было проведено два двойных слепых плацебо-контролируемых рандомизированных мультицентровых клинических исследования фазы 3 с участием пациентов с недержанием мочи вследствие нейрогенной гиперактивности детрузора, в которых наблюдалось или непроизвольное мочеиспускание, или им применяли катетеризацию. Был привлечен 691 пациент с повреждением спинного мозга или рассеянным склерозом; достаточного эффекта от применения хотя бы одного антихолинергического средства участники исследования не имели. Эти пациенты были рандомизированы в группы для получения 200 единиц-Аллерган препарата БОТОКС® (227 человек), 300 единиц-Аллерган препарата БОТОКС® (223 человека) или плацебо (241 человек).
В обоих исследованиях фазы 3 значительные улучшения по сравнению с плацебо в первичном анализе эффективности относительно начального уровня, который определялся частотой эпизодов недержания мочи в течение недели, наблюдались в пользу препарата БОТОКС® (200 единиц-Аллерган и 300 единиц-Аллерган) в промежуточном анализе показателей эффективности на 6-й неделе, учитывая процент «сухих» пациентов. Наблюдались значительные улучшения уродинамических параметров, включая максимальное увеличение цистометричного объема и уменьшение предельного давления детрузора во время первого непроизвольного сокращения. Также наблюдалось значительное улучшение по сравнению с плацебо у пациентов с недержанием мочи по специфическим показателям качества жизни, обусловленными состоянием здоровья, были измерены по результатам анкеты качества жизни у пациентов с недержанием мочи (I-QOL), включая поведение уклонения, психологическое воздействие и социальное смущение. Не было продемонстрировано дополнительных преимуществ 300 единиц-Аллерган по сравнению с 200 единицами-Аллерган препарата БОТОКС®, и более благоприятный профиль безопасности был продемонстрирован применением 200 единиц-Аллерган препарата БОТОКС®.
Результаты объединенных базовых исследований указанные в таблице 6.
Таблица 6
Первичные и вторичные конечные точки и изменения относительно базового уровня
показатели | БОТОКС®, 200 единиц-Аллерган (227 человек) | Плацебо (241 человек) | p-значение |
Недельная частота эпизодов недержания мочи * Средний базовый уровень Среднее изменение на 2-й неделе Среднее изменение на 6-м тижниа среднее изменение на 12-й неделе | 32,4 -17,7 -21,3 -20,6 | 31,5 -9,0 -10,5 -9,9 | р <0,001 р <0,001 р <0,001 |
Максимальная цистометрична способность (мл) Средний базовый уровень Среднее изменение на 6-й неделе b | 250,2 +153,6 | 253,5 +11,9 | р <0,001 |
Максимальное давление детрузора во время первого самопроизвольного сжатия детрузора (cmH20) Средний базовый уровень Среднее изменение на 6-м b недели | 51,5 -32,4 | 47,3 +1,1 | р <0,001 |
Общий показатель качества c, d Средний базовый уровень Среднее изменение на 6-м b недели Среднее изменение на 12-й неделе | 35,37 +25,89 +28,89 | 35,32 +11,15 +8,86 | р <0,001 р <0,001 |
* Процент «сухих» пациентов ( без недержание ) в течение 6 недели составил 37% в группе препарата БОТОКС® , 200 единиц - Аллерган , и 9% в группе плацебо . Доля минимум 75% -го уменьшения относительно базового уровня в случаях недержания мочи составила 63% и 24% соответственно . Доля 50% -го уменьшения относительно базового уровня составляла 76% и39% соответственно .
a Первичная конечная точка .
b Вторичная конечная точка .
c Показатель качества жизни по результатам а нкеты качества жизни у пациентов с недержанием мочи (I-QOL) составляет от 0 баллов ( проблематично ) к 100 баллов ( без проблем ).
d Во время базового исследования предварительно установлена минимальная важная разница (MID) относительно начального уровня для общего показателя I-QOL составляла 8 баллов на основе оценки (MID) и примерно составляет от 4 до 11 баллов для пациентов с нейрогенной гиперактивностью детрузора.
Средняя продолжительность реакции пациентов на препарат в обоих базовых исследованиях, рассчитанная на основе требования пациентов на проведение повторного лечения, составила 256-295 дней (36-42 недель) для группы препарата БОТОКС®, 200 единиц-Аллерган, и 92 дня (13 недель) для группы плацебо. Средняя продолжительность реакции на препарат, рассчитанная на основе требования пациентов на проведение повторного лечения у пациентов, которые продолжили участвовать в новом открытом расширенном исследовании и получали только БОТОКС®, 200 единиц-Аллерган (174 человек), составила 253 дня (~ 36 недель ).
Для всех конечных показателей эффективности у пациентов наблюдалось постоянное улучшение во время повторного лечения.
Во время базовых исследований у одного из общего количества 475 пациентов с нейрогенной гиперактивностью детрузора не было обнаружено нейтрализующих антител. В ходе разработки препарата (в том числе открытого расширенного исследования) нейтрализующие антитела были обнаружены у 3 из 300 пациентов (1,0%) после применения только препарата БОТОКС®, 200 единиц-Аллерган, и у 5 из 258 пациентов (1,9% ) после применения менее одной дозы 300 единиц-Аллерган этого препарата. В четырех из этих восьми пациентов клиническая польза от применения препарата наблюдалась и в дальнейшем. По сравнению с общим числом пациентов, которым вводили препарат БОТОКС®, у пациентов с выявленными нейтрализующими антителами наблюдалась меньшая продолжительность реакции, поэтому препарат им вводили чаще.
пострегистрационных исследования
Пострегистрационных плацебо-контролируемое двойное слепое исследование было проведено с участием пациентов с рассеянным склерозом (РС) и недержанием мочи вследствие нейрогенной гиперактивности детрузора, которые не могли должным образом контролировать эти заболевания с помощью одного антихолинергического средства и которым не осуществлялась катетеризация на базовом уровне. Эти пациенты были рандомизированы в группу БОТОКС®, 100 единиц-Аллерган (66 человек) и группу плацебо (78 человек).
Значительные улучшения по сравнению с плацебо в основной переменной эффективности относительно начального уровня, который определялся частотой эпизодов недержания мочи в течение суток, наблюдались в пользу препарата БОТОКС®, 100 единиц-Аллерган, на 6 неделе, учитывая процент «сухих» пациентов. Также наблюдались значительные улучшения уродинамических показателей и результатов анкеты качества жизни у пациентов с недержанием мочи (I-QOL), включая поведение уклонения, психологическое воздействие и социальное смущение.
Результаты пострегистрационных исследования указано в таблице 7.
Таблица 7
Первичные и вторичные конечные точки и изменения относительно базового уровня в пострегистрационных исследовании применения препарата БОТОКС®, 100 единиц-Аллерган, у пациентов с рассеянным склерозом, которым не осуществлялась катетеризация на базовом уровне
показатели | БОТОКС® 100 единиц-Аллерган (66 человек) | Плацебо (78 человек) | p-значение |
Суточная частота эпизодов недержания мочи * Средний базовый уровень Среднее изменение на 2-й неделе Среднее изменение на 6-м тижниa Среднее изменение на 12-й неделе | 4,2 -2,9 -3,3 -2,8 | 4,3 -1,2 -1,1 -1,1 | р <0,001 р <0,001 р <0,001 |
Максимальная цистометрична способность (мл) Средний базовый уровень Среднее изменение на 6-й неделе b | 24,4 +127,2 | 245,7 -1,8 | р <0,001 |
Максимальное давление детрузора во время первого самопроизвольного сжатия детрузора (cmH20) Средний базовый уровень Среднее изменение на 6-й неделе b | 35,9 -19,6 | 36,1 +3,7 | p=0,007 |
Общий показатель качества жизни при недержании мочи c, d Средний базовый уровень Среднее изменение на 6-й неделе b Среднее изменение на 12-й неделе | 32,4 +40,4 +38,8 | 34,2 +9,9 +7,6 | р <0,001 р <0,001 |
Процент «сухих» пациентов (без недержание) в течение 6 недели составил 53,0% в группе препарата БОТОКС®, 100 единиц-Аллерган, и 10,3% в группе плацебо.
a Первичная конечная точка.
b Вторичная конечная точка.
c Показатель качества жизни по результатам анкеты качества жизни у пациентов с недержанием мочи (I-QOL) составляет от 0 баллов (проблематично) до 100 баллов (без проблем).
d Предварительно установлена минимальная важная разница (MID) для общего показателя I-QOL составила 11 баллов на основе оценки (MID) и примерно составляет от 4 до 11 баллов для пациентов с нейрогенной гиперактивностью детрузора.
Средняя продолжительность реакции на препарат в этом исследовании, рассчитанная на основе требования пациентов на проведение повторного лечения, составила 362 дня (~ 52 недели) для группы препарата БОТОКС®, 100 единиц-Аллерган, и 88 дней (~ 13 недель) для группы плацебо.
Расстройства кожи и подкожной клетчатки
Первичный гипергидроз подмышечных впадин .
Двойное слепое клиническое мультицентровое исследование проводилось с участием пациентов с устойчивым двусторонним первичным подмышечным гипергидрозом, в которых, по данным гравиметрических измерений, в каждой подмышке в спокойном состоянии невольно выделялось не менее 50 мг пота за 5 мин при комнатной температуре. 320 пациентов были рандомизированы в две группы, одна из которых получала 50 единиц-Аллерган препарата (242 человека), а вторая (78 человек) - плацебо. Пациенты продемонстрировали уменьшение подмышечных потение по сравнению с исходными данными на 50%. За 4 недели после инъекции этот процент составлял в группе (первичная конечная точка), которая получала препарат, 93,8% по сравнению с группой плацебо, где этот процент составлял 35,9% (р <0,001). Процент респондентов в группе пациентов, которым вводили БОТОКС®, продолжал быть значительно выше (р <0,001), чем в группе плацебо,
Дальнейшее открытое исследование зарегистрировало 207 пациентов, которые прошли в 3 курсов лечения. Доля клинической реакции на 16-й неделе после первой (287 человек), второй (123 человека) и третьей (30 человек) инъекции составляла 85,0%, 86,2% и 80% соответственно.
Средняя продолжительность эффекта, определенная на основании комбинированного однодозового и открытого длительного испытания, составляла 7,5 месяца после первого курса, однако для 27,5% пациентов продолжительность эффекта составила 1 год и более.
Имеющийся небольшой опыт клинических исследований применения препарата БОТОКС® детям в возрасте от 12 до 18 лет с первоначальным гипергидрозом подмышечных впадин. В США проведено единовременное годовалого неконтролируемое с повторяющейся дозой исследования по безопасности с участием педиатрических пациентов в возрасте от 12 до 17 лет (144 человека) с сильным первичным гипергидрозом подмышечных впадин. Участниками были преимущественно женщины (86,1%) и пациенты кавказского типа (82,6%). Участницы получили лечение в дозе 50 единиц-Аллерган в каждую подмышечную впадину с общей дозой 100 единиц-Аллерган за весь период лечения. Однако никаких исследований по определению дозы для подростков не было проведено, таким образом, никаких рекомендаций относительно дозирования не может быть предоставлено. Эффективность и безопасность применения препарата БОТОКС® для данной группы не были окончательно установлены.
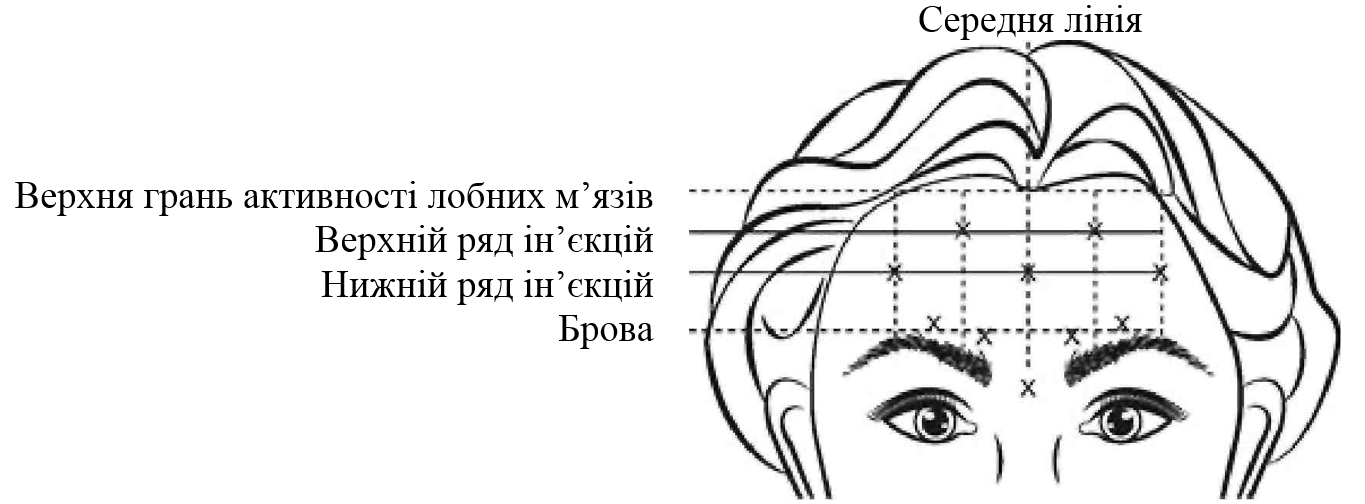
Вертикальные морщины между бровями ( глабелярни морщины ).
В клиническом исследовании пациентам (537 человек) с вертикальными морщинами между бровями (глабелярнимы морщинами) (от умеренно до значительно выраженных) при максимальном насупленни инъекции препарата значительно уменьшили выраженность таких морщин на срок до 4 месяцев, было определено специальной оценке выраженности глабелярних морщин при максимальном насупленни и общей самооценкой изменений своего внешнего вида. Никакие клинические показатели не включали объективной оценки психологического воздействия. Через 30 дней после инъекции препарата 80% пациентов (325 из 405 человек) ответили на лечение (полное отсутствие или незначительная выраженность при максимальном насупленни) по сравнению с 3% пациентов (4 из 132 человек), получили плацебо. В то же время 89% пациентов (362 из 405 человек), прошедших лечение препаратом,
Инъекции препарата БОТОКС® также значительно уменьшили выраженность глабелярних морщин в состоянии покоя. 39% пациентов (210 из 537 человек) имели глабелярни морщины от умеренных до значительных в состоянии покоя (15% не имели морщин в состоянии покоя). Из них 74% пациентов (119 из 161 человека), прошедших лечение препаратом БОТОКС®, ответивших на лечение (полное отсутствие или незначительная выраженность) через 30 дней после инъекции по сравнению с 20% пациентов (10 из 49 человек) группы плацебо.
Имеющиеся ограниченные клинические данные фазы 3 по применению препарата БОТОКС® пациентам в возрасте старше 65 лет (6% субъектов (32 из 537). Эффективность препарата была меньше для этой возрастной группы.
Морщины в форме « гусиных лапок »
В исследовании приняли участие 1362 пациентов с умеренной и тяжелой формой морщин в форме «гусиных лапок» при широкой улыбке (445 человек, исследования № 191622-098) или также с умеренной и тяжелой формой глабелярних морщин, при максимальном насупленни (917 человек, исследования № 191622-099).
Инъекции препарата БОТОКС® значительно уменьшили тяжесть морщин в форме «гусиных лапок» при широкой улыбке по сравнению с плацебо во всех контрольных точках (р <0,001) на срок до 5 месяцев. Это было определено по доле пациентов, у которых морщины отсутствовали или были средней тяжести по шкале оценки выраженности морщин в форме «гусиных лапок» при широкой улыбке при проведении 2 базовых исследований: до 150 дня (завершение исследования) в исследовании № 191622-098 и на 120 день (завершение первого цикла лечения в исследовании № 191622-099). При оценке как исследователем, так и пациентом, на базовом уровне соотношение пациентов без морщин или морщин средней тяжести по шкале оценки выраженности морщин в форме «гусиных лапок» при широкой улыбке было в пользу пациентов с умеренной тяжестью таких морщин по сравнению с пациентами с тяжелой формой таких морщин. В таблице 7 приведены результаты на 30 день, первичная контрольная точка оценки эффективности.
В исследовании № 191622-104 (дополнение к Исследования №191622-099) 101 пациент, предварительно отобран в группу плацебо, был отобран для первой инъекции 44 единиц-Аллерган. Пациенты группы введения препарата БОТОКС® имели статистически значительное преимущество на первичной контрольной точке оценки эффективности по сравнению с пациентами группы плацебо на 30 день после инъекции. Скорость реакции была схожей с группой введение 44 единиц-Аллерган на 30 день после первой инъекции в исследовании №191622-099. Всего 123 пациентов прошли 4 курса введение 44 единиц-Аллерган препарата БОТОКС® в комбинированном лечении морщин в форме «гусиных лапок» и глабелярних морщин.
Таблица 8
30-й день: Оценка исследователем и пациентом морщин в форме «гусиных лапок» при широкой улыбке - соотношение респондентов (% пациентов без морщин или с морщинами средней тяжести в форме «гусиных лапок»)
клиническое исследование | Доза | БОТОКС® | Плацебо | БОТОКС® | Плацебо |
оценка исследователем | оценка пациентом | ||||
191622-098 | 24 единицы-Аллерган | 66,7%* (148/222) | 6,7% (15/223) | 58,1%* (129/222) | 5,4% (12/223) |
191622-099 | 24 единицы-Аллерган | 54,9%* (168/306) | 3,3% (10/306) | 45,8%* (140/306) | 3,3% (10/306) |
44 единицы-Аллерган | 59,0%* (180/305) | 3,3% (10/306) | 48,5%* (148/305) | 3,3% (10/306) | |
* P <0,001 (БОТОКС® сравнению с плацебо)
По оценке пациентов улучшение относительно базового уровня вида морщин в форме «гусиных лапок» при широкой улыбке в группе БОТОКС® (24 единицы-Аллерган и 44 единицы-Аллерган) по сравнению с плацебо наблюдалось на 30 день, а также во всех контрольных точках после каждого курса лечения в обеих базовых исследованиях (р <0,001).
Лечение препаратом БОТОКС® (24 единицы-Аллерган) также значительно ослабило степень тяжести морщин в форме «гусиных лапок» в состоянии покоя. 63% пациентов (330 из 528 человек) имели умеренную или тяжелую степень морщин в форме «гусиных лапок» в состоянии покоя в начале исследования. Из них у 58% пациентов (192 из 330 человек) группы БОТОКС® наблюдалась положительная реакция на лечение (Нет морщин или имеющиеся морщины средней тяжести) через тридцать дней после инъекции по сравнению с 11 пациентов% (39 из 352 человек) в группе плацебо.
По шкале самостоятельной оценки морщин (FLO-11) на первой контрольной точке (30 день) (р <0,001) и на всех последующих контрольных точках в обоих базовых исследованиях, улучшение самооценки и привлекательности также наблюдались в группе БОТОКС® (24 единицы-Аллерган и 44 единицы-Аллерган) по сравнению с плацебо.
В базовых исследованиях 3,9% пациентов (53 из 1362 человек) были старше 65 лет. Ответ на лечение пациентов этой возрастной группы оценивалась исследователем и наблюдалась у 36% пациентов (на 30-й день) группы БОТОКС® (24 единицы-Аллерган и 44 единицы-Аллерган). При анализе в группах по возрасту (≤50 лет и> 50 лет) обе группы продемонстрировали статистически значительное улучшение по сравнению с плацебо. Ответ на лечение в группе БОТОКС® 24 единиц-Аллерган, по оценке исследователя, была меньше у пациентов в возрасте> 50 лет, чем у пациентов в возрасте ≤50 лет (42,0% и 71,2% соответственно).
В целом ответ на препарат БОТОКС® для лечения морщин в форме «гусиных лапок» при широкой улыбке была меньше (60%), чем при лечении глабелярних морщин при максимальном насупленни (80%).
В 916 пациентов (517 пациентов в группе введения 24 единиц-Аллерган и 399 пациентов в группе введения 44 единиц-Аллерган), которым применяли Ботокс ® , были взяты образцы для анализа на образование антител. Ни у одного из пациентов не было выявлено нейтрализующих антител.
Морщины на лбу
В исследовании приняли участие 822 пациентов с умеренной или тяжелой формой морщин на лбу и глабелярних морщин при максимальном насупленни, отдельно (254 пациенты, исследования 191622-142) или с умеренной или тяжелой формой морщин в форме «гусиных лапок» при максимальной улыбке (568 пациентов , исследования 191622-143). Они были включены в основную группу пациентов для анализа первичных и вторичных точек оценки эффективности. В клинических исследованиях коррекцию морщин на лбу выполняли одновременно с коррекцией глабелярних морщин.
По оценке исследователей и пациентов процент пациентов с отсутствием или умеренной выраженности морщин на лбу при максимальном подъеме бровей после инъекции препарата Ботокс ® был выше, чем после применения плацебо, на 30-й день, первичная точка оценки эффективности (таблица 9). Ниже также приведены соотношение пациентов с уменьшением на 1 балл выраженности морщин на лбу в состоянии покоя по сравнению с началом исследования и пациентов с отсутствием или умеренной выраженности морщин в верхней части лица при максимальном насупленни.
Таблица 9
30-й день: Оценка исследователями и пациентами выраженности морщин на лбу и морщин в верхней части лица при максимальном насупленни и в состоянии покоя
клиническое исследование | Точка оценки эффективности | БОТОКС® | Плацебо | БОТОКС® | Плацебо |
оценка исследователями | оценка пациентами | ||||
исследование 191622-142 40 единиц-Аллерган (20 единиц-Аллерган морщины на лбу + 20 единиц-Аллерган глабелярни морщины) | Морщины на лбу при максимальном сокращении мьязивa | 94,8% (184/194) | 1,7% (1/60) | 87,6% (170/194) | 0,0% (0/60) |
P <0,0005 | P <0,0005 | ||||
Морщины на лбу состоянии спокоюb | 86,2% (162/188) | 22,4% (13/58) | 89,7% (174/194) | 10,2% (6/59) | |
P <0,0001 | P <0,0001 | ||||
исследование 191622-143 40 единиц-Аллерган (20 единиц-Аллерган морщины на лбу + 20 единиц-Аллерган глабелярни морщины) | Морщины на лбу при максимальном сокращении мьязивa | 90,5% (201/222) | 2,7% (3/111) | 81,5% (181/222) | 3,6% (4/111) |
P <0,0005 | P <0,0005 | ||||
Морщины на лбу состоянии спокоюb | 84,1% (185/220) | 15,9% (17/107) | 83,6% (184/220) | 17,4% (19/109) | |
р <0,0001 | р <0,0001 | ||||
исследование 191622-143 64 единиц-Аллерган (20 единиц-Аллерган морщины на лбу + 20 единиц-Аллерган глабелярни морщины + 24 единиц-Аллерган морщины в форме «гусиных лапок») | Морщины на лбу при максимальном сокращении мьязивa | 93,6% (220/235) | 2,7% (3/111) | 88,9% (209/235) | 3,6% (4/111) |
р <0,0005 | р <0,0005 | ||||
Морщины в верхней части лица при максимальном сокращении мьязивc | 56,6% (133/235) | 0,9% (1/111) | данные отсутствуют | ||
P <0,0001 | |||||
a Процент п ациентив с отсутствием или умеренной выраженности морщин на лбу при максимальном подъеме бровей.
b Процент п ациентив с уменьшением на 1 балл выраженности морщин на лбу в состоянии покоя по сравнению с началом исследования.
c Процент п ациентив с реакцией на препарат, определенных как те же пациенты с отсутствием или умеренной выраженности морщин на лбу, глабелярних морщин и морщин в форме «гусиных лапок» для каждой зоны на лице при максимальном насупленни.
Инъекции препарата БОТОКС® значительно уменьшили выраженность морщин на лбу при максимальном подъеме бровей сравнению с плацебо сроком до 6 месяцев (p <0,05): оценивалось по проценту пациентов с отсутствием или умеренной выраженности морщин на лбу при максимальном подъеме бровей в обоих базовых исследованиях; до 150 дня в исследовании 191622-142 (21,6% после инъекции препарата БОТОКС® по сравнению с 0% после плацебо) и до 180 дня в исследовании 191622-143 (6,8% после инъекции препарата БОТОКС® сравнению с 0% после плацебо).
При одновременном введении препарата во все 3 зоны в исследовании 191622-143 (группа БОТОКС®, 64 единицы-Аллерган) инъекции препарата БОТОКС® значительно уменьшили выраженность глабелярних морщин сроком до 6 месяцев (5,5% после инъекции препарата БОТОКС® по сравнению с 0% после плацебо), латеральных морщин в углу глаза сроком до 6 месяцев (3,4% после инъекции препарата БОТОКС® по сравнению с 0% после плацебо) и морщин на лбу сроком до 6 месяцев (9,4% после инъекции препарата БОТОКС® по сравнению с 0% после плацебо).
Всего в течение 1 года 116 и 150 пациентов получили 3 курса инъекций препарата БОТОКС® по 40 единиц-Аллерган (20 единиц-Аллерган при морщинах на лбу и 20 единиц-Аллерган при глабелярних морщинах) и 64 единицы-Аллерган (20 единиц-Аллерган при морщинах на лбу, 20 единиц-Аллерган при глабелярних морщинах и 24 единицы-Аллерган при морщинах в форме «гусиных лапок»), соответственно. Показатели улучшения реакции на препарат для морщин на лбу были похожими во время всех курсов инъекций.
По шкале самостоятельной оценки морщин (FLO-11) улучшение самовосприятие пациентами морщин на лбу, внешнего вида для своего возраста и привлекательности было достоверно (p <0,001) больше у пациентов после инъекции препарата БОТОКС® в дозе 40 единиц-Аллерган (20 единиц-Аллерган при морщинах на лбу и 20 единиц-Аллерган при глабелярних морщинах) и 64 единиц-Аллерган (20 единиц-Аллерган при морщинах на лбу, 20 единиц-Аллерган при глабелярних морщинах и 24 единицы-Аллерган при морщинах в форме «гусиных лапок ») по сравнению с плацебо в первичной точке оценки эффективности на 30-й день в исследованиях 191622-142 и 191622-143.
Согласно шкале удовольствие морщинами на лице (FLSQ), в 78,1% (150 из 192) пациентов в исследовании 191622-142 и 62,7% (138 из 220) в исследовании 191622-143 наблюдалось улучшение самоощущение и эмоционального состояния (по таким показателям, как плохой внешний вид для своего возраста, самоощущение, усталость вида, чувства себя несчастным, раздраженный вид) после инъекции препарата БОТОКС® 40 в дозе единиц-Аллерган (20 единиц-Аллерган при морщинах на лбу и 20 одиниць- Аллерган при глабелярних морщинах) по сравнению с пациентами после инъекции плацебо 19,0% (11 из 58) в исследовании 191622-142 и 18,9% (21 из 111) в исследовании 191622-143 на 30 день (p <0, 0001 в обоих исследованиях).
Согласно этой же шкале, 90,2% (174 из 193) пациентов в исследовании 191622-142 и 79,2% (175 из 221, 40 единиц-Аллерган) или 86,4% (203 из 235, 64 единицы-Аллерган ) в исследовании 191622-143 сообщили о том, что они были очень довольны / в основном довольны после инъекции препарата БОТОКС® в дозе 40 единиц-Аллерган или 64 единицы-Аллерган сравнению с пациентами после инъекции плацебо (1,7% [ 1 из 58], 3,6% [4 из 110] в исследовании 191622-142 и исследовании 191622-143 соответственно), в первичной точке оценки на 60 день по шкале FLSQ
(P <0,0001 в обоих исследованиях).
В базовых исследованиях 3,7% (22 из 587) пациентов были старше 65 лет. По оценке исследователей реакция на препарат в этой возрастной группе наблюдалась в 86,7% (13 из 15) (на 30-й день) после инъекции препарата БОТОКС® по сравнению с 28,6% (2 из 7) пациентов после инъ инъекции плацебо. Реакция на препарат в группе БОТОКС® была подобна реакции у пациентов с общей группы, но статистическая достоверность не была достигнута и трудно сделать сравнение с плацебо учитывая малое количество пациентов.
Фармакокинетика .
Общие свойства действующего вещества
Исследования распределения, проведенные на животных, показали медленную диффузию 125И-комплекса нейротоксина ботулина А в икроножную мышцу после инъекции, затем быстрый системный метаболизм и выделение с мочой. Количество меченого изотопом материала в мышце уменьшалось с периодом полувыведения около 10:00. В месте инъекции радиоактивность была ограничена большими молекулами протеина, а в плазме - малыми молекулами, свидетельствует о скором системный метаболизм субстрата. В течение 24 часов после введения дозы 60% радиоактивности было выведено с мочой. Токсин, вероятно, метаболизируется протеазами и молекулярными компонентами, которые рециркулируют обычными путями метаболизма.
Классические исследования абсорбции, распределения, биотрансформации и выведения активной субстанции не проводились из природу этого препарата.
Свойства при применении у пациентов
Считается, что происходит незначительное системное всасывание препарата БОТОКС® при применении в терапевтических дозах. Клинические исследования с использованием моноволоконнои электромиографического техники показали увеличение электрофизиологических нервно-мышечной активности в мышцах, удаленных от места инъекции, без каких-либо клинических симптомов.
Доклинические данные по безопасности
исследования репродуктивности
Когда беременным животным вводили внутримышечно Ботокс ® в течение периода органогенеза, показатели по шкале NOAEL (доза , при которой не наблюдается побочная реакция) составили 4 - 0,125 единиц / кг. Сообщалось о более высокие дозы, связанные с уменьшением массы тела плод а и / или замедленной осификациею и выкидышами у кроликов.
Фертильность и репродуктивность
Относительно репродуктивной функции при введении препарата Ботокс ® токсическим была доза 4 единицы-Аллерган / кг для самцов крыс и 8 единиц / кг для самок крыс. Повышенные дозы были связаны с задержкой фертильности пропорционально к увеличению я доз. Хотя бывали случаи наступления оплодотворения, ни побочной реакции относительно количества или живучести эмбрионов не обнаружено.
другие исследования
Дополнительно к исследованию репродуктивной Токси чности проводились такие доклинические исследования безопасности препарата Ботокс ® : острая токсичность, токсичность повторной инъекции, местная переносимость, мутагенность, антигенность, совместимость с кровью человека. Эти исследования не выявили значительной угрозы для человека при применении в соответствующих клинических дозах. Максимальная рекомендованная доза для человека на один курс лечения составляет 300 единиц-Аллерган (что соответствует 6 единицам-Аллерган / кг для лица с массой тела 50 кг). Зарегистрировано внутримышечная летальная доза LD -50 в животных составляет 39 единиц-Аллерган / кг.
Системная токсичность не отмечено во время одноразовой внутришньодетрузорнои инъекции <50 единиц-Аллерган / кг препарата Ботокс ® в животных . Через 9 месяцев интрадетрузорного исследования повторной дозы (4 инъекции) наблюдался птоз при дозе 24 единицы-Аллерган / кг и летальные случаи при дозе 24 единицы-Аллерган / кг и больше. Дегенерация / регенерация миофибры наблюдалась в скелетной мышце животных при дозе 24 единиц-Аллерган / кг и больше. Эти миопатические изменения считаются вторичными эффектами системного воздействия. Доза в 12 единиц-Аллерган / кг превышает в три раза клинически рекомендованную дозу препарата Ботокс ® в 200 единиц-Аллерган для недержание мочи в результате нейрогенной гиперактивности детрузора (дляпациента с массой тела 50 кг).
Клинические характеристики
Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) Показания
Лечение неврологических расстройств:
• фокусное спастичность , это связано с динамической деформацией стопы в результате спастичности , у детей в возрасте от двух лет , находящихся на амбулаторном лечении церебрального паралича ;
• фокусное спастичность запястья и руки у взрослых пациентов после перенесенного инсульта ;
• фокусное спастичность лодыжки и стопы у взрослых пациентов после перенесенного инсульта (см. «Особые меры безопасности» ) ;
• блефароспазм, гемифациальный спазм и эт ' связанных а с ними фокальной а дистонии я ;
• цервикальная дистония (спастическая кривошея ) ;
• ослабление симптомов хронической мигрени (головные боли в течение ≥15 дней в месяц, из которых по крайней мере 8 дней с мигренью) в взрослых пациентов с ненадлежащей реакцией или непереносимостью профилактических средств против мигрени (см. « Особые меры безопасности » ).
Л икування нарушений функций мочевого пузыря :
• идиопатическая гиперактивность мочевого пузыря и с симптомами недержания мочи, ургентного мочеиспускания и повышенной частоты мочеиспусканий у взрослых, недостаточно реагируют или не переносят антихолинергические лекарственные средства ;
• недержание мочи у взрослых пациентов с нейрогенной гиперактивностью детрузора при нейрогенному мочевом пузыре, является следствием устойчивого повреждения суб-цервикального (шейного) отдела спинного мозга или рассеянного склероза .
Лечение расстройств функции кожи и смежных с ней органов:
- стойка, тяжелая форма первичного гипергидроза подмышечных впадин , что препятствует социализации и не поддается местному лечению;
- для временного улучшения внешнего вида, когда резкая выраженность нижеуказанных морщин имеет сильное психологическое воздействие на взрослого пациента в возрасте до 65 лет:
- вертикальные морщины между бровями (от умеренных до значительно выраженных) при максимальном насупленни (глабелярни морщины) и / или
- умеренная или тяжелая форма латеральных морщин в углу глаза (морщины в форме «гусиных лапок») при широкой улыбке и / или
- умеренная или тяжелая форма морщин на лбу при максимальном подъеме бровей.
Противопоказания
- Гиперчувствительность к ботулинического токсина типа А или любого другого компонента препарата
- миастения гравис или синдромом Итона-Ламберта (для устранения вертикальных морщин между бровями (глабелярни морщины) у детей (в возрасте до 18 лет) и пациентов пожилого возраста (старше 65 лет);
- имеющийся инфекционный процесс в месте запланированной инъекции.
Нарушение функции мочевого пузыря:
- имеется на момент лечения инфекция мочевыводящих путей
- острая задержка мочеиспускания на момент лечения у пациентов, не применяют катетеризацию на регулярной основе;
- у пациентов, которые не хотят и / или не в состоянии инициировать катетеризацию после лечения, если необходимо;
- наличие камней в мочевом пузыре.
Особые меры безопасности .
Единицы токсина ботулина одного препарата не является взаимозаменяемыми с единицами другого препарата . Дозы, рекомендуемые в единицах-Аллерган, отличные от доз других ботулотоксичних препаратов.
Следует соблюдать особые меры безопасности во время приготовления и введения препарата, а также при инактивации и утилизации остатков неиспользованного раствора.
Рекомендуемые дозы и частота введения препарата БОТОКС® не должны превышаться, поскольку существует риск передозировки, чрезмерной мышечной слабости, распространение токсина дальше от места введения и формирования нейтрализующих антител. Лечение пациентов, которым не вводился препарат ранее, нужно начинать с низкой рекомендованной дозы для конкретного показания.
Врачам и пациентам необходимо осознавать, что побочные эффекты могут возникнуть, несмотря на хорошо перенесены предыдущие инъекции. Поэтому каждую инъекцию необходимо проводить с осторожностью. Флакон с препаратом предназначен только для одноразового использования, а любое количество неиспользованного раствора необходимо утилизировать.
Сообщалось о побочных реакциях, касающиеся распространения токсина далеко от места инъекции и которые иногда были летальными, а в некоторых случаях сопровождалось дисфагией, пневмонией и / или значительным упадком сил. Симптомы соответствуют механизма действия ботулинического токсина и регистрировались через несколько часов или несколько недель после инъекции. Риск возникновения побочных реакций, вероятно, является самым у пациентов с основными и сопутствующими заболеваниями, обусловливающие возникновение таких симптомов, в том числе у детей и взрослых, которые лечат спастичность и каким вводят высокие дозы.
Пациенты, получавшие терапевтические дозы, могут чувствовать повышенную слабость мышц.
Необходимо учитывать соотношение риска и пользы для каждого отдельного пациента, прежде чем начинать лечение препаратом БОТОКС®.
О дисфагию также сообщалось после инъекций за пределами цервикального отдела.
Препарат БОТОКС® следует применять с осторожностью и под тщательным медицинским наблюдением пациентам с субклиническими и клиническими признаками нарушения нервно-мышечной передачи (например, с миастенией гравис или синдромом Итона-Ламберта), с поражением периферических двигательных нейронов (например с боковым амиотрофическим склерозом или двигательной нейропатии) или с сопутствующими неврологическими заболеваниями. Такие пациенты могут иметь повышенную чувствительность к препарату БОТОКС® даже в терапевтических дозах, может привести к чрезмерной слабости мышц и повышенного риска клинически выраженных системных воздействий, включая тяжелую дисфагию и дыхательную недостаточность.
Трудности глотания и дыхания является тяжелыми побочными реакциями и могут привести к смерти.
Таким пациентам токсин ботулина необходимо применять под наблюдением специалиста и только тогда, когда преимущества от лечения значительно превышают риск. Пациентов с дисфагией и аспирацией в анамнезе нужно лечить особенно осторожно.
Пациенты и лица, надзирающих за ними, должны знать, что в случае возникновения нарушений глотания, речи или дыхания необходимо немедленно обратиться за медицинской помощью.
Как и при любом лечении, что позволяет восстановить активность малоподвижных пациентов, такое восстановление в этой категории пациентов должно происходить постепенно.
Особенности анатомии пациента и любые изменения в ней через предыдущие хирургические вмешательства необходимо изучить к применению препарата БОТОКС® и избегать инъекций в уязвимые анатомические структуры.
Сообщалось о пневмоторакс, связанный с процедурой инъекции, после введения препарата БОТОКС® в область торакального отдела. С осторожностью применять вблизи легких, особенно верхней части легких.
Серьезные побочные реакции, в том числе летальные случаи были зафиксированы у пациентов, которым вводили инъекции препарата БОТОКС® не по показаниям: непосредственно в слюнных железах, орально-языково-глоточную участок, пищевод и желудок. У некоторых пациентов предварительно были дисфагия и значительная слабость.
Поступали сообщения о единичных случаях тяжелых реакций гиперчувствительности немедленного типа, включая анафилаксии, сывороточную болезнь, крапивницу, отек мягких тканей и одышка. О некоторых из этих реакций сообщалось после применения препарата БОТОКС® отдельно или вместе с другими препаратами, которые ассоциируются с аналогичными реакциями. При возникновении такой реакции дальнейшие инъекции препарата БОТОКС® нужно отменить и немедленно применить соответствующую терапию, например, эпинефрином. Зафиксирован летальный исход вследствие анафилактического шока в результате нарушения инструкции по восстановлению препарата БОТОКС®, при использовании в качестве растворителя 5 мл 1% раствора лидокаина.
Как и при любых инъекциях, могут возникнуть травмы, связанные непосредственно с самой процедурой введения. Инъекция может привести к локальному инфицирования, боли, воспаления, парестезии, гипостезии, болезненности, припухлости, эритемы и / или кровотечения / синяков. Боль, вызванная иглой, и / или страх могут привести к вазовагальных реакций, например артериальной гипотензии, обмороки.
Следует с осторожностью применять препарат БОТОКС® при наличии воспаления в месте запланированной инъекции или слабости или атрофии мышцы, в который планируется инъекция. Препарат БОТОКС® следует применять с осторожностью при лечении пациентов с поражением периферических двигательных нейронов (например с боковым амиотрофическим склерозом или двигательной нейропатии).
Сообщалось также о случаях побочных реакций со стороны сердечно-сосудистой системы, в частности аритмии и инфаркта миокарда, в т.ч. летальных. Некоторые из этих побочных реакций развивались у пациентов с факторами риска сердечно-сосудистых заболеваний.
Новые или повторе нападения регистрировались, как правило, у предрасположенных к этим заболеваниям пациентов. Точный взаимосвязь этих заболеваний с инъекциями ботулинического токсина не установлен. Сообщение о возникновении побочных реакций у детей регистрировались в основном у пациентов с церебральным параличом, прошедших курс лечения спастичности.
Появление антител, нейтрализующих токсин ботулина типа А, может снизить эффективность лечения БОТОКС® через инактивування биологической активности токсина.
Результаты некоторых исследований показывают, что инъекции препарата БОТОКС® через небольшие интервалы времени или в высоких дозах могут привести к большему количеству случаев появления антител. В случае необходимости возможность формирования антител может быть минимизирована путем введения наименьшей эффективной дозы с крупнейшими клинически показанными интервалами между инъекциями.
Клинические отклонения во время повторного применения препарата БОТОКС® (как и всех токсинов ботулина) могут зависеть от разных процедур при растворении содержимого флакона, от интервалов между инъекциями, различных мышц, в которые вводится препарат и незначительной разнице в значениях активности, которую показал использован метод биологического тестирования.
Неврологические заболевания
Фокусное спастичность , связанная с детским церебральным параличом , и фокусное спастичность руки и запястья , лодыжки и стопы у взрослых пациентов после инсульта .
Лечение фокальной спастичности, которое находится на стадии изучения в обычных стандартных схемах лечения и не предназначено для замены существующих способов лечения, вероятно, не будет эффективным для увеличения границ подвижности в суставах, пораженных контрактурой.
Препарат не следует применять для лечения спастичности лодыжки у пациентов пожилого возраста, перенесших инсульт, если снижение мышечного тонуса не приведет к улучшению функции (например улучшение походки) или к ослаблении симптомов (например уменьшение боли). Улучшение активной функции может быть ограниченным, если лечение препаратом началось позже чем через 2 года после инсульта у пациентов с низкой степенью спастичности лодыжки (с показателем <3 по модифицированной шкале Эшворт (MAS)).
Следует с осторожностью применять при лечении взрослых пациентов со спастичностью после перенесенного инсульта, которые относятся к группе повышенного риска внезапной слабости.
БОТОКС® следует применять с осторожностью у фокальной спастичности лодыжки у пациентов пожилого возраста, перенесших инсульт с тяжелыми сопутствующими заболеваниями, и только при условии, что польза от лечения превышает потенциальный риск.
БОТОКС® следует применять для лечения спастичности нижних конечностей после перенесенного инсульта только после обследования пациента медицинскими работниками с опытом ухода и реабилитации больных, перенесших инсульт.
В постмаркетинговых отчетах сообщалось о летальных случаях (иногда связаны с возникновением аспирационной пневмонии) и о возможном распространении токсина у детей, имели сопутствующие заболевания, преимущественно у пациентов с церебральным параличом, после применения ботулинического токсина.
Блефароспазм .
Уменьшение количества моргания после инъекции токсина ботулина в круговую мышцу глаза у глазницы может привести к воздействию на роговицу, устойчивого эпителиального дефекта и язвы роговицы, особенно у пациентов с нарушениями функций VII пары черепных нервов. Необходимо провести внимательную проверку чувствительности роговицы в глазах, которые были прооперированы, не делать инъекций в зону нижнего века, чтобы предотвратить выворачиванию (эктропиона) и хорошо обработать любой дефект эпителия. Это может привести к необходимости применения защитных капель, мазей, терапевтических мягких контактных линз или закрытия глаз повязкой.
Экхимозы очень легко возникает в мягких тканях века. Его можно минимизировать, слегка нажав на место инъекции сразу же после проведения процедуры.
Через антихолинергическим действием токсина ботулина нужно с большой осторожностью лечить пациентов с имеющимся риском возникновения закрытоугольной глаукомы, включая пациентов с анатомически узким углом.
Цервикальная дистония.
Пациентов с цервикальной дистонией нужно проинформировать о возможности развития дисфагии, которая может быть очень умеренной или выраженной. Дисфагия может длиться 2-3 недели после инъекции, однако есть сообщения и о ее продолжительность в течение 5 месяцев после инъекции. После дисфагии может наблюдаться аспирация, одышка и необходимость зондового питания. В редких случаях сообщалось о возникновении аспирационной пневмонии вследствие дисфагии, которая имела летальный исход.
Ограничения дозы до 100 единиц-Аллерган, что вводится в грудино-ключично-сосцевидная мышца, может снизить риск возникновения дисфагии. У пациентов с меньшей массой шейного мышцы или пациентов, которые получали инъекции в грудинно-ключично-сосцевидная мышца с обеих сторон, риск возникновения дисфагии увеличивается.
Дисфагия объясняется распространением токсина в мышцы пищевода. Инъекции в мышцу, поднимающую лопатку, могут быть связаны с повышенным риском возникновения инфекции верхних дыхательных путей и дисфагии.
Дисфагия может вызвать уменьшение поступления пищи и воды и как следствие - потерю массы тела и обезвоживание. У пациентов с субклинической дисфагией повышенный риск возникновения серьезной дисфагии после инъекций препарата БОТОКС®.
Хроническая мигрень .
Хроническую мигрень нужно диагностировать, а БОТОКС® следует применять исключительно под наблюдением неврологов, специализирующихся на лечении хронической мигрени.
Безопасность и эффективность применения препарата БОТОКС® для профилактики головной боли у пациентов с эпизодическими проявлениями мигрени (головные боли <15 дней в месяц) или хронической головной болью напряжения не изучались.
Безопасность и эффективность применения препарата БОТОКС® пациентам с головной болью, вызванным чрезмерным приемом лекарственных средств (расстройство вторичного головной боли), не изучались.
Нарушение функции мочевого пузыря
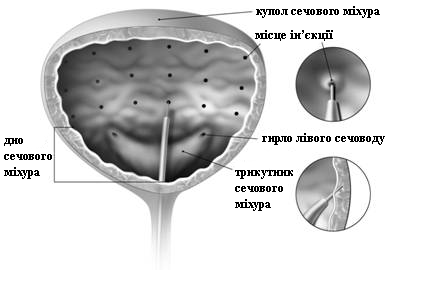
Необходимо принять соответствующие меры предосторожности при проведении цистоскопии.
У пациентов, которым не применяют катетеризацию, следует определить остаточный объем мочи после мочеиспускания в течение 2 недель после лечения и периодически при необходимости с медицинской точки зрения, в течение 12 недель. Пациентов следует проинформировать о необходимости обращения к врачу, если они испытывают затруднения при мочеиспускании, поскольку в этом случае может быть необходима катетеризация.
Идиопатическая гиперактивность мочевого пузыря .
Мужчинам с гиперактивным мочевым пузырем и симптомами непроходимости мочевыводящих каналов не следует применять БОТОКС® для лечения.
Недержание мочи в результате нейрогенной гиперактивности детрузора .
Возможно возникновение автономной дизрефлексии, связанной с процедурой. Может возникнуть необходимость в неотложной медицинской помощи.
Расстройства кожи и подкожной клетчатки
Первичный гипергидроз подмышечных впадин .
Изучение анамнеза, обследование и специальные дополнительные исследования - все это необходимо, чтобы исключить потенциальные причины вторичного гипергидроза (например гипертиреоз, феохромоцитома). Это позволит предотвратить симптоматическом лечению гипергидроза без диагностирования и / или лечения болезни, его вызвала.
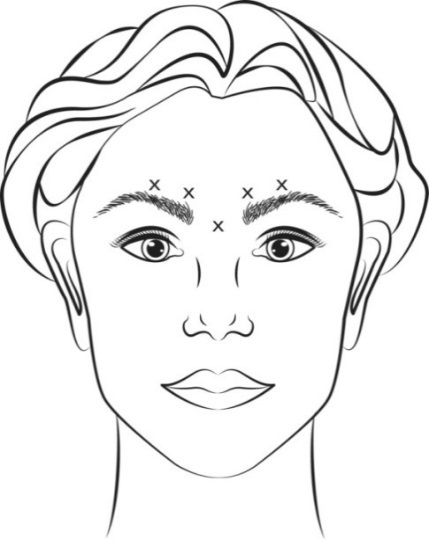
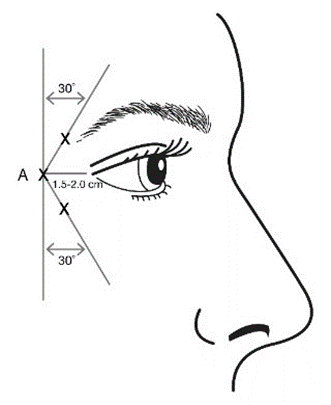
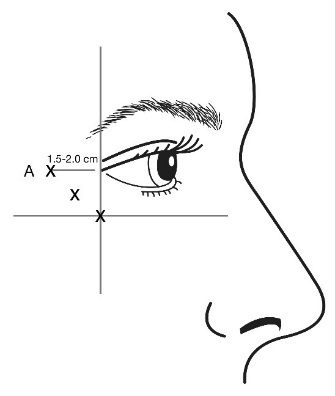
В ертикальни морщины между бровями (глабелярн и морщины) при максимальном насупленни и / или « гусиные лапки » при широкой улыбке и / или зморш ки на лбу при максимальном подъеме бровей.
Чтобы избежать попадания в кровеносные сосуды, необходимо с осторожностью вводить препарат БОТОКС® в зону вертикальных морщин между бровями при максимальном насупленни, в «гусиные лапки» при максимальной улыбке или в морщины на лбу при максимальном подъеме бровей. Следует соблюдать особые меры предосторожности при подготовке и введении препарата, а также при деактивации и утилизации неиспользованного раствора. Существует риск птоза века после инъекции, рекомендации по минимизации этого риска см. в разделе «Способ применения и дозы».
Эффективность и безопасность повторных инъекций препарата БОТОКС® при вертикальных морщинах между бровями (глабелярни морщины) при максимальном насупленни, «гусиных лапках» при широкой улыбке или морщинах на лбу при максимальном подъеме бровей в течение более 12 месяцев не изучались.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Не применять вместе с аминогликозидными антибиотиками или спектиномицин, или другими препаратами, препятствующих нервно-мышечной передачи (например, с нервно-мышечными блокаторами).
Эффект от применения различных серологических типов нейротоксина ботулина одновременно или с интервалом в несколько месяцев неизвестен. Чрезмерное нервно-мышечная слабость может быть усилена в результате применения другого токсина ботулина до окончания действия ранее примененного ботулотоксина.
Изучение взаимодействия не проводилось. О клинически важные взаимодействия не сообщалось.
Дети.
Изучение взаимодействия у детей не проводилось.
Особенности применения
В соответствии с инструкциями следует выполнять восстановление во флаконе и приготовления шприца над специальной плотной бумажной салфеткой для предотвращения течением.
Восстановление препарата БОТОКС® нужно осуществлять только с помощью стерильного физиологического раствора без консервантов (0,9% натрия хлорида для инъекций). Соответствующее количество растворителя нужно набирать в шприц см. раздел «Способ применения и дозы».
При использовании различных флаконов препарата БОТОКС® во время одной инъекции следует тщательно отбирать количество растворителя, восстанавливая определенное количество единиц на 0,1 мл. Количество растворителя различна для препаратов БОТОКС®, 100 единиц-Аллерган, и БОТОКС®, 200 единиц-Аллерган. Каждый шприц нужно маркировать соответствующим образом.
Поскольку препарат БОТОКС® денатурируется при образовании пузырей или при другом сильном взбалтывании, вводите растворитель во флакон осторожно. Не используйте флакон, если вакуум не впитывает растворитель в него. Восстановленный препарат БОТОКС® представляет собой прозрачный бесцветный или слегка желтоватый раствор без посторонних твердых частиц. Перед применением визуально проверьте разведенный раствор на прозрачность и отсутствие частиц. Восстановленный во флаконе раствор препарата БОТОКС® может храниться до применения в холодильнике (при температуре от 2 до 8 ° С) в течение 24 часов. Данные о дате и времени восстановления должны быть нанесены на специальное место на этикетке флакона. Если препарат БОТОКС® восстанавливается в шприце для внутрипузырного введения, раствор следует использовать немедленно.
Для безопасной утилизации неиспользованные флаконы восстанавливаются небольшим количеством воды, а затем стерилизуются в автоклаве. Любые использованные флаконы, шприцы, разлитый раствор и т.п. необходимо стерилизовать в автоклаве; остатки препарата БОТОКС® могут деактивуватися с помощью разбавленного раствора гипохлорита (0,5%) в течение 5 минут.
Любой неиспользованный препарат или отходы должны утилизироваться в соответствии с установленными национальными требованиями.
Применение в период беременности или кормления грудью
беременность
Нет достаточных данных относительно применения ботулинического токсина типа А беременным женщинам. Исследования на животных показали репродуктивной токсичности. Потенциальный риск для человека неизвестен. Препарат БОТОКС® не применяется беременным женщинам, планирующим беременность и не используют контрацептивы.
кормление грудью
Нет информации относительно попадания препарата БОТОКС® в грудное молоко. Не рекомендуется применять женщинам, которые кормят грудью.
фертильность
Нет достаточных данных о влиянии ботулинического токсина типа А на фертильность женщин репродуктивного возраста. Исследования показали задержку фертильности у животных.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Исследований влияния препарата БОТОКС® на скорость реакции при управлении автотранспортом или работе с другими механизмами не проводилось. Однако БОТОКС® может вызвать астению, слабость мышц, головокружение и нарушение зрения, которые могут сделать управление автомашинами или эксплуатацию механизмов опасными.
Способ применения Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) и дозы
Единицы токсина ботулина одного препарата не являются взаимозаменяемыми с единицами другого препарата. Дозы, рекомендуемые в единицах-Аллерган, отличные от других ботулотоксичних препаратов.
Пациенты пожилого возраста .
Специальная коррекция дозы не требуется в случае применения пациентам пожилого возраста. Начальная доза препарата должна быть минимальной рекомендованной дозе для конкретного показания. Для повторных инъекций рекомендуется самая низкая эффективная доза с как можно большим клиническим интервалом между инъекциями. С осторожностью применять у пациентов пожилого возраста с тяжелыми заболеваниями в анамнезе и пациентам, которые принимают сопутствующие лекарственные средства. Имеющиеся ограниченные данные по применению препарата БОТОКС® для лечения пациентов старше 65 лет с недержанием мочи вследствие нейрогенной гиперактивности детрузора, с нарушением функции лодыжки и стопы вследствие спастичности нижних конечностей, связанной с перенесенным инсультом, и для лечения морщин на лице.
Если флаконы БОТОКС® разного объема используются в одной терапевтической процедуре, следует тщательно отбирать необходимое количество растворителя при восстановлении определенного количества единиц препарата на 0,1 мл. Количество растворителя варьируется для 100 единиц-Аллерган и 200 единиц-Аллерган. Каждый шприц необходимо соответствующим образом маркировать.
БОТОКС® необходимо восстанавливать только стерильным физиологическим раствором без консервантов (0,9% натрия хлорида для инъекций). Соответствующее количество растворителя (см. Таблицу 10) необходимо набрать шприцем.
Таблица 10
Восстановление препарата БОТОКС®, 100 единиц-Аллерган и 200 единиц-Аллерган, для всех показаний, за исключением нарушения функции мочевого пузыря
полученная доза (Единиц-Аллерган на 0,1 мл) | Количество растворителя (0,9% хлорида натрия), которая прилагается к флакону | |
100 единиц-Аллерган | 200 единиц-Аллерган | |
20 единиц-Аллерган | 0,5 мл | 1 мл |
10 единиц-Аллерган | 1 мл | 2 мл |
5 единиц-Аллерган | 2 мл | 4 мл |
4 единиц-Аллерган | 2,5 мл | 5 мл |
2,5 единиц-Аллерган | 4 мл | 8 мл |
1,25 единиц-Аллерган | 8 мл | Не применяется |
Идиопатическая гиперактивность мочевого пузыря
Рекомендуется использовать флакон по 100 единиц -Аллерган для удобства восстановления.
Д ля 100 единиц - Аллерган
- Восстановите один флакон препарата БОТОКС®, 100 единиц-Аллерган, с помощью 10 мл 0,9% раствора натрия хлорида для инъекций без консервантов и осторожно перемешайте.
- Перенесите 10 мл из флакона в шприц емкостью 10 мл.
В результате будет получено шприц емкостью 10 мл с общим количеством восстановленного препарата БОТОКС®, 100 единиц-Аллерган. Использовать немедленно после восстановления в шприце. Неиспользованный раствор нужно утилизировать.
Д ля 200 единиц - Аллерган
- Восстановите один флакон препарата БОТОКС®, 200 единиц-Аллерган, с помощью 8 мл 0,9% раствора натрия хлорида для инъекций без консервантов и осторожно перемешайте.
- Перенесите 4 мл из флакона в шприц емкостью 10 мл.
- Закончите восстановления, добавив 6 мл 0,9% раствора натрия хлорида для инъекций без консервантов к шприцу емкостью 10 мл, и осторожно перемешайте.
В результате будет получено шприц емкостью 10 мл с общим количеством восстановленного препарата БОТОКС®, 100 единиц-Аллерган. Использовать немедленно после восстановления в шприце. Неиспользованный раствор нужно утилизировать.
Недержание мочи вследствие нейрогенной гиперактивности детрузора
Рекомендуется использовать флакон по 200 единиц -Аллерган или два флакон и по 100 единиц -Аллерган для удобства восстановления.
Д ля 100 единиц - Аллерган
- Восстановите два флакона препарата БОТОКС®, 100 единиц-Аллерган, каждый с помощью 6 мл 0,9% раствора натрия хлорида для инъекций без консервантов, и осторожно перемешайте.
- Перенесите 4 мл из каждого флакона к каждому из двух шприцев емкостью 10 мл.
- Остаток по 2 мл из каждого флакона перенесите к третьему шприца емкостью 10 мл.
- Закончите восстановления, добавив 6 мл 0,9% раствора натрия хлорида для инъекций без консервантов к каждому из шприцов емкостью 10 мл, и осторожно перемешайте.
В результате будет получено 3 шприца, каждый емкостью 10 мл, с общим количеством восстановленного препарата БОТОКС®, 200 единиц-Аллерган. Использовать немедленно после восстановления в шприце. Неиспользованный раствор нужно утилизировать.
Д ля 200 единиц - Аллерган
- Восстановите 200 единиц-Аллерган препарата БОТОКС® с помощью 6 мл 0,9% раствора натрия хлорида для инъекций без консервантов и осторожно перемешайте.
- Перенесите 2 мл из флакона к каждому из трех шприцев емкостью 10 мл.
- Закончите восстановления, добавив 8 мл 0,9% раствора натрия хлорида для инъекций без консервантов к каждому из шприцов емкостью 10 мл, и осторожно перемешайте.
В результате будет получено 3 шприца, каждый емкостью 10 мл, с общим количеством восстановленного препарата БОТОКС®, 200 единиц-Аллерган. Использовать немедленно после восстановления в шприце. Неиспользованный раствор нужно утилизировать.
Ознакомьтесь с подробной инструкцией по применению для каждого из показаний, указанных ниже.
БОТОКС® должен вводить только врач соответствующей квалификации, который имеет соответствующий опыт лечения и использует при лечении соответствующее оборудование.
В общем оптимальная доза и количество инъекций в одну мышцу не определены для всех показаний, потому индивидуальную терапевтическую дозу должен определять врач. Оптимальную дозу определяют методом титрования, но рекомендованную максимальную дозу следует превышать.
Неврологические заболевания
Фокусное спастичность , связанная с детским церебральным параличом
Рекомендуемая игла | Стерильная игла калибра 23-26 / 0,60-0,45 мм. |
Инструкция и по применению | Применяется в виде распределенной на курс лечения общей вводимой дозы отдельными инъекциями в центральную и боковые верхние части пораженного икроножной мышцы. |
Рекомендуемая доза | При гемиплегии : начальная рекомендуемая доза составляет 4 единицы-Аллерган на 1 кг массы тела в пораженную конечность. При диплегии : начальная рекомендуемая доза составляет 6 единиц-Аллерган на 1 кг массы тела, разделенная между пораженными конечностями. |
Максимальная общая доза | 200 единиц-Аллерган или 6,0 единиц-Аллерган / кг в зависимости от того, какая из зазаначени доз меньше. Лекарственное средство вводят с 3-месячным интервалом. |
Дополнительная информация | Клиническое улучшение, как правило, появляется в течение первых 2 недель после инъекции. Повторные дозы следует применять при уменьшении эффекта предыдущих инъекций, но не чаще чем каждые 3 месяца. Для детей следует подбирать такую дозу, которая позволит делать перерывы между инъекциями продолжительностью не менее 6 месяцев. |
Фокусное спастичность верхних конечностей после перенесенного инсульта.
Рекомендуемая игла | Стерильная игла калибра 25, 27 или 30. Длину иглы следует выбирать в зависимости от месторасположения мышцы и его глубины. | ||||||||||||||
Инструкция по применению | Для локализации привлеченного мышцы можно использовать методику нейростимуляции или электромиографию. Различные места инъекций позволяют препарата БОТОКС® иметь большее влияние на зоны иннервации, что особенно важно для больших мышц. | ||||||||||||||
Рекомендуемая доза | Точную дозу и количество мест для инъекций необходимо корректировать в зависимости от индивидуальных размеров, количества и локализации вовлеченных мышц, тяжести спастичности, наличия локальной мышечной слабости и индивидуального ответа пациента на предыдущее лечение. Таблица 11 Дозы, которые применяли при проведении контролируемых клинических исследований
| ||||||||||||||
Максимальная общая доза | 200-240 единиц-Аллерган. Дозу разделяют и вводят в определенные мышцы. | ||||||||||||||
Дополнительная информация | При проведении контролируемых клинических исследований пациенты обследовались в течение 12 недель после единичной инъекции. Улучшение мышечного тонуса появилось в течение двух недель, а максимальный эффект, как правило, наблюдался в течение 4-6 недель. При проведении открытого неконтролируемого клинического исследования большинство пациентов получали повторную инъекцию с интервалом 12-16 недель, когда эффект на тонус мышцы уменьшается. Этим пациентам вводили до 4 инъекций с максимальной кумулятивной дозой 960 единиц-Аллерган в течение 54 недель. По усмотрению врача повторную дозу можно назначать, когда эффект от предыдущей инъекции уменьшается. Степень и характер мышечной спастичности во время повторной инъекции может быть причиной изменения дозы и выбора мышцы для инъекции. Нужно применять минимальную эффективную дозу. |
Фокусное спастичность нижних конечностей, связанная с перенесенным инсультом.
Рекомендуемая игла | Стерильная игла калибра 25, 27 или 30. Длину иглы нужно выбирать в зависимости от месторасположения мышцы и его глубины. |
Инструкция по применению | Полезной может быть локализация привлеченного мышцы с использованием методики нейростимуляции или электромиографии или ультразвука. Большее количество мест ввода позволяет препарата БОТОКС® иметь большее влияние на зоны иннервации, что особенно важно для больших мышц. Ниже приведены диаграммы с местами для инъекций при лечении спастичности нижних конечностей у взрослых. |
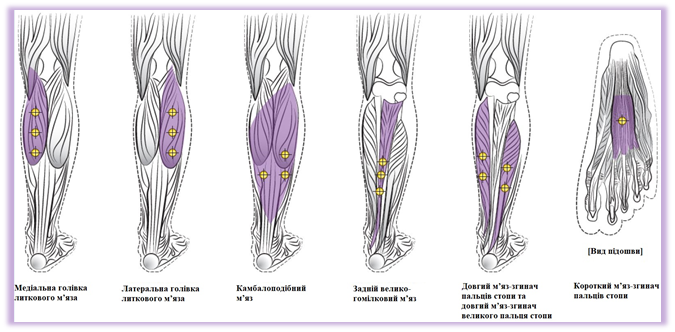
Рекомендуемая доза | 300 - 400 единиц-Аллерган, разделенных на 6 мышц, как указано в таблице 12. Таблица 12 Дозировка препарата БОТОКС® при лечении спастичности нижних конечностей у взрослых
| ||||||||||||||
Максимальная доза | 400 единиц-Аллерган общо. | ||||||||||||||
Дополнительная информация | Врач может считать необходимым проведение повторной инъекции, когда клинический эффект предыдущей инъекции уменьшился, но повторную инъекцию следует проводить не ранее чем через 12 недель после предыдущей инъекции. |
Блефароспазм / гемифациальный спазм
Рекомендуемая игла | Стерильная игла калибра 27-30 / 0,40-0,30 мм. |
Инструкция и по применению | Электромиографическое исследования не требуется. |
Рекомендуемая доза | Рекомендуемая начальная доза 1,25-2,5 единиц-Аллерган вводят в среднюю и боковую часть orbicularis oculi верхнего века и в боковую часть orbicularis oculi нижнего века. Можно вводить препарат и в дополнительные зоны - зону бровей, боковую часть круговой мышцы и в верхний участок лица, если спазмы в них мешают выполнять зрительные функции. |
Максимальная общая доза | Начальная доза не должна превышать 25 единиц-Аллерган на одну очную зону. При регулировании блефароспазма общая доза не должна превышать 100 единиц-Аллерган каждые 12 недель. |
Дополнительная информация | Чтобы уменьшить риск такого осложнения, как птоз (опущение), не допускаются инъекции у мышцы, поднимающей верхнее веко. А чтобы уменьшить риск такого осложнения, как диплопия (двоение в глазах), не допускаются инъекции в среднюю часть нижнего века. На рисунке 1 показаны возможные зоны инъекции. |
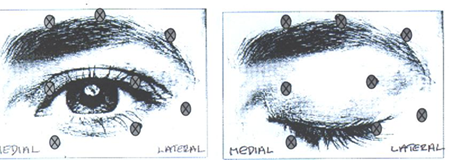
Рис 1
Первичный эффект от инъекций можно увидеть через 3 дня, а максимальный достигается за первые 2 недели после процедуры. Эффект от каждой процедуры действует примерно 3 месяца, после чего в случае необходимости ее можно повторить. При повторных сеансах дозу можно увеличить почти вдвое, если результат после первой процедуры недостаточный. |
Однако доказано, что нет преимуществ при введении более 5 единиц-Аллерган в одну зону. Нет никаких дополнительных преимуществ при применении чаще, чем каждые 3 месяца. Пациенты с гемифациальный спазмом или нарушениями функций VII пары черепных нервов должны лечиться как пациенты с односторонним блефароспазмом, при необходимости можно вводить препарат в другие пораженные мышцы (например, мышцы zygomaticus major , orbicularis oris ). |
Спастичность м ' мышц шеи и плеч у взрослых ( цервикальная дистония ).
Рекомендуемая игла | Иглы соответствующего калибра (обычно 25-30 / 0,50-0,30 мм). |
Инструкция и по применению | В клинических исследования лечения цервикальной дистонии обычно осуществлялось посредством введения препарата БОТОКС® в такие мышцы: грудино-ключично-сосцевидная ( sternocleidomastoid ) мышца, поднимающая лопатку ( levator scapulae ) лестничный ( scalene ) кожаный мышцу головы ( splenius capitis ) полуостистая ( semispinalis ) самый длинный ( longissimus ) и / или трапециевидный ( trapezius). Этот список не является исчерпывающим, поскольку любой из мышц, ответственных за контроль положения головы, может быть поврежден и поэтому потребует лечения. Мышечная масса и степень гипертрофии или атрофии являются факторами, которые необходимо учитывать при выборе соответствующей дозы. Модель активации мышц может спонтанно меняться при цервикальной дистонии без изменения клинической картины дистонии. В случае каких-либо осложнений относительно выделения определенных мышц, инъекции нужно осуществлять с помощью электромиографии. |
Рекомендуемая доза | При первичном курсе терапии общая доза не должна превышать 200 единиц-Аллерган, при последующих курсах дозу корректируют в зависимости от первоначального результата. При проведении первых контролируемых клинических исследований для определения безопасности и эффективности при лечении цервикальной дистонии дозы восстановленного препарата БОТОКС® составляли от 140 до 280 единиц-Аллерган. При проведении более поздних исследований дозы варьировались от 95 до 360 единиц-Аллерган (со средней дозой примерно 240 единиц-Аллерган). Как и в случае применения любого другого лекарственного средства, начальная доза у пациента, которому ранее не вводился препарат, должен составлять минимальную эффективную дозу. Не более 50 единиц-Аллерган препарата в каждый отдельный участок. Не более 100 единиц-Аллерган в грудино-сосцевидной мышцы ( sternomastoid). Для минимизации случаев дисфагии грудино-сосцевидный мускул не следует обкалывать с двух сторон. |
Максимальная общая доза | Общая доза введения препарата за один сеанс не должна превышать 300 единиц-Аллерган. Интервалы лечения, меньше, чем 10 недель, не рекомендуются. |
Дополнительная информация | Клиническое улучшение обычно наблюдается в течение первых 2 недель после инъекции. Максимальный положительный клинический результат обычно достигается через 6 недель после инъекции. Продолжительность клинического результата, зарегистрированного в клинических исследованиях, существенно отличалась в каждом отдельном случае (от 2 до 33 недель), а средняя продолжительность составляла 12 недель. |
Хроническая мигрень .
Рекомендуемая игла | Стерильная игла калибра 30 / 0,30 мм. |
Инструкция и по применению: | Инъекции следует вводить в 7 специфических зон мышц головы и шеи, как указано на рисунке 2 и в таблице 11. Для шейной зоны пациентам с очень толстыми шейными мышцами может потребоваться игла калибра 25 / 0,50 мм. В мышцу гордиев ( procerus ) инъекцию нужно вводить в один участок (линия середины), в другие мышцы следует вводить двусторонним способом: половину количества инъекций в участки в левой стороне и половину - в правой стороне головы и шеи. Если имеется участок / ки основной локализации боли, можно ввести дополнительные инъекции с одной или обеих сторон в 3 специфические группы мышц: occipitalis , temporalis и trapezius . Максимальная доза на одну мышцу указанная в таблице 12. На рисунке 2 показано участка для инъекций. |
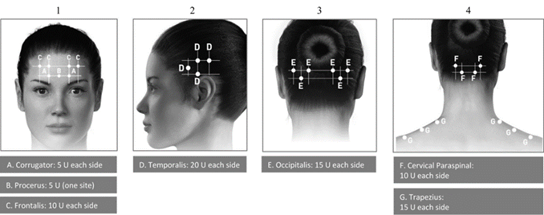
Рис. 2
На рисунке 2а указано рекомендованные группы мышц для осуществления опциональных дополнительных инъекций.
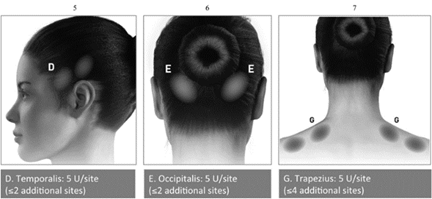
Рекомендуемая доза | От 155 до 195 единиц-Аллерган, которые вводятся внутримышечно по 0,1 мл (5 единиц-Аллерган) в 31-39 участков. Таблица 13 Дозировка препарата БОТОКС® для лечения хронической мигрени по видам мышц
a 1 Доза для инъекции в один участок составляет 0,1 мл, равна 5 единиц-Аллерган препарата БОТОКС®. b доза введена двусторонним способом. | ||||||||||||||||||
Дополнительная информация | Рекомендуемый режим лечения составляет - 12 недель. |
Нарушение функции мочевого пузыря
На момент лечения у пациентов не должно быть инфекции мочевыводящих путей.
С целью профилактики следует применять антибиотики 1-3 дня до начала лечения, в день лечения и 1-3 дня после лечения.
Пациентам рекомендуется прекратить антитромбоцитарные терапию минимум за 3 дня до проведения процедуры. Пациенты, получающие антикоагулянтную терапию, должны находиться под надлежащим контролем, чтобы уменьшить риск появления кровотечения.
Для лечения недержания мочи БОТОКС® имеет вводить врач, который имеет соответствующий опыт в диагностике и лечении нарушений функции мочевого пузыря (например уролог, урогинеколог).
Идиопатическая гиперактивность мочевого пузыря .
Рекомендуемая игла | Можно использовать гибкий или зафиксирован (ригидный) цистоскоп. Инъекционную иглу следует наполнить (промыть) примерно 1 мл восстановленного продукта БОТОКС® перед началом проведения инъекций (в зависимости от длины иглы), чтобы вытеснить воздух. |
Инструкция и по применению: | Перед инъекцией возможно Внутрипузырное введения растворенного обезболивающего средства (с успокаивающим или без него) по локализации вовлеченной участка. Если применяется местная анестезия, то следует провести дренирование мочевого пузыря и его промывания с помощью стерильного раствора натрия хлорида перед тем, как продолжать процедуру. Восстановленный препарат БОТОКС® (100 единиц-Аллерган / 10 мл) вводится в мышцу детрузора с помощью гибкого или зафиксированного (ригидного) цистоскопа, избегая треугольника и дна мочевого пузыря (см. Рис. 3). В мочевой пузырь следует ввести достаточное количество раствора натрия хлорида, чтобы достичь достаточной визуализации для инъекций, но следует избегать чрезмерного растяжения мочевого пузыря. Иглу следует вводить примерно на 2 мм в детрузор. Вводят 20 инъекций, каждая по 0,5 мл (общий объем 10 мл), на расстоянии примерно 1 см друг от друга (см. Рис. 3). В последний инъекции следует ввести примерно 1 мл стерильного раствора натрия хлорида, чтобы обеспечить полное дозировки. После введения инъекций раствор натрия хлорида, используемый для визуализации стенки мочевого пузыря, не следует дренировать, пока у пациентов не будет возможности стул перед тем, как покинуть лечебное учреждение. Следует наблюдать за пациентом не менее 30 минут после введения инъекций, пока имеющиеся спонтанные стул.
Рис. 3. |
Рекомендуемая доза | Рекомендуемая доза составляет 100 единиц-Аллерган препарата БОТОКС®, по 0,5 мл инъекции (5 единиц-Аллерган) в 20 участков детрузора. |
Дополнительная информация | Клиническое улучшение может наблюдаться в течение 2 недель. Пациентам следует сделать повторную инъекцию, если клинический эффект от предыдущей инъекции уменьшился (во время клинических исследований фазы 3 средняя продолжительность эффекта составила 166 дней [~ 24 недели] на основе требования пациентов на проведение повторного лечения), но не ранее чем через 3 месяца после предыдущего введения. |
Недержание мочи вследствие нейрогенной гиперактивности детрузора .
Рекомендуемая игла | Можно использовать гибкий или зафиксирован (ригидный) цистоскоп. Инъекционную иглу следует наполнить (промыть) примерно 1 мл восстановленного продукта БОТОКС® перед началом проведения инъекций (в зависимости от длины иглы), чтобы вытеснить воздух. |
Инструкция и по применению | Перед инъекцией возможно Внутрипузырное введения растворенного обезболивающего средства (с успокаивающим или без него) или применения общей анестезии, местной анестезии по локализации вовлеченной участка. Если применяется местная анестезия по локализации вовлеченной участка, то следует провести дренирование мочевого пузыря и его промывания с помощью стерильного раствора натрия хлорида перед тем, как продолжать процедуру ведения инъекции. Восстановленный препарат БОТОКС® (200 единиц-Аллерган / 30 мл) вводится в мышцу детрузора с помощью гибкого или зафиксированного (ригидного) цистоскопа, избегая зоны треугольника и дна мочевого пузыря. В мочевой пузырь следует ввести достаточное количество раствора натрия хлорида, с целью достаточной визуализации, но следует избегать чрезмерного растяжения мочевого пузыря. Иглу следует вводить примерно на 2 мм в детрузор. Проводят 30 инъекций, каждая по 1 мл (общий объем 30 мл), на расстоянии примерно 1 см друг от друга (см. Рис. 3). В последний инъекции следует ввести примерно 1 мл стерильного раствора натрия хлорида, чтобы обеспечить полное дозировки. После введения инъекций раствор натрия хлорида, используемый для визуализации стенки мочевого пузыря, следует дренировать. Следует наблюдать за пациентом не менее 30 минут после введения инъекций. |
Рекомендуемая доза | Рекомендуемая доза составляет 200 единиц-Аллерган препарата БОТОКС®, по 1 мл инъекции (~ 6,7 единиц-Аллерган) параллельно в 30 участков детрузора. |
Дополнительная информация | Клиническое улучшение обычно может быть зарегистрировано в течение 2 недель. Пациентам следует сделать повторную инъекцию, если клинический эффект от предыдущей инъекции уменьшился (во время клинических исследований фазы 3 средняя продолжительность эффекта составляла 256-295 дней (~ 36-42) при применении препарата БОТОКС® 200 единиц-Аллерган на основе требования пациентов на проведение повторного лечения), но не ранее чем через 3 месяца после предыдущего введения. |
Расстройства кожи и подкожной клетчатки
Первичный гипергидроз подмышечных впадин.
Рекомендуемая игла | Стерильная игла калибра 30 / 0,30 мм. |
Инструкция и по применению | Зона максимального потоотделение может быть определена с помощью техники окрашивания, например йодо-крахмальный тест. |
Рекомендуемая доза | 50 единиц-Аллерган препарата вводят подкожно, распределяя их по многим точкам участка на расстоянии примерно 1-2 см друг от друга в зоне максимального потоотделения каждой подмышечной впадины. |
Максимальная общая доза | Не рекомендуется вводить дозу более 50 единиц-Аллерган на одну подмышечную впадину. Инъекции следует повторять чаще, чем каждые 16 недель |
Дополнительная информация | Клиническое улучшение обычно может наблюдаться в течение первой недели после инъекции. Повторную инъекцию препарата БОТОКС® можно осуществлять тогда, когда клинический эффект предыдущей инъекции уменьшился и по мнению врача повторная инъекция необходима. |
Вертикальные морщины между бровями ( глабелярни морщины ).
Рекомендуемая игла | Стерильная игла калибра 30 / 0,30 мм. |
Инструкция и по применению | Перед введением инъекции следует крепко прижать большой или указательный палец ниже орбитального края, чтобы предотвратить экстравазации. Иглу следует направлять сверху и посередине. Кроме того, не допускаются инъекции у мышцы, поднимающей верхнее веко ( levator palpebrae superioris ), особенно у пациентов с большим комплексом бровного депрессор ( depressor supercilii ). Инъекции в мышцу, вызывает сморщивание кожи ( corrugator ), следует вводить в центральную часть мышцы, как минимум на 1 см выше дуг бровей (см. Рис. 4). С осторожностью вводить в зону вертикальных морщин между бровями (глабелярних морщин при максимальном насупленни), чтобы избежать попадания в кровеносные сосуды.
Рис. 4 |
Рекомендуемая доза | Вводят инъекцию объемом 0,1 мл (4 единицы-Аллерган) в каждую из пяти участков для инъекций (см. Рис. 4): 2 инъекции в каждую мышцу, что вызывает сморщивание кожи ( corrugator ) и 1 инъекция в мышцу гордецов ( procerus ), чтобы общая доза составляла 20 единиц-Аллерган. |
Максимальная общая доза | Для уменьшения риска птоза века не следует превышать максимальную дозу 4 единицы-Аллерган на один участок, а также количество участков для инъекций. |
Дополнительная информация | Уменьшение выраженности морщин между бровями при максимальном насупленни обычно наблюдается через одну неделю после лечения, эффект длится до 4 месяцев. Лечение можно повторять не чаще чем каждые 3 месяца. В случае неэффективного лечения или уменьшения эффекта после повторных инъекций можно применять альтернативные методы лечения. В случае неэффективности введенной дозы БОТОКС® повторные введения препарата могут быть применены и увеличена общая доза до 40-50 единиц-Аллерган, учитывая анализ предыдущих неудачных введений препарата. |
Морщины в форме « гусиных лапок» при широкой улыбке .
Рекомендуемая игла | Стерильная игла калибра 30 / 0,30 мм. | |||
Инструкция и по применению | Инъекцию необходимо проводить, вводя иглу со скосом направленным вверх и от глаза. Первую инъекцию (A) нужно осуществлять примерно в 1,5-2,0 см от наружного угла глаза в височно-орбитальную зону. Если морщины в форме «гусиных лапок» находятся выше или ниже внешнего угла глаза, сделайте инъекцию, как показано на рис. 5. В противном случае, если морщины в форме «гусиных лапок» находятся преимущественно ниже внешнего угла глаза, сделайте инъекцию, как показано на рис. 5а. Для уменьшения риска птоза века инъекции нужно осуществлять в височно-орбитальную зону для обеспечения необходимого удаления от мышцы, контролирует открытие века.
С осторожностью вводить в зону морщин в форме «гусиных лапок» при широкой улыбке, чтобы избежать попадания в кровеносные сосуды. | |||
Рекомендуемая доза | 0,1 мл (4 единицы-Аллерган) в каждую из 3-х участков каждой стороны мышцы (всего 6 участков для инъекций) вводится в латеральный круговая мышца ок; общая доза составляет 24 единицы-Аллерган с общим объемом 0,6 мл (12 единиц-Аллерган на каждую сторону). При одновременном лечении глабелярних морщин при максимальном насупленни (доза препарата составляет 20 единиц-Аллерган) и морщин в форме «гусиных лапок» при широкой улыбке (доза препарата составляет 24 единицы-Аллерган) общая доза составляет 44 единицы-Аллерган с общим объемом 1 , 1 мл (см. инструкцию по применению препарата для лечения глабелярних морщин и рис. 4). | |||
Максимальная общая доза | Для уменьшения риска птоза века не следует превышать максимальную дозу 4 единицы-Аллерган на один участок, а также количество участков для инъекций. | |||
Дополнительная информация | Интервалы между инъекциями не должны составлять менее 3 месяцев. |
Морщины на лбу при максимальном подъеме бровей
Рекомендуемая игла | Стерильная игла калибра 30 / 0,30 мм. |
Инструкция по применению | Для определения соответствующих мест инъекций в лобные мышцы необходимо оценить общее соотношение между площадью лоб пациента и распространенности активности лобных мышц. Для определения горизонтальных рядов инъекции необходимо выполнить легкую пальпацию лобных мышц в состоянии покоя и при максимальном подъеме бровей • Верхний предел активности лобных мышц - примерно 1 см над самой складкой на лбу. • Нижний ряд инъекций вводят посередине между верхней границей активности лобных мышц и бровью, не менее 2 см над бровью • Верхний ряд инъекций вводят посередине между верхней границей активности лобных мышц и нижним рядом инъекций 5 инъекций должны быть выполнены в точке пересечения горизонтальных рядов инъекции с указанными ниже вертикальными ориентирами: • На нижнем ряду инъекции посередине лба и 0,5-1,5 см медиально к височной линии (до височной гребня), пальпируется, для одной стороны; повторите процедуру для другой стороны. • На верхнем ряду инъекции посередине между латеральной и медиальной зонами на нижнем ряду инъекции для одной стороны; повторите процедуру для другой стороны. |
Рис. 6 С осторожностью вводить в зону морщин на лбу при максимальном подъеме бровей, чтобы избежать попадания в кровеносные сосуды. | |
Рекомендуемая доза | По 0,1 мл (4 единицы-Аллерган) в каждую из пяти участков для инъекций в лобный мышцу, чтобы общая доза составляла 20 единиц-Аллерган с общим объемом 0,5 мл (см. Рис. 6). Общая доза для коррекции морщин на лбу (20 единиц-Аллерган) одновременно с глабелярнимы морщинами (20 единиц-Аллерган) составляет 40 единиц-Аллерган / 1,0 мл. При одновременной коррекции глабелярних морщин и морщин в форме «гусиных лапок» общая доза составляет 64 единицы-Аллерган, которая включает 20 единиц-Аллерган для морщин на лбу, 20 единиц-Аллерган для глабелярних морщин (см. Инструкции по применению препарата для коррекции глабелярних морщин, и рис. 4) и 24 единицы-Аллерган для морщин в форме «гусиных лапок» (см. инструкции по применению препарата для коррекции морщин в форме «гусиных лапок» и рис. 5 и 5а) |
Дополнительная информация | Интервалы между инъекциями не должны составлять менее 3 месяцев. Улучшение по выраженности морщин на лбу при максимальном подъеме бровей наблюдалось в течение 1 недели после инъекции. Эффект в среднем наблюдался в течение 4 месяцев после инъекции. |
Все показания .
Если после первого курса лечения в течение первого месяца после инъекции не появилось значительного клинического улучшения по сравнению с исходным состоянием, необходимо принять следующие меры:
- провести клиническое обследование, включающее электромиографическое обследование у специалиста для выявления действия токсина на мышцу (-и), в который (-ые) осуществлялась инъекция;
- провести анализ причин неудачи, например неправильный выбор мышц для инъекции, недостаточная доза, неправильный метод инъекции, появление устойчивой контрактуры, слабость мышц-антагонистов, появление антител, нейтрализующих токсин;
- провести повторную оценку целесообразности лечения ботулинического токсина типа А;
- при отсутствии каких-либо побочных реакций после первого курса лечения провести второй курс лечения следующим образом:
- отрегулировать дозу, приняв во внимание анализ предыдущих неэффективных доз
- применить электромиографию;
- выдержать 3-х месячный интервал между двумя курсами лечения.
В случае неэффективного лечения или уменьшения эффекта после следующих повторных инъекций необходимо применять другие методы лечения.
Во время лечения взрослых пациентов с несколькими показаниями, максимальная суммарная доза не должна превышать 400 единиц-Аллерган. Интервал между приемами суммарных доз должен составлять не менее 12 недель.
Дети
Безопасность и эффективность применения препарата БОТОКС® для лечения по показаниям, кроме описанных в разделе «Показания» не были установлены. Никаких рекомендаций не предоставляется по применению для лечения по другим показаниям, кроме фокальной спастичности, связанной с детским церебральным параличом. Как указано в таблице 14, в настоящее время имеющиеся данные по применению, как описано в разделах «Применение», «Особые меры безопасности», «Побочные реакции» и «Фармакологические».
Таблица 14
показания | возраст пациента |
Фокусное спастичность, связанная с детским церебральным параличом | 2 года (см. Разделы «Способ применения и дозы», «Особые меры безопасности», «Побочные реакции») |
Блефароспазм, гемифациальный спазм и цервикальная дистония (спастическая кривошея) | 12 лет (см. Разделы «Особые меры безопасности», «Побочные реакции») |
Первичный гипергидроз подмышечных впадин | 12 лет (ограниченный опыт применения подросткам 12 - 17 лет, см. Разделы «Особые меры безопасности», «Побочные реакции» и «Фармакологические») |
В постмаркетинговых отчетах очень редко сообщалось о возможном распространения токсина далеко от места применения у детей, имели сопутствующие заболевания, преимущественно у пациентов с церебральным параличом. Всего в таких случаях применялась доза превышала рекомендуемую.
Были получены жидкие спонтанные сообщения о летальных случаях, иногда связанные с возникновением аспирационной пневмонии у детей с тяжелой формой церебрального паралича, после применения ботулинического токсина, включая применение не по показаниям (например, в область шеи). С особой осторожностью следует применять препарат при лечении детей с тяжелыми формами неврологических нарушений, с дисфагией, а также детей, которые недавно болели аспирационную пневмонию или имели заболевания легких. Лечение ослабленных пациентов следует проводить только тогда, когда доказано, что преимущества от лечения превышают риски.
Передозировка
Передозировка препаратом БОТОКС® от дозы, зоны инъекции и основных свойств тканей. Никаких сообщений о случаях системной токсичности вследствие случайной инъекции препарата БОТОКС® не было. Превышение дозы может стать причиной локализованного или распространенного и частичного или полного нервно-мышечного паралича.
Случаи проглатывания препарата БОТОКС® неизвестны.
Симптомы передозировки не являются сразу же после инъекции. В случае случайной инъекции, проглатывания или возникновения подозрения о передозировке пациент должен находиться под наблюдением несколько недель, чтобы выявить прогрессирующие признаки мышечной слабости, которые могут возникнуть в месте инъекции или в отдаленном от инъекции месте, включая птоз , диплопию, дисфагию, дизартрию, общую слабость или респираторные расстройства. Эти пациенты должны пройти дальнейшее медицинское обследование и немедленно получить необходимую медицинскую помощь, которая может включать госпитализацию.
При поражении мышц ротовой части глотки и пищевода может развиться аспирационная пневмония. Если развилась чрезмерная мышечная слабость или паралич дыхательных мышц, необходимо провести интубацию трахеи и искусственную вентиляцию легких до восстановления нормальной функции дыхания. Дополнительно к мерам общей поддерживающей терапии может быть необходимым применение трахеостомии и длительной искусственной вентиляции легких.
Побочные эффекты
Общие .
В контролируемых клинических исследованиях побочные реакции наблюдались у 35% пациентов с блефароспазмом, у 28% - с цервикальной дистонией, 17% - с детским церебральным параличом, 11% - с первичным гипергидрозом подмышечных впадин, 16% - с фокальной спастичностью верхних конечностей и 15% - с фокальной спастичностью нижних конечностей, связанной с инсультом.
В клинических исследованиях по идиопатического мочевого пузыря частота возникновения побочных реакций составляла 26% во время первого лечения и уменьшилась до 22% во время второго лечения. В клинических исследованиях по недержание мочи вследствие нейрогенной гиперактивности детрузора частота возникновения побочных реакций составляла 32% во время первого лечения и уменьшилась до 18% во время второго лечения. В клинических исследованиях относительно хронической мигрени частота возникновения побочных реакций составляла 26% во время первого лечения и уменьшилась до 11% во время второго лечения.
В контролируемых клинических исследованиях по вертикальной х измор щек между бровями побочные реакции наблюдались в 23,5% пациентов . В контролируемых клинических исследованиях относительно морщин в форме «гусиных лапок» при широкой улыбке побочные реакции были зарегистрированы в 7,6% (24 единицы-Аллерган только при морщинах в форме «гусиных лапок») и 6,2% (44 единицы-Аллерган: 24 единицы-Аллерган при морщинах в форме «гусиных лапок» одновременно с введением 20 единиц-Аллерган при глабелярних морщинах) пациентов по сравнению с 4,5% пациентов в группе плацебо.Во время 1-го курса инъекций в клинических исследованиях морщин на лбу при максимальном подъеме бровей побочные реакции, которые, по мнению исследователей, были связаны с препаратом БОТОКС®, зарегистрировано в 20,6% пациентов после инъекции 40 единиц -Аллерган (20 единиц-Аллерган в группу лобных мышц и 20 единиц-Аллерган в глабелярну группу мышц) и в 14,3% пациентов после инъекции 64 единиц-Аллерган (20 единиц-Аллерган в группу лобных мягкие мышц, 20 единиц-Аллерган в глабелярну группу мышц и 24 единицы-Аллерган в латеральные морщины в углу глаза) по сравнению с 8,9% пациентов после инъекции плацебо.
Как правило, побочные реакции возникают в течение первых нескольких дней после инъекции и являются обычно временными: могут длиться до нескольких месяцев, редко - дольше.
Локальная слабость мышцы представляет собой ожидаемую фармакологическое действие ботулотоксина в мышечной ткани. Однако сообщалось о случаях слабости близлежащих мышц и / или мышц, удаленных от места инъекции.
Как и при любых других инъекциях, возможны локальная боль, воспаление, парестезии, гипестезия, вялость, отек, эритема, локализованная инфекция, кровоточивость и / или синяки. Боль или неприятные ощущения, связанные с использованием иглы, могут закончиться вазовагальный реакциями, включая мимолетные симптоматическую гипотензию и обморок. Сообщалось также о высокой температуре и гриппоподобный синдром после инъекций ботулотоксина.
Побочные реакции классифицированы по следующим категориям в зависимости от частоты :
очень часто | возникает в более чем 1 из 10 пациентов |
Часто | возникает в 1-10 из 100 пациентов |
Нечасто | возникает в 1-10 с 1000 пациентов |
редко | возникает в 1-10 с 10 000 пациентов |
Очень редко | возникает в менее чем 1 из 10 000 пациентов |
Ниже указан перечень побочных реакций, которые могут отличаться в зависимости от части тела, в которую вводят БОТОКС®.
Неврологические расстройства
Фокусное спастичность, связанная с детским церебральным параличом .
Таблица 15
Класс систем органов | преференциальный срок | Частота |
Инфекции и инвазии | Вирусная инфекция и ушная инфекция | очень часто |
Расстройства нервной системы | Сонливость, нарушение походки, парестезии | Часто |
Со стороны кожи и подкожной клетчатки | Сыпь | Часто |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Миалгия, мышечная слабость, боль в конечностях | Часто |
Почечные расстройства и расстройства мочевыводящей системы | недержание мочи | Часто |
Травмы, отравления и процедурные осложнения | слабость | Часто |
Общие нарушения и реакции в месте введения | Недомогание, боль в месте инъекции, астения | Часто |
Фокусное спастичность верхних конечностей, связанная с перенесенным инсультом .
Таблица 16
Класс систем органов | преференциальный срок | Частота |
психические расстройства | Депрессия и бессонница | Нечасто |
Расстройства нервной системы | гипертония | Часто |
Гипоэстезия, головная боль, парестезии, нарушения координации, амнезия | Нечасто | |
Расстройства слуха и внутреннего уха | головокружение | Нечасто |
сосудистые расстройства | ортостатическая гипотензия | Нечасто |
Желудочно-кишечные расстройства | Тошнота, оральная парестезии | Нечасто |
Со стороны кожи и подкожной клетчатки | Экхимоз, пурпура | Часто |
Дерматиты, зуд, высыпания | Нечасто | |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Боль в конечностях, мышечная слабость | Часто |
Артралгия и бурсит | Нечасто | |
Общие нарушения и реакции в месте введения | Боль в месте инъекции, лихорадка, гриппоподобные заболевания, кровоизлияние и раздражение в месте инъекции | Часто |
Астения, боль, повышенная чувствительность в месте введения, недомогание, периферический отек | Нечасто |
Некоторые из редких побочных реакций могут быть связаны с заболеванием.
Фокусное спастичность нижних конечностей, связанная с перенесенным инсультом .
Таблица 17
Класс систем органов | преференциальный срок | Частота |
Со стороны кожи и подкожной клетчатки | высыпания | Часто |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Артралгия, костно-мышечная окоченение, мышечная слабость | Часто |
Общие нарушения и реакции в месте введения | периферический отек | Часто |
Травмы, отравления и процедурные осложнения | слабость | Часто |
В клинических исследованиях с участием пациентов со спастичностью нижних конечностей частота возникновения внезапной слабости составляла 5,9% и 5,3% в группе БОТОКС® и группе плацебо соответственно.
После повторной инъекции общие показатели безопасности остались неизмененными.
Блефароспазм, гемифациальный спазм и связанные с ними дистонии.
Таблица 18
Класс систем органов | преференциальный срок | Частота |
Расстройства нервной системы | Головокружение, парез лицевого нерва, поражения лицевого нерва | Нечасто |
Расстройства органов зрения | птоз века | очень часто |
Пятнистый кератит, несмыкание глазной щели, сухость глаз, светобоязнь, раздражение глаз, повышенная слезоточивость | Часто | |
Кератит, изнанку века, диплопия, энтропион, нарушения и расплывчатость зрения | Нечасто | |
отек век | редко | |
Язвенный кератит, дефект эпителия роговицы, перфорация роговицы | Очень редко | |
Со стороны кожи и подкожной клетчатки | экхимозы | Часто |
Высыпания / дерматит | Нечасто | |
Общие нарушения и реакции в месте введения | Раздражение, отек лица | Часто |
апатия | Нечасто |
Цервикальная дистония.
Класс систем органов | преференциальный срок | Частота |
Инфекции и инвазии | Ринит, инфекция верхних дыхательных путей | Часто |
Расстройства нервной системы | Головокружение, мышечная гипертензия, гипестезия, сонливость, головная боль | Часто |
Расстройства органов зрения | Диплопия, птоз века | Нечасто |
Респираторные, декабре и медиастинальные нарушения | Одышка, дистония | Нечасто |
Желудочно-кишечные расстройства | Дисфагия | очень часто |
Сухость во рту, тошнота | Часто | |
Скелетно-мышечные расстройства и расстройства соединительной ткани | мышечная слабость | очень часто |
Скелетно-мышечное окоченение, болезненность | Часто | |
Общие нарушения и реакции в месте введения | боль | очень часто |
Астения, гриппоподобное заболевания, недомогания | Часто | |
лихорадка | Нечасто |
Хроническая мигрень.
Класс систем органов | преференциальный срок | Частота |
Расстройства нервной системы | Головная боль, мигрень, парез лица | Часто |
Расстройства органов зрения | птоз века | Часто |
Со стороны кожи и подкожной клетчатки | Зуд, сыпь | Часто |
боль кожи | Нечасто | |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Боль в шее, миалгия, скелетно-мышечная боль и окоченение, мышечные спазмы, мышечное напряжение, мышечная слабость | Часто |
Боль в челюсти | Нечасто | |
Общие нарушения и реакции в месте введения | Боль в месте инъекции | Часто |
Желудочно-кишечные расстройства | Дисфагия | Нечасто |
Процент пациентов, прекративших лечение из-за возникновения побочных реакций, в испытаниях фазы 3 составлял 3,8% для препарата БОТОКС® и 1,2% для плацебо.
Нарушение функции мочевого пузыря
Гиперактивность мочевого пузыря.
Таблица 21
Класс систем органов | преференциальный срок | Частота |
Инфекции и инвазии | Инфекция мочевыводящих путей | очень часто |
бактериурия | Часто | |
Почечные расстройства и расстройства мочевыводящей системы | дизурия | очень часто |
Задержка мочеиспускания, поллакиурия, лейкоцитурия | Часто | |
исследования | Неполное опорожнение мочевого пузыря * | Часто |
* Объем мочи при неполном освобождении мочевого пузыря, не требует катетеризации.
Побочными реакциями, связанными с процедурой, с частотой возникновения «часто» были дизурия и гематурия.
В 6,5% пациентов было инициировано применение стерильной перемежающейся катетеризации после лечения БОТОКС®, 100 единиц-Аллерган, по сравнению 0,4% пациентов в группе плацебо.
С 1242 пациентов, участвовавших в плацебо-контролируемых клинических исследованиях, 41,4% пациентов (514 человек) были в возрасте ≥ 65 лет и 14,7% (182 человека) - в возрасте ≥ 75 лет. В этих исследованиях не было выявлено существенных различий в профиле безопасности после лечения БОТОКС® между пациентами в возрасте ≥ 65 лет и пациентами в возрасте <65 лет, за исключением инфекций мочевыводящих путей, чаще возникали у пациентов пожилого возраста в обеих подгруппах по сравнению с младшими участниками исследования.
При повторном применении препарата не наблюдалось изменений в общем профиле безопасности.
Недержание мочи в результате нейрогенной гиперактивности детрузора .
Таблица 22
Класс систем органов | преференциальный срок | Частота |
Инфекции и инвазии | Инфекция мочевыводящих путей a, b, бактериурия b | очень часто |
исследования | Неполное опорожнение мочевого пузыря ** b | очень часто |
психические расстройства | бессонница a | Часто |
Желудочно-кишечные расстройства | Запор a | Часто |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Мышечная слабость a, мышечный спазм a | Часто |
Почечные расстройства и расстройства мочевыводящей системы | Задержка мочеиспускания a, b | очень часто |
Гематурия * a, b, дизурия * a, b, дивертикул мочевого пузыря a | Часто | |
Общие нарушения и реакции в месте введения | Усталость a, нарушение походки a | Часто |
Травмы, отравления и процедурные осложнения | Автономная дизрефлексия * a, слабость a | Часто |
* Побочные реакции, связанные с процедурой.
** Объем мочи при неполном освобождении мочевого пузыря (PVR), не требует катетеризации.
a Побочные реакции, возникавшие во время проведения базовых клинических исследований фазы 2 и 3.
b Побочные реакции, возникавшие во время проведения пострегистрационных исследования применения препарата БОТОКС®, 100 единиц-Аллерган, у пациентов с рассеянным склерозом, которым не осуществлялась катетеризация на базовом уровне.
В клинических исследованиях инфекция мочевыводящих путей наблюдалась в 49,2% пациентов, проходивших лечение препаратом БОТОКС®, 200 единиц-Аллерган, и в 35,7% пациентов группы плацебо (53,0% пациентов с рассеянным склерозом, проходивших лечение препаратом Ботокс ®, 200 единиц-Аллерган, и 29,3% группы плацебо; 45,4% пациентов с повреждением спинного мозга, проходивших лечение препаратом БОТОКС®, 200 единиц-Аллерган, и 41,7% группы плацебо). Задержка мочеиспускания наблюдалась у 17,2% пациентов, проходивших лечение препаратом БОТОКС®, 200 единиц-Аллерган, и в 2,9% пациентов группы плацебо (28,8% пациентов с рассеянным склерозом, проходивших лечение препаратом БОТОКС®, 200 единиц -Аллерган, и 4,5% в группе плацебо; 5,4% пациентов с повреждением спинного мозга, проходивших лечение препаратом БОТОКС®, 200 единиц-Аллерган,
Изменений в типе побочных реакций при повторном применении не наблюдалось.
Различия в годовых показателях обострения рассеянного склероза (то есть количества обострений рассеянного склероза на пациенто-год) не наблюдались (БОТОКС® - 0,23, плацебо - 0,20) у пациентов с рассеянным склерозом, принимавших участие в базовых исследованиях, или в пострегистрационных исследовании препарата БОТОКС®, 100 единиц-Аллерган, у пациентов с рассеянным склерозом, которым осуществляли катетеризацию на базовом уровне (БОТОКС® - 0, плацебо - 0,07).
В базовых исследованиях среди пациентов, которым не проводили катетеризацию на базовом уровне перед инъекцией, катетеризацию проводили 38,9% пациентов после применения препарата БОТОКС®, 200 единиц-Аллерган по сравнению с 17,3% пациентов группы плацебо.
В пострегистрационных исследовании применения препарата БОТОКС®, 100 единиц-Аллерган, у пациентов с рассеянным склерозом, которым осуществляли катетеризацию на базовом уровне, катетеризацию проводили 15,2% пациентов после применения препарата БОТОКС®, 100 единиц-Аллерган по сравнению с 2,6 % пациентов группы плацебо.
Расстройства кожи и подкожной клетчатки
Первичный гипергидроз подмышечных впадин.
Таблица 23
Класс систем органов | преференциальный срок | Частота |
Расстройства нервной системы | Головная боль, парестезии | Часто |
сосудистые расстройства | приливы крови | Часто |
Желудочно-кишечные расстройства | тошнота | Нечасто |
Со стороны кожи и подкожной клетчатки | Гипергидроз (непахвове потение) необычный запах кожи, зуд, подкожные узелки, облысение | Часто |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Боль в конечностях | Часто |
Мышечная слабость, миалгия, артропатия | Нечасто | |
Общие нарушения и реакции в месте введения | Боль в месте инъекции | очень часто |
Боль, отек в месте инъекции, кровоизлияния в месте инъекции, повышенная чувствительность в месте инъекции, раздражение в месте инъекции, астения и реакции в месте инъекции | Часто |
В клинических исследованиях при лечении первичного подмышечного гипергидроза увеличение непахвового потение наблюдалось в течение 1 месяца после инъекции в 4,5% пациентов, локализация в конкретных анатомических участок не проявлялась. Такие признаки исчезали в примерно 30% пациентов в течение четырех месяцев.
О слабости рук сообщалось редко (0,7%), она была умеренной, временной, не требовала лечения и проходила без последствий. Этот отрицательный эффект можно отнести к последствиям лечебных процедур и / или техники выполнения инъекций. В редких случаях мышечной слабости можно провести неврологическое обследование. Кроме того, перед последующими инъекциями можно посоветовать пересмотреть технику их выполнения, чтобы гарантировать их подкожную локализацию.
В неконтролируемом исследовании по безопасности препарата БОТОКС® (50 единиц-Аллерган в каждую подмышечную впадину) с участием пациентов-подростков в возрасте от 12 до 17 лет (144 человека) к побочным реакциям, которые возникали более одного раза (в двух пациентов каждая), относятся боль в месте инъекции и гипергидроз (непахвове потение).
Глабелярни морщины
Таблица 24
Класс систем органов | преференциальный срок | Частота |
Инфекции и инвазии | инфекция | Нечасто |
психические расстройства | тревога | Нечасто |
Расстройства нервной системы | Головная боль, парестезии | Часто |
головокружение | Нечасто | |
Расстройства органов зрения | птоз века | Часто |
Блефарит, боль в глазах, нарушение зрения (включая расплывчатый зрение) | Нечасто | |
Желудочно-кишечные расстройства | тошнота | Часто |
Сухость ротовой полости | Нечасто | |
Со стороны кожи и подкожной клетчатки | Покраснение, напряженность кожи | Часто |
Отек (лицо, веки, периорбитальные), реакция фоточувствительности, зуд, сухость кожи | Нечасто | |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Локализованная мышечная слабость | Часто |
М’язова судома | Нечасто | |
Общие нарушения и реакции в месте введения | Лицевая боль, отек в месте инъекции, экхимозы, боль в месте инъекции, раздражение в месте инъекции | Часто |
Гриппоподобный синдром, астения, лихорадка | Нечасто |
Морщины в форме « гусиных лапок» и / или глабелярни морщины
Нижеприведенные побочные реакции были зарегистрированы при проведении двойных слепых плацебо-контролируемых клинических исследований после инъекций для коррекции морщин в форме «гусиных лапок» вместе с глабелярнимы морщинами или без них.
Таблица 25
Класс систем органов | преференциальный срок | Частота |
Расстройства органов зрения | отек век | Часто |
Общие нарушения и реакции в месте введения | Гематома в месте инъекции * | Часто |
Кровоизлияния в месте инъекции *, боль в месте инъекции *, парестезии в месте инъекции | Нечасто |
* Побочные реакции, связанные с процедурой.
Морщины на лбу и глабелярни морщины с / без морщин в форме "гусиных лапок"
Нижеприведенные побочные реакции были зарегистрированы во время проведения двойных слепых плацебо-контролируемых клинических исследований после инъекции препарата БОТОКС® для одновременной коррекции морщин на лбу и глабелярних морщин с или без морщин в форме "гусиных лапок".
Таблица 26
Классификация систем и органов | преференциальный срок | Частота |
Расстройства нервной системы | Головная боль | Часто |
Расстройства органов зрения | Птоз века 1 | Часто |
Со стороны кожи и подкожной клетчатки | уплотнение кожи | Часто |
Птоз брови 2 | Нечасто | |
Общие нарушения и реакции в месте инъекции | Кровоизлияния в месте инъекции * гематома в месте инъекции * | Часто |
Боль в месте инъекции * | Нечасто |
1 Среднее время до возникновения птоза века составлял 9 дней после инъекции.
2 Среднее время до возникновения птоза брови составил 5 дней после инъекции.
* Побочные реакции, связанные с процедурой
После повторной инъекции общие показатели безопасности остались неизмененными.
Дополнительная информация.
Ниже указан перечень побочных реакций или других побочных эффектов, которые были зарегистрированы после начала продаж препарата без учета показаний и которые могут дополнять побочные реакции, указанные в разделе «Особые меры безопасности » и разделе «Побочные реакции».
Таблица 27
Класс систем органов | преференциальный срок |
Расстройства иммунной системы | Анафилаксия, ангионевротический отек, сывороточная болезнь, крапивница |
Метаболизм и желудочно-кишечные расстройства | анорексия |
Расстройства нервной системы | Бронхиальная плексопатия, дисфония, дизартрия, парез лицевого нерва, гипестезия, мышечная атрофия, миастения гравис, периферическая нейропатия, парестезии, радикулопатия, головокружение, лицевой паралич |
Расстройства органов зрения | Глаукома (при лечении блефароспазма), птоз века, лагофтальмоз, страбизм, расплывчатый зрение, нарушение зрения, сухость глаз |
Расстройства слуха и внутреннего уха | Гипоакузия, ушной шум, головокружение |
сердечные расстройства | Аритмия, инфаркт миокарда |
Респираторные, декабре и медиастинальные нарушения | Аспирационная пневмония (летальная в нескольких случаях), одышка, бронхоспазм, дыхательная недостаточность и остановка дыхания |
Желудочно-кишечные расстройства | Боль в животе, понос, запор, сухость во рту, дисфагия, тошнота, рвота |
Со стороны кожи и подкожной клетчатки | Алопеция, птоз брови, псориазоподобная дерматит, мультиформная эритема, гипергидроз, мадароз, зуд, сыпь |
Скелетно-мышечные расстройства и расстройства соединительной ткани | Мышечная атрофия, миалгия, локализованные мышечные судороги / спонтанные мышечные сокращения |
Общие нарушения и реакции в месте введения | Денервационных атрофия, недомогание, лихорадка |
Срок годности Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum)
3 года.
Препарат нельзя применять после истечения срока годности , указанного на упаковке .
Условия хранения Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum)
Хранить в холодильнике (при температуре от 2 до 8 ° С) или в морозильной камере (при температуре от минус 5 до минус 20 ° С).
Приготовленный раствор во флаконе можно хранить до 24 часов в холодильнике при температуре от 2 до 8 ° С.
После приготовления в шприце раствор использовать немедленно.
Хранить в недоступном для детей месте.
Несовместимость.
Поскольку изучение совместимости не проводилось, этот препарат не следует смешивать с другими лекарственными средствами.
Упаковка
Порошок для приготовления раствора для инъекций по 100 или 200 единиц-Аллерган во флаконе.
По 1 флакону в картонной коробке.
Категория отпуска
По рецепту.
Производитель
Аллерган Фармасьютикалз Ирландия.
Allergan Pharmaceuticals, Ирландия.
Местонахождение производителя
Каслбар Роуд, Вестпорт, Ко. Мое, Ирландия.
Каслбар-роуд, Вестпорт, графство Мейо, Ирландия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Аллерган Фармасьютикалз Ирландия
| Тип данных | Сведения из реестра |
| Торговое наименование: | Ботокс комплекс ботулинического токсина типа А (от Clostridium Botulinum) |
| Производитель: | Аллерган Фармасьютикалз Ирландия |
| Форма выпуска: | порошок для приготовления раствора для инъекций по 100 или 200 единиц-Аллерган; 1 флакон с порошком в картонной коробке |
| Регистрационное удостоверение: | UA/16656/01/01, UA/16656/01/02 |
| Дата начала: | 26.04.2018 |
| Дата окончания: | 26.04.2023 |
| МНН: | Botulinum toxin |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон содержит ботулинического токсина типа А (от Clostridium botulinum) 100 единиц-Аллерган |
| Фармакологическая группа: | Миорелаксанты с периферическим механизмом действия. Ботулинический токсин. |
| Код АТХ: | M03AX01 |
| Заявитель: | Аллерган Фармасьютикалз Ирландия |
| Страна заявителя: | Ирландия |
| Адрес заявителя: | Каслбар Роуд, Вестпорт, Ко. Мое, Ирландия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |