- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Брилинта инструкция по применению
Официальная инструкция лекарственного препарата Брилинта таблетки 90 мг. Описание и применение Brilinta, аналоги и отзывы. Инструкция Брилинта таблетки утвержденная компанией производителем.
Состав
действующее вещество: тикагрелор;
1 таблетка, покрытая оболочкой, содержит 90 мг тикагрелора;
вспомогательные вещества : маннит (Е 421), кальция гидрофосфат, натрия крахмала (тип А), гидроксипропилцеллюлоза, магния стеарат, гипромеллоза 2910, титана диоксид (Е 171), тальк, полиэтиленгликоль 400, железа оксид желтый (Е 172).
Лекарственная форма
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства: круглые, двояковыпуклые, желтые, покрытые пленочной оболочкой таблетки с гравировкой 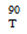 с одной стороны и гладкие с другой.
с одной стороны и гладкие с другой.
Фармакологическая группа
Антитромботическое средство. Ингибиторы агрегации тромбоцитов, кроме гепарина.
Код АТХ B01A C24.
Фармакологические свойства
Фармакологические.
механизм действия
Брилинта содержит тикагрелор, что относится к химическому классу циклопентилтриазолопиримидинив (ЦПТП) и является пероральным, селективным и обратимо связующим антагонистом рецепторов P2Y12 прямого действия, предотвращает АДФ-опосредованным P2Y12-зависимым активации и агрегации тромбоцитов. Тикагрелор не предотвращает связывание АДФ, но будучи связанным с рецептором P2Y12, препятствует АДФ-индуцированной передачи сигналов. Поскольку тромбоциты участвуют в инициации и / или развития тромботических осложнений атеросклероза, угнетение функции тромбоцитов, как было показано, уменьшает риск сердечно-сосудистых событий, таких как смерть, инфаркт миокарда (ИМ) или инсульт.
Тикагрелор также повышает местные уровни эндогенного аденозина, подавляя уравновешивающий нуклеозидный транспортер подтипа 1 (ENT-1).
Было зарегистрировано, что тикагрелор усиливает такие индуцированные аденозином эффекты в здоровых добровольцев и у пациентов с острым коронарным синдромом (ОКС): вазодилатацию (что определяется усилением коронарного кровотока у здоровых добровольцев и пациентов с ОКС, головная боль), угнетение функции тромбоцитов (в цельной крови человека in vitro ) и одышку. Однако связь между наблюдаемым повышением уровней аденозина и клиническими результатами (например, заболеваемость смертность) четко не установлен.
фармакодинамические эффекты
начало действия
У пациентов со стабильной ишемической болезнью сердца (ИБС), которые получают ацетилсалициловую кислоту (АСК), фармакологический эффект тикагрелору проявляется быстро, о чем свидетельствует средний показатель подавление агрегации тромбоцитов (ПАО) тикагрелором через 0,5 часа после применения нагрузочной дозы 180 мг на уровне примерно 41% с максимальным эффектом ПАО на уровне 89% через 2 - 4:00 после применения дозы, который сохранялся в течение 2 - 8:00. В 90% пациентов окончательный показатель ПАО через 2:00 после применения дозы составлял> 70%.
конец действия
Если планируется процедура аортокоронарного шунтирования (АКШ), риск кровотечения у пациентов, применяющих тикагрелор, повышен по сравнению с теми, кто получает клопидогрел, в случае прекращения терапии менее чем за 96 часов до процедуры.
Переход с одного препарата на другой
Переход с приема клопидогреля в дозе 75 мг тикагрелор в дозе 90 мг два раза в сутки приводит к абсолютному увеличению ПАО на 26,4%, а переход с тикагрелору на клопидогрел приводит к абсолютному снижению ПАО на 24,5%. Пациенты могут быть переведены с клопидогреля на тикагрелор без изменения антитромбоцитарной эффекта (см. Раздел «Способ применения и дозы»).
Клиническая эффективность и безопасность
В исследовании PLATO участвовали 18 624 пациентов, в которых за последние 24 часа были отмечены симптомы нестабильной стенокардии, инфаркта миокарда без подъема сегмента ST или инфаркта миокарда с подъемом сегмента ST и которых сначала лечили медикаментозно или с помощью перкутанного коронарного вмешательства (ПКВ) или аортокоронарного шунтирования (АКШ).
клиническая эффективность
На фоне ежедневного приема АСК применения тикагрелору по 90 мг дважды в сутки было более эффективным, чем клопидогреля в дозе 75 мг в сутки, для предотвращения первичной комбинированной конечной точки, включавшей сердечно-сосудистую смерть, инфаркт миокарда (ИМ) или инсульт, за счет разницы в показателях сердечно-сосудистой смерти и ИМ. Пациенты получали нагрузочную дозу 300 мг клопидогреля (в случае ЧКВ - возможно, 600 мг) или 180 мг тикагрелору.
Эффект достигался быстро и сохранялся в течение всего 12-месячного периода лечения, что обеспечивало снижение абсолютного риска (САР) на 1,9% в год и снижение относительного риска (СОР) на 16%. Лечение тикагрелором вместо клопидогреля в 54 пациентов с ОКС позволило предотвратить 1 атеротромботических события; лечение тикагрелором в 91 пациента позволило предотвратить 1 сердечно-сосудистой смерти.
Лечение препаратом Брилинта уменьшало частоту первичной комбинированной конечной точки по сравнению с клопидогрелом как у пациентов с нестабильной стенокардией / ИМ без подъема сегмента ST, так и у пациентов с ИМ с подъемом сегмента ST. Итак, препарат Брилинта в дозе 90 мг два раза в сутки в комбинации с низкими дозами АСК можно назначать пациентам с ОКС (нестабильной стенокардией, инфарктом миокарда без подъема сегмента ST или инфарктом миокарда с подъемом сегмента ST), в том числе пациентам, которых лечат медикаментозно, с помощью перкутанного коронарного вмешательства (ПКВ) или аортокоронарного шунтирования (АКШ).
Генетическое исследование PLATO
Генотипирование 10285 пациентов с CYP2C19 и ABCB1 в исследовании PLATO позволило установить связь между группами по генотипу и результатами исследования PLATO. Преимущества тикагрелору над клопидогрелем в снижении частоты серьезных сердечно-сосудистых событий не зависящим во многом от генотипа CYP2C19 или ABCB1 пациентов. Общая частота больших кровотечений по определению исследования PLATO не отличалась между группами тикагрелору и клопидогреля независимо от генотипа CYP2C19 или ABCB1. Частота не связанных с АКШ больших кровотечений по определению исследования PLATO была повышенной при применении тикагрелору по сравнению с клопидогрелем у пациентов с отсутствием одного или нескольких функциональных аллелей CYP2C19, но подобной таковой при применении клопидогреля у пациентов без потери функциональных аллелей.
Комплексная составляющая эффективности и безопасности
Комплексная составляющая эффективности и безопасности (сердечно-сосудистая смерть, инфаркт миокарда, инсульт или общее количество больших кровотечений по определению исследования PLATO) указывает на то, что преимущества эффективности тикагрелору по сравнению с клопидогрелом НЕ нивелируются случаями больших кровотечений (САР - 1,4%, ЗВР - 8%, ВР - 0,92; p = 0,0257) в течение 12 месяцев после ОКС.
клиническая безопасность
Холтеровское исследования в PLATO
По данным холтеровского мониторинга в рамках исследования PLATO, пациентов, у которых наблюдались эпизоды желудочковой асистолии> 3 секунд в острой фазе острого коронарного синдрома, было больше в группе тикагрелору, чем в группе клопидогреля; такие эпизоды чаще наблюдались у пациентов с хронической сердечной недостаточностью (ХСН) по сравнению с общей популяцией; однако статистически значимой разницы между группами тикагрелору и клопидогреля через месяц не отмечалось. Нежелательных клинических последствий (в том числе обмороки или установки кардиостимулятора) обусловленных с таким расхождением в этой популяции пациентов не наблюдалось.
Фармакокинетика.
Фармакокинетика тикагрелору имеет линейный характер, а экспозиция тикагрелору и его активного метаболита (AR-C124910XX) примерно пропорциональны дозе до 1260 мг.
абсорбция
Тикагрелор всасывается с медианой tmax примерно 1,5 часа. Образование основного циркулирующего метаболита тикагрелору AR-C124910XX (также активного) происходит быстро с медианой tmax примерно 2,5 часа. После приема внутрь разовой дозы 90 мг тикагрелору натощак здоровыми добровольцами Cmax составляет 529 нг / мл, а AUC - 3451 нг * ч / мл. Соотношение метаболита и исходного соединения равна 0,28 для Cmax и 0,42 для AUC.
Рассчитано, что средняя биодоступность тикагрелору составляет 36%. Потребление богатой жирами пищи приводило к росту AUC тикагрелору на 21% и снижение Cmax активного метаболита на 22%, но не влияло на Cmax тикагрелору или AUC активного метаболита. Считается, что эти незначительные изменения имеют минимальное клиническое значение; поэтому тикагрелор можно применять независимо от приема пищи. Тикагрелор, как и его активный метаболит, являются субстратами P-gp.
Тикагрелор в виде измельченных таблеток, смешанных с водой, в случае его перорального применения или введения через назогастральный зонд в желудок имеет биодоступность сравнимую с таковой из целых таблеток, по AUC и Cmax тикагрелору и его активного метаболита. Начальная экспозиция (через 0,5 и 1:00 после применения дозы) измельченных и смешанных с водой таблеток тикагрелору была выше, чем начальная экспозиция целых таблеток, с, как правило, одинаковым профилем концентраций в дальнейшем (через 2 - 48 часов).
распределение
Равновесный объем распределения тикагрелору составляет 87,5 л. Тикагрелор и его активный метаболит в значительной степени связываются с белками плазмы крови человека (> 99,0%).
Метаболизм
CYP3A4 является основным ферментом, который отвечает за метаболизм тикагрелору и образование активного метаболита, а их взаимодействие с другими субстратами CYP3A колеблется от активации к угнетению.
Основным метаболитом тикагрелору является AR-C124910XX, который также является активным, о чем свидетельствует связывания in vitro с тромбоцитарными АДФ-рецепторами P2Y12. Системная экспозиция активного метаболита составляет около 30-40% от системной экспозиции тикагрелору.
вывод
Основным путем выведения тикагрелору является печеночный метаболизм. При применении меченого радиоактивным изотопом тикагрелору средний уровень выводимой радиоактивной метки составляет примерно 84% (57,8% в кале и 26,5% в моче). Содержание тикагрелору и активного метаболита в моче составлял менее 1% от дозы. Основным путем выведения активного метаболита, скорее всего, является секреция с желчью. Средний t1 / 2 тикагрелору составлял примерно 7:00, активного метаболита - 8,5 часа.
Особые группы пациентов
Пациенты пожилого возраста
По данным популяционного фармакокинетического анализа, у пациентов пожилого возраста (в возрасте ≥75 лет) с ОКС наблюдались высокие экспозиции тикагрелору (примерно на 25% как для Cmax, так и для AUC) и активного метаболита, чем у пациентов более молодого возраста. Эти различия не считаются клинически значимыми (см. Раздел «Способ применения и дозы»).
дети
Применение тикагрелору детям изучали (см. Разделы «Способ применения и дозы» и «Фармакологические»).
Стать
У женщин отмечались более высокие экспозиции тикагрелору и активного метаболита, чем у мужчин. Эти различия не считаются клинически значимыми.
Нарушение функции почек
Экспозиция тикагрелору была примерно на 20% ниже, а экспозиция активного метаболита - примерно на 17% выше у пациентов с тяжелым нарушением функции почек (клиренс креатинина <30 мл / мин), чем у пациентов с нормальной функцией почек.
У пациентов с терминальной стадией почечной недостаточности, которые проходят гемодиализ, значение AUC и Cmax тикагрелору 90 мг, в случае применения лекарственного средства в день, когда гемодиализ не проводился, были на 38% и 51% выше, по сравнению с пациентами с нормальной функцией почек . Подобное увеличение экспозиции наблюдалось при применении тикагрелору непосредственно перед диализом (49% и 61% соответственно), что свидетельствует о том, что тикагрелор не выводится из организма с помощью диализа. Экспозиция активного метаболита увеличивалась в меньшей степени (AUC 13-14% и Cmax 17-36%). Ингибирование агрегации тромбоцитов (ИАГ) тикагрелором не зависело от диализа у пациентов с терминальной стадией почечной болезни и была подобной у пациентов с нормальной функцией почек (см. Раздел «Способ применения и дозы».
Нарушение функции печени
Cmax и AUC тикагрелору были соответственно на 12% и 23% выше у пациентов с нарушением функции печени легкой степени по сравнению с соответствующими показателями у здоровых добровольцев. Коррекция дозы пациентам с печеночной недостаточностью легкой степени не нужна. Применение тикагрелору пациентам с умеренной или тяжелой печеночной недостаточностью не исследовался, поэтому применение таким пациентам противопоказано.
Этническая принадлежность
У пациентов азиатского происхождения биодоступность на 39% выше, чем у пациентов европеоидной расы. У пациентов негроидной расы биодоступность тикагрелору была на 18% ниже, чем у пациентов европеоидной расы; в ходе исследования клинической фармакологии экспозиция (Cmax и AUC) тикагрелору у японцев была примерно на 40% (на 20% после поправки на массу тела) выше, чем у представителей европеоидной расы.
Клинические характеристики
Брилинта Показания
Применение препарата Брилинта одновременно с ацетилсалициловой кислотой (АСК) показано для предупреждения атеротромботических событий у взрослых пациентов с острым коронарным синдромом (ОКС).
Противопоказания
Гиперчувствительность к действующему веществу или любому из вспомогательных веществ (см. Раздел «Побочные реакции»).
Активная патологическая кровотечение.
Внутричерепное кровоизлияние в анамнезе (см. Раздел «Побочные реакции»).
Нарушение функции печени умеренной и тяжелой степени (см. Разделы «Способ применения и дозы», «Специальные предостережения и особые меры предосторожности при применении» и «Фармакокинетические свойства»).
Одновременное применение тикагрелору с мощными ингибиторами CYP3А4 (например кетоконазол, кларитромицин, нефазодоном, ритонавиром и атазанавиром) противопоказано, поскольку их одновременное применение может привести к значительному увеличению экспозиции тикагрелору (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Беременность и период кормления грудью.
Детский возраст.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Тикагрелор преимущественно является субстратом CYP3A4 и умеренным ингибитором CYP3A4. Тикагрелор также является субстратом P-гликопротеина (P-gp) и слабым ингибитором P-gp и может повышать экспозицию субстратов P-gp.
Влияние лекарственных средств и других средств на тикагрелор
ингибиторы CYP3A4
- Мощные ингибиторы CYP3A4: одновременное применение кетоконазола и тикагрелору приводило к повышению Cmax и AUC тикагрелору в 2,4 и 7,3 раза соответственно. Cmax и AUC активного метаболита снижались на 89% и 56% соответственно. Ожидается, что другие мощные ингибиторы CYP3A4 (кларитромицин, нефазодон, ритонавир и атазанавир) оказывать такое же влияние, а поэтому одновременное применение мощных ингибиторов CYP3A4 с тикагрелором противопоказано (см. «Противопоказания»).
- Умеренные ингибиторы CYP3A4: одновременное применение дилтиазема с тикагрелором приводило к увеличению Cmax тикагрелору на 69% и AUC в 2,7 раза, а также к снижению Cmax активного метаболита на 38%, при этом его AUC оставалась неизменной. Влияния тикагрелору на плазменные уровни дилтиазема не наблюдалось. Ожидается, что другие умеренные ингибиторы CYP3A4 (например ампренавир, апрепитант, эритромицин и флуконазол) оказывать такое же влияние, а потому могут применяться одновременно с тикагрелором.
- После ежедневного потребления грейпфрутового сока в больших количествах (3 × 200 мл) наблюдалось увеличение экспозиции тикагрелору в 2 раза. Не ожидается, что такое увеличение экспозиции будет клиническое значение для большинства пациентов.
индукторы CYP3A4
Одновременное применение рифампицина с тикагрелором приводило к снижению Cmax и AUC тикагрелору на 73% и 86% соответственно. Cmax активного метаболита оставалась неизменной, тогда как AUC снижалась на 46%. Ожидается, что другие индукторы CYP3A (например фенитоин, карбамазепин и фенобарбитал) также будут приводить к снижению экспозиции тикагрелору. Одновременное применение тикагрелору с мощными индукторами CYP3A может привести к снижению экспозиции и эффективности тикагрелору, поэтому их одновременное применение с тикагрелором не рекомендуется.
Циклоспорин (ингибитор P-gp и CYP3A)
Одновременное применение циклоспорина (600 мг) и тикагрелору приводило к повышению Cmax и AUC тикагрелору в 2,3 и 2,8 раза соответственно. В присутствии циклоспорина AUC активного метаболита росла на 32%, а Cmax снижалась на 15%.
Данные по одновременному применению тикагрелору с другими действующими веществами, также являются мощными ингибиторами P-gp и умеренными ингибиторами CYP3А4 (например с верапамилом, хинидином) и могут вызывать рост экспозиции тикагрелору, отсутствуют. Если комбинации невозможно избежать, одновременное применение этих лекарственных средств следует осуществлять с осторожностью.
другие
Исследование клинической фармакологической взаимодействия показали, что одновременное применение тикагрелору с гепарином, эноксапарином и АСК или десмопрессином не влияет на фармакокинетику тикагрелору или его активного метаболита или на АДФ-индуцированную агрегацию тромбоцитов по сравнению с применением только тикагрелору. При наличии клинических показаний лекарственные средства, влияющие на гемостаз, следует с осторожностью применять в комбинации с тикагрелором.
У пациентов с ОКС, которые получали морфий, наблюдалась задержка и уменьшение экспозиции пероральных ингибиторов P2Y12, в том числе тикагрелору и его активных метаболитов (уменьшение влияния тикагрелору на 35%). Это взаимодействие может быть связана с пониженной моторикой желудочно-кишечного тракта и применяться к другим опиоидных средств. Клиническая значимость такого взаимодействия неизвестна, но данные указывают на возможное снижение эффективности тикагрелору у пациентов, получающих тикагрелор и морфий одновременно. У пациентов с ОКС, применение морфия в которых нельзя отложить, а быстрое ингибирование P2Y12 считается жизненно важным, может быть рассмотрена возможность применения ингибитора P2Y12 с парентеральным введением.
Влияние тикагрелору на другие лекарственные средства
Лекарственные средства, которые метаболизируются CYP3A4
- Симвастатин: одновременное применение тикагрелору с симвастатином увеличивало Cmax симвастатина на 81% и AUC на 56%, а также увеличивало Cmax симвастатиновой кислоты на 64% и AUC на 52% (в отдельных случаях отмечалось увеличение в 2 - 3 раза). Одновременное применение тикагрелору с симвастатином в дозе более 40 мг в сутки может вызвать побочные эффекты симвастатина, что следует взвешивать с возможной пользой. Влияния симвастатина на плазменные уровни тикагрелору не наблюдалось. Тикагрелор может иметь подобное воздействие на ловастатин. Одновременное применение тикагрелору с симвастатином или ловастатином в дозах более 40 мг не рекомендуется.
- Аторвастатин: одновременное применение аторвастатина и тикагрелору увеличивало Cmax аторвастатиновои кислоты на 23% и AUC на 36%. Подобное увеличение AUC и Cmax было отмечено для всех метаболитов аторвастатиновои кислоты. Такое увеличение не считают клинически значимым.
- Нельзя исключить подобное влияние на другие статины, которые метаболизируются CYP3A4. Участники исследования PLATO, которые получали тикагрелор, принимали различные статины, и у 93% таких пациентов никаких проблем с безопасностью статинов не возникало.
Тикагрелор является слабым ингибитором CYP3A4. Одновременное применение тикагрелору и субстратов CYP3A4 с узким терапевтическим индексом (например цизаприда или алкалоидов спорыньи) не рекомендуется, поскольку тикагрелор может увеличивать экспозицию этих лекарственных средств.
Субстраты P-gp (в том числе дигоксин и циклоспорин)
Одновременное применение тикагрелору увеличивало Cmax дигоксина на 75% и AUC - на 28%. Средние минимальные уровни дигоксина увеличивались примерно на 30% при одновременном применении тикагрелору, а в некоторых случаях наблюдалось максимальное увеличение в 2 раза. В присутствии дигоксина Cmax и AUC тикагрелору и его активного метаболита оставались неизмененными. Поэтому в случае одновременного применения P-gp-зависимых лекарственных средств с узким терапевтическим индексом, таких как дигоксин, и тикагрелору рекомендуется надлежащий клинический и / или лабораторный мониторинг.
Влияния тикагрелору на концентрацию циклоспорина в крови не наблюдалось. Влияние тикагрелору на другие субстраты P-gp не изучались.
Лекарственные средства, которые метаболизируются CYP2С9
Одновременное применение тикагрелору с тольбутамидом не меняло плазменных уровней обоих лекарственных средств, что свидетельствует о том, что тикагрелор не является ингибитором CYP2C9, а потому маловероятно, что препарат будет влиять на CYP2C9-опосредованный метаболизм таких лекарственных средств, как варфарин и толбутамид.
пероральные контрацептивы
Одновременное применение тикагрелору и левоноргестрела и этинилэстрадиола увеличивало экспозицию этинилэстрадиола примерно на 20%, но не меняло фармакокинетики левоноргестрела. Не ожидается клинически значимого влияния на эффективность перорального контрацептива в случае одновременного применения левоноргестрела и этинилэстрадиола с тикагрелором.
Лекарственные средства, способные вызывать брадикардию
Поскольку наблюдались случаи преимущественно бессимптомной асистолии желудочков и брадикардии, следует с осторожностью применять тикагрелор одновременно с лекарственными средствами, которые способны вызывать брадикардию (см. Раздел «Особенности применения»). Однако в исследовании PLATO не наблюдалось клинически значимых побочных реакций после одновременного применения одного или нескольких лекарственных средств, способных вызывать брадикардию (например, 96% пациентов одновременно получали бета-блокаторы, 33% - блокаторы кальциевых каналов дилтиазем и верапамил и 4% - дигоксин).
Другая сопутствующая терапия
В исследовании PLATO тикагрелор часто применяли вместе с АСК, ингибиторами протонной помпы, статинами, бета-блокаторами, ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов ангиотензина в течение длительного времени, как того требовали сопутствующие состояния пациентов; а также с гепарином, низкомолекулярным гепарином и ингибиторами GpIIb / IIIa, которые вводили внутришнтовенно, в течение непродолжительного периода (см. раздел «Фармакологические»). Признаков клинически значимых нежелательных взаимодействий с этими лекарственными средствами не наблюдалось.
Одновременное применение тикагрелору с гепарином, эноксапарином или десмопрессином не влияло на активированное частичное тромбопластиновое время (АЧТВ), активированное время свертывания (АВС) или на результаты количественного определения фактора Ха. Однако из-за возможных фармакодинамические взаимодействия следует с осторожностью применять тикагрелор одновременно с лекарственными средствами, способными влиять на гемостаз.
В связи с сообщениями о патологических кожные кровотечения на фоне применения селективных ингибиторов обратного заахоплення серотонина (СИОЗС) (например пароксетина, сертралина и циталопрама), рекомендуется с осторожностью применять СИОЗС с тикагрелором, поскольку это может повысить риск кровотечения.
Особенности применения
риск кровотечения
Применение тикагрелору пациентам с известным повышенным риском кровотечения следует взвешивать, учитывая пользу от препарата для профилактики атеротромботических событий (см. Разделы «Побочные реакции» и «Фармакологические»). При наличии клинических показаний тикагрелор следует с осторожностью применять таким группам пациентов:
- Пациентам со склонностью к кровотечению (например, в связи с недавними травмами или недавними хирургическими вмешательствами, расстройствами свертывания крови, активной или недавно перенесенной желудочно-кишечным кровотечением). Применение тикагрелору противопоказано пациентам с активной патологической кровотечением, с внутричерепным кровоизлиянием в анамнезе и пациентам с нарушением функции печени умеренной и тяжелой степени (см. Раздел «Противопоказания»).
- Пациентам, которые одновременно применяют лекарственные средства, способные повышать риск кровотечения (например нестероидные противовоспалительные препараты (НПВП), пероральные антикоагулянты и / или фибринолитические средства), в течение 24 часов применения тикагрелору.
Переливание тромбоцитарной массы не нивелировало антитромбоцитарных эффект тикагрелору у здоровых добровольцев и, вероятно, не будет эффективным для лечения пациентов с кровотечением. Поскольку одновременное применение тикагрелору с десмопрессином не приводил к уменьшению времени кровотечения по методу шаблона, маловероятно, что десмопрессин будет эффективным для лечения клинической кровотечения (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Применение антифибринолитических средств (аминокапроновой кислоты или транексамовой кислоты) и / или рекомбинантного фактора VIIа может повысить гемостаз. Применение тикагрелору можно восстановить после того, как причина кровотечения будет установлена и контролируема.
хирургическое вмешательство
Пациентам необходимо посоветовать, чтобы они сообщали врачам и стоматологам, принимающих тикагрелор, к планированию любого хирургического вмешательства и перед применением любого нового лекарственного средства.
В исследовании PLATO у пациентов, которым проводилось аортокоронарное шунтирование (АКШ), в группе тикагрелору случаев кровотечения было больше, чем в группе клопидогреля, в случае прекращения терапии за 1 сутки до операции, но большие кровотечения наблюдались с такой же частотой, как и в группе клопидогреля, в случае прекращения терапии по 2 или более дней до оперативного вмешательства (см. раздел «Побочные реакции»). Если пациент нуждается планового хирургического вмешательства, и антитромбоцитарных эффект является нежелательным, применение тикагрелору следует прекратить за 5 дней до операции (см. Раздел «Фармакологические»)
Пациенты с риском брадикардии
По результатам холтеровского мониторирования ЭКГ выявлено повышение частоты эпизодов преимущественно бессимптомной асистолии желудочков во время лечения тикагрелором по сравнению с клопидогрелем. Пациентов с повышенным риском брадикардии (например пациентов без кардиостимулятора с синдромом слабости синусового узла, AV-блокадой 2-го или 3-й степени или обмороки, обусловленным брадикардией) не включали в основные исследования, в которых оценивали безопасность и эффективность тикагрелору. Поэтому, в связи с ограниченным клиническим опытом, тикагрелор следует с осторожностью применять таким пациентам (см. Раздел «Фармакологические»).
Кроме этого, осторожность необходимо соблюдать при одновременном применении тикагрелору с лекарственными средствами, способными вызвать брадикардию. Однако в исследовании PLATO не наблюдалось признаков клинически значимых побочных реакций после одновременного применения одного или нескольких лекарственных средств, способных вызывать брадикардию (например, 96% пациентов принимали бета-блокаторы, 33% - блокаторы кальциевых каналов дилтиазем и верапамил и 4% - дигоксин) ( см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Во время холтеровского пиддослидження в рамках исследования PLATO эпизоды асистолии желудочков длительностью ≥3 секунд в течение острой фазы ГКС чаще наблюдались при применении тикагрелору, чем клопидогреля. Увеличение частоты выявленных с помощью холтеровского мониторинга эпизодов желудочковой асистолии при применении тикагрелору было более выраженным у пациентов с хронической сердечной недостаточностью (ХСН), чем в общей популяции исследования во время острой фазы ОКС, но этой разницы уже через месяц лечения тикагрелором или по сравнению с клопидогрелом не наблюдалось. Нежелательных клинических последствий, связанных с такой расхождением (в том числе обмороки или установки кардиостимулятора), в этой популяции пациентов не наблюдалось (см. Раздел «Фармакологические»).
одышка
Следует с осторожностью применять тикагрелор пациентам с бронхиальной астмой и / или ХОБЛ в анамнезе. Механизм развития этого явления не выяснен. Если пациент сообщает о появлении, большую продолжительность или усиление одышки, следует выполнить полное обследование, а при наличии непереносимости препарата, следует прекратить лечение тикагрелором. Более подробную информацию см. в разделе «Побочные реакции».
Повышение уровня креатинина
Во время лечения тикагрелором рекомендуется также проверить функцию почек (определить уровень креатинина) через месяц после начала лечения, уделяя особое внимание пациентам в возрасте ≥75 лет, пациентам с нарушением функции почек умеренного / тяжелой степени, а также тем, кто одновременно применяет блокаторы рецепторов ангиотензина ( БРА).
Повышение уровня мочевой кислоты
При лечении пациентов с гиперурикемией или подагрического артрита в анамнезе следует соблюдать осторожность. В качестве меры пресечения применения тикагрелору пациентам с Мочекислый нефропатией не рекомендуется.
Другое
Одновременное применение тикагрелору и высоких поддерживающих доз АСК (> 300 мг) не рекомендуется.
Лекарственное средство Брилинта содержит менее 1 ммоль (23 мг) / дозу натрия, то есть практически свободный от натрия.
Преждевременное прекращение лечения
Преждевременное прекращение применения любого антитромбоцитичного средства, в том числе препарата Брилинта, может привести к повышению риска сердечно-сосудистой смерти, ИМ или инсульта вследствие основного заболевания пациента. Поэтому преждевременной отмены лечения следует избегать.
Применение в период беременности или кормления грудью
Женщины репродуктивного возраста
Женщинам репродуктивного возраста следует применять соответствующие средства контрацепции, чтобы избежать беременности во время лечения тикагрелором.
беременность
Данные по применению тикагрелору беременным женщинам отсутствуют или ограничены. В ходе исследований на животных было отмечено репродуктивной токсичности. Тикагрелор противопоказан при беременности.
кормление грудью
Имеющиеся данные исследований фармакодинамики / токсикологии в животных свидетельствуют, что тикагрелор и его активный метаболит выделяются в грудное молоко. Невозможно исключить риск для новорожденного / грудного ребенка. Решение о прекращении кормления грудью или прекращения / отказа от лечения тикагрелором необходимо принимать, учитывая пользу грудного кормления для ребенка и пользу терапии для женщины.
репродуктивная функция
Тикагрелор не влиял на фертильность самцов и самок животных.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Тикагрелор не влияет или влияет незначительно на способность управлять транспортными средствами и работать с другими механизмами. Сообщалось о случаях головокружение и спутанность сознания во время лечения тикагрелором. Поэтому пациентам, в которых появляются эти симптомы, следует быть осторожными при управлении транспортными средствами или работы с другими механизмами.
Способ применения Брилинта и дозы
дозировка
Пациентам, принимающим препарат Брилинта, следует также ежедневно принимать АСК в поддерживающей дозе 75 - 150 мг, если для этого нет особых противопоказаний.
Лечение препаратом Брилинта необходимо начинать с разовой нагрузочной дозы 180 мг (две таблетки по 90 мг) и в дальнейшем принимать по 90 мг дважды в сутки. Рекомендуемая продолжительность лечения Брилинта в дозе 90 мг для пациентов с ОКС составляет 12 месяцев при отсутствии клинических показаний для преждевременного прекращения лечения (см. Раздел «Фармакологические»).
Опыт применения препарата в течение более 12 месяцев ограничен.
Превышать максимальную суточную дозу 180 мг.
При необходимости перехода с другого лекарственного средства на препарат Брилинта первую дозу препарата Брилинта следует принять через 24 часа после приема последней дозы другого антитромботического препарата.
Пропуск доз и
Следует также избегать пропусков приема препарата. Если пациент пропустил дозу препарата Брилинта, ему следует принять только одну таблетку (следующую дозу) в назначенное время.
Особые группы пациентов
Пациенты пожилого возраста
Коррекция дозы у пациентов пожилого возраста не требуется (см. Раздел «Фармакологические»).
Нарушение функции почек
Коррекция дозы пациентам с нарушением функции почек не требуется (см. Раздел «Фармакологические»).
Нарушение функции печени
Коррекция дозы пациентам с печеночной недостаточностью легкой степени не нужна. Применение тикагрелору пациентам с умеренной или тяжелой печеночной недостаточностью не исследовался, поэтому применение таким пациентам противопоказано.
способ применения
Для перорального применения.
Препарат Брилинта можно применять независимо от приема пищи.
Для пациентов, которые не могут проглотить таблетку целиком, таблетку можно измельчить в порошок, смешать с половиной стакана воды и сразу выпить. Стакан необходимо промыть, использовав еще полстакана воды и выпить содержимое стакана. Смесь можно вводить через назогастральный зонд (СН8 или больше). Важно промыть назогастральный зонд водой после введения смеси.
Дети
Безопасность и эффективность применения тикагрелору детям (в возрасте до 18 лет) не установлены. Применение противопоказано.
Передозировка
Тикагрелор хорошо переносится в разовых дозах до 900 мг. Желудочно-кишечная токсичность была дозолимитирующим в исследовании с нарастающими разовыми дозами. Другими клинически значимыми побочными реакциями, которые могут возникать в случае передозировки, является одышка и эпизоды желудочковой асистолии (см. Раздел «Побочные реакции»).
В случае передозировки могут возникать вышеупомянутые потенциальные побочные реакции, поэтому следует рассмотреть возможность ЭКГ-мониторинга.
На сегодняшний день антидот для тикагрелору неизвестен; тикагрелор не выводится с помощью диализа (см. раздел «Фармакокинетика»). Лечение передозировки следует проводить в соответствии с местными стандартами медицинской практики. Ожидаемым следствием чрезмерного дозирования тикагрелору является увеличение продолжительности риска кровотечения в связи с угнетением тромбоцитов. Маловероятно, что переливание тромбоцитарной массы будет эффективным методом лечения пациентов с кровотечением (см. Раздел «Особенности применения»). В случае возникновения кровотечения следует принять другие соответствующие поддерживающих мероприятий.
Побочные эффекты
Наиболее частыми побочными реакциями, о которых сообщали у пациентов, получавших лечение тикагрелором, были кровотечение и одышка (см. Раздел «Особенности применения»).
Следующие побочные реакции были обнаружены в ходе клинических исследований или о них сообщали при постмаркетинговом применении тикагрелору (см. Таблицу).
Нижеприведенные реакции приведены по классам систем органов Медицинского словаря нормативно-правовой деятельности (MedDRA). В пределах каждого класса системы органов побочные реакции классифицированы в группы по частоте. Группы по частоте определяются согласно следующим критериям: очень часто (≥ 1/10), часто (≥ 1/100 до <1/10); редкие (от ≥ 1/1000 до <1/100); редкие (от ≥ 1/10000 до <1/1000); очень редкие (<1/10 000) частота неизвестна (не может быть рассчитана по имеющимся данным).
Классы систем органов | очень часто | Часто | Нечасто |
Доброкачественные, злокачественные и неуточненной характера новообразования (в том числе кисты и полипы) | Кровотечения из опухоли a | ||
Со стороны крови и лимфатической системы | Кровотечения на фоне нарушение свертываемости крови b | ||
Со стороны иммунной системы | Гиперчувствительность, в том числе ангионевротический отек c | ||
Метаболические и алиментарные расстройства | Гиперурикемия d | Подагра / подагрический артрит | |
психические расстройства | утрата сознания | ||
Со стороны нервной системы | Головокружение, обмороки, головная боль | внутричерепное кровоизлияние | |
Со стороны органов зрения | Кровоизлияние в глаз е | ||
Со стороны органов слуха и равновесия | Системное головокружение (вертиго) | ушное кровотечение | |
Со стороны сосудов | гипотензия | ||
Со стороны дыхательной системы | Диспное | Кровотечения из органов дыхания f | |
Со стороны желудочно-кишечного тракта | Желудочно-кишечная кровотечение g, тошнота, диспепсия, запор | ретроперитонеальные кровотечение | |
Со стороны кожи и подкожной клетчатки | Кровоизлияния в подкожную клетчатку или в кожу h, сыпь, зуд | ||
Со стороны скелетной мускулатуры и соединительной ткани | Кровоизлияния в мышцы i | ||
Со стороны почек и мочевыводящей системы | Кровотечения из мочевыводящих путей j | ||
Со стороны репродуктивной системы и молочной железы | Кровотечения в репродуктивной системы k | ||
Расстройства, выявленные по результатам обследования | Повышенный уровень креатинина в крови d | ||
Травмы, отравления, осложнения процедур | Кровотечение после проведения процедуры, травматическое кровотечение l |
a например кровотечение из злокачественной опухоли мочевого пузыря, желудка, толстой кишки
b например повышенная склонность к образованию синяков, спонтанная гематома, геморрагический диатез
c обнаружено в пострегистрационный период
d частота установлена на основе лабораторных данных (рост уровня мочевой кислоты выше верхней границы нормы от исходного уровня, который был ниже нормального диапазона или отвечал ему, повышение уровня креатинина> 50% от исходного уровня) и не отражает частоту сообщений о нежелательное явление
e например кровоизлияние в конъюнктиву, сетчатку, внутриглазное кровоизлияние
f например носовое кровотечение, кровохарканье
g например кровотечение из десен, ректальное кровотечение, кровотечение из язвы желудка
h например экхимозы, кровоизлияние в кожу, петехии
i например гемартроз, кровоизлияние в мышцу
j например гематурия, геморрагический цистит
k например вагинальное кровотечение, гематоспермия, постменопаузального кровотечение
l например ушиб, травматическая гематома, травматическая кровотечение
Описание отдельных нежелательных реакций
кровотечения
Случаи кровотечений в исследовании PLATO
Тикагрелор и клопидогрел не отличались по критериям PLATO частотой больших роковых / угрожающих жизни кровотечений, общим количеством крупных кровотечений, частотой больших кровотечений по критериям TIMI или частотой малых кровотечений по критериям TIMI. Однако частота комбинированных PLATO больших и малых кровотечений была выше в группе тикагрелору по сравнению с группой клопидогреля. Несколько пациентов в исследовании PLATO имели роковые кровотечения: 20 (0,2%) в группе тикагрелору и 23 (0,3%) в группе клопидогреля (см. Раздел «Особенности применения»).
Возраст, пол, масса тела, расовая принадлежность, географический регион, сопутствующие состояния, одновременное лечение и медицинский анамнез, в том числе перенесены инсульт или транзиторная ишемическая атака не были прогностическими факторами для общей частоты кровотечений или частоты больших кровотечений в исследовании PLATO, не пол "связанных с процедурами. Итак, ни одна группа не была определена как группа повышенного риска кровотечения определенному типу.
Кровотечения, связанные с АКШ. М астота больших роковых / угрожающих жизни кровотечений по критериям PLATO у пациентов, которым было проведено аортокоронарное шунтирование (АКШ), была подобной в группах лечения тикагрелором и клопидогрелем.
Кровотечения, не связанные с АКШ, и кровотечения, не связанные с процедурами. Тикагрелор и клопидогрел не отличались по частоте не связанных с АКШ роковых / угрожающих жизни больших кровотечений по критериям PLATO, но общая частота крупных кровотечений по критериям PLATO, частота больших кровотечений по критериям Тиме и общая частота крупных + малых кровотечений по критериям TIMI были выше в группе лечения тикагрелором. Аналогично, если исключить все связанные с процедурами кровотечения, то их частота была выше в группе тикагрелору сравнению с группой клопидогреля.
Внутричерепное кровоизлияние. При применении тикагрелору было больше внутричерепных кровоизлияний, не связанных с процедурами (0,3%), чем при применении клопидогреля (0,2%). Разницы в общей частоте фатальных кровотечений не было.
одышка
Пациенты, которых лечили препаратом Брилинта, сообщали о одышку, чувство нехватки воздуха. В исследовании PLATO о таком побочное явление (ПЯ), как одышка (одышка, одышка в покое, одышка при физической нагрузке, пароксизмальная ночная одышка и ночная одышка), в общем сообщалось в 13,8% пациентов, леченных тикагрелором, и в 7, 8% пациентов, леченных клопидогрелем. В исследовании PLATO в 2,2% пациентов, получавших тикагрелор, и в 0,6% пациентов, получавших клопидогрел, исследователи считали одышку связанной с лечением, некоторые из этих случаев были серьезными (0,14% в группе тикагрелору; 0,02% в группе клопидогреля) (см. раздел «Особенности применения»). Чаще всего симптомы одышки были легкими или умеренными; в большинстве случаев сообщалось о разовом приступ, который имел место вскоре после начала лечения.
По сравнению с применений клопидогреля, пациенты с бронхиальной астмой / ХОБЛ, получающих тикагрелор, могут иметь повышенный риск возникновения несерьезных случаев одышки (3,29% при применении тикагрелору и 0,53% при применении клопидогреля) и серьезных случаев одышки (0,38 % при лечении тикагрелором и 0,00% при лечении клопидогрелем). В абсолютном выражении этот риск был выше, чем в общей популяции исследования PLATO. Тикагрелор следует с осторожностью применять пациентам с бронхиальной астмой и / или ХОБЛ в анамнезе (см. Раздел «Особенности применения»).
Примерно 30% эпизодов одышки прошли в течение 7 дней. В исследование PLATO включали пациентов с такими заболеванием исходном уровне, как застойная сердечная недостаточность, ХОБЛ или бронхиальная астма; эти пациенты, а также пациенты пожилого возраста имели большую склонность к развитию одышки. 0,9% пациентов, получавших препарат Брилинта, преждевременно прекратили лечение исследуемым препаратом из-за появления одышки по сравнению с 0,1% пациентов, получавших клопидогрел. Высокая частота одышки при применении препарата Брилинта не связана с развитием новой или ухудшением течения имеющейся болезни сердца или легких (см. Раздел «Особенности применения»). Брилинта не влияет на результаты исследования легочной функции.
Данные лабораторных исследований
В исследовании PLATO концентрация креатинина сыворотки крови повысилась более чем на 30% в 25,5% пациентов, получавших тикагрелор, по сравнению с 21,3% пациентов, получавших клопидогрел, и на более чем 50% в 8,3% пациентов, лечившихся тикагрелором, по сравнению с 6,7%, которые лечились клопидогрелем. Повышение уровня креатинина более чем на 50% было более выраженным у пациентов старше 75 лет (13,6% пациентов, получавших тикагрелор, и 8,8% пациентов, получавших клопидогрел), у пациентов с тяжелой почечной недостаточностью на начальной стадии (17 , 8% и 12,5% соответственно) и у пациентов, получающих сопутствующее лечение блокаторами рецепторов ангиотензина (11,2% и 7,1% соответственно). В этих подгруппах серьезные нежелательные явления связаны с почечной системой и такие, которые привели к отмене препарата, были подобными в исследуемых группах. Почечно-связанных нежелательных явлений было сообщено в совокупности 4,9% для тикагрелору и 3,8% для клопидогреля. Однако процент случаев, которые были уведомлены пациентами и были определены врачами как имеющие причинная связь с лечением, был подобен и составлял 54 (0,6%) для тикагрелору и 43 (0,5%) для клопидогреля.
Повышение уровня мочевой кислоты: в исследовании PLATO концентрация мочевой кислоты повысилась более верхней границы нормы у 22% пациентов, получавших тикагрелор, по сравнению с 13% пациентов, получавших клопидогрел. Средний уровень мочевой кислоты в сыворотке повысилась примерно на 15% при применении тикагрелору по сравнению с примерно 7,5% при применении клопидогреля, а после прекращения лечения снизился примерно на 7% при применении тикагрелору, но не снизился при применении клопидогреля. В исследовании PLATO частота подагрического артрита составила 0,2% при применении тикагрелору и 0,1% при применении клопидогреля.
Сообщение о подозреваемых нежелательные реакции
Сообщение о подозреваемых побочные реакции после выхода лекарственного средства на рынок важно. Это позволяет осуществлять длительный мониторинг соотношения польза / риск для этого лекарственного средства. Медицинских работников просят сообщать о любых подозреваемые побочные реакции.
Срок годности Брилинта
3 года.
Условия хранения Брилинта
Хранить в недоступном для детей месте. Хранить при температуре не выше 30 0С.
Упаковка
14 таблеток в блистере. По 1 или 4 блистера в картонной коробке.
Категория отпуска
По рецепту.
Производитель
AstraZeneca AB.
Местонахождение производителя
Гертуневеген, Содерталье, 151 85, Швеция / Gartunavagen, Sodertalje, 151 85, Sweden.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Брилинта только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- «АстраЗенека» АБ
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Брилинта |
| Производитель: | «АстраЗенека» АБ |
| Форма выпуска: | таблетки, покрытые оболочкой 90 мг по 14 таблеток в блистере, по 1 или 4 блистера в картонной коробке |
| Регистрационное удостоверение: | UA/12164/01/01 |
| Дата начала: | 06.04.2017 |
| Дата окончания: | неограниченный |
| МНН: | Ticagrelor |
| Условия отпуска: | по рецепту |
| Состав: | 1 таблетка, покрытая оболочкой, содержит 90 мг тикагрелору |
| Фармакологическая группа: | Антитромботический средство. Ингибиторы агрегации тромбоцитов, кроме гепарина. |
| Код АТХ: | B01AC24 |
| Заявитель: | АстраЗенека АБ |
| Страна заявителя: | Швеция |
| Адрес заявителя: | SE-151 85 Содерталье, Швеция |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| B | Средства, влияющие на систему крови и гемопоэз |
| B01 | Антикоагулянты |
| B01A | Антикоагулянты |
| B01AC | Антиагреганты |
| B01AC24 | Тикагрелор |
