- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/16651/01/01, UA/16651/01/02 закончился 26.04.2023
Варгатеф инструкция по применению
Официальная инструкция лекарственного препарата Варгатеф капсулы 100 мг, 150 мг. Описание и применение Vargatef, аналоги и отзывы. Инструкция Варгатеф капсулы утвержденная компанией производителем.
Состав
действующее вещество: нинтеданиб; 1 капсула мягкая содержит 100 мг или 150 мг нинтеданиба (в виде эзилата).
Вспомогательные вещества: триглицериды со средней, твердый жир, лецитин (соевый) (Е 322);
оболочка капсулы: желатин, глицерин 85%, титана диоксид (Е 171), железа оксид красный (Е172), железа оксид желтый (Е172) чернила черного цвета для маркировки капсул: шеллак, этанол, пропиленгликоль (Е 1520), железа оксид черный (Е172).
Лекарственная форма
Капсулы мягкие.
Основные физико-химические свойства:
ВАРГАТЕФ. капсулы мягкие по 100 мг
Продолговатые непрозрачные мягкие желатиновые капсулы персикового цвета, с одной стороны черными чернилами нанесен логотип компании «Boehringer Ingelheim» и маркировку «100». Капсулы содержат вязкую суспензию ярко-желтого цвета.
ВАРГАТЕФ. капсулы мягкие по 150 мг
Продолговатые непрозрачные мягкие желатиновые капсулы коричневого цвета, с одной стороны черными чернилами нанесен логотип компании «Boehringer Ingelheim» и маркировку «150». Капсулы содержат вязкую суспензию ярко-желтого цвета.
Фармакологическая группа
Антинеопластичес средства. Ингибиторы протеинкиназы.
Код ATX L01X Е31.
Фармакологические свойства
Фармакологические
Механизм действия Нинтеданиб является ингибитором ангиокиназы тройного действия, который блокирует рецепторы фактора роста эндотелия сосудов (VEGFR 1-3), рецепторов тромбоцитарного фактора роста (PDGFR а и ß), рецепторы фактора роста фибробластов (FGFR 1-3), через которые осуществляется активность киназы . Нинтеданиб конкурентно взаимодействует с аденозинтрифосфат (АТФ) -связывающих участком этих рецепторов и блокирует внутриклеточную передачу сигналов, которая важна для пролиферации и выживания эндотелиальных. а также периваскулярных клеток (перицитов и гладкомышечных клеток сосудов). Кроме того, нинтеданиб ингибирует киназы Flt-3 (Fms-образная белковая Тирозинкиназа), Lek (лимфоцит-специфическая белковая Тирозинкиназа), Lyn (белковая Тирозинкиназа ИУП) и Src (протоонкогенна белковая Тирозинкиназа Src).
Фармакологические
Опухолевый ангиогенез - это особый процесс, способствует росту опухоли, прогрессированию заболевания и образованию метастазов. Этот процесс преимущественно запускается проангиогенных факторами, секретируемые опухолевыми клетками (в частности, VEGF и bFGF), чтобы привлечь эндотелиальные и периваскулярные клетки хозяина и облегчить доставку кислорода и питательных веществ через сосудистую систему хозяина. В доклинических моделях заболевания нинтеданиб в качестве монотерагиии эффективно противодействовал образованию и развитию сосудистой системы опухоли, что приводило к замедлению и остановке роста опухоли. В частности, лечение ксенотрансплантатов опухоли нинтеданибом приводило к быстрому уменьшению плотности микрососудов опухоли, покрытие перицитами сосудов и перфузии опухоли. Измерение методом динамической контрастной магнитно-резонансной томографии показали антиангиогенный эффект нинтеданибу у людей. Он не полностью зависел от дозы, но большинство реакций наблюдалась при дозах> 200 мг. Логистическая регрессия выявила статистически значимую связь ангиогенного эффекта с экспозицией нинтеданибу. Эффект динамической контрастной магнитно-резонансной томографии наблюдался через 24 - 48 часов после первого приема препарата и был сохранен или даже увеличен после длительного лечения в течение нескольких недель. Не установлено взаимосвязи ответы, обнаруженной методом динамической контрастной магнитно-резонансной томографии, и последующего клинически значимого снижения размера поражения мишени, но ответ, обнаружена методом динамической контрастной магнитно-резонансной томографии,
Абсорбция Максимальная концентрация нинтеданибу в плазме крови достигается через 2-4 часа после приема препарата в форме мягких желатиновых капсул во время еды (диапазон 0,5-8 часов). Биодоступность дозы 100 мг составляет у здоровых добровольцев 4,69% (90% ДИ: 3,615-6,078). Абсорбция и биодоступность уменьшаются вследствие действия транспортера и существенного пресистемного метаболизма. Установлено, что экспозиция нинтеданибу увеличивается пропорционально дозе (в диапазонах доз 50 ^ 450 мг один раз в сутки и 150-300 мг дважды в сутки).
Устойчивые концентрации в плазме крови достигаются, как максимум, в течение одной недели после начала приема. Экспозиция нинтеданибу увеличивается после еды примерно на 20% по сравнению с приемом препарата натощак (ДИ: 95,3-152,5%), а всасывание замедляется (медиана времени достижения максимальной концентрации в плазме крови натощак (tmax) - 2.00 часа: после еды -3.98 часа). Распределение распределение нинтеданибу осуществляется путем двухфазной кинетики. После инфузии наблюдается большой объем распределения (Vss) 1050 л, геометрический коэффициент вариации (gCV) 45.0%). Связывание нинтеданибу с белками плазмы in vitro считается значительным, связанная фракция составляет 97.8%. Основным белком, участвует в связывании, считается альбумин сыворотки крови. Нинтеданиб преимущественно распределяется в плазме, соотношение кровь / плазма составляет 0. 869, Метаболизм Основной реакцией, участвует в метаболизме нинтеданибу, является гидролитическое расщепление с помощью эстераз. что приводит к образованию свободного кислого метаболита нинтеданибу (BIBF 1202). В дальнейшем BIBF 1202 глюкуронизуеться ферментами уридин-5-дифосфат-глюкуронозилтрасферазы (UGT). а именно UGT 1А1, UGT 1А7, UGT 1А8 и UGT 1А10, с образованием глюкуронида BIBF 1202.
Метаболизм нинтеданибу с участием изоферментов CYP происходит лишь в незначительной степени; основную роль в этом процессе играет изофермент CYP ЗА4. В исследовании ADME у человека основной метаболит, который образуется при участии изоферментов CYP. обнаружить в плазме не удалось. По данным исследования in vitro CYP-зависимый метаболизм составляет примерно 5%, тогда как расщепление, осуществляемое эстеразами, составляет 25%. В доклинических исследованиях in vivo BIBF 1202 не показал эффективность, несмотря на его активность на целевых рецепторах субстанции. Общий клиренс плазмы после инфузии является высоким (СИ: 1390 мл / мин, gCV - 28.8%). Выведение с мочой неизмененного активного вещества в течение 48 часов после приема нинтеданибу внутренне составляет примерно 0.05% от величины дозы (gCV - 31.5%), а после введения - примерно 1.4% (gCV - 24 2%); почечный клиренс составляет 20 мл / мин (gCV - 32,6%). После приема внутрь [И4С] -нинтеданибу радиоактивный материал выводился преимущественно с желчью и оказывался в кале (93.4% дозы. GCV - 2.61%). Доля почечной экскреции в общем клиренсе низкая (0.649% дозы (gCV - 26,3%)). Вывод считается полным (более 90%) через 4 дня после приема. Период полувыведения нинтеданибу в терминальной стадии составляет от 10 до 15 часов (gCV примерно 50%).
Линейность / нелинейность Можно предположить, что фармакокинетика (ФК) нинтеданибу линейная относительно времени (то есть данные по применению разовой дозы могут быть экстраполированы на данные по многократного использования). Значение Стах в результате накопления препарат) после многократного применения превышает показатель Сщах разовой дозы в 1,04 раза, а значение AUCT - в 1,38 раза. Минимальные окончательные концентрации нинтеданибу остаются стабильными в течение более одного года. Вывод Общий клиренс плазмы после инфузии является высоким (СИ: 1390 мл / мин, gCV - 28.8%). Выведение с мочой неизмененного активного вещества в течение 48 часов после приема нинтеданибу внутренне составляет примерно 0.05% от величины дозы (gCV - 31.5%), а после введения - примерно 1.4% (gCV - 24,2%); почечный клиренс составляет 20 мл / мин (gCV - 32,6%). После приема внутрь [И4С] -нинтеданибу радиоактивный материал выводился преимущественно с желчью и оказывался в кале (93.4% дозы. GCV - 2.61%). Доля почечной экскреции в общем клиренсе низкая (0.649% дозы (gCV - 26,3%)). Вывод считается полным (более 90%) через 4 дня после приема. Период полувыведения нинтеданибу в терминальной стадии составляет от 10 до 15 часов (gCV примерно 50%).
Линейность / нелинейность Можно предположить, что фармакокинетика (ФК) нинтеданибу линейная относительно времени (то есть данные по применению разовой дозы могут быть экстраполированы на данные по многократного использования). Значение Стах в результате накопления препарат) после многократного применения превышает показатель Сщах разовой дозы в 1,04 раза, а значение AUCT - в 1,38 раза. Минимальные окончательные концентрации нинтеданибу остаются стабильными в течение более одного года. Другая информация о межлекарственного взаимодействия Метаболизм не ожидается межлекарственного взаимодействия между нинтеданибом и субстратами CYP, ингибиторами CYP или индукторами CYP. поскольку нинтеданиб, BIBF 1202 и глюкуронид BIBF 1202 НЕ ингибувалы либо не индуцировали ферменты CYP во время клинических исследований, а также должным образом не метаболизувався ферментами CYP. Транспортировка Нинтеданиб является субстратом P-gp. Более подробная информация о возможном взаимодействии нинтеданибу с этим транспортером приведена в разделе «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий». Было показано, что нинтеданиб не является субстратом или ингибитором ОАТР-1В1, ОАТР-1ВЗ, ОАТР-2В1, ОСТ-2 или MRP-2 in vitro. Нинтеданиб также не является субстратом BCRP. Наблюдался лишь слабый ингибирующий потенциал в OCT-1. BCRP и P-gp in vitro, что имеет низкую клиническую значимость, что также может быть применено для нинтеданибу как субстрата ОСТ-1. Взаимосвязь между фармакокинетикой и фармакодинамики В исследовательских фармакокинетических анализах побочных реакций высокая экспозиция нинтеданибу как правило, была связана с повышением уровня печеночных ферментов, а не с побочными реакциями со стороны желудочно-кишечного тракта. Более подробная информация о возможном взаимодействии нинтеданибу с этим транспортером приведена в разделе «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий». Было показано, что нинтеданиб не является субстратом или ингибитором ОАТР-1В1, ОАТР-1ВЗ, ОАТР-2В1, ОСТ-2 или MRP-2 in vitro. Нинтеданиб также не является субстратом BCRP. Наблюдался лишь слабый ингибирующий потенциал в OCT-1. BCRP и P-gp in vitro, что имеет низкую клиническую значимость, что также может быть применено для нинтеданибу как субстрата ОСТ-1. Взаимосвязь между фармакокинетикой и фармакодинамики В исследовательских фармакокинетических анализах побочных реакций высокая экспозиция нинтеданибу как правило, была связана с повышением уровня печеночных ферментов, а не с побочными реакциями со стороны желудочно-кишечного тракта. Более подробная информация о возможном взаимодействии нинтеданибу с этим транспортером приведена в разделе «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий». Было показано, что нинтеданиб не является субстратом или ингибитором ОАТР-1В1, ОАТР-1ВЗ, ОАТР-2В1, ОСТ-2 или MRP-2 in vitro. Нинтеданиб также не является субстратом BCRP. Наблюдался лишь слабый ингибирующий потенциал в OCT-1. BCRP и P-gp in vitro, что имеет низкую клиническую значимость, что также может быть применено для нинтеданибу как субстрата ОСТ-1. Взаимосвязь между фармакокинетикой и фармакодинамики В исследовательских фармакокинетических анализах побочных реакций высокая экспозиция нинтеданибу как правило, была связана с повышением уровня печеночных ферментов, а не с побочными реакциями со стороны желудочно-кишечного тракта.
Для клинических конечных точек анализ взаимосвязи фармакокинетики с эффективностью не проводился. С помощью метода логистической регрессии установлен статистически значимый взаимосвязь между экспозицией нинтеданибу и влиянием на изменения, которые оказываются методом динамической контрастной магнитно-резонансной томографии. Популяционный фармакокинетический анализ v особых группах пациентов Фармакокинетические свойства нинтеданибу были сравнены у здоровых добровольцев, пациентов с онкологическими заболеваниями и пациентов целевой популяции. Пол (скорректированная масса тела), слабое или умеренное нарушение функции почек (измеренное путем оценки клиренса креатинина). метастазы в печени, баллы по шкале ECOG. употребление алкоголя и генотип P-gp не влияли надежду нинтеданибу. Популяционный фармакокинетический анализ выявил умеренное влияние возраста, массы тела и расы (см. ниже) на действие нинтеданибу. Из-за высокой межиндивидуальную вариабельность экспозиции, которая наблюдалась во время клинического исследования LUME-Lung-И, эти влияния не считались клинически значимыми.
Однако рекомендуется проводить тщательное наблюдение за состоянием пациентов с несколькими из этих факторов риска (см. Раздел «Особенности применения»). Возраст. Экспозиция нинтеданибу линейно увеличивается с возрастом. В 45-летних пациентов (5-й процентиль) значения AUCT.SS было ниже на 16%. а в 76-летних пациентов (95-й процентиль) выше на 13% по сравнению с пациентами, медиана возраста которых составляла 62 года. Диапазон возраста, оценивался в ходе анализа, составлял 29-85 лет возраст более 75 лет отмечался примерно у 5% популяции пациентов. Исследования у детей не проводились. Масса тела. Наблюдается обратная корреляция между массой тела и экспозицией нинтеданибу. У пациентов с массой тела 50 кг (5-й процентиль) величина AUCT.SS увеличивалась на 25%, а у пациентов с массой тела 100 кг (95-й процентиль) уменьшалась на 19% по сравнению с пациентами, медиана массы тела которых составляла 71.5 кг. Раса. Средняя экспозиция нинтеданибу на 33 - 50% выше у пациентов-китайцев. тайваньцев и индусов, и на 16% выше у пациентов японцев, тогда как у пациентов-корейцев - на 16 - 22% ниже, чем у пациентов европеоидной расы (с поправкой на массу тела). Из-за высокой межиндивидуальную вариабельность экспозиции эти эффекты не являлись статистически значимыми. Данные о пациентов негроидной расы являются очень ограниченными; диапазон этих данных похож на таковой у пациентов европеоидной расы. Нарушение функции печени. Во время специального исследования разовой дозы фазы 1 и по сравнению со здоровыми пациентами экспозиция нинтеданибу на основании показателей Стах и AUC была в 2,2 раза выше у добровольцев с легким нарушением функции печени (класс А по шкале Чайлд-П * й, 90% ДИ 1.3 - 3,7 для Cnm и 1,2 - 3.8 для AUC, соответственно). У добровольцев с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) экспозиция была в 7,6 раза выше на основании показателя Стах (90% ДИ 4,4 - 13.2) и в 8.7- раз выше (90% ДИ 5,7 - 13.1) на основании показателя AUC, соответственно, по сравнению со здоровыми добровольцами. Пациенты с тяжелым нарушением функции печени (класс С по шкале Чайлд- Пью) не изучались.
Клинические характеристики
Варгатеф Показания
ВАРГАТЕФ показан в комбинации с доцетакселом у пациентов с локально распространенным, метастатическим или локально рецидивирующим немелкоклеточным раком легких с признаками аденокарциномы гистологического типа после химиотерапии первой линии у взрослых.
Противопоказания
Повышенная чувствительность к нинтеданибу, арахиса или сои или к любой из вспомогательных веществ препарата
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Р-гликопрогеин (Р-сг) Нинтеданиб является субстратом P-gp (см. Раздел «Фармакологические свойства. Фармакокинетика»). В специальном исследовании взаимодействия препаратов установлено, что совместное применение с активным ингибитором P-gp кетоконазолом увеличивает экспозицию нинтеданибу, судя по величине AUC, в 1.61 раза, а по показателю Стах в 1.83 раза. Специальное исследование взаимодействия препаратов показало, что одновременное применение рифампицина (активного индуктора P-gp) приводит к уменьшению экспозиции нинтеданибу, по показателю AUC на 50.3%, а по показателю Cmax на 60.3% по сравнению с применением одного нинтеданибу.
Активные ингибиторы P-gp (например кетоконазол или эритромицин) в случае совместного применения с нинтеданибом могут увеличивать экспозицию последнего. У таких пациентов переносимость нинтеданибу нужно тщательно отслеживать. При возникновении побочных реакций может потребоваться приостановления терапии, снижение дозы или отмена лечения ВАРГАТЕФ (см. Раздел «Способ применения и дозы»). Активные индукторы P-gp (например рифампицин. Карбамазепин. Фенитоин и препараты зверобоя продырявленного) могут уменьшать экспозицию нинтеданибу. Необходимо тщательно взвесить одновременное применение с нинтеданибом. Изофермент цитохрома (CYP) Изоферменты CYP берут только незначительное участие в биотрансформации нинтеданибу.
В доклинических исследованиях нинтеданиб и его метаболиты (BIBF 1202 - свободный кислый метаболит нинтеданибу и его глюкуронид BIBF 1202) не ингибувалы и не индуцировали изоферменты CYP (см. Раздел «Фармакологические свойства. Фармакокинетика»), поэтому вероятность лекарственных взаимодействий с нинтеданибом, основанные на метаболизме CYP, считается небольшой. Одновременное применение с другими препаратами Одновременное применение нинтеданибу с доцетакселом (75 мг / м ') не изменяет фармакокинетику ни одного из этих веществ в клинически значимой степени. Возможность взаимодействия нинтеданибу с гормональными контрацептивными средствами не изучалась.
Особенности применения
Со стороны желудочно-кишечного тракта Диарея была наиболее частым побочным явлением со стороны желудочно-кишечного тракта также отмечается тесная временная связь между развитием диареи и применением доцетаксела (см. раздел «Побочные реакции»). Во время клинического исследования LUME-Lung 1 (см. Раздел «Фармакологические свойства. Фармакологические») у большинства пациентов диарея была легкой и средней степени тяжести. В послерегистрационный период были отмечены серьезные случаи диареи, которые привели к дегидратации и нарушений электролитного баланса. Диарею следует лечить при первых признаках путем надлежащей гидратации и противодиарейными средствами, например, лоперамидом. Она может привести к приостановке приема препарата, снижение дозы и отмены лечения ВАРГАТЕФ (см. Раздел «Способ применения и дозы»). Тошнота и рвота,
Приостановление приема, снижения дозы или прекращения лечения ВАРГАТЕФ (см. Раздел «Способ применения и дозы») может быть необходимым, несмотря на соответствующую поддерживающую терапию. Поддерживающая терапия тошноты и рвоты может включать лекарственные средства с антиэметическими действием, например, глюкокортикоиды, антигистаминные препараты или антагонисты 5НТЗ-рецепторов и адекватную гидратацию. В случае обезвоживания следует применять электролиты и жидкость. В случае возникновения соответствующих побочных явлений со стороны желудочно-кишечного тракта следует контролировать уровень электролитов в плазме крови (см. Раздел «Способ применения и дозы»). Может потребоваться приостановлении приема, снижения дозы или прекращения лечения ВАРГАТЕФ (см. 4.2).
Нейтропения и сепсис Высокая частота развития нейтропении по критериям СТСАЕ> 3 наблюдалась у пациентов, принимавших препарат ВАРГАТЕФ в комбинации с доцетакселом по сравнению с монотерапией доцетакселом. Наблюдались такие осложнения, как сепсис или фебрильная нейтропения. Во время терапии следует контролировать показатели крови, особенно при одновременном применении с доцетакселом. Следует регулярно проводить анализ крови в начале каждого цикла лечения и при максимальном снижении уровня нейтрофилов, обусловленном проведением химиотерапии, пациентам, которые применяют нинтеданиб в комбинации с доцетакселом. и по клиническим показаниям после последнего цикла приема комбинации.
Нарушение функции печени С учетом повышенной экспозиции риск развития побочных реакций может быть повышен у пациентов со слабым нарушением функции печени (класс А по шкале Чайлда- Пью: см. Разделы «Способ применения и дозы» и «Фармакологические свойства. Фармакокинетика»). Имеющиеся ограниченные данные по безопасности по 9 пациентов с гепатоцеллюлярной карциномой и умеренным нарушением функции печени (класс В по шкале Чайлд-Пью). Несмотря на отсутствие неожиданных выводов безопасности в этих пациентов, данные недостаточны для поддержания рекомендации по лечению пациентов с умеренным нарушением функции печени. Эффективность нинтеданибу не изучалась у пациентов с умеренным нарушением функции печени (класс В по шкале Чайлд-ГТю). безопасность,
Лечение препаратом ВАРГАТЕФ не рекомендуется пациентам с умеренным или тяжелым нарушением функции печени (см. Раздел «Способ приме ния и дозы»). Прием нинтеданибу сопровождался повышением уровня ферментов печени (АЛТ. АСТ, щелочной фосфатазы (ЩФ), гамма-глютамилтрансферазы (ГГТ)). билирубина и медикаментозным поражением печени. В большинстве случаев эти повышения были в основном обратимыми при уменьшении дозы или приостановлении лечения. Пациенты с низкой массой тела (<65 кг). женского рода и пациенты азиатского происхождения имеют повышенный риск повышения уровня ферментов печени. Экспозиция нинтеданибу увеличивается линейно с возрастом пациента, также может привести к более высокому риску увеличения уровня ферментов печени (см. Раздел «Фармакологические свойства. Фармакокинетика»). Для пациентов с этими факторами риска рекомендуется проводить тщательный мониторинг. Уровни трансфераз, ЛФК и билирубина следует исследовать до начала комбинированного лечения ВАРГАТЕФ и доцетакселом. Следует контролировать эти значения по клиническим показаниям или периодически во время лечения, а именно, в фазе комбинированного лечения доцетакселом в начале каждого цикла лечения и ежемесячно, если продолжают лечение препаратом ВАРГАТЕФ в виде монотерапии после прекращения лечения доцетакселом.
В случае установления соответствующего повышения уровня ферментов печени, может потребоваться приостановлении приема, снижение дозы или прекращения терапии с применением препарата ВАРГАТЕФ (см. Раздел «Способ применения и дозы»). Следует изучить альтернативные причины повышения уровня ферментов печени и при необходимости принять необходимых действий. В случае изменения каких-либо показателей функции печени (АСТ / АЛТ> С ВМН (верхняя граница нормы), общий билирубин> 2 ВМН и ЛФ <2 ВМН). лечения ВАРГАТЕФ следует прекратить. Если альтернативная причина не установлена, лечения ВАРГАТЕФ следует прекратить (см. Раздел «Способ применения и дозы»). Кровотечения Подавление рецептора сосудистого эндотелиального фактора роста (VEGFR) может быть связано с повышенным риском кровотечения. Во время клинического испытания (LUME-Lung 1; см. раздел 5.1) препарата ВАРГАТЕФ частота развития кровотечений в обеих группах лечения была сопоставлена (см. раздел «Побочные реакции»). Легкие или умеренные носовые кровотечения были наиболее частым нежелательным явлением. Большинство кровотечений с летальным исходом были связаны с опухолями. Отсутствуют различия между респираторными или фатальными кровотечениями и не было сообщений о внутрицеребральном кровотечения. Пациенты с недавней легочной кровотечением (> 2,5 мл крови), а также пациенты с опухолями центральной локализации с радиографическим доказательством местной инвазии главных кровеносных сосудов или радиографическим доказательством наличия кавернозных опухолей или некрозом опухолей были исключены из клинических исследований. Легкие или умеренные носовые кровотечения были наиболее частым нежелательным явлением. Большинство кровотечений с летальным исходом были связаны с опухолями. Отсутствуют различия между респираторными или фатальными кровотечениями и не было сообщений о внутрицеребральном кровотечения. Пациенты с недавней легочной кровотечением (> 2,5 мл крови), а также пациенты с опухолями центральной локализации с радиографическим доказательством местной инвазии главных кровеносных сосудов или радиографическим доказательством наличия кавернозных опухолей или некрозом опухолей были исключены из клинических исследований. Легкие или умеренные носовые кровотечения были наиболее частым нежелательным явлением. Большинство кровотечений с летальным исходом были связаны с опухолями. Отсутствуют различия между респираторными или фатальными кровотечениями и не было сообщений о внутрицеребральном кровотечения. Пациенты с недавней легочной кровотечением (> 2,5 мл крови), а также пациенты с опухолями центральной локализации с радиографическим доказательством местной инвазии главных кровеносных сосудов или радиографическим доказательством наличия кавернозных опухолей или некрозом опухолей были исключены из клинических исследований.
Итак, препарат ВАРГАТЕФ не рекомендуется применять этим пациентам. В послерегистрационный период были зарегистрированы несерьезные и серьезные случаи кровотечения, некоторые из которых были смертельными, в том числе у пациентов с антикоагулянтной терапией или без нее, или которые лечиться другими препаратами, которые могли вызвать кровотечение (информацию о клинических данных см. «Терапевтическая антикоагуляция» ), в случае кровотечения, следует учитывать корректировки дозы, приостановления или прекращения лечения, исходя из клинической оценки (см. Раздел 4.2).
Случаи кровотечений, которые наблюдаться в послерегистрационный период включают, но не ограничиваются кровотечениями со стороны органов желудочно-кишечного тракта, дыхательной системы и центратьнои нервной системы, чаще всего со стороны дыхательной системы. Терапевтичнии антикоагуляиия Пока нет данных о пациентах с наследственной склонностью к кровотечениям или пациентов, получать антикоагулянтную терапию в высоких дозах до начала лечения ВАРГАТЕФ. У пациентов, получавших триваиу терапию низкомолекулярного гепарина или ацетилсалициловой кислотой в низких дозах, не наблюдалось повышения частоты возникновения кровотечений.
Пациентам, у которых развивались тромбоэмболические события на фоне лечения и нуждающихся приема антикоагулянтов, было разрешено продолжить прием препарата ВАРГАТЕФ. Не наблюдалось повышения частоты возникновения кровотечений. Следует регулярно наблюдать за состоянием пациентов, одновременно принимающих антикоагулянты, такие как варфарин или фенпрокумоном. об изменениях показателя ПВ, международного нормализованного отношения (МНО) и клинических эпизодов кровотечений. Метастазы в головном мозге Стабильные метастазы в головном мозге Не отмечено повышение частоты внутримозговых кровотечений у пациентов, получивших должное предыдущее лечение метастазов в головном мозге, которые были стабильными в течение> 4 недель до начала лечения ВАРГАТЕФ.
Однако состояние таких пациентов следует тщательно контролировать на наличие признаков и симптомов внутримозговой кровотечения. Активные метастазы в головном мозге пациентов с активными метастазами в головном мозге были исключены из клинических исследований. Этим пациентам не рекомендуется применять препарат ВАРГАТЕФ. Венозная тромбоэмболия Пациенты, применяющие препарат ВАРГАТЕФ. имеют повышенный риск развития венозной тромбоэмболии, включая тромбоз глубоких вен. Состояние пациентов следует тщательно контролировать в случае развития тромбоэмболических событий. Лечение препаратом ВАРГАТЕФ следует прекратить пациентам с опасной для жизни венозной тромбоэмболией.
Артериальные тромбоэмболические события Частота развития артериачьних тромбоэмболических события была сравнительная между двумя группами лечения в ходе исследования 1199.13 (ШМЕ-Еипу 1) фазы 3. Пациенты с инфарктом миокарда или инсультом в анамнезе были исключены из этого исследования. Однако повышенная частота развития артериальных тромбоэмболических события наблюдалась у пациентов с идиопатическим легочным фиброзом (ИЛФ), которые применять нинтеданиб в виде монотерапии. Необходимо соблюдать осторожность при лечении пациентов с высоким сердечно-сосудистым риском, включая известное заболевание коронарных артерий. Следует рассмотреть возможность перерыва в лечении пациентов, у которых развились симптомы острой миокардиаиьнои ишемии.
Перфорации желудочно-кишечного тракта Частота развития перфораций желудочно-кишечного тракта была сравнительная между группами лечения во время клинического исследования. Однако в связи с особенностями механизма действия нинтеданибу у пациентов, получавших препарат ВАРГАТЕФ. может отмечаться повышение риска развития перфораций желудочно-кишечного тракта. Особое внимание следует уделять лечению пациентов, ранее подвергались абдоминальной хирургическим вмешательством или имели перфорации полых органов в анамнезе. В связи с этим. препарат ВАРГАТЕФ можно применять только как минимум через 4 недели после обширных хирургических вмешательств. Терапию ВАРГАТЕФ следует прекратить пациентам, у которых развиваются перфорации желудочно-кишечного тракта. Нарушение заживления ран Учитывая механизм действия нинтеданибу, это вещество может негативно влиять на заживление ран. В исследовании ШМЕ-Ьии ^ 1 увеличение частоты нарушений заживления ран не наблюдалось. Специальных исследований, в которых изучалось бы влияние нинтеданибу на заживление ран, не проводилось. Поэтому лечения ВАРГАТЕФ должно начинаться или возобновляться (если осуществлялась перерыв в связи с хирургическим вмешательством) с учетом клинической оценки об адекватности заживления раны.
Влияние на интервал ОТ Никаких признаков удлинение интервала ОьГ при применении нинтеданибу в рамках программы клинических исследований не выявлено (см. Раздел «Фармакологические свойства. Фармакологические»). Поскольку известно, что некоторые другие ингибиторы тирозинкиназы влияют на ОТ, следует с осторожностью назначать нинтеданиб пациентам, которые находятся в группе риска удлинения комплекса ВТ. Аллергические реакции Известно, что продукты лечебного питания с содержанием сои вызывают аллергические реакции, в том числе тяжелый анафилактический шок. у лиц с аллергией на сою. Пациенты с известной аллергией на арахисовый белок находятся в группе риска развития тяжелых реакций на препараты с содержанием сои. Особые группы пациентов В ходе исследования 1199.13 (ЬиМЕ-Еип§ 1) наблюдалась высокая частота развития серьезных побочных явлений у пациентов с массой тела менее 50 кг. получавших нинтеданиб и доцетаксел, по сравнению с пациентами с массой тела> 50 кг однако количество пациентов с массой тела менее 50 кг была низкой. Итак, следует тщательно контролировать состояние пациентов с массой тела <50 кг.
Применение в период беременности или кормления грудью
Женщины репродуктивного возраста / контрацепция V женщин Нинтеданиб может оказать негативное влияние на плод человека. Женщинам репродуктивного возраста, принимающих препарат ВАРГАТЕФ, следует рекомендовать избегать беременности. им нужно посоветовать использовать надежные методы контрацепции во время применения препарата и в течение не менее 3 месяцев после приема последней дозы препарата Варгатеф. Поскольку действие нинтеданибу на метаболизм и эффективность гормональных контрацептивов не изучалось, вторым методом предохранения должен стать барьерный метод.
Беременность Специальных исследований по применению препарата ВАРГАТЕФ во время беременности у человека не проводилось, однако в доклинических исследованиях на животных установлена репродуктивная токсичность этого активного вещества. Поскольку нинтеданиб может иметь эмбриотоксическое действие у человека, его не следует применять во время беременности, если только клиническое состояние не требует проведения лечения. Перед тем. как начать лечение препаратом ВАРГАТЕФ. следует провести тест на беременность. Пациенткам следует немедленно сообщить врачу о развитии беременности во время терапии препаратом ВАРГАТЕФ. Если во время терапии препаратом ВАРГАТЕФ развивается беременность, пациентку необходимо проинформировать о потенциальной опасности ембриотоксичиои действия препарата. Также следует рассмотреть вопрос о прекращении лечения ВАРГАТЕФ.
Кормление грудью Отсутствуют данные о выделении нинтеданибу и его метаболитов в грудное молоко. В доклинических исследованиях показано, что у животных в период лактации в грудное молоко проникает небольшое количество нинтеданибу и его метаболитов (<0.5% от величины дозы применялась). Поэтому нельзя исключить риск для новорожденных и грудных детей. Во время лечения ВАРГАТЕФ кормления грудью следует прекратить. Фертильность В доклинических исследованиях признаков нарушений фертильности у самцов обнаружено не было. Отсутствуют данные относительно людей и животных о потенциальном воздействии нинтеданибу на женскую фертильность.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
ВАРГАТЕФ масс незначительное влияние на способность управлять транспортными средствами и работать с механизмами. Во время применения препарата ВАРГАТЕФ пациентам нужно рекомендовать соблюдать осторожность при управлении транспортными средствами или другими механизмами.
Способ применения Варгатеф и дозы
Лечение препаратом ВАРГАТЕФ следует начинать и проводить под наблюдением врача, имеющего опыт проведения противоопухолевой терапии.
Дозы Рекомендуемая доза нинтеданибу составляет 200 мг дважды в сутки, примерно через каждые 12:00, со 2 по 21 день 21-дневного цикла химиотерапии доцетакселом в стандартном режиме. Варгатеф не следует применять в тот же день, когда вводится доцетаксел (= 1 день). Если любая доза была пропущена, то следует продольными прием препарата в первоначально рекомендованной дозе по расписанию следующего приема препарата. Индивидуальные суточные дозы нинтеданибу не должны превышать рекомендуемую дозу для того, чтобы компенсировать пропущенную дозу. Не следует превышать максимальную рекомендуемую суточную дозу 400 мг. Пациенты могут продолжать терапию нинтеданибом после прекращения приема доцетаксела до достижения клинического эффекта или к развитию неприемлемой токсичности.
Дозы, способы применения и изменения дозы доцетаксела приведены в соответствующей инструкции по применению для доцетаксела. Корректировка дозы качестве исходного мероприятие для контроля за побочными реакциями (см. Таблицы 2 и 3), следует временно прекратить применение нинтеданибу к уменьшению специфической побочной реакции до уровня, который бы позволил продолжить лечение (до степени 1 или начального уровня). Лечение нинтеданибом может быть восстановлено в сниженной дозе. Корректировка дозы с шагом в 100 мг в сутки (в частности, снижение дозы на 50 мг) на основании индивидуальной безопасности и переносимости рекомендуется, как указано в Таблице 2 и Таблице 3. В случае дополнительного развития побочного (их) реакции (й) , а именно, если пациент не переносит дозу 100 мг дважды в сутки, препарат ВАРГАТЕФ следует совсем прекратить. В случае повышения уровня аспартатаминотрансферазы (ACT) / аланин-аминотрансферазы (АЛТ) более чем в 3 раза выше верхней границы нормы одновременно с повышением уровня общего билирубина> 2 раза верхней границы нормы и щелочной фосфатазы (ЛФ) <2 раза верхней границы нормы (см. Таблицу 2) лечения ВАРГАТЕФ следует приостановить. Если альтернативная причина не установлена, применение препарата ВАРГАТЕФ следует прекратить (см. Также раздел «Особенности применения»).
Таблица 2. Рекомендуемое корректировки дозы препарата ВЛРГАТЕФ (нинтеданиб) в случае развития диареи. рвота и других гематологических и негематологических побочных реакций

* СТСАЕ: Общая терминология критериев побочных явлений
Таблица 3. Рекомендуемая коррекция дозы препарата ВАРГАТЕФ (нинтеданиб) при повышении

ACT: аспартатаминотрансфераза; АЛТ: аланин-аминотрансфераза ЛФ: ЩФ; ВМН: верхняя граница нормы
Особые группы пациентов
Возраст Безопасность и эффективность применения препарата ВАРГАТЕФ детям (в возрасте до 18 лет) не установлены. Данные отсутствуют. Пациенты пожилого возраста (> 65 лет) не отмечено никаких общих различий с точки зрения безопасности и эффективности применения препарата пожилым пациентам. Во время проведения базового исследования 1199.13 85 пациентов (12,9% пациентов с гистологически выявленной аденокарциномой) были в возрасте> 70 лет (средний возраст 72 лет, диапазон: 70 - 80 лет) (см. Раздел «Фармакологические свойства. Фармакологические») , Корректировка начальной дозы препарата в зависимости от возраста пациента не требуется (см. раздел «Фармакологические свойства. Фармакокинетика»).
Раса и масса тела На основании данных популяционного фармакокинетического анализа теоретически корректировать дозу препарата ВАРГАТЕФ не требуется (см. Раздел «Фармакологические свойства. Фармакокинетика»). Данные по безопасности по пациентов негроидной и афро-американской расы ограничены. Нарушение функции почек Почками выводится менее 1% разовой дозы нинтеданибу (см. Раздел «Фармакологические свойства. Фармакокинетика»), пациентов с нарушениями функции почек легкой или умеренной степени тяжести коррекции начальной дозы. Для пациентов с тяжелыми нарушениями функции почек (клиренс креатинина <30 мл / мин.) Безопасность, эффективность и фармакокинетика нинтеданибу не изучали.
Нарушение функции печени
Нинтеданиб выводится преимущественно с желчью / калом (> 90%). Действие усиливается у пациентов с нарушением функции печени (класс А и класс В по шкале Чайлд-ГГю, см. Раздел «Фармакологические свойства. Фармакокинетика»). На основании данных клинических исследований Корр ваты начальную дозу не нужно пациентам с нарушениями функции печени легкой степени тяжести (класс А по шкале Чайлд-ГГю). Ограниченные данные по безопасности по 9 пациентам с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) недостаточны, чтобы характеризовать эту популяцию. У пациентов с тяжелым нарушением функции печени (класс С по шкале Чайлд-ГГю) безопасность, эффективность и фармакокинетика нинтеданибу не изучали.
Дети
Препарат применяют в педиатрической практике.
Передозировка
Симптомы
Самая высокая разовая доза нинтеданибу. которая применялась при проведении исследований фазы И, составляла 450 мг один раз в сутки. Зафиксированы случаи передозировки у двух пациентов при применении препарата в максимальной дозе 600 мг дважды в сутки в течение восьми дней. Нежелательные явления, наблюдавшиеся были сопоставимы с известным профилем безопасности нинтеданибу: увеличение активности ферментов печени и нарушения со стороны ЖКТ. Оба пациента полностью восстановились после нежелательных явлений.
лечение
Специфического антидота или способа лечения передозировки нинтеданибу нет. В случае передозировки необходимо отменить препарат и проводить симптоматическую терапию.
Побочные эффекты
Данные по безопасности, приведенные в разделах ниже, базируются на основании результатов глобального, двойного слепого, рандомизированного базового исследования III фазы 1199.13 (LUME-Lung 1), в ходе которого сравнивалось лечение нинтеданибом и доцетакселом с курсом лечения плацебо и доцетакселом у пациентов с локально распространенным или метастатическим или рецидивирующим немелкоклеточным раком легких после химиотерапии первой линии. Наиболее частыми побочными реакциями на фоне применения нинтеданибу были диарея, повышение уровня ферментов печени (АЛТ и ACT) и рвота. В таблице 4 суммированы побочные реакции по классам систем органов. Для получения информации по лечению отдельных побочных реакций см. «Особенности применения». Информация об отдельных побочные реакции, шо наблюдались во время проведения исследования LUME-Lung 1.
Перечень побочных реакций (ГОР)
В таблице 4 суммированная частота побочных реакций, о которых сообщалось во время проведения базового исследования LUME-Lung 1, у пациентов с немелкоклеточным раком легких с признаками аденокарциномы гистологического типа (n = 320). Побочные явления приведены в соответствии с частотой возникновения: очень часто (> 1/10), часто (> 1/100 до <1/10), нечастые (> 1 / 1,000 до <1/100), редкие (> 1 / 10,000 до <1 / 1,000), редкие (<1/10 000), неизвестно (невозможно установить по имеющимся данным). В пределах каждой группы по частоте побочные реакции представлены в порядке убывания серьезности.
Таблица 4. Резюме побочных реакций на лекарственное средство по категориям частоты
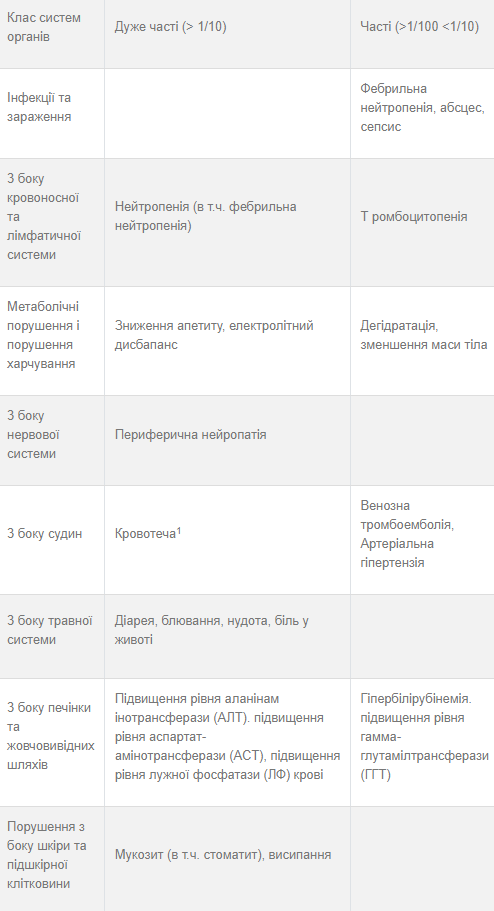

1 Частота развития не увеличивалась у пациентов, получавших нинтеданиб и доцетаксел, по сравнению с плацебо и доцетаксел. 2 Случаи панкреатита наблюдались у пациентов, принимавших нинтеданиб для лечения идиопатического легочного фиброза и немелкоклеточного рака легких. Большинство этих случаев наблюдались у пациентов по показаниям идиопатического легочного фиброза.
Описание отдельных побочных реакций
диарея
Диарея отмечалась в 43,4% (> степени 3: 6,3%) пациентов, с аденокарциномой в группе нинтеданибу. Большинство побочных реакций была временно тесно связана с приемом доцетаксела. У большинства пациентов проявления диареи исчезали после прекращения лечения, проведения противодиарейной терапии и уменьшения дозы нинтеданибу. Рекомендуемые мероприятия и корректировки доз в случае диареи см. в разделах «Особенности применения» и «Способ применения и дозы», соответственно.
Повышение уровня ферментов печени и гипербииирубинемия
Побочные реакции со стороны печени возникали в 42,8% пациентов, принимавших нинтеданиб. Примерно в одной трети этих пациентов отмечали побочные реакции со стороны печени> С степени тяжести. У пациентов с повышенным печеночными параметрам применения установленной схемы постепенного снижения дозы было необходимой мерой, а прекращение лечения было необходимо только в 2,2% пациентов. У большинства пациентов повышение печеночных параметров были обратимыми. Информацию о специальных групп пациентов, рекомендованных мероприятий и корректировки доз в случае повышения уровня печеночных ферментов и билирубина можно найти в разделах «Особенности применения» и «Способ применения и дозы», соответственно.
Нейтропения.
Фебрииьна нейтропения и сепсис. Сепсис и фебрильная нейтропения наблюдаться как осложнение нейтропении. Частота развития сепсиса (1.3%) и фебрильной нейтропении (7.5%) увеличивалось на фоне приема нинтеданибу по сравнению с группой плацебо. Во время терапии важно проводить анализ крови пациента, особенно во время комбинированного лечения доцетакселом (см. Раздел «Особенности применения»).
кровотечение
В пострегистрационный период были зарегистрированы несерьезные и серьезные кровотечения, некоторые из которых были фатальными, включая пациентов с терапией антикоагулянтами или без них, или другими препаратами, которые могут вызвать кровотечение. Случаи кровотечения в пислиреестрацийному периоде включают, но не ограничиваются, со стороны органов желудочно-кишечного тракта, органов дыхания и центральной нервной системы, причем чаще всего со стороны органов дыхания (см. Также раздел «Особенности применения»).
перфорация
Как ожидается, в связи с особенностями механизма действия перфорация может возникнуть у пациентов, получавших нинтеданиб. Однако количество пациентов с перфорацией желудочно-кишечного тракта была низкой.
периферическая нейропатия
Также известно, что периферическая нейропатия может возникать на фоне лечения доцетакселом. Периферическая нейропатия наблюдалась в 16.5% пациентов в группе плацебо и в 19.1% пациентов в группе нинтеданибу.
Сообщение о побочных реакциях
Сообщение о побочных реакциях после регистрации лекарственного препарата важны. Это позволяет постоянно вести мониторинг соотношения польза / риск лекарственного средства. Просим медицинских работников сообщать о любых возможных побочных реакциях с помощью национальной системы отчетности.
Срок годности Варгатеф
С года.
Условия хранения Варгатеф
Хранить при температуре не выше 25 ° С, в оригинальной упаковке для защиты от влаги.
Упаковка
Для дозирования 100 мг: по 10 капсул в алюминиевом блистере, по 6 или 12 блистеров в картонной упаковке.
Категория отпуска
По рецепту.
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко. КГ / Boehringer Ingelheim Pharma GmbH & Co. KG.
Местонахождение производителя
Бингер Штрассе 173, 55216, Ингельхайм на Рейне, Германия Binger Strasse 173, 55216, Ingelheim am Rhein, Germany.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Варгатеф только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Берингер Ингельхайм Фарма ГмбХ и Ко. КГ
| Тип данных | Сведения из реестра |
| Торговое наименование: | Варгатеф |
| Производитель: | Берингер Ингельхайм Фарма ГмбХ и Ко. КГ |
| Форма выпуска: | капсулы мягкие по 100 мг или 150 мг, по 10 капсул мягких в алюминиевом блистере, по 6 или 12 блистеров в картонной коробке |
| Регистрационное удостоверение: | UA/16651/01/01, UA/16651/01/02 |
| Дата начала: | 26.04.2018 |
| Дата окончания: | 26.04.2023 |
| МНН: | Nintedanib |
| Условия отпуска: | по рецепту |
| Состав: | 1 капсула содержит нинтеданибу 100 мг (120,40 мг в виде езилату) |
| Фармакологическая группа: | Антинеопластичес средства. Ингибиторы протеинкиназы. |
| Код АТХ: | L01XE31 |
| Заявитель: | Берингер Ингельхайм Интернешнл ГмбХ |
| Страна заявителя: | Германия |
| Адрес заявителя: | Бингер Штрассе 173, D-55216 Ингельхайм-на-Рейне, Германия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L01 | Противоопухолевые препараты |
| L01X | Другие антинеопластичес средства |
| L01XE | Ингибиторы протеинкиназы |
| L01XE31 | Нинтеданиб |
