- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Бримика Дженуейр инструкция по применению
Официальная инструкция лекарственного препарата Бримика Дженуейр порошок 60 доз. Описание и применение Brimika Dzhenuejr, аналоги и отзывы. Инструкция Бримика Дженуейр порошок утвержденная компанией производителем.
Состав
действующие вещества: аклидинию бромид / aclidinium bromide, формотерола фумарат дигидрат / formoterol fumarate dehydrate;
1 доза высвобождается (доза выходит из мундштука), содержит 396 мкг аклидинию бромид, что эквивалентно 340 мкг аклидинию, и 11,8 мкг формотерола фумарата дигидрата. Это соответствует дозе 400 мкг аклидинию бромида, что соответствует 343 мкг аклидинию и отмеренной дозе.
12 мкг формотерола фумарата дигидрат;
вспомогательные вещества : каждая отмерено доза содержит 11,6 мг лактозы моногидрата.
Лекарственная форма
Порошок для ингаляций.
Основные физико-химические свойства: белый или почти белый мелкозернистый вильносипучий порошок без видимых агломератов или посторонних включений.
Фармакологическая группа
Средства, влияющие на респираторную систему. Средства, применяемые при обструктивных заболеваниях дыхательных путей. Адренергические средства в комбинации с антихолинергическими средствами.
Код ATH R03A L05.
Фармакологические свойства
механизм действия
В лекарственном средстве Бримика® Дженуейр® содержится два бронходилататоры: аклидиний, что является антагонистом мускариновых рецепторов пролонгированного действия (также известно, что он оказывает антихолинергическое действие) и формотерол, что является β2-адреномиметик пролонгированного действия. Комбинация этих двух веществ с различными механизмами действия оказывает аддитивный эффект в отличие от применения каждого из компонентов в отдельности. Вследствие различной плотности мускариновых рецепторов и β2-адренорецепторов в центральных и периферических дыхательных путях мускариновые антагонисты должны быть более эффективными в расширении центральных дыхательных путей, тогда как β2-адреномиметики должны более эффективно расширять периферические дыхательные пути. Ожидается, что расширение как центральных, так и периферических дыхательных путей в комбинированной терапии положительно влияет на функцию легких.
Аклидиний является конкурентным селективным антагонистом мускариновых рецепторов с более длительным временем удержания на М3-рецепторах, чем на М2-рецепторах. М3-рецепторы служат посредниками при сокращении гладкой мускулатуры дыхательных путей. Вдыхаемый аклидинию бромид действует местно в легких как антагонист М3-рецепторов гладкой мускулатуры дыхательных путей и вызывает расширение бронхов. Также было доказано, что аклидиний оказывает положительное влияние на пациентов с ХОБЛ, относительно ослабления симптомов, улучшение состояния здоровья, является специфическим для данного заболевания, снижение частоты обострений и повышение переносимости физических нагрузок. Аклидинию бромид быстро разрушается в плазме крови, поэтому количество системных антихолинергических побочных реакций является низкой.
Формотерол является мощным селективным β2-адреномиметик. Бронходилатация происходит вследствие непосредственного расширения гладкой мускулатуры дыхательных путей в результате увеличения содержания циклического АМФ, обусловленного активацией аденилатциклазы. Кроме улучшения функции легких, было также доказано, что формотерол ослабляет симптомы заболевания и повышает качество жизни пациентов с ХОБЛ.
Фармакологические
Исследование клинической эффективности показали, что лекарственное средство Бримика ® Дженyейр ® обеспечивает клинически значимое улучшение функции легких (при измерении объема форсированного выдоха за первую секунду маневра форсированного выдоха [ОФВ1]) более чем через 12:00 после применения.
Лекарственное средство Бримика® Дженyейр® продемонстрировал быстрое начало действия в течение 5 минут после первого вдоха по сравнению с плацебо (p <0,0001). Начало действия лекарственного средства Бримика® Дженyейр® было схожим с эффектом формотерола в дозе 12 мкг, быстродействующего β2-адреномиметиков. Максимальная Бронходилатационный действие (пик ОФВ1) относительно исходного значения наблюдалась с первого дня (304 мл) и сохранялась в течение 6-месячного периода лечения
(326 мл).
электрофизиология сердца
В ходе ИИИ фазы клинического исследования продолжительностью 6-12 месяцев, в котором участвовало 4000 пациентов с ХОБЛ, не наблюдалось клинически значимого влияния лекарственного средства Бримика® Дженyейр® на параметры ЭКГ (в том числе интервал QT) по сравнению с аклидинием, формотеролом и плацебо. Не было выявлено клинически значимого влияния лекарственного средства Бримика ® Дженyейр ® на сердечный ритм при проведении 24-часового Холтеровского мониторинга в подгруппе с 551 пациента (114 из которых применяли препарат Бримика ® Дженyейр® раза в сутки).
Клиническая эффективность и безопасность
Фаза ИИИ программы клинической разработки включала 4000 пациентов с клиническим диагнозом ХОБЛ. К данной фазы входило два 6-месячных рандомизированных плацебо исследования с активным препаратом сравнения (ACLIFORM-COPD и AUGMENT), а также 6-месячного продолжения исследования AUGMENT и еще одно 12-месячное рандомизированное контролируемое исследование. В ходе данных исследований пациентам было разрешено продолжать свою обычную терапию ингаляционными кортикостероидами, ГКС для приема внутрь в низких дозах, лечение кислородом (если оно занимало менее 15 ч / сут) или метилксантинами, также разрешалось применять сальбутамол как препарат экстренной помощи. Эффективность оценивалась по результатам измерений функций легких и симптоматическим последствиям, характерным для данного заболевания, а также по применению препаратов экстренной терапии и наличии обострений. При проведении долгосрочных исследований безопасности Бримика® Дженyейр® продемонстрировал устойчивую эффективность при применении в течение более 1 года, причем тахифилаксия не отмечено.
Влияние на функцию легких
Применение лекарственного средства Бримика ®Дженyейр® 340 мкг / 12 мкг два раза в сутки стабильно обеспечивало клинически значимое улучшение функции легких (измеренное с помощью ОФВ1, форсированной жизненной емкости легких и объема максимального выдоха) по сравнению с плацебо. В исследованиях фазы ИИИ клинически значимая Бронходилатационный действие наблюдалась в течение 5 минут после применения первой дозы и продолжалась в течение периода между приемами лекарственного средства. Стойкий эффект наблюдался в течение 6-месячных и годовых исследований фазы ИИИ. ОФВ1 через 1:00 после приема препарата и маленький ОФВ1 (по сравнению с 400 мкг аклидинию и 12 мкг формотерола соответственно) были установлены как комбинированные первичные конечные точки в обоих 6-месячных опорных исследованиях фазы ИИИ с целью продемонстрировать Бронходилатационный действие формотерола и аклидинию в лекарственном средстве Бримика® Дженyейр® соответственно.
В исследовании ACLIFORM-COPD лекарственное средство Бримика ® Дженyейр® продемонстрировал повышение ОФВ1 через 1:00 после приема препарата по сравнению с плацебо и аклидинием: 299 мл и 125 мл соответственно (для обоих p <0,0001), а также повышение малейшего ОФВ1 по сравнению с плацебо и формотеролом, 143 мл и 85 мл соответственно (для обоих p <0,0001). В исследовании AUGMENT лекарственное средство Бримика ® Дженyейр® продемонстрировал повышение ОФВ1 через 1:00 после приема препарата по сравнению с плацебо и аклидинием:
284 мл и 108 мл (для обеих p <0,0001) соответственно, а также повышение малейшего ОФВ1 по сравнению с плацебо и формотеролом 130 мл (p <0,0001) и 45 мл (p = 0,01) соответственно.
Положительное влияние на ослабление симптомов и состояние здоровья, в случае данного заболевания является специфическим
Одышка и другая симптоматика
Бримика® Дженyейр® обеспечивал клинически значимое уменьшение одышки (оценено с помощью динамического индекса одышки [TDI]) с улучшением показателя фокусного индекса TDI после 6-месячного лечения по сравнению с плацебо на 1,29 единицы в исследовании ACLIFORM-COPD (p <0,001) и на 1,44 единицы в исследовании AUGMENT (p <0,0001). Процент пациентов с клинически значимым улучшением показателя фокусного индекса TDI (определяется как увеличение минимум на 1 единицу) был выше у пациентов, получавших Бримика® Дженyейр®, по сравнению с группой плацебо в исследовании ACLIFORM-COPD (64,8% по сравнению с 45,5 %; p <0,001) и AUGMENT (58,1% по сравнению с 36,6%; p <0,0001). Объединенный анализ этих двух исследований продемонстрировал, что лекарственное средство Бримика® Дженyейр® способствует статистически значимом улучшению показателя фокусного индекса TDI по сравнению с аклидинием (0,4 единицы, p = 0,016) или формотеролом (0,5 единицы, p = 0,009). Кроме того, процент пациентов, у которых наблюдалось клинически значимое улучшение показателя фокусного индекса TDI, был выше в группе применения лекарственного средства Бримика® Дженyейр® сравнению с такими, в группах застосовання аклидинию или формотерола (61,9% по сравнению с 55,7% и 57,0% соответственно; p = 0,056 и p = 0,100 соответственно). Лекарственное средство Бримика® Дженyейр® ослаблял дневные симптомы ХОБЛ, такие как одышка, «грудные симптомы» (симптомы патологии со стороны дыхательных путей), кашель и удаление мокроты (оценка по общему баллу E-RS), а также общие ночные симптомы, общие утренние симптомы и симптомы, ограничивающие утреннюю активность, по сравнению с плацебо, аклидинием и формотеролом, однако улучшения не всегда было статистически значимым. Аклидиний / формотерол статистически значимо не снижал по сравнению с плацебо, среднее количество ночных пробуждений, вызванных проявлениями ХОБЛ.
Качество жизни, обусловлена состоянием здоровья
Лекарственное средство Бримика® Дженyейр® обеспечивал клинически значимое улучшение качества жизни, связанное с состоянием здоровья (оценено с помощью Респираторной анкеты госпиталя Св. Георгия [SGRQ])), в исследовании AUGMENT, в котором улучшение общего балла SGRQ по сравнению с плацебо составило -4,35 единиц (p <0,0001). Процент пациентов в исследовании AUGMENT, в которых наблюдалось клинически значимое улучшение по сравнению с исходными показателями общего балла SGRQ (определяется как повышение на минимум 4 единицы), был выше в группе применения лекарственного средства Бримика® Дженyейр®, чем в группе плацебо (58,2% по сравнению с 38,7% соответственно; p <0,001). В исследовании ACLIFORM-COPD наблюдалось незначительное снижение общего балла SGRQ по сравнению с плацебо в связи с внезапно выраженной реакцией на плацебо (p = 0,598), процент пациентов, которые достигли клинически значимого улучшения по сравнению с исходными показателями, составлял 55,3% в группе применения лекарственного средства Бримика® Дженyейр® и 53,2% в группе плацебо (p = 0,669). В объединенном анализе вышеуказанных двух исследований было показано, что препарат Бримика® Дженyейр® способствует значительному улучшению общего балла SGRQ сравнению с формотеролом (-1,7 единицы; p = 0,018) или аклидинием (-0,79 единицы; p = 0,273 ). Кроме того, в более высокого процента пациентов, получавших препарат Бримика® Дженyейр®, наблюдалось клинически значимое улучшение общего балла SGRQ по сравнению с таковым у группах применения аклидинию и формотерола (56,6% по сравнению с 53,9% и 52,2% соответственно; p = 0,603 и p = 0,270 соответственно). 3% в группе применения лекарственного средства Бримика® Дженyейр® и 53,2% в группе плацебо (p = 0,669). В объединенном анализе вышеуказанных двух исследований было показано, что препарат Бримика® Дженyейр® способствует значительному улучшению общего балла SGRQ сравнению с формотеролом (-1,7 единицы; p = 0,018) или аклидинием (-0,79 единицы; p = 0,273 ). Кроме того, в более высокого процента пациентов, получавших препарат Бримика® Дженyейр®, наблюдалось клинически значимое улучшение общего балла SGRQ по сравнению с таковым у группах применения аклидинию и формотерола (56,6% по сравнению с 53,9% и 52,2% соответственно; p = 0,603 и p = 0,270 соответственно). 3% в группе применения лекарственного средства Бримика® Дженyейр® и 53,2% в группе плацебо (p = 0,669). В объединенном анализе вышеуказанных двух исследований было показано, что препарат Бримика® Дженyейр® способствует значительному улучшению общего балла SGRQ сравнению с формотеролом (-1,7 единицы; p = 0,018) или аклидинием (-0,79 единицы; p = 0,273 ). Кроме того, в более высокого процента пациентов, получавших препарат Бримика® Дженyейр®, наблюдалось клинически значимое улучшение общего балла SGRQ по сравнению с таковым у группах применения аклидинию и формотерола (56,6% по сравнению с 53,9% и 52,2% соответственно; p = 0,603 и p = 0,270 соответственно). что лекарственное средство Бримика® Дженyейр® способствует значительному улучшению общего балла SGRQ сравнению с формотеролом (-1,7 единицы; p = 0,018) или аклидинием (-0,79 единицы; p = 0,273). Кроме того, в более высокого процента пациентов, получавших препарат Бримика® Дженyейр®, наблюдалось клинически значимое улучшение общего балла SGRQ по сравнению с таковым у группах применения аклидинию и формотерола (56,6% по сравнению с 53,9% и 52,2% соответственно; p = 0,603 и p = 0,270 соответственно). что лекарственное средство Бримика® Дженyейр® способствует значительному улучшению общего балла SGRQ сравнению с формотеролом (-1,7 единицы; p = 0,018) или аклидинием (-0,79 единицы; p = 0,273). Кроме того, в более высокого процента пациентов, получавших препарат Бримика® Дженyейр®, наблюдалось клинически значимое улучшение общего балла SGRQ по сравнению с таковым у группах применения аклидинию и формотерола (56,6% по сравнению с 53,9% и 52,2% соответственно; p = 0,603 и p = 0,270 соответственно).
Снижение частоты обострений ХОБЛ
Фулу анализ эффективности двух 6-месячных исследований фазы ИИИ продемонстрировал значительное (на 29%) снижение частоты умеренных или тяжелых обострений (требующих лечения антибиотиками или кортикостероидами или заканчиваются госпитализацией) при применении лекарственного средства Бримика® Дженyейр® по сравнению с плацебо (частота на пациента в год: 0,29 по сравнению с 0,42 соответственно; p = 0,036).
Кроме того, лекарственное средство Бримика® Дженyейр® способствовал отсрочке времени первого умеренного или тяжелого обострения по сравнению с плацебо (соотношение рисков 0,70; p = 0,027).
Необходимость в лекарственных средствах неотложной помощи
Лекарственное средство Бримика® Дженyейр® течение 6 месяцев снизил необходимость в лекарственных средствах неотложной помощи по сравнению с плацебо (на 0,9 вдохов в сутки [p <0,0001]), аклидинием (на 0,4 вдохов в сутки [p <0,001] ) и формотеролом (на 0,2 вдохов в сутки [p = 0,062]).
Функциональные показатели объема легких, способность переносить физическую нагрузку и физическую активность
Влияние лекарственного средства Бримика® Дженyейр® на функциональные показатели объема легких, продолжительность физической нагрузки и физическую активность исследовались в течение 8 недель в ходе параллельного рандомизированного плацебо-контролируемых клинических исследования пациентов с ХОБЛ с гиперинфляцией легких (функциональная остаточная емкость [ФЗЕ] ˃120%). После 4 недель применения лекарственного средства Бримика® Дженyейр® наблюдалось улучшение утренней (наименьшей) ФЗЕ перед применением лекарственного средства относительно исходной (первичная конечная точка исследования) по сравнению с группой плацебо, однако данное отличие не имела статистической значимости (-0,125 л 95% доверительный интервал [ДИ] -0,259; 0,010; p = 0,069 *).
* Поскольку не было достигнуто статистической достоверности относительно первичной конечной точки исследования, анализ всех значений р-критерия для вторичных конечных точек был проведен с использованием номинального уровня значимости 0,05 и формальный статистический отчет не может быть получен.
Применение лекарственного средства Бримика® Дженyейр® привело к улучшению функциональных показателей объема легких через 2-3 часа после приема сравнению с группой плацебо (ФЗЛ) (ФЗЛ -0,366 л [95% ДИ -0,515, -0,216; p <0,0001 ]; остаточный объем [ЗО] -0,465 л [95%
ДИ -0,648, -0,281; p <0,0001] и объем максимального вдоха [ОМУ] 0,293 л [95% ДИ 0,208, 0,378; p <0,0001]). Применение лекарственного средства Бримика® Дженyейр® также способствовало улучшению способности переносить физическую нагрузку по сравнению с приемом плацебо после лечения в течение 8 недель (55 секунд [95% ДИ 5,6, 104,8; p = 0,0292]; исходное значение 456 секунд) . Через 4 недели после начала применения лекарственного средства Бримика® Дженyейр® наблюдалось увеличение пройденных шагов по сравнению с приемом плацебо (731 шаг / сутки 95% ДИ 279,
1181; p = 0.0016) и уменьшение доли (%) пациентов с низкой физической активностью (˂6000 шагов / сут) [40,8% по сравнению с 54,5%; p <0,0001]. У пациентов, получавших препарат Бримика® Дженyейр®, по сравнению с группой, в которой применяли плацебо, наблюдалось улучшение показателей шкалы «PROactive» (p = 0,0002), предназначенной для оценки физической активности пациентов с ХОБЛ. Программа по изменению образа жизни была добавлена к обеим группам лечения на дополнительные 4 недели. Количество пройденных за сутки шагов в группе пациентов, получавших препарат Бримика® Дженyейр® не изменилась и составила 510 шагов / сутки по сравнению с группой, в которой применяли плацебо (р = 0,1588); процент (%) пациентов с низкой физической активностью (<6000 шагов / сутки) по сравнению с таковыми у плацебо сократился (41,5% по сравнению с 50,4%; р = 0,1134).
Пациенты педиатрического профиля
Европейская медицинская агентство по лекарственным средствам отказалась от обязательств предоставлять результаты исследований лекарственного средства Бримика® Дженyейр® во всех подгруппах пациентов педиатрического профиля с ХОБЛ.
Фармакокинетика.
При совместном применении аклидинию и формотерола ингаляционно фармакокинетика каждого из веществ не показала значимых различий по сравнению с фармакокинетикой при введении отдельно.
всасывания
После ингаляции однократной дозы лекарственного средства Бримика® Дженyейр® 340 мкг / 12 мкг аклидиний и формотерол быстро всасываются, достигая максимальной концентрации в плазме крови в течение 5 минут после ингаляции у здоровых добровольцев и в течение 24 минут у пациентов с ХОБЛ. Максимальная концентрация в плазме крови аклидинию и формотерола в равновесном состоянии, наблюдавшиеся у пациентов с ХОБЛ, получавших препарат Бримика® Дженyейр® дважды в сутки в течение 5 дней, были достигнуты в течение 5 минут после ингаляции и составили 128 пг / мл и 17 пг / мл соответственно.
распределение
Общее количество аклидинию, ингальованого через ингалятор Дженyейр ® , что попадает в легкие, составляла примерно 30% отмерено дозы. Связывание аклидинию с белками плазмы крови in vitro отвечает, скорее всего, связывание метаболитов с белками в связи с быстрым гидролизом аклидинию бромида в плазме крови связывания с белками плазмы крови составляло 87% для метаболита карбоновой кислоты и 15% для спиртового метаболита. Основным белком плазмы крови, связывает аклидинию бромид, является альбумин. Связывание формотерола с белками плазмы составляет 61 - 64% (34% преимущественно с альбумином). Насыщение связей не происходит при концентрациях, достигаемых при применении в терапевтических дозах.
Метаболизм
Аклидинию бромид быстро и активно гидролизуется до своих фармакологически неактивных спиртовых дериватов и дериватов карбоновой кислоты. Уровень кислотного метаболита в плазме крови после ингаляции примерно в 100 раз выше, чем уровень спиртового метаболита и неизмененной действующего вещества. Происходит как химический гидролиз (неферментативными), так и ферментативный, с участием эстераз. Основной эстераз, вовлеченной в гидролиз у человека, есть бутирилхолинэстераза. Низкая биодоступность аклидинию бромида при ингаляционном введении (<5%) связана с тем, что аклидинию бромид подвергается активному системном и пресистемном гидролиза как в легких, так и при применении внутрь. Метаболизм при участии ферментов CYP450 играет незначительную роль в общем метаболическом клиренсе аклидинию бромида.
Исследования in vitro показали, что аклидинию бромид в терапевтической дозе или его метаболиты не подавляют и не индуцируют какие ферменты цитохрома P450 (CYP450) и не подавляют активность эстераз (карбоксилэстеразы, ацетилхолинэстеразы и БУТИРИЛХОЛИНЭСТЕРАЗЫ). Исследования in vitro показали, что аклидинию бромид или его метаболиты являются субстратами или ингибиторами гликопротеина Р. Формотерол выводится преимущественно метаболическим путем. Основным путем является непосредственная глюкуронизация с о-деметилирования с последующей конъюгацией с глюкуронидом. Изоферменты цитохрома P450 - CYP2D6, CYP2C19, CYP2C9 и CYP2A6 - участвуют в о деметилирования формотерола. Формотерол в терапевтических концентрациях не ингибируется ферменты CYP450.
вывод
После ингаляции лекарственного средства Бримика® Дженyейр® 340 мкг / 12 мкг при отборе плазмы в течение 24 часов после введения лекарственного средства, конечный период полувыведения аклидинию бромида составлял от 11 до 33 часов, а для формотерола - 12 - 18 часов. Среднее значение периода эффективного полувыведения (Период полувыведения соответствует накоплению лекарственного средства при известном режиме ввода) как для аклидинию, так и для формотерола составляет примерно 10:00 (рассчитано на основе отношения значений накопления).
После введения здоровым добровольцам 400 мкг меченого радиоактивной меткой аклидинию бромида около 1% дозы выводилось в неизмененном виде с мочой. До 65% дозы выводилось в виде метаболитов и до 33% в виде метаболитов с калом. После ингаляционного введения здоровым добровольцам и пациентам с ХОБЛ 200 мкг и 400 мкг аклидинию бромида очень малое количество, около 0,1% принятой дозы, выводилась в неизмененном виде с мочой, что указывает на то, что почечный клиренс играет незначительную роль в общем клиренсе аклидинию из плазмы крови. Основная часть принятого формотерола превращается путем метаболизма в печени, а затем выводится почками. После ингаляции 6 - 9% высвобожденной дозы формотерола выводится с мочой в неизмененном виде или в форме конъюгатов формотерола.
Особые группы пациентов
Пациенты пожилого возраста
Фармакокинетические исследования аклидинию / формотерола с участием пациентов пожилого возраста не проводились. Для пациентов пожилого возраста коррекция дозы не требуется при применении аклидинию или формотерола отдельно. Поэтому в случае применения аклидинию / формотерола коррекция дозы не является целесообразной.
Пациенты с нарушением функции печени и почек
С участием пациентов с нарушением функции печени или почек испытания не проводились. Поскольку для пациентов с нарушением функции печени или почек не требуется коррекции дозы ни аклидинию, ни формотерола, то в случае применения аклидинию / формотерола коррекция дозы не является целесообразной.
расовая принадлежность
У жителей Японии и европейцев после повторных ингаляций лекарственного средства Бримика® Дженyейр® наблюдался похожий системное влияние аклидинию и формотерола (по показаниям AUC).
Доклинические данные по безопасности
Доклинические данные по безопасности, основанные на традиционных фармакологических исследованиях безопасности, токсичности при многократном применении, генотоксичности, канцерогенного действия и репродуктивной токсичности, не выявили особых рисков, связанных с применением аклидинию и формотерола, для человека. При проведении доклинических исследований эффекты аклидинию отношении органов репродукции (фетотоксические эффекты) и фертильности (небольшое снижение частоты зачатий, количества желтых тел и пре- и постимплантацийна гибель эмбрионов) наблюдались только при применении доз, значительно превышающих максимальную дозу для человека, указывает на небольшую значимость для клинического применения. В исследованиях формотерола, при высоких уровнях системного воздействия наблюдалось снижение фертильности (постимплантацийна гибель эмбрионов) у крыс, а также снижение постнатальной выживаемости и средней массы при рождении. У крыс наблюдалось незначительное повышение частоты развития Лейкома матки; этот эффект считается эффектом, присущим данному классу грызунов при длительной экспозиции β2-адреномиметиками в высоких дозах. Доклинические исследования, в ходе которых изучалось влияние аклидинию / формотерола сердечно-сосудистые параметры, продемонстрировали повышенную частоту сердечных сокращений и аритмии при применении доз, значительно превышающих максимальную для человека, указывает на небольшую значимость данных эффектов для клинического применения. Эти эффекты известны как реакции на β2-адреномиметики. присущим данному классу грызунов при длительной экспозиции β2-адреномиметиками в высоких дозах. Доклинические исследования, в ходе которых изучалось влияние аклидинию / формотерола сердечно-сосудистые параметры, продемонстрировали повышенную частоту сердечных сокращений и аритмии при применении доз, значительно превышающих максимальную для человека, указывает на небольшую значимость данных эффектов для клинического применения. Эти эффекты известны как реакции на β2-адреномиметики. присущим данному классу грызунов при длительной экспозиции β2-адреномиметиками в высоких дозах. Доклинические исследования, в ходе которых изучалось влияние аклидинию / формотерола сердечно-сосудистые параметры, продемонстрировали повышенную частоту сердечных сокращений и аритмии при применении доз, значительно превышающих максимальную для человека, указывает на небольшую значимость данных эффектов для клинического применения. Эти эффекты известны как реакции на β2-адреномиметики.
Клинические характеристики
Бримика Дженуейр Показания
Поддерживающая Бронходилатационный терапия с целью облегчения симптомов хронического обструктивного заболевания легких (ХОБЛ) у взрослых пациентов.
Противопоказания
Гиперчувствительность к действующим веществам или к вспомогательному веществу.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Лекарственные средства, применяемые для лечения ХОБЛ
Совместное применение лекарственного средства Бримика® Дженyейр® с другими антихолинергическими лекарственными средствами и / или β2-адреномиметиками пролонгированного действия не рекомендуется, поскольку не изучено. Хотя формальные исследования лекарственного взаимодействия с лекарственным средством Бримика® Дженyейр® in vivo не проводились, его применяли одновременно с другими лекарственными средствами, предназначенными для лечения ХОБЛ, в том числе β2-адренорецепторами бронходилататорами короткого действия, метилксантинами и ингаляционными стероидами, без возникновения клинических признаков лекарственной взаимодействия.
метаболические взаимодействия
Исследования in vitro показали, что аклидиний в терапевтической дозе или его метаболиты не взаимодействуют с лекарственными средствами, являются субстратами гликопротеина Р (P-gp) и лекарственными средствами, которые метаболизируются ферментами цитохрома Р450 (CYP450) и эстеразами. Формотерол в терапевтических концентрациях не ингибируется ферменты CYP450.
лечение гипокалиемии
Одновременное применение с производными метилксантану, стероидами или некалийзберигаючимы диуретиками может усилить возможную гипокалиемическое действие β2-адреномиметиков, поэтому их совместное применение требует осторожности.
β- адреноблокаторы
β-адреноблокаторы могут ослаблять эффект β2-адреномиметиков или осуществлять антагонистическое действие. В случае если требуется применение β-адреноблокаторов (включая глазными каплями), рекомендуется применять кардиоселективность β-адреноблокаторы, хотя их также следует применять с осторожностью.
Другие фармакодинамические взаимодействия
Лекарственное средство Бримика® Дженyейр® следует назначать с осторожностью пациентам, которые применяют лекарственные средства, которые могут удлинять интервал QTc, такие как ингибиторы МАО, трициклические антидепрессанты, антигистаминные лекарственные средства или макролиты, поскольку действие формотерола, входящего в состав лекарственного средства Бримика® Дженyейр ®, на сердечно-сосудистую систему может быть усилена такими лекарственными средствами. Лекарственные средства, которые могут удлинять интервал QTc, ассоциируются с повышенным риском развития желудочковой аритмии.
Особенности применения
бронхиальная астма
Лекарственное средство Бримика® Дженyейр® не следует применять при бронхиальной астме, так как клинические испытания лекарственного средства Бримика® Дженyейр® при астме не проводились.
Парадоксальний бронхоспазм
В ходе клинических исследований применения лекарственного средства Бримика® Дженyейр® случаев парадоксального бронхоспазма не наблюдалось. Однако парадоксальный бронхоспазм наблюдался в случае другой ингаляционной терапии. Если это произошло, то применение лекарственного средства Бримика® Дженyейр® необходимо прекратить и рассмотреть возможность альтернативной терапии.
Не суждено для экстренной помощи
Лекарственное средство Бримика® Дженyейр® не показан для применения при острых приступах бронхоспазма.
Влияние на сердечно-сосудистую систему
Лекарственное средство Бримика® Дженyейр® нужно применять с осторожностью пациентам, которые перенесли инфаркт миокарда в предшествующие 6 месяцев, пациентам с нестабильной стенокардией, впервые диагностированной аритмией в предыдущие 3 месяца, у которых наблюдается удлинение QTc (метод Базетта) более 470 миллисекунд, и пациентам, которые были госпитализированы по поводу сердечной недостаточности III и IV функциональных классов по классификации Нью-Йоркской кардиологической ассоциации в предыдущие 12 месяцев, поскольку данные пациенты были исключены из клинических исследований. β2-адреномиметики могут повышать частоту пульса и артериальное давление, на электрокардиограмме (ЭКГ) у некоторых пациентов наблюдалось уплощение зубца Т, депрессия сегмента ST и удлинение интервала QTc. В случае развития таких эффектов может возникнуть необходимость отмены препарата.
Системные эффекты
Лекарственное средство Бримика® Дженyейр® следует с осторожностью применять пациентам с тяжелой сердечно-сосудистой патологией, судорожными расстройствами, тиреотоксикозом и феохромоцитомой.
При применении β2-адреномиметиков в высоких дозах возможны такие метаболические эффекты, как гипергликемия и гипокалиемия. В ходе клинических исследований фазы ИИИ частота случаев заметного повышения содержания глюкозы в крови при применении лекарственного средства Бримика® Дженyейр® была низкой (0,1%) и схожей с таковой при применении плацебо. Гипокалиемия обычно является обратимой и не требует заместительной терапии. У пациентов с тяжелой ХОБЛ гипокалиемия может быть усилено гипоксией и сопутствующей терапией. При гипокалиемии повышается возможность развития аритмии сердца. В связи с антихолинергическим действием лекарственное средство Бримика® Дженyейр® нужно с осторожностью применять пациентам с симптоматической гиперплазией предстательной железы, задержкой мочи или закрытоугольной глаукомой (несмотря на то, что прямой контакт лекарственного средства с глазами очень маловероятен).
вспомогательные вещества
Пациентам с редкими наследственными заболеваниями, связанными с непереносимостью галактозы, врожденной недостаточностью лактазы или нарушением всасывания глюкозы / галактозы, лекарственное средство Бримика® Дженyейр® применять не следует.
Применение в период беременности или кормления грудью
беременность
Данных по применению лекарственного средства Бримика® Дженyейр® беременным женщинам нет.
Исследования на животных токсическое действие на плод только в дозах, сильно превышающих максимальную дозу аклидинию для человека. Также побочные эффекты наблюдались в исследованиях репродуктивной функции, проводившихся с формотеролом, при очень высоких уровнях системной экспозиции.
Лекарственное средство Бримика® Дженyейр® следует применять во время беременности только в случае, если ожидаемая польза превышает потенциальный риск.
кормление грудью
Неизвестно, проникает аклидинию и / или его метаболиты или формотерол в грудное молоко. Поскольку исследования на животных показали, что небольшие количества аклидинию и / или его метаболитов и формотерола проникают в молоко, применение лекарственного средства Бримика® Дженyейр® во время кормления грудью следует рассматривать только в случае, если ожидаемая польза для матери превосходит любой потенциальный риск для ребенка.
фертильность
Исследования на животных небольшое снижение фертильности только в дозах, значительно превышающих максимальную дозу аклидинию и формотерола для человека. Считается маловероятным, что лекарственное средство Бримика® Дженyейр®, назначенный в рекомендуемой дозе, влияет на фертильность у человека.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Лекарственное средство Бримика® Дженyейр® не влияет или влияет в незначительной степени на скорость реакции при управлении автотранспортом или другими механизмами. Возникновение размытости зрения или головокружение может влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Способ применения Бримика Дженуейр и дозы
Рекомендуемая доза - 1 ингаляция лекарственного средства Бримика® Дженyейр® 340 мкг / 12 мкг 2 раза в сутки.
В случае пропуска приема дозы следующую дозу необходимо принять как можно скорее, а следующий прием следует провести в обычное время. Однако если время для приема следующей дозы почти подошел, пропущенную дозу применять не следует.
Пациенты пожилого возраста
Пациентам пожилого возраста коррекция дозы не требуется.
Нарушение функции почек
Пациентам с нарушениями функции почек коррекция дозы не требуется.
Нарушение функции печени
Пациентам с нарушениями функции печени коррекция дозы не требуется.
Пациенты педиатрического профиля
Опыт применения лекарственного средства Бримика® Дженyейр® для лечения ХОБЛ у детей и подростков (до 18 лет) отсутствует.
способ применения
Для ингаляций.
Пациенты должны быть проинструктированы относительно правильного применения лекарственного средства. Следует рекомендовать пациентам внимательно ознакомиться с инструкцией по применению лекарственного средства Бримика® Дженyейр®.
Инструкция по применению
Ознакомление с частями, из которых состоит ингалятор Дженyейр®
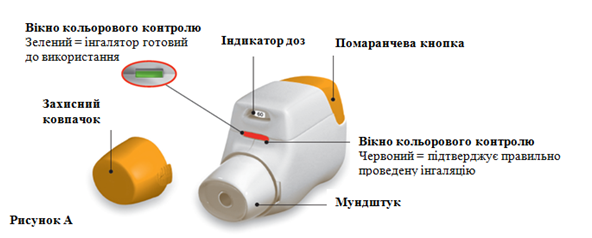
Перед использованием:
- Перед первым использованием разорвите упаковку и достаньте ингалятор. Упаковку и осушитель следует выбросить.
- Не будет нажата оранжевую кнопку до тех пор, пока не будете готовы применить препарат.
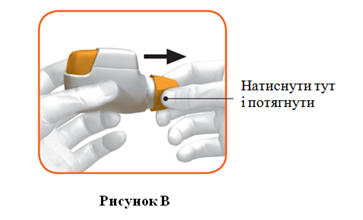
- Снять колпачок слегка нажав стрелки на каждой стороне (рисунок B).
Шаг 1: Подготовить дозу лекарственного средства
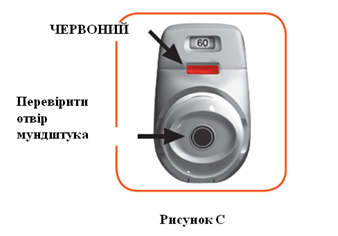
- Посмотреть в отверстие мундштука и убедиться, что он ничем не заблокирован (Рисунок C).
- Посмотреть на окно цветного контроля (должно быть красного цвета Рисунок C).
3. Ингалятор следует держать горизонтально мундштуком по направлению к себе, оранжевая кнопка должна быть направлена вверх (рисунок D).

Рисунок D
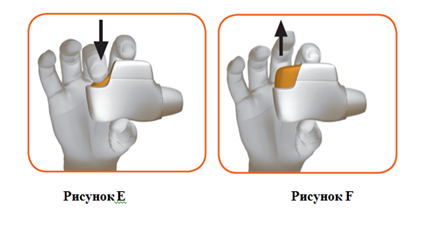
4. Нажать оранжевую кнопку вниз до конца для подготовки дозы лекарственного средства (рисунок Е). Когда кнопка нажата вниз до конца, окно цветного контроля меняет цвет с красного на зеленый.
Следует удостовериться, что оранжевая кнопка находится сверху. НЕ наклонять и нгалятор.
Отпустить оранжевую кнопку (рисунок F).
Следует удостовериться, что кнопка отпущена; это необходимо для правильной работы ингалятора.
Остановиться и проверить :
Следует удостовериться, что окно цветного контроля имеет зеленый цвет (рисунок G). Лекарственное средство готов к проведению ингаляции. Перейти в раздел «Шаг 2: Провести ингаляцию лекарственным средством».

Что делать, если окно цветного контроля осталось красным после нажатия на кнопку (рисунок Н).

Рисунок Н
Доза лекарственного средства не была подготовлена. Следует вернуться назад к разделу « Шаг 1: Подготовьте дозу лекарственного средства » и повторить пункты с 1 до 6.
Шаг 2: Провести ингаляцию лекарственного средства
Подробнее пункты с 2.1 до 2.7 перед применением лекарственного средства. Не наклонять ингалятор.
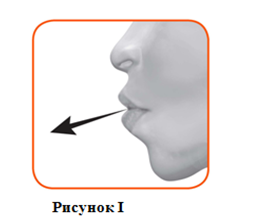
2.1 Держа ингалятор на удаленном расстоянии от рта полностью выдохнуть . Никогда не следует выдыхать в ингалятор (рисунок I).
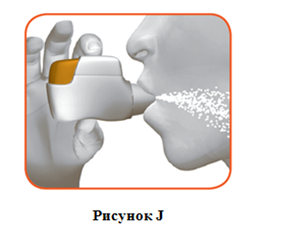
2,2 Держать голову вертикально, поместить мундштук между губами и плотно сжать губы вокруг него (рисунок J).
Не нужно удерживать оранжевую кнопку нажатой во время вдоха .
2.3 Сделать сильными и и, гл и Бокий вд и х ртом. Продолжать вдох как можно дольше.
Если ингаляция проведена правильно, раздастся щелчок. После того, как Вы услышите щелчок, следует продолжать вдох как можно дольше. Некоторые пациенты могут не услышать щелчок. Использовать окно цветного контроля чтобы убедиться, что ингаляция была проведена правильно.
2.4 Вынуть ингалятор изо рта.
2.5 Задержать дыхание как можно дольше.
2.6 Медленно выдохнуть, но не в ингалятор.
Некоторые пациенты могут испытывать ощущение песчинок во рту, слабый сладкий или горький привкус. Не применять дополнительную дозу препарата, даже если вы не почувствуете никакого вкуса или ничего не чувствуете после ингаляции.
Остановиться и проверить :
2.7 Убедиться, что окно цветного контроля имеет красный цвет (Рисунок K). Это означает, что ингаляция лекарственного средства была проведена правильно.

Что делать, если окно цветного контроля осталось зеленым после ингаляции (рисунок L).

Рисунок L
Это означает, что ингаляция лекарственного средства была проведена неправильно. Следует вернуться назад к разделу « Шаг 2: Провести ингаляцию лекарственного средства » и повторить пункты с 2.1 до 2.7.
Если окно цветного контроля все еще не изменило свой цвет на красный, то возможно, что Вы забыли отпустить оранжевую кнопку перед ингаляцией или вдох во время ингаляции был недостаточно сильным. В таком случае попробуйте повторить процедуру. Убедитесь, что Вы отпустили оранжевую кнопку и полностью выдохнули. Затем сделать сильный, глубокий вдох через мундштук.
Следует п роконсульту ваться с врачом, если окно цветного контроля остается зеленым после повторных попыток.
После каждого использования надевайте на мундштук защитный колпачок (рисунок M) для предотвращения загрязнения ингалятора пылью или другими веществами. В случае потери колпачка ингалятор следует выбросить.

Дополнительная информация
Что делать, если Вы нечаянно подготовили к приему дозу препарата?
Храните ингалятор с надетым защитным колпачком до момента запланированного приема лекарственного средства, затем снимите колпачок и перейдите к пункту 1.6.
Как работает индикатор доз?
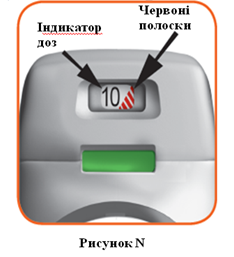
• Индикатор доз показывает общее количество доз лекарственного средства, оставшегося в ингаляторы (рисунок N).
• В момент первого использования в ингаляторе содержится не менее 60 доз или не менее 30 доз в зависимости от размера упаковки.
• Каждый раз при подготовке дозы лекарственного средства путем нажатия на оранжевую кнопку индикатор дозы осуществляет небольшое перемещение в направлении следующего числа (50, 40, 30, 20, 10 или 0).
Когда Вам необходим новый ингалятор?
Вам необходим новый ингалятор:
• Если ингалятор оказался поврежденным или если Вы потеряли колпачок, или
• Когда на индикаторе доз появились красные полоски, обозначающие приближение последней дозы препарата (Рисунок N), или
• Если ингалятор пуст (рисунок O).
Индикатор дозы осуществляет небольшое перемещение в направлении от 60 до 0: 60, 50, 40, 30, 20, 10, 0.
Как узнать, что Ваш ингалятор пуст?
Когда оранжевая кнопка не вернется полностью в свое верхнее положение, а останется заблокированной в среднем положении, это будет означать, что подготовлена последняя доза (рисунок O). Даже когда оранжевая кнопка заблокирована, Вы сможете принять последнюю дозу. После этого ингалятор не может быть использован снова, и Вам необходимо начать использовать новый ингалятор.

Как чистить ингалятор?
НИКОГДА нельзя использовать воду для чистки ингалятора, так как это может повредить лекарственное средство. Ингалятор нельзя мыть, но если это необходимо, можно протереть мундштук сухой тканью или бумажной салфеткой.
Дети
Лекарственное средство Бримика ® Дженyейр ® не рекомендуется применять детям (в возрасте до 18 лет) в связи с отсутствием достаточного клинического опыта применения при ХОБЛ данной категории пациентов.
Передозировка
Данные по лечебных мероприятий при передозировке лекарственным средством Бримика® Дженyейр® ограничены. Высокие дозы аклидинию бромида могут вызвать симптомы антихолинергического и / или β2-адренергической действия; наиболее частыми из этих симптомов является нечеткость зрения, сухость во рту, тошнота, мышечные судороги, тремор, головную боль, сердцебиение и артериальная гипертензия. При передозировке следует прекратить прием лекарственного средства Бримика® Дженyейр®. Показана поддерживающая и симптоматическая терапия.
Побочные эффекты
Профиль безопасности базируется на опыте, который был получен при применении лекарственного средства Бримика® Дженyейр® и его отдельных компонентов.
Обзор профиля безопасности
Опыт исследования безопасности применения лекарственного средства Бримика® Дженyейр® охватывает период клинических исследований в рекомендованной терапевтической дозе продолжительностью 12 месяцев и послерегистрационного наблюдения. Побочные реакции, связанные с применением лекарственного средства Бримика® Дженyейр®, были похожи на те, что наблюдались при применении его отдельных компонентов. Поскольку в лекарственном средстве Бримика® Дженyейр® содержится аклидиний и формотерол, тип и степень тяжести побочных реакций, известные по отношению к каждому из компонентов, можно ожидать относительно лекарственного средства Бримика® Дженyейр®.
Побочными реакциями, наиболее часто встречающиеся при применении лекарственного средства Бримика ® Дженyейр ® , является назофарингиты (7,9%) и головная боль (6,8%).
Таблица побочных реакций
Программа клинической разработки лекарственного средства Бримика® Дженyейр® была проведена среди пациентов с ХОБЛ средней или тяжелой степени. Всего 1222 пациентам применяли препарат Бримика® Дженyейр® 340 мкг / 12 мкг. Частоту следующих побочных реакций установлено по общим коэффициентами возникновения побочных реакций, в связи с применением лекарственного средства Бримика ® Дженyейр ® при свободном анализе рандомизированных клинических исследований фазы ИИИ с плацебо-контролем продолжительностью не менее 6 месяцев или по опыту применения его отдельных компонентов.
Частота возникновения побочных реакций классифицируется следующим образом: очень часто (≥1 / 10), часто (от ≥1 / 100 до <1/10), нечасто (от ≥1 / 1000 до <1/100), редко (от 1 / 10000 до <1/1000), очень редко (<1/10000); частота неизвестна (частоту нельзя оценить по имеющимся данным).
Классы системы органов | побочные реакции | Частота |
Инфекции и паразитарные заболевания | Назофарингит Инфекции мочевыводящих путей Синусит абсцесс зуба | Часто |
Со стороны иммунной системы | реакции гиперчувствительности | редко |
Ангионевротический отек анафилактическая реакция | частота неизвестна | |
Со стороны обмена веществ и пищеварения | гипокалиемия гипергликемия | Нечасто |
Со стороны психики | бессонница тревожные состояния | Часто |
возбуждение | Нечасто | |
Со стороны нервной системы | Головная боль головокружение Тремор | Часто |
Дисгезия | Нечасто | |
Со стороны органов зрения | размытость зрения | Нечасто |
Со стороны сердечно-сосудистой системы | тахикардия Удлинение интервала QTc на ЭКГ сердцебиение стенокардия | Нечасто |
Со стороны органов дыхания, грудной клетки и средостения | Кашель | Часто |
дисфония Першение в горле | Нечасто | |
Бронхоспазм, в том числе парадоксальный | редко | |
Со стороны ЖКТ | диарея тошнота Сухость во рту | Часто |
Стоматити | Нечасто | |
Со стороны кожи и подкожной ткани | сыпь зуд | Нечасто |
Со стороны скелетной мускулатуры и соединительной ткани | миалгия мышечные судороги | Часто |
Со стороны почек и мочевыводящих путей | задержка мочи | Нечасто |
Общие нарушения в месте введения | периферический отек | Часто |
Влияние на результаты лабораторных и инструментальных исследований | Повышение уровня КФК в крови | Часто |
Повышение артериального давления | Нечасто |
Сообщение о подозреваемых побочные реакции.
Сообщение о подозреваемых побочные реакции после регистрации лекарственного средства играет важную роль. Это позволяет наблюдение за соотношением польза / риск данного лекарственного средства. Работники учреждений здравоохранения должны сообщать о любых подозреваемые побочные реакции через национальную систему оповещения.
Срок годности Бримика Дженуейр
3 года. Использовать в течение 60 дней с момента вскрытия.
Условия хранения Бримика Дженуейр
Специальные условия хранения не требуются. Ингалятор хранить в оригинальной упаковке до начала использования. Хранить в недоступном для детей месте.
Упаковка
По 60 доз порошка в ингаляторе, по 1 или по 3 ингаляторы в алюминиевом ламинированной пакете каждый вместе с пакетиком с осушителем в коробке из картона.
Категория отпуска
По рецепту.
Производитель
Индастриас Фармасеутикас Алмирал С.А.
Местонахождение производителя
Стра. Насионал ИИ, км 593, 08740 Сант Андреу де ла Барса (Барселона), Испания.
Заявитель.
Берлин-Хеми АГ.
Местонахождение заявителя.
Глиникер Вег 125, 12489 Берлин, Германия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Бримика Дженуейр только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Индастриас Фармасеутикас Алмирал С.А.
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
Бримика Дженуейр и Алкоголь?
Ваше состояние само по себе может ухудшаться после приема спиртного, так как алкоголь расширяет сосуды и вызывает отечность. Не рекомендуем принимать алкоголь в течение всего курса приема препарата Бримика Дженуейр, а также несколько дней после завершения лечения.
| Тип данных | Сведения из реестра |
| Торговое наименование: | Бримика Дженуейр |
| Производитель: | Индастриас Фармасеутикас Алмирал С.А. |
| Форма выпуска: | порошок для ингаляций 340 мкг / 12 мкг по 60 доз порошка в ингаляторе, по 1 ингалятора в алюминиевом ламинированной пакете вместе с пакетиком с осушителем в коробке из картона или по 60 доз порошка в ингаляторе, по 3 ингаляторы в алюминиевом ламинированной пакете каждый, вместе с пакетиком с осушителем в коробке из картона |
| Регистрационное удостоверение: | UA/17683/01/01 |
| Дата начала: | 17.10.2019 |
| Дата окончания: | 17.10.2024 |
| МНН: | Formoterol and aclidinium bromide |
| Условия отпуска: | по рецепту |
| Состав: | 1 доза высвобождается (доза выходит из мундштука), содержит 396 мкг аклидинию бромид, что эквивалентно 340 мкг аклидинию, и 11,8 мкг формотерола фумарата дигидрат. Это соответствует отмеренном дозе 400 мкг аклидинию бромида, соответствует 343 мкг аклидинию и отмеренном дозе 12 мкг формотерола фумарата дигидрат; |
| Фармакологическая группа: | Средства, влияющие на респираторную систему. Средства, применяемые при обструктивных заболеваниях дыхательных путей. Адренергические средства в комбинации с антихолинергическими средствами. |
| Код АТХ: | R03AL05 |
| Заявитель: | БЕРЛИН-Хеми АГ |
| Страна заявителя: | Германия |
| Адрес заявителя: | Глиникер Вег 125, 12489 Берлин, Германия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Комбинированный |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| R | Средства, действующие на респираторную систему |
| R03 | Средства, применяемые при обструктивных заболеваниях дыхательных путей |
| R03A | Адренергические препараты для ингаляционного применения |
| R03AL | Адренергические в сочетании с антихолинергическими средствами |
| R03AL05 | Формотерол и аклидинию бромид |
