- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Внимание! Срок действия регистрационного удостоверения UA/16841/01/01 закончился 13.07.2023
Бринейра инструкция по применению
Официальная инструкция лекарственного препарата Бринейра раствор 30 мг/мл. Описание и применение Brinejra, аналоги и отзывы. Инструкция Бринейра раствор утвержденная компанией производителем.
Состав
действующее вещество: сerliponase alfa;
1 мл раствора для инфузий содержит 30 мг церлипоназы альфа;
1 флакон содержит 150 мг церлипоназы альфа;
Вспомогательные вещества: натрия фосфат, гептагидрат; натрия дигидрофосфат моногидрат, натрия хлорид, калия хлорид, магния хлорид, гексагидрат; кальция хлорид, дигидрат; вода для инъекций.
Флакон с 5 мл раствора для промывания содержит натрия фосфат, гептагидрат; натрия дигидрофосфат моногидрат, натрия хлорид, калия хлорид, магния хлорид, гексагидрат; кальция хлорид, дигидрат; воду для инъекций.
Лекарственная форма
Раствор для инфузий.
Основные физико-химические свойства: жидкость от прозрачной до слегка опалесцирующая, от бесцветной до бледно желтого цвета, практически свободный от частиц, может содержать эндогенные белковые частицы, которые наблюдаются в виде полупрозрачных волокон или непрозрачных частиц;
раствор для промывания: прозрачная бесцветная жидкость, практически свободная от частиц.
Фармакологическая группа
Средства, влияющие на функцию пищеварительной системы и обмен веществ. Ферменты.
Код ATH A16A V17.
Фармакологические свойства
Фармакологические.
механизм действия
Церлипоназа альфа - это рекомбинантная форма человеческой трипептидилпептидазы-1 (rhTPP1) товары в клетках яичников китайских хомячков.
Церлипоназа альфа представляет собой протеолитический неактивный профермент (зимоген), который активируется в лизосомах. Церлипоназа альфа захватывается клетками-мишенями и перемещается в лизосомы через катионнезалежний маннозы-6-фосфатный рецептор (CI- MPR, также известный как рецептор M6P / IGF2). Профиль гликозилирования церлипоназы альфа обеспечивает стабильное поглощения клетками и попадание в лизосомы для активации.
Активированный протеолитический фермент (rhTPP1) отщепляет трипептиды от N-конца белка-мишени с неизвестной специфичностью субстрата. Недостаточные уровни TPP1 вызывают нейрональный цероидний липофусциноз 2 типа (CLN2), что приводит у больных до нейродегенерации, потери неврологических функций и смерти в детстве.
Клиническая эффективность и безопасность
Безопасность и эффективность препарата Бринейра оценивали в открытом клиническом исследовании с повышением дозы (190-201) и в долгосрочном расширенном исследовании (190-202), который проходит с участием больных CLN2 сравнению с неликованимы больными CLN2, данные по которым брали с исторической базы данных естественного течения заболевания (контрольная группа с естественным течением). Чтобы оценить прогрессирование заболевания, в этих исследованиях использовали совокупность двигательных и речевых доменов хворобоспецифичнои шкалы клинического оценивания (см. Таблицу 1). Каждый домен предусматривает оценки от 3 (всего нормально) до 0 (выраженное нарушение) с общей возможной оценкой 6; уменьшение оценки соответствует основным явлениям потери ранее достигнутых функций способности передвигаться и разговаривать.
Таблица 1. Шкала клинического оценивания при CLN 2
Домен | Бали | оценивания |
двигательная функция | 3 | В общем нормальная походка. Выраженная атаксия и патологические падения отсутствуют. |
2 | Самостоятельная походка определяется по способности пройти без помощи 10 шагов. Наблюдается явная нестабильность, время от времени возможные падения. | |
1 | Нуждается в посторонней помощи при ходьбе или может только ползать. | |
0 | Больше не может ходить или ползать. | |
Язык | 3 | Видимо нормальная речь. Разборчива и вообще соответствующая возрасту. Отклонений пока не наблюдается. |
2 | Язык становится заметно нарушенной: некоторые слова неразборчивы, пациент может формировать короткие предложения для описания явлений, вопросов или потребностей. Эта оценка означает снижение по сравнению с предыдущим уровнем способности (от максимального индивидуального достигнутого ребенком уровня). | |
1 | Тяжелая для понимания. Отдельные разборчивы слова. | |
0 | Отсутствие разборчивых слов или выкриков. |
Всего 24 пациента в возрасте от 3 до 8 лет получали лечения Бринейра в дозе 300 мг через неделю. В исследовании 190-201 23 пациента получали лечение в течение 48 недель (1 пациент выбыл после первой недели из-за неспособности продолжать исследовательские процедуры). Средняя начальная оценка CLN2 составила 3,5 (стандартное отклонение (СО) 1,20) с диапазоном от 1 до 6, пациенты с прогрессированием распространенного заболевания не принимали участия в исследовании (критерии включения - легкое или средней тяжести прогрессирования CLN2). Все 23 пациента, которые завершили исследование 190-201 и продолжили участие в расширенном исследовании 190-202, продолжается, получавших лечение препаратом Бринейра в дозе 300 мг через неделю максимум в течение 124 недель.
Данные исследований 190-201 и 190-202 сравнивали с контрольной группой естественного течения заболевания, включала пациентов, удовлетворяли критериям включения для исследований 190-201 и 190-202. Результаты в контрольной группе естественного течения свидетельствуют, что CLN2 является быстро прогрессирующим нейродегенеративным заболеванием с прогнозируемым снижением двигательной и речевой функций по рассчитанной средней скорости снижения оценки CLN2 на 2 балла за 48 недель.
Эффект лечения пациентов, получавших препарат Бринейра, оценивали с помощью шкалы клинического оценивания CLN2, а результаты сравнивали с прогнозируемым снижением на 2 балла по 48 недель в контрольной группе естественного течения. В исследовании 190-201 в 20 из 23 (87%) пациентов, получавших препарат Бринейра в течение 48 недель, не наблюдалось необратимому снижению на 2 балла, что наблюдалось у нелеченных пациентов (р = 0,0002, предположение о биномиального критерия р0 = 0 , 50). Всего в 15 пациентов из 23 (65%) не наблюдалось снижения оценки CLN2 вообще независимо от начальной оценки, а в 2 из этих 15 пациентов оценка повысилась на один балл в период лечения. У 5 пациентов оценка снизилась на 1 балл, а у 3 пациентов - на 2 балла.
В исследовании 190-201 средняя скорость снижения оценки заболевания (скорость ухудшения) пациентов, получавших лечение препаратом Бринейра в дозе 300 мг через неделю, составляла 0,40 баллов за 48 недель. По сравнению с прогнозируемой скоростью ухудшения в случае естественного течения заболевания, результаты исследования являются статистически значимыми (p <0,0001) (см. Таблицу 2). Эффект лечения, наблюдался считается клинически значимым в свете естественного течения CLN2 без лечения.
Таблица 2. Клиническая шкала оценки двигательной и речевой функций при заболевании CLN 2 от 0 до 6 баллов: скорость ухудшения в течение 48 недель (популяция пациентов, которым назначали исследуемое лечение (ИВС))
Скорость ухудшения (баллов / 48 недель) а | Всего (n = 23) | р-значенняb |
Среднее значение (СВ) | 0,40 (0,809) в | <0,0001 |
медиана | 0,00 | |
Мин., Макс. | -0,88, 2,02 | |
Границы 95% ДИ | 0,05, 0,75 |
a Скорость снижения оценки функций у пациента за 48 недель (начальная оценка CLN2 - последняя оценка CLN2) / (время, прошедшее в отрезках 48-недельного периода).
b p-значения на основе сравнения скорости снижения оценки со значением 2 с помощью 1-выборочного Т-критерию.
c Положительный показатель указывает на клиническое ухудшение; отрицательный показатель указывает на клиническое улучшение.
В исследовании 190-202, что продолжается (по состоянию на 3 июня 2016 года), скорость ухудшения у пациентов, получающих лечение препаратом Бринейра по сравнению с контрольной группой естественного течения заболевания (N = 42 пациента), так свидетельствовать об устойчивом эффект лечения (см . рисунок 1).
Рисунок 1. Среднее изменение оценки CLN 2 от начального уровня (контрольная группа естественного течения заболевания по сравнению с пациентами, которые получают лечения Бринейра в дозе 300 мг через неделю)
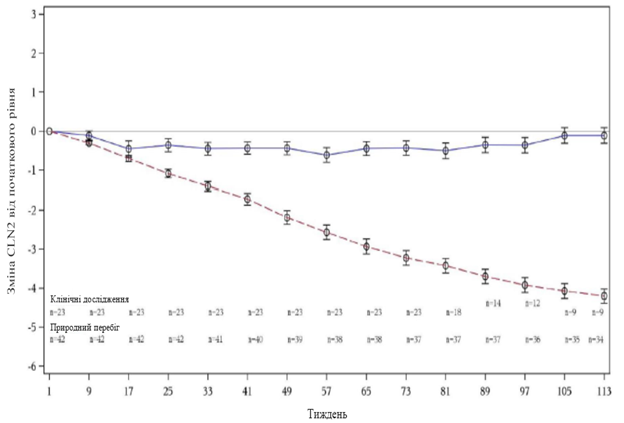
Вертикальные столбики на рис.1 соответствуют стандартной погрешности среднего значения.
Сплошная линия - клинические исследования 190-201 и 190-202.
Пунктирная линия - контрольная группа естественного течения заболевания 190-901.
Оценки зрения и судом наряду с оценкой CLN2 (двигательный и речевой домены) остаются стабильными. Показатели, определенные с помощью МРТ-волюметрии, свидетельствуют о замедлении ухудшения.
педиатрические пациенты
Важно начинать лечение детей как можно раньше, хотя пациентов в возрасте до 3 лет не включали в базовое исследование.
Исследование 190-203 - это открытое клиническое исследование, продолжается, в котором оценивают безопасность и эффективность препарата у пациентов в возрасте от рождения до 18 лет. В основу дозирования положен анализ различий показателей массы головного мозга у детей до 3 лет. Полученные результаты оценки безопасности у более молодых пациентов свидетельствуют, что профиль безопасности соответствует определенному у детей старшего возраста. На сегодня клинический опыт применения препарата Бринейра детям до 2 лет отсутствует (см. Раздел «Побочные реакции»).
Европейское агентство лекарственных средств временно освободило разработчика от обязательств представлять результаты исследований препарата Бринейра в одной или нескольких подгруппах педиатрической популяции с CLN2 (см. Раздел «Способ применения и дозы», где приведена информация о применении детям).
Это лекарственное средство зарегистрировано на условиях применения в исключительных случаях. Это означает, что, учитывая редкость заболевания, невозможно получить полную информацию об этом лекарственное средство.
Европейское агентство лекарственных средств ежегодно рассматривать любую новую информацию, которая может появиться, и при необходимости обновлять эту инструкцию для медицинского применения.
Фармакокинетика.
Фармакокинетику церлипоназы альфа оценивали у пациентов, больных CLN2, которые получали интрацеребровентрикулярни инфузии по 300 мг в течение примерно 4,5 часа через неделю.
Все фармакокинетические показатели были одинаковыми после начальной инфузии в день 1 и после следующих инфузий на неделе 5 и недели 13, что указывает на отсутствие явного накопления или зависимости от времени фармакокинетики церлипоназы альфа в спинно-мозговой жидкости (СМР) или плазме после введения в дозе 300 мг через неделю. Фармакокинетические показатели в СМР было определено у 17 пациентов; сводный обзор представлен в таблице 3. Фармакокинетика церлипоназы альфа в плазме крови была оценена в 13 пациентов; медиана Tmax равна 12:00 (от начала инфузии), средняя Cmax - 1,39 мкг / мл, а средняя AUC0-t - 24,1 мкг-час / мл. Явного влияния антител к лекарственному средству в сыворотке или СМР на фармакокинетику препарата в плазме крови или СМР не наблюдалось.
Таблица 3. Фармакокинетические показатели после первой интрацеребровентрикулярнои инфузии (продолжительностью около 4:00) 300 мг церлипоназы альфа в СМР
показатель | SMR (N = 17) Среднее значение (СВ) |
Tmax*, год | 4,50 [4,25, 5,75] |
Cmax, мкг/мл | 1490 (942) |
AUC0-t, мкг-год/мл | 9510 (4130) |
Vz, мл | 435 (412) |
CL, мл/год | 38,7 (19,8) |
t1/2, год | 7,35 (2,90) |
* Tmax выражено как время от начала ~ 4-часовой инфузии и представлено как медиану [мин., Макс.], Соответствует первой временной точке взятия образцов после инфузии.
распределение
Расчетный объем распределения церлипоназы альфа после интрацеребровентрикулярнои инфузии 300 мг (Vz = 435 мл) превышает типичный объем СМР (100 мл), что свидетельствует о распределении в другие ткани, кроме СМР. Значительные отношение СМР / плазма по показателям Cmax и AUC0-t (примерно 1000 и 400 соответственно) свидетельствуют, что большинство введенной церлипоназы альфа локализуется в пределах ЦНС. Нет оснований ожидать, что интрацеребровентрикулярне введение церлипоназы альфа приведет терапевтические концентрации в тканях глаза учитывая ограниченный доступ с СМР в пораженные клетки сетчатки и наличие гематоретинального барьера.
вывод
Церлипоназа альфа представляет собой белок, который, как ожидается, метаболически деградировать путем гидролиза пептидов. Согласно прогнозируется, что нарушение функции печени не влияет на фармакокинетику церлипоназы альфа.
Вывод церлипоназы альфа почками считается незначительным путем клиренса.
Доклинические данные по безопасности
Ограничены доклинические данные по безопасности церлипоназы альфа получено в исследованиях токсичности после однократного введения на обезьянах и исследований токсичности после многократного введения на собаках-ТАСС, которых использовали для создания модели классического инфантильного нейронального цероидного липофусциноза 2 типа. Эту модель заболевания использовали, в первую очередь, для изучения фармакодинамических и фармакокинетических свойств церлипоназы альфа, но также и для оценки токсичности вещества. Однако результаты этих исследований на такси не позволяют достоверно прогнозировать безопасность препарата для человека, поскольку режим инфузий церлипоназы альфа был другим и значительно отличался даже в пределах одного исследования из-за трудностей с установлением полостного катетера и выраженные реакции гиперчувствительности. Кроме того, эти исследования включали очень малое количество животных, в которых исследовали преимущественно однократное введение, и не предполагали надлежащего контроля. Таким образом, доклинические исследования препарата не позволяют сделать окончательные выводы относительно клинической безопасности церлипоназы альфа. Исследование генотоксичности, канцерогенности и репродуктивной токсичности не проводились.
Клинические характеристики
Бринейра Показания
Препарат Бринейра показан для лечения нейронального цероидного липофусциноза 2 типа (CLN2), также известного как дефицит трипептидилпептидазы 1 (TPP1).
Противопоказания
Анафилактическая реакция, представляет угрозу для жизни, действующее вещество или любую из вспомогательных веществ, указанных в разделе «Состав», если проба с повторным введением препарата неуспешный (см. Раздел «Особенности применения»).
Вентрикуло-перитонеальные шунты у больных CLN2.
Препарат Бринейра нельзя вводить до тех пор, пока имеются признаки сильного подтекание из устройства для интрацеребровентрикулярного доступа, неисправности устройства или связанной с устройством инфекции (см. Разделы «Способ применения и дозы» и «Особенности применения»).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследование взаимодействия не проводились. Церлипоназа альфа - рекомбинантный человеческий белок, и его системная экспозиция ограничена из-за интрацеребровентрикулярний путь введения, поэтому взаимодействие между церлипоназою альфа и лекарственными средствами, которые метаболизируются при участии ферментов цитохрома Р450, маловероятно.
Особенности применения
Осложнения, связанные с устройством
Чтобы уменьшить риск инфекции, необходимо вводить препарат Бринейра, соблюдая правила асептики. У пациентов, которых лечили препаратом Бринейра, наблюдались случаи инфекций, связанных с применением устройства для интрацеребровентрикулярного доступа, в частности, субклинические инфекции и менингит. Менингит может проявляться следующими симптомами: лихорадка, головная боль, ригидность мышц шеи, чувствительность к свету, тошнота, рвота и изменение психического состояния. Необходимо регулярно присылать образцы спинномозговой жидкости на анализ для выявления субклинических инфекций, связанных с применением устройства. В клинических исследованиях назначали антибиотики, осуществляли замену устройства интрацеребровентрикулярного доступа и продолжали лечения Бринейра.
Медицинские работники должны проверять волосистую часть головы пациента относительно целостности кожи перед каждой инфузией, чтобы убедиться в исправности устройства интрацеребровентрикулярного доступа. К общим признакам подтекания устройства и его неисправности относятся отек, эритема кожи волосистой части головы, экстравазация жидкости или вздутие кожи волосистой части головы вокруг места интрацеребровентрикулярного доступа или над ним. Однако эти признаки могут возникать как симптомы связанных с применением устройства инфекций.
Прежде чем начинать инфузию препарата Бринейра, необходимо проверить место инфузии и проходимость устройства интрацеребровентрикулярного доступа, чтобы выявить протечек и / или неисправность (см. Разделы «Способ применения и дозы» и «Противопоказания»). Признаки и симптомы связанных с применением устройства инфекций могут быть неявными, поэтому необходимо регулярно присылать образцы спинномозговой жидкости на анализ для выявления субклинических инфекций, связанных с применением устройства. Чтобы подтвердить целостность устройства, может биты необходимым обратиться за консультацией к нейрохирургу. Лечение препаратом Бринейра следует прервать в случае неисправности устройства, перед последующей инфузией может быть необходимо заменить устройство доступа.
После длительного периода использования резервуара устройства интрацеребровентрикулярного доступа может произойти существенное ухудшение его состояния, что было подтверждено контрольными испытаниями и наблюдалось во время клинических исследований после примерно 4 лет использования резервуара. В двух клинических исследованиях устройство для интрацеребровентрикулярного доступа не имел признаков неисправности во время инфузии, однако после его удаления были видимые признаки порчи устройства, которые согласовывались с данными контрольного тестирования устройства интрацеребровентрикулярного доступа. Устройство доступа был заменен, а пациент возобновил лечения Бринейра.
Устройство интрацеребровентрикулярного доступа необходимо заменить до завершения 4-летнего периода регулярного введения Бринейры, однако следует всегда быть уверенными, что устройство для интрацеребровентрикулярного доступа применяется в соответствии с рекомендациями соответствующего производителя медицинского изделия.
В случае развития связанных с устройством для интрацеребровентрикулярного доступа осложнений следует ознакомиться с дополнительными указаниями, приведенными в документации производителя.
В случае лечения пациентов, склонных к возникновению осложнений в связи с интрацеребровентрикулярним введением лекарственных средств, в том числе пациентов с обструктивной гидроцефалией, необходимо проявлять осторожность.
Клинический и лабораторный мониторинг
Основные жизненные показатели следует проверять в условиях медицинского учреждения до начала инфузии, периодически во время инфузии и после инфузии. После завершения инфузии следует осуществить клиническое оценки состояния пациента и обеспечить более длительное наблюдение при наличии клинических показаний, особенно в отношении пациентов в возрасте до 3 лет.
ЭКГ (ЭКГ) мониторинг во время инфузии следует осуществлять пациентам с брадикардией, нарушением проводимости или структурального пороками сердца в анамнезе, поскольку у некоторых пациентов с CLN2 могут развиться нарушения проводимости или болезнь сердца. У пациентов со здоровым сердцем регулярное ЭКГ обследования в 12 отведениях следует выполнять каждые 6 месяцев.
Образцы СМР следует отправлять на исследование в плановом порядке с целью выявления субклинических, связанных с устройством инфекций (см. Раздел «Способ применения и дозы»).
педиатрические пациенты
В клинических исследованиях не участвовали пациенты с прогрессированием распространенного заболевания на момент начала лечения. Также отсутствуют клинические данные относительно детей <2 лет. Пациенты с распространенным заболеванием CLN2 и новорожденные могут иметь пониженную целостность гематоэнцефалического барьера. Влияние потенциально повышенной экспозиции лекарственного средства на периферические отделы организма неизвестен.
анафилактические реакции
Во время применения препарата Бринейра сообщалось о случаях анафилактических реакций. В качестве меры пресечения следует обеспечить средства оказания неотложной медицинской помощи во время введения препарата Бринейра. В случае появления анафилактических реакций немедленно прекратите инфузию препарата и начните необходимое медицинское лечение. Внимательно наблюдайте за пациентами во время и после инфузии препарата.
Если наблюдается анафилаксия, следует проявлять осторожность при повторном введении препарата.
содержание натрия
Это лекарственное средство содержит 17,4 мг натрия в одном флаконе препарата Бринейра и раствора для промывания, что эквивалентно 0,87% максимального ежедневного потребления 2 г натрия взрослыми, как рекомендовано ВОЗ.
Каждый флакон содержит менее 1 ммоль (39 мг) калия, то есть практически свободный от калия.
прослеживаемость
С целью улучшения видстежуваности биологических лекарственных средств название и номер серии вводимого должны быть четко записаны.
Препарат Бринейра и раствор для промывания следует использовать сразу после размораживания. Препарат следует набирать из закрытого флакона непосредственно перед использованием. Если невозможно использовать немедленно, закрытые флаконы препарата Бринейра или раствора для промывания следует хранить при температуре 2-8 ° C и использовать в течение 24 часов.
Доказано химическую и физическую стабильность в процессе эксплуатации в течение 12:00 при комнатной температуре (19-25 ° C). С микробиологической точки зрения, открытые флаконы или набранный в шприц лекарственный препарат следует использовать сразу. Ответственность за время и условия хранения в процессе использования препарата, не применен немедленно, несет пользователь.
Применение в период беременности или кормления грудью
беременность
Данные по применению препарата Бринейра беременным женщинам отсутствуют. Исследование влияния препарата Бринейра на репродуктивную функцию животных не проводились. Неизвестно, может ли препарат Бринейра нанести вред плоду в случае введения препарата беременной женщине или влиять на репродуктивную функцию. Препарат Бринейра следует назначать беременным женщинам только в случае крайней необходимости.
кормление грудью
Данные о присутствии церлипоназы альфа в грудном молоке человека, влияния церлипоназы альфа на младенца, которое кормят грудью, или на выработку грудного молока отсутствуют. Во время лечения Бринейра кормления грудью следует прекратить.
фертильность
Исследование влияния церлипоназы альфа на фертильность животных или человека не проводились.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Исследование влияния препарата Бринейра на способность управлять транспортными средствами и работать с другими механизмами не проводились.
Способ применения Бринейра и дозы
Препарат Бринейра должен вводить только специально подготовленный медицинский работник, который владеет методикой интрацеребровентрикулярного ввода, в условиях лечебного учреждения.
дозировка
Рекомендуемая доза составляет 300 мг церлипоназы альфа, вводится один раз каждые две недели (через неделю) путем интрацеребровентрикулярнои инфузии.
Для пациентов в возрасте до 2 лет рекомендуются более низкие дозы (см. Раздел «Педиатрические пациенты»).
За 30-60 минут до начала инфузии рекомендуется проведение премедикации антигистаминными средствами с антипиретиками или без.
Продолжение длительного лечения требует регулярного клинического оценивания соотношение пользы и потенциальных рисков для конкретного пациента.
коррекция дозы
Если пациент не может переносить инфузию, следует рассмотреть возможность коррекции дозы. Дозу можно снизить на 50% и / или уменьшить скорость инфузии.
Если инфузию пришлось прервать из-за реакции гиперчувствительности, ее следует восстановить со скоростью, примерно равна половине начальной скорости инфузии, на фоне которой развилась реакция гиперчувствительности.
Следует прервать инфузию и / или уменьшить ее скорость, если, по мнению врача, у пациента во время инфузии может повышаться внутричерепное давление, на что указывают такие симптомы, как головная боль, тошнота, рвота или ухудшение состояния сознания. Такие меры имеют особое значение для пациентов в возрасте до 3 лет.
педиатрические пациенты
Безопасность и эффективность применения препарата Бринейра детям в возрасте до 3 лет сегодня не установлены. Имеющиеся ограниченные данные в отношении детей в возрасте от 2 лет, а клинические данные в отношении детей в возрасте до 2 лет отсутствуют (см. Раздел «Фармакологические свойства»). Дозировка, предлагаемого для детей до 2 лет, рассчитана с учетом массы головного мозга.
В клинических исследованиях лечения Бринейра начинали у детей от 2 до 8 лет. Опыт применения препарата пациентам старше 8 лет ограничен. Решение по лечению принимают на основе соотношения между пользой и рисками по оценке врача.
Выбор дозы для пациентов осуществляют в зависимости от возраста на момент лечения и соответственно корректируют (см. Таблицу 4). У пациентов в возрасте до 3 лет рекомендуемая доза соответствует дозе, применявшейся в продолжающемся клиническом исследовании 190-203 см. раздел «Фармакологические свойства».
Таблица 4. Доза и объем препарата Бринейра
возрастные группы | Общая доза вводится через неделю (мг) | Объем раствора препарата Бринейра (мл) |
От рождения до <6 месяцев | 100 | 3,3 |
От 6 месяцев до <1 года | 150 | 5 |
От 1 года до <2 лет | 200 (первые 4 дозы) 300 (последующие дозы) | 6,7 (первые 4 дозы) 10 (дальнейшие дозы) |
2 года и старше | 300 | 10 |
способ применения
Интрацеребровентрикулярне применения.
Меры предосторожности, которые следует принять перед работой с этим лекарственным средством или его введением
Во время подготовки и введения препарата необходимо строго соблюдать правила асептики.
Препарат Бринейра и раствор для промывания можно вводить только интрацеребровентрикулярним путем. Каждый флакон препарата Бринейра и раствора для промывания предназначен исключительно для одноразового использования.
Препарат Бринейра вводят в спинномозговую жидкость (СМР) путем инфузии через имплантированный хирургически резервуар и катетер (устройство для интрацеребровентрикулярного доступа). Перед первой инфузии необходимо имплантировать устройство для интрацеребровентрикулярного доступа. Имплантированный устройство для интрацеребровентрикулярного доступа должен подходить для доступа к желудочков головного мозга для введения лекарственных средств.
После инфузии препарата Бринейра необходимо использовать рассчитанное количество раствора для промывания, чтобы промыть компоненты инфузионной системы, в том числе устройство для интрацеребровентрикулярного доступа, с целью полного введения препарата Бринейра и поддержания проходимости устройства интрацеребровентрикулярного доступа. Перед введением следует разморозить флаконы с препаратом Бринейра и раствором для промывания. Скорость инфузии препарата Бринейра и раствора для промывания составляет 2,5 мл / час. Полное время инфузии, то есть введение препарата Бринейра и необходимого количества раствора для промывания, составляет примерно 2-4,5 часа в зависимости от дозы и введенного объема.
Интрацеребровентрикулярна инфузии препарата Бринейра
Следует вводить препарат Бринейра перед введением раствора для промывания.
1. Отметить инфузионную систему как «Только для интрацеребровентрикулярнои инфузии».
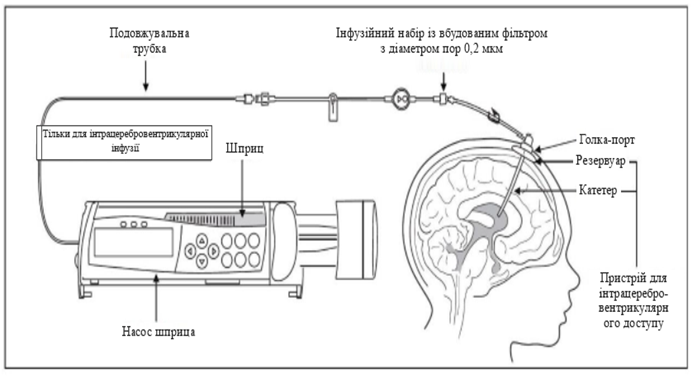
2. Подключить шприц с препаратом Бринейра к продольной трубки, если она используется, или к инфузионной системы. Инфузионная система должна быть оборудована встроенным фильтром с диаметром пор 0,2 мкм (см. Рисунок 2).
3. Заполнить компоненты инфузионной системы препаратом Бринейра.
4. Осмотреть волосистую часть головы по признакам подтекание из устройства для интрацеребровентрикулярного доступа или неисправности и о возможных признаков инфекции. Не вводить препарат Бринейра, если имеются признаки сильного подтекание из устройства для интрацеребровентрикулярного доступа, неисправности устройства или симптомы связанной с устройством инфекции (см. Разделы «Противопоказания» и «Особенности применения»).
5. Подготовить волосистую часть головы для интрацеребровентрикулярнои инфузии, соблюдая правила асептики согласно стандартам оказания помощи в медицинском учреждении.
6. Вставить иглу-порт в устройство интрацеребровентрикулярного доступа.
7. Подключить отдельный пустой стерильный шприц (емкостью не более чем 3 мл) к игле-порта. Вытянуть 0,5-1 мл СМР, чтобы проверить проходимость устройства интрацеребровентрикулярного доступа.
- Не возвращать СМР обратно в устройство для интрацеребровентрикулярного доступа . Образцы СМР следует отправить в бактериологическую лабораторию в плановом порядке с целью мониторинга инфекций (см. Раздел «Особенности применения»).
8. Подключить инфузионную систему к игле-порта (см. Рисунок 2).
- Зафиксировать компоненты согласно стандартам оказания помощи медицинского учреждения.
9. Поместить шприц с препаратом Бринейра в насос шприца и запрограммировать насос для введения препарата со скоростью инфузии 2,5 мл в час.
- Запрограммировать сигналы насоса звучать при малейшем отклонении от границ давления, скорости и объема. Подробную информацию можно найти в инструкциях по эксплуатации, предоставленных производителем насоса.
- Не вводить препарат болюсно или вручную.
10. Начать инфузию препарата Бринейра со скоростью 2,5 мл в час.
11. Периодически проверять инфузионную систему во время инфузии по признакам подтекание или проблемы с доставкой препарата.
12. После завершения инфузии убедиться, что шприц «Бринейра» в насосе шприца пуст. Отсоединить и извлечь пустой шприц с насоса и отсоединить его от трубки. Утилизировать пустой шприц в соответствии с местными требованиями.
Рисунок 2. Настройка инфузионной системы
Интрацеребровентрикулярна инфузия раствора для промывания
Вводить предоставлен раствор для промывания после завершения инфузии препарата Бринейра.
1. Подключить шприц с рассчитанным объемом раствора для промывания к компонентам инфузионной системы.
2. Поместить шприц с раствором для промывки в насос шприца и запрограммировать насос на введение со скоростью инфузии 2,5 мл в час.
- Запрограммировать сигналы насоса звучать при малейшем отклонении от границ давления, скорости и объема. Подробную информацию можно найти в инструкциях по эксплуатации, предоставленных производителем насоса.
- Не вводить раствор болюсно или вручную.
3. Начать инфузию раствора для промывания со скоростью 2,5 мл в час.
4. Периодически проверять инфузионную систему во время инфузии по признакам подтекание или проблемы с доставкой препарата.
5. После завершения инфузии убедиться, что шприц «Раствор для промывания» в насосе шприца пуст. Отсоединить и извлечь пустой шприц с насоса и отсоединить его от инфузионной системы.
6. Вытянуть иглу-порт. Осторожно прижать и наложить повязку на место инфузии согласно стандартам оказания помощи медицинского учреждения.
7. Утилизировать компоненты инфузионной системы, иглы, неиспользованные растворы и другие отходы в соответствии с местными требованиями.
Подготовка препарата Бринейра и раствора для промывания до введения
Для введения препарата Бринейра следует использовать инфузионную систему, химическую и физическую совместимость которой с препаратом Бринейра и раствором для промывания доказано. Для введения препарата Бринейра следует использовать устройства для интрацеребровентрикулярного доступа и расходные компоненты, перечисленные ниже или эквивалентные, имеющие маркировку СЕ.
К устройствам для интрацеребровентрикулярного доступа, совместимость которых с препаратом Бринейра и раствором для промывания доказано и которые использовались в клинических исследованиях препарата Бринейра, принадлежат резервуары CodmanHOLTER RICKHAM и HOLTER SALMON-RICKHAM, вентрикулярное катетер Codman и СМР-вентрикулярное резервуар Medtronic (с катетером).
Бринейра совместима с расходными компонентами инфузионной системы, изготовленными из ПВХ, ПВХ (никак ДЕГФ) полиэтилена, полиэфирсульфона (ПЭС), полипропилена (ПП) и ПТФЭ. В клинических исследованиях препарата Бринейра использовали такие расходные компоненты инфузионных систем с маркировкой СЕ:
- шприц: Braun та BD Luer-Lok;
- удлинительная трубка: линия Fresenius Injectomat®, удлинительная инфузионная линия Alaris CC, удлинительная инфузионная линия Vygon Lectro-Cath;
- удлинительная трубка с фильтром 0,2 микрон: Impromediform GmbH;
- игла-порт: иглы Deltec GRIPPER.
Для правильной подготовки препарата Бринейра и раствора для промывания нужны такие компоненты, не включенные в комплект поставки (см. Рисунок 2). Все компоненты инфузионной системы должны быть стерильными. Препарат Бринейра и раствор для промывания поставляются и хранятся в замороженном состоянии.
- Программируемый насос шприца с соответствующим диапазоном доставки точностью скорости ввода и сигналами в случае неправильного ввода или окклюзии системы. Насос должен быть программируемым для введения лекарственного средства с постоянной скоростью 2,5 мл / час.
- Два одноразовые шприцы, совместимые с насосным оборудованием. Рекомендуемый объем шприца от 10 до 20 мл.
- Две одноразовые иглы для шприца для подкожного введения (21 G, 25,4 мм).
- Один одноразовый инфузионный набор. При необходимости можно добавить удлинительную трубку. Рекомендуемая длина от 150 до 206 см (не более 400 см) и внутренний диаметр 0,1 см.
- Необходим проходной фильтр с диаметром пор 0,2 мкм. Проходной фильтр может быть вмонтирован в инфузионный набор. Проходной фильтр следует поместить как можно ближе к игле-порта.
- Игла-порт, специально обработана для снижения риска закупорки просвета, диаметром 22 или меньше и рекомендованной длиной 16 мм. Ознакомьтесь с рекомендациями производителя устройства интрацеребровентрикулярного доступа по выбору иглы-порта.
- Один пустой стерильный одноразовый шприц (для забора СМР с целью проверки проходимости системы).
Размораживания препарата Бринейра и раствора для промывания
Оставить флаконы препарата Бринейра и раствора для промывания размораживаться при комнатной температуре примерно на 60 минут. НЕ растапливать и не нагревать флаконы никаким другим способом. НЕ встряхивать флаконы. В процессе размораживания происходит конденсация. Рекомендуется для размораживания извлечь флаконы из картонной коробки.
Бринейра и раствор для промывания должны полностью растаять, после чего их следует сразу использовать.
НЕ замораживать флаконы повторно и не замораживать шприцы с препаратом Бринейра или раствором для промывания.
Проверка флаконов с размороженными препаратом Бринейра и раствором для промывания
Проверить флаконы, чтобы убедиться, что препараты полностью растаяли. Препарат Бринейра должен быть прозрачным или слегка опалесцирующая и бесцветным или бледно-желтым. Иногда флаконы с препаратом Бринейра могут содержать прозрачные волокна или непрозрачные частицы. Эти образованные естественным путем частицы являются церлипоназою альфа. Частицы задерживаются встроенным фильтром с диаметром пор 0,2 мкм без существенного влияния на чистоту или активность препарата Бринейра.
Раствор для промывания может содержать частицы, растворяются после полного размораживания флакона. Раствор для промывания должен быть прозрачным и бесцветным.
НЕ использовать препараты, если цвет растворов изменился или если в растворах присутствуют посторонние твердые частицы.
Набор препарата Бринейра
Отметить один неиспользованный стерильный шприц «Бринейра» и подсоединить иглу. Снять зеленый съемный колпачок с обеих флаконов препарата Бринейра. Соблюдая правила асептики, набрать раствор препарата Бринейра в объеме, который соответствует нужной дозе (см. Таблицу 4) в стерильный шприц «Бринейра». Не разводить препарат Бринейра. Не смешивать препарат Бринейра с любыми другими лекарственными средствами. Утилизировать иглу и пустые флаконы в соответствии с местными требованиями.
Набор раствора для промывания
Определить объем раствора для промывания, необходимый для обеспечения полного попадания препарата Бринейра в желудочки головного мозга. Рассчитать объем раствора для промывания, учитывая объем заполнения всех компонентов инфузионной системы, в том числе устройства для интрацеребровентрикулярного доступа.
Отметить один неиспользованный стерильный шприц «Раствор для промывания» и подсоединить иглу. Снять желтый съемный колпачок с флакона с раствором для промывания. Соблюдая правила асептики, набрать нужное количество раствора для промывания из флакона в новый стерильный шприц «Раствор для промывания». Утилизировать иглу и флакон с остальными раствора в соответствии с местными требованиями.
Любой неиспользованный препарат или его отходы следует утилизировать в соответствии с местными требованиями.
Дети
Безопасность и эффективность применения препарата Бринейра детям в возрасте до 3 лет сегодня не установлены. Имеющиеся ограниченные данные в отношении детей в возрасте от 2 лет, а клинические данные в отношении детей в возрасте до 2 лет отсутствуют (см. Раздел «Фармакологические свойства»). Дозировка, предлагаемого для детей до 2 лет, рассчитана с учетом массы головного мозга.
Передозировка
Информация отсутствует.
Побочные эффекты
Краткий обзор профиля безопасности
Нежелательные реакции, описанные в этом разделе, оценивались у 24 пациентов с CLN2, которые получили хотя бы одну дозу препарата Бринейра в клинических исследованиях продолжительностью до 141 недели или в течение пострегистрационных применения. Наиболее частыми (> 20%) нежелательными реакциями, которые наблюдались на фоне лечения Бринейра в клинических исследованиях, были гипертермия, низкое содержание белка в СМР, отклонения от нормы на ЭКГ, рвота, инфекции верхних дыхательных путей и гиперчувствительность. Ни один пациент не нуждался прекращения лечения из-за нежелательных явлений.
Табличный перечень побочных реакций
Побочные реакции представлены по категориям система-орган-класс и частотой согласно критериям частоты Медицинского словаря нормативно-правовой деятельности (MedDRA): очень часто (≥ 1/10); часто (≥ 1/100 и <1/10); нечасто (≥ 1/1000 и <1/100); редко (≥ 1/10 000 и <1/1000); очень редко (<1/10 000), частота неизвестна (невозможно установить на основе имеющихся данных). Побочные реакции представлены в порядке убывания серьезности.
Таблица 5. Частота побочных реакций, наблюдаемых на фоне лечения Бринейра
Система-орган-класс | побочные реакции | Частота |
Инфекции и инвазии | Инфекция верхних дыхательных путей конъюнктивит Инфекция, связанная с пристроема менингит | очень часто Часто Часто неизвестно |
Со стороны иммунной системы | гиперчувствительность анафилактическая реакция | очень часто Часто |
Со стороны психики | раздражительность | очень часто |
Со стороны сердца | брадикардия | Часто |
Со стороны нервной системы | явления судомb Головная боль Плеоцитоз у СМР Синдром свеса председателя | очень часто очень часто очень часто Часто |
Со стороны пищеварительной системы | рвота Боль в животе Образование пузырей на слизистой оболочке ротовой полости Образование пузырей на языке Желудочно-кишечное расстройство | очень часто Часто Часто Часто Часто |
Со стороны кожи и подкожной клетчатки | сыпь крапивница | Часто Часто |
Общие нарушения и реакции в месте введения препарата | Гипертермияс ощущение беспокойства боль | очень часто Часто Часто |
Расстройства, выявленные по результатам обследования | Повышение уровня белка в СМР Отклонение от нормы на ЭКГ Снижение уровня белка в СМР | очень часто очень часто очень часто |
Проблемы с медицинской продукцией | Проблема с устройством: подтекание устройства окклюзия пристроюd смещение пристроюe проблемы с голкоюf | Часто Часто неизвестно очень часто |
a Акне, вызванное пропионобактерии или эпидермальный стафилококк.
b Атонические судороги, клонические судороги, внезапная потеря сознания, эпилепсия, генерализованные тонико-клонические судороги, миоклоническая эпилепсия, парциальные припадки, малый эпилептический припадок, судорожный приступ, кластерные судороги и эпилептический статус.
c Гипертермия, объединяющая сроки преимущественного использования "Гипертермия" и "Повышение температуры тела".
d Закупорка катетера.
e Смещение устройства в клинических исследованиях не наблюдалось.
f Смещение инфузионной иглы.
Описание отдельных нежелательных реакций
судороги
Судороги является частым проявлением заболевания CLN2 и ожидаемо наблюдаются у таких пациентов. Всего в 23 (96%) пациентов, принимавших церлипоназу альфа, развилось явление, отвечающее критериям судом стандартизированного запроса MedDRA. Наиболее частыми явлениями судом были судорожный припадок, эпилепсия и генерализованные тонико-клонические судороги. Всего явления судом с временным связью с введением церлипоназы альфа составляли 17% и были легкими или средней тяжести (1-2 степени тяжести). Всего 6% всех случаев судом рассматривались как связанные с церлипоназою альфа; их тяжесть колебалась от легких до тяжелых (1-4 степени согласно Общим терминологическим критериям для нежелательных явлений (СТСАЕ)). Судороги удавалось устранить с помощью стандартных противосудорожных лекарственных средств, и они не привели к необходимости прекращения лечения Бринейра.
гиперчувствительность
Реакции гиперчувствительности наблюдались в 14 из 24 пациентов (58%), получавших лечение препаратом Бринейра. Тяжелые (3 степени согласно Общим терминологическим критериям для нежелательных явлений (СТСАЕ)) реакции гиперчувствительности развились у трех пациентов; ни один из пациентов не прекратил лечение препаратом. Наиболее частыми проявлениями были гипертермия с рвотой, плеоцитоз или раздражительность, не характерны для классической иммунной реакции гиперчувствительности. Эти побочные реакции наблюдались во время или в течение 24 часов после окончания инфузии препарата Бринейра и не влияли на лечение. Симптомы проходили со временем или после введения жаропонижающих, антигистаминных средств и / или ГКС.
иммуногенность
Антитела к лекарственному средству были обнаружены в сыворотке крови и СМР соответственно в 79% и 21% пациентов, получавших лечение церлипоназою альфа течение периода до 107 недель. В СМР не было обнаружено нейтрализующих антител, специфичных к лекарственному средству, способных ингибировать рецепторопосередковане захвата клетками церлипоназы альфа. Никакой зависимости между титрами антител к лекарственному средству в сыворотке или СМР и частотой или тяжестью гиперчувствительности установлено не было. Пациентов, у которых развились нежелательные явления гиперчувствительности средней тяжести, обследовали на наличие специфического IgE к лекарственному средству и получили отрицательные результаты анализа. Взаимосвязи между повышенными титрами антител к лекарственному средству и снижением показателей эффективности выявлено не было.
педиатрические пациенты
Исследования, продолжается, обеспечило опыт лечения двух пациентов двухлетнего возраста, получавших препарат Бринейра в дозе 300 мг через неделю (см. Раздел «Фармакологические свойства»). Оба пациента получили по 8 инфузий, и общий профиль безопасности препарата Бринейра у этих пациентов младшего возраста в целом соответствует профилю безопасности у детей старшего возраста. На сегодня клинический опыт применения препарата Бринейра детям до 2 лет отсутствует.
Сообщение о подозреваемых побочные реакции
Сообщение о подозреваемых побочные реакции после регистрации лекарственного средства имеет большое значение. Это позволяет осуществлять длительный мониторинг отношение польза / риск применения лекарственного средства. Медицинских работников просят сообщать обо всех подозреваемых побочные реакции через национальную систему сообщений.
Срок годности Бринейра
2 года.
Условия хранения Бринейра
Хранить в вертикальном положении в морозильнике (от -25 ° C до -15 ° C).
Транспортировать и выдавать в замороженном состоянии (от -85 ° C до -15 ° C).
Хранить в оригинальной упаковке, чтобы защитить от света.
Хранить в недоступном для детей месте.
Несовместимость .
Поскольку исследования совместимости не проводились, это лекарственное средство нельзя смешивать с другими лекарственными средствами.
Упаковка
5 мл раствора для инфузий в прозрачном стеклянном флаконе (стекло I типа), закупоренной пробкой (бутилкаучук) и обжатом алюминиевой крышкой типа flip-off seal с пластиковым колпачком зеленого цвета.
5 мл раствора для промывания в прозрачном стеклянном флаконе (стекло I типа), закупоренной пробкой (бутилкаучук) и обжатом алюминиевой крышкой типа flip-off seal с пластиковым колпачком желтого цвета.
По 2 флакона с раствором для инъекций в комплекте с 1 флаконом с раствором для промывки в картонной коробке.
Категория отпуска
По рецепту.
Производитель
БиоМарин Интернешнл Лимитед.
Местонахождение производителя
Шанбалли, Рингаскидди, Ко. Корк, Ирландия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Бринейра только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Веттер Фарма-Фертигунг ГмбХ и Ко. КГ
| Тип данных | Сведения из реестра |
| Торговое наименование: | Бринейра |
| Производитель: | Веттер Фарма-Фертигунг ГмбХ и Ко. КГ |
| Форма выпуска: | раствор для инфузий 30 мг / мл (150 мг / 5 мл) по 5 мл раствора для инфузий в прозрачном стеклянном флаконе (I типа), закупоренной пробкой (бутилкаучук) и обжатом алюминиевой крышкой типа flip-off seal с пластиковым колпачком зеленого цвета. По 5 мл раствора для промывания в прозрачном стеклянном флаконе (I типа), закупоренной пробкой (бутилкаучук) и обжатом алюминиевой крышкой типа flip-off seal с пластиковым колпачком желтого цвета. По 2 флакона с раствором для инъекций в комплекте с 1 флаконом с раствором для промывки в картонной коробке |
| Регистрационное удостоверение: | UA/16841/01/01 |
| Дата начала: | 13.07.2018 |
| Дата окончания: | 13.07.2023 |
| МНН: | Cerliponase alfa |
| Условия отпуска: | по рецепту |
| Состав: | 1 мл раствора для инфузий содержит 30 мг церлипоназы альфа; / 1 флакон содержит 150 мг церлипоназы альфа |
| Фармакологическая группа: | Средства, влияющие на функцию пищеварительной системы и обмен веществ. Ферменты. |
| Код АТХ: | A16AB17 |
| Заявитель: | БиоМарин Интернешнл Лимитед |
| Страна заявителя: | Ирландия |
| Адрес заявителя: | Шанбалли, Рингаскидди, Ко. Корк, Ирландiя |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| A | Средства, влияющие на пищеварительную систему и метаболизм |
| A16 | Средства, влияющие на пищеварительную систему и метаболические процессы |
| A16A | Средства, действующие на пищеварительную систему и метаболические процессы |
| A16AB | Ферментные препараты |
| A16AB17 | Церлипоназа альфа |
