- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Бемфола инструкция по применению
Официальная инструкция лекарственного препарата Бемфола раствор . Описание и применение Bemfola, аналоги и отзывы. Инструкция Бемфола раствор утвержденная компанией производителем.
Состав
действующее вещество: фолитропин альфа *;
1 мл 600 МЕ (44 мкг) фолитропин альфа;
одна предварительно наполненая ручка содержит:
75 МЕ (5,5 мкг) фолитропин альфа в 0,125 мл, или
150 МЕ (11 мкг) фолитропин альфа в 0,25 мл или
225 МЕ (16,5 мкг) фолитропин альфа в 0,375 мл, или
300 МЕ (22 мкг) фолитропин альфа в 0,5 мл, или
450 МЕ (33 мкг) фолитропин альфа в 0,75 мл
* Рекомбинантный человеческий фолликулостимулирующий гормон (р-лФСГ)
Вспомогательные вещества: сахароза; натрия фосфат, дигидрат; натрия дигидрофосфат, дигидрат; L-метионин; полоксамер 188 / лютрол F-68; фосфорная кислота; вода для инъекций.
Лекарственная форма
Раствор для инъекций в предварительно заполненной ручке.
Основные физико-химические свойства: прозрачная бесцветная жидкость.
Фармакологическая группа
Половые гормоны и модуляторы половой системы. Гонадотропины.
Код ATХ G03G A05.
Фармакологические свойства
Фармакологические.
Бемфола - это подобный биологический препарат, содержащий рекомбинантный человеческий фолликулостимулирующий гормон (р-лФСГ) в качестве действующего вещества, полученный методом генной инженерии из клеток яичника китайского хомячка.
фармакодинамические эффекты
Важнейшим эффектом парентерального введения фолликулостимулирующего гормона (ФСГ) у женщин является развитие зрелых граафовых фолликулов. Целью терапии фолитропин альфа у женщин с ановуляцией является формирование одного зрелого граафова фолликула, из которого после введения человеческого хорионического гонадотропина (чХГ) высвободится яйцеклетка.
Клиническая эффективность и безопасность применения для женщин
В клинических исследованиях пациентки с тяжелой недостаточностью ФСГ и ЛГ гормона (ЛГ) определялись по сыворотке уровнем эндогенного ЛГ <1,2 МЕ / л, полученным в анализе центральной лаборатории. Однако следует учесть, что уровень ЛГ, определенный в разных лабораториях, может отличаться.
В клинических исследованиях с целью сравнения рекомбинантного человеческого ФСГ (р-лФСГ) (фолитропин альфа) и мочевого ФСГ при проведении процедур вспомогательных репродуктивных технологий (ВРТ) (см. Таблицу 1) и индукции овуляции фолитропин альфа оказался более эффективным, чем мочевой ФСГ, что выражалось в низкой общей дозе и более коротком периоде лечения, необходимых для индукции созревания фолликула. Применение низких доз фолитропин альфа в течение короткого периода лечения при проведении ВРТ позволило получить большее количество яйцеклеток, чем в случае применения мочевого ФСГ.
Таблица 1
Результаты исследования GF 8407 (рандомизированного исследования в параллельных группах с целью сравнения эффективности и безопасности фолитропин альфа и мочевого ФСГ при применении вспомогательных репродуктивных технологий)
фолитропин альфа (n = 130) | мочевой ФСГ (n = 116) | ||
| 11,0 ± 5,9 | 8,8 ± 4,8 | |
Необходимое количество дней стимуляции при применении ФСГ | 11,7 ± 1,9 | 14,5 ± 3,3 | |
Необходима общая доза ФСГ (количество ампул ФСГ по 75 МО) | 27,6 ± 10,2 | 40,7 ± 13,6 | |
Необходимость увеличения дозы (%) | 56,2 | 85,3 |
Разница между 2 группами была статистически значимой (p <0,05) по всем перечисленным критериям.
Клиническая эффективность и безопасность применения для мужчин
У мужчин с недостаточностью ФСГ одновременное применение фолитропин альфа и хорионического гонадотропина в течение не менее 4 месяцев способствует индуцированию сперматогенеза.
Фармакокинетика.
После введения фолитропин альфа распределяется в межклеточной жидкости с начальным периодом полувыведения составляет примерно 2:00, и выводится из организма с конечным периодом полувыведения составляет примерно 1 сутки. Равновесный объем распределения и общий клиренс составляет 10 л и 0,6 л / ч соответственно. Одна восьмая дозы фолитропин альфа выводится с мочой.
После подкожного введения биодоступность фолитропин альфа составляет около 70%. Повторное введение приводит к увеличению его кумуляции в три раза с достижением равновесного состояния в течение 3-4 дней. У женщин с подавленной секрецией эндогенных гонадотропинов тем не менее было обнаружено, что фолитропин альфа эффективно стимулирует фолликулярный развитие и стероидогенез, несмотря на неизмеримо низкие уровни ЛГ.
Клинические характеристики
Бемфола Показания
взрослые женщины
• Ановуляция (включая синдром поликистозных яичников (СПКЯ)) у женщин, оказались нечувствительными к лечению кломифена цитратом.
• Стимуляция развития множественных фолликулов у пациенток при проведении суперовуляции в рамках вспомогательных репродуктивных технологий (ВРТ), таких как экстракорпоральное оплодотворение (ЭКО), перенос гаметы в фаллопиевой трубы (GIFT) и переноса зиготы до фаллопиевой трубы (ZIFT).
• фолитропин альфа в комбинации с препаратами лютеинизирующего гормона (ЛГ) рекомендуется для стимуляции развития фолликулов у женщин с тяжелой недостаточностью ЛГ и ФСГ. В клинических исследованиях такие пациентки определялись по уровню эндогенного сывороточного ЛГ <1,2 МЕ / л.
взрослые мужчины
• фолитропин альфа предназначен для стимуляции сперматогенеза у мужчин с врожденным или приобретенным гипогонадотропным гипогонадизмом, одновременно с терапией ХГ (хорионического гонадотропина).
Противопоказания
• чувствительность к действующему веществу или любому из вспомогательных веществ (см. Раздел «Состав»);
• опухоли гипоталамуса или гипофиза
• увеличение размера яичников или кисты яичников, не связанные с синдромом поликистозных яичников;
• гинекологические кровотечения неизвестного происхождения;
• рак яичников, матки или молочных желез.
Фолитропин альфа нельзя применять в случаях, когда невозможно получить эффективный ответ на лечение, например при:
• первичной недостаточности яичников;
• пороках половых органов, несовместимых с беременностью;
• фиброзных опухолях матки, несовместимых с беременностью;
• первичной тестикулярной недостаточности.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Одновременное применение фолитропин альфа с другими лекарственными средствами, применяемыми для стимуляции овуляции (например, чХГ, кломифена цитрат), может усиливать фолликулярной реакцию, тогда как одновременное применение с агонистами или антагонистами гонадотропин-рилизинг-гормона (ГнРГ), которые индуцируют десенсибилизацию гипофиза, может привести к необходимости увеличения дозы фолитропин альфа, необходимого для достижения адекватной реакции яичников. О каких других клинически значимые лекарственные взаимодействия во время терапии фолитропин альфа не сообщалось.
Особенности применения
отслеживание
С целью улучшения отслеживания биологических лекарственных средств и сообщения о подозреваемых побочные реакции медицинским работникам следует четко записать торговое наименование и номер партии введенного препарата в медицинскую карту пациента.
Поскольку фолитропин альфа проявляет значительную гонадотропную активность, которая способна вызвать развитие побочных реакций легкой и тяжелой степени препарат могут назначать только врачи, хорошо знакомые с проблемами бесплодия и методами его лечения.
Терапия гонадотропинами требует затрат определенного времени от врачей и других медицинских работников, а также наличия соответствующей аппаратуры для мониторинга лечения. Безопасное и эффективное применение фолитропин альфа для женщин предусматривает регулярный мониторинг овариальной реакции с помощью ультразвукового исследования, отдельно или, предпочтительно, в сочетании с одновременным регулярным определением сывороточного уровня эстрадиола. Возможна определенная индивидуальная вариабельность ответа на применение ФСГ, то есть в одних пациентов может отмечаться слабая реакция на ФСГ, а в других - чрезмерная. Для лечения как женщин, так и мужчин следует применять самую низкую эффективную дозу препарата в целях лечения.
порфирия
Во время лечения фолитропин альфа пациенты с порфирией или со случаями порфирии в семейном анамнезе должны находиться под тщательным медицинским наблюдением. При первых признаках развития этого состояния или при его ухудшении может потребоваться прекращении лечения.
лечение женщин
Перед началом лечения необходимо тщательно исследовать причину бесплодия пары и определить возможные противопоказания к беременности. В частности, пациентов следует обследовать на наличие гипотиреоза, недостаточности надпочечников, гиперпролактинемии и назначить им соответствующее лечение.
При проведении стимуляции роста фолликулов при лечении ановуляторного бесплодия или процедур ВРТ у пациенток может наблюдаться увеличение размера яичников или развитие гиперстимуляции. Соблюдение рекомендованной дозировки и режима введения фолитропин альфа, а также тщательный мониторинг терапии снизят частоту подобных явлений. Точная интерпретация показателей развития фолликулов и созревания требует привлечения специалиста, имеющего опыт толкования соответствующих тестов.
Во время клинических исследований было выявлено усиление чувствительности яичников к действию фолитропин альфа при одновременном введении лютропину альфа. Если считается необходимым увеличение дозы ФСГ, корректировки дозы желательно осуществлять с интервалами в 7-14 дней и с пошаговым повышением на 37,5-75 МЕ.
Непосредственного сравнения применения фолитропин альфа / ЛГ и человеческого менопаузального гонадотропина (чМГ) не проводилось. Сравнение с существующими данными дает основания предположить, что частота овуляций, полученная при применении фолитропин альфа / ЛГ, подобная частоты, полученной для чМГ.
Синдром гиперстимуляции яичников (СГЯ)
Ожидаемым следствием контролируемой стимуляции яичников есть определенное их увеличения. Это явление, наиболее распространено у женщин с синдромом поликистозных яичников, обычно проходит без лечения.
В отличие от неосложненного увеличения размера яичников, СГСЯ является синдромом, проявляется с нарастанием степени тяжести. Он включает значительное увеличение размера яичников, высокие сывороточные уровни половых стероидов и рост проницаемости сосудов, что может привести к накоплению жидкости в брюшной, плевральной и иногда в перикардиальной полостях.
В тяжелых случаях СГЯ могут наблюдаться следующие симптомы: боль и чувство растяжения в брюшной полости, значительное увеличение размера яичников, увеличение массы тела, одышка, олигурия и симптомы со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При клиническом обследовании могут быть выявлены гиповолемия, гемоконцентрация, электролитный дисбаланс, асцит, гемоперитонеум, гидроторакс, гидроторакс или острый респираторный дистресс-синдром. В редких случаях тяжелый СГЯ может быть осложнен искажением яичников и тромбоэмболических явлений, такими как эмболия легочной артерии, ишемический инсульт и инфаркт миокарда.
К независимых факторов риска развития СГЯ относятся синдром поликистозных яичников, высокие абсолютные или быстро растущие сывороточные уровни эстрадиола (например> 900 пг / мл> 3300 пмоль / л ановуляции;> 3000 пг / мл> 11000 пмоль / л ВРТ) и большое количество фолликулов, которые формируются (например> 3 фолликулов диаметром ≥ 14 мм при ановуляции; ≥ 20 фолликулов диаметром ≥ 12 мм при ВРТ).
Соблюдение рекомендованной дозировки и режима введения фолитропин альфа может минимизировать риск овариальной гиперстимуляции (см. Разделы «Способ применения и дозы» и «Побочные реакции»). Для раннего выявления соответствующих факторов риска рекомендуется проводить мониторинг циклов стимуляции с помощью ультразвукового исследования и определения уровня эстрадиола.
Известно, что чХГ играет ключевую роль в инициации СГСЯ и этот синдром может становиться тяжелее и длительнее при наступлении беременности. Поэтому при наличии признаков гиперстимуляции яичников, таких как сывороточные уровни эстрадиола> 5500 пг / мл> 20200 пмоль / л и / или общее количество фолликулов ≥ 40, рекомендуется отменить введение чХГ и посоветовать пациентке воздержаться от половых сношений или применять барьерные средства контрацепции в течение не менее 4 дней. СГСЯ может быстро прогрессировать (в пределах 24 часов), и в течение нескольких дней стать серьезным медицинским осложнениям. Чаще всего он возникает после прекращения гормональной терапии и достигает максимума примерно через 7-10 дней после завершения лечения. Поэтому после введения чХГ пациентки должны находиться под контролем в течение не менее 2 недель.
Частоту развития гиперстимуляции при проведении ВРТ может уменьшить аспирация всех фолликулов до овуляции.
Обычно легкие или умеренные формы СГЯ проходят спонтанно. Если наблюдается тяжелая форма СГЯ, лечение гонадотропинами рекомендуется прекратить, если оно еще продолжается, пациентку следует госпитализировать и начать соответствующую терапию.
многоплодная беременность
Частота многоплодных беременностей в случае индукции овуляции выше, чем после естественного оплодотворения. Большинство множественных оплодотворений представлена двойнями. Многоплодная беременность, особенно высшего порядка, несет повышенный риск нежелательных последствий для матери, плода и новорожденного.
Для снижения риска многоплодной беременности рекомендуется тщательно контролировать реакцию яичников.
При проведении процедур ВРТ риск многоплодной беременности связан, главным образом, с количеством пересаженных эмбрионов, их качеством и возрастом пациентки.
Пациентки должны быть проинформированы о потенциальном риске многоплодной беременности до начала лечения.
прерывание беременности
У пациенток при проведении стимуляции роста фолликулов для индукции овуляции или ВРТ частота случаев прерывания беременности в результате выкидыша или спонтанного аборта выше, чем после естественного оплодотворения.
внематочная беременность
Женщины с заболеваниями труб в анамнезе имеют риск внематочной беременности независимо от того, наступила она в результате спонтанного оплодотворения или лечения бесплодия. Сообщалось, что распространенность внематочной беременности после проведения ВРТ выше, чем в общей популяции.
Новообразования органов репродуктивной системы
Имеются сообщения как о доброкачественные, так и о злокачественные новообразования яичников и других органов репродуктивной системы у женщин, проходили различные режимы лечения бесплодия. Еще не установлено, увеличивает лечения гонадотропинами риск развития таких опухолей у бесплодных женщин.
врожденные пороки
Распространенность врожденных пороков после проведения ВРТ может быть несколько выше, чем после спонтанного оплодотворения. Считается, что это является следствием характеристик состояния здоровья родителей (возраст матери, свойства спермы отца) и многоплодных беременностей.
тромбоэмболические осложнения
У женщин с недавними или существующими тромбоэмболическими заболеваниями и у женщин, для которых в целом установлены факторы риска развития тромбоэмболических явлений, такие как индивидуальные или семейные случаи, лечение гонадотропинами может привести к дальнейшему росту риска обострения или появления подобных явлений. У таких женщин необходимо оценить преимущество применения гонадотропинов над существующим риском развития таких осложнений. Однако следует отметить, что собственно беременность и СГСЯ увеличивают риск развития тромбоэмболических осложнений.
лечение мужчин
Повышение эндогенных уровней ФСГ у пациентов является показателем первичной тестикулярной недостаточности. Такие пациенты нечувствительны к терапии фолитропин альфа / чХГ. Фолитропин альфа не следует применять в случаях, когда невозможно получить эффективный ответ на лечение.
Для оценки реакции на лечение рекомендуется проводить анализ семенной жидкости через
4-6 месяцев от начала лечения.
содержание натрия
Лекарственное средство содержит менее 1 ммоль натрия (23 мг) в одной дозе, то есть практически не содержит натрия.
Применение в период беременности или кормления грудью
беременность
Показаний к применению фолитропин альфа в период беременности нет. Данные, полученные для небольшого количества случаев применения препарата в период беременности (менее 300 случаев), свидетельствуют об отсутствии врожденных пороков или фето / неонатальной токсичности фолитропин альфа.
В исследованиях на животных тератогенного эффекта не наблюдалось. Клинических данных для исключения тератогенного эффекта фолитропин альфа при применении его во время беременности недостаточно.
кормление грудью
Фолитропин альфа не показан для применения в период кормления грудью.
фертильность
Фолитропин альфа показан для лечения бесплодия (см. Раздел «Показания»).
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Ожидается, что фолитропин альфа не влияет или почти не влияет на способность управлять автомобилем и работать с механизмами.
Способ применения Бемфола и дозы
Лечение следует начинать под наблюдением врача, имеющего опыт лечения бесплодия.
Пациентов необходимо обеспечить предварительно заполненными лекарственным средством ручками для ввода в количестве, необходимом для курса лечения, и научить правильно вводить лекарственное средство.
дозировка
Рекомендации по дозированию фолитропин альфа такие же, как и для мочевого ФСГ. Клиническая оценка фолитропин альфа свидетельствует, что его суточные дозы, режим применения и процесс мониторинга лечения не должны отличаться от таковых для препаратов мочевого ФСГ. Рекомендуется соблюдать предложенных начальных доз, приведенных ниже.
В сравнительных клинических исследованиях было показано, что при применении фолитропин альфа по сравнению с мочевым ФСГ пациентам необходима меньшая общая доза в течение короткого периода лечения. Таким образом, считается целесообразным применять более низкую общую дозу фолитропин альфа, чем та, что обычно применяется для мочевого ФСГ. Это позволяет не только оптимизировать лечение, но и снизить риск нежелательной гиперстимуляции яичников (см. Раздел «Фармакологические»).
Женщины с ановуляцией, включая синдром поликистозных яичников
Фолитропин альфа назначают в виде курса ежедневных инъекций. У пациенток с менструациями лечение следует начинать в течение первых 7 дней менструального цикла.
Обычно применяемый режим лечения начинается с введения 75-150 МЕ ФСГ ежедневно при необходимости дозу можно увеличивать на 37,5 или 75 МЕ с интервалом 7 или (лучше) 14 дней для получения адекватной, но не чрезмерной реакции. Лечение должно быть адаптировано к индивидуальной реакции пациентки, оценивается по результатам ультразвукового исследования размера фолликулов и / или определения уровня секреции эстрогенов. Максимальная суточная доза обычно не превышает 225 МЕ ФСГ. Если пациентка в течение 4 недель не реагирует на лечение должным образом, этот лечебный цикл следует прекратить, провести дополнительное обследование пациентки и повторно начать лечение с большей, чем в предыдущем цикле, начальной дозы препарата.
После достижения оптимальной реакции в течение 24-48 часов после последней инъекции фолитропин альфа однократно вводят 250 мкг рекомбинантного человеческого хорионического гонадотропина альфа (р-чХГ) или 5000-10000 МЕ чХГ. Пациентке рекомендуется иметь половой контакт в день введения чХГ и на следующий день. В альтернативном варианте может быть проведена внутриматочная инсеминация (ВМИ).
Если наблюдается чрезмерная реакция, лечение следует прекратить и отменить введение чХГ (см. Раздел «Особенности применения»). В следующем цикле лечение необходимо начинать с дозы, ниже той, что применяли в предыдущем цикле.
Стимуляция развития множественных фолликулов у женщин при проведении стимуляции яичников перед экстракорпоральным оплодотворением ( ЭКО) или в рамках других вспомогательных репродуктивных технологий
Режим лечения, обычно применяется для суперовуляции, заключается во введении 150-225 МЕ фолитропин альфа ежедневно, начиная со 2-го или 3-го дня цикла. Лечение продолжают до достижения надлежащего формирования фолликулов (оцениваемой по сыворотке уровнем эстрогенов и / или по данным ультразвукового исследования). В течение лечения дозу подбирают в соответствии с реакцией пациентки, но обычно она не должна превышать 450 МЕ ежедневно. В общем надлежащее формирование фолликулов достигается в среднем на 10-й день лечения (в пределах от 5 до 20 дней).
Для индукции окончательного созревания фолликулов через 24-48 часов после последней инъекции фолитропин альфа вводят разовую инъекцию 250 мкг р-чХГ или 5000-10000 МЕ чХГ.
Для подавления резкого подъема уровня эндогенного ЛГ и контроля за тоническим уровнем ЛГ обычно применяют угнетающее регуляцию агонистами или антагонистами гонадотропин-рилизинг-гормона (ГнРГ). По обычному протоколу лечения введение фолитропин альфа начинают примерно через 2 недели после начала применения агониста и продолжают их совместное введение до достижения надлежащего формирования фолликулов. Например, после двух недель лечения агонистом начинают вводить по 150-225 МЕ фолитропин альфа в течение первых 7 дней, меняя в дальнейшем дозу в соответствии с реакцией яичников.
Общий опыт ЭКО свидетельствует, что в целом частота успешного лечения остается стабильной в течение первых четырех попыток и затем постепенно снижается.
Женщины с ановуляцией, вызванной тяжелой недостаточностью ЛГ и ФСГ
У женщин с недостаточностью секреции ЛГ и ФСГ (гипогонадотропный гипогонадизм) целью комбинированной терапии с применением фолитропин альфа в сочетании с лютропином альфа является формирование одного зрелого граафова фолликула, из которого после введения человеческого хорионического гонадотропина (чХГ) высвобождается яйцеклетка. Фолитропин альфа назначают в виде курса ежедневных инъекций одновременно с введением лютропину альфа. Поскольку такие пациентки страдают аменорею и имеют низкую эндогенную секрецию эстрогенов, лечение может быть начато в любое время.
Рекомендуемый режим лечения начинается с ежедневного введения 75 МЕ лютропину альфа одновременно с 75-150 МЕ ФСГ. Лечение нужно адаптировать к индивидуальной реакции пациентки, оценивается по данным ультразвукового исследования размера фолликула и уровнем секреции эстрогенов.
Если считается необходимым увеличение дозы ФСГ, ее лучше менять с интервалами в 7-14 дней с пошаговым увеличением на 37,5-75 МЕ. Допустимое увеличение продолжительности стимуляции в пределах одного лечебного цикла до 5 недель.
После достижения оптимальной реакции в течение 24-48 часов после последней инъекции фолитропин альфа и лютропину альфа однократно вводят 250 мкг р-чХГ или 5000-10000 МЕ чХГ. Пациентке рекомендуется иметь половой контакт в день введения чХГ и на следующий день. Альтернативно можно провести ВМИ.
Следует учитывать необходимость поддержки лютеиновой фазы, поскольку недостаточность веществ с лютеотропной активностью (ЛГ / чХГ) после овуляции может привести к преждевременной недостаточность желтого тела.
Если наблюдается чрезмерная реакция, лечение следует прекратить и отменить введение чХГ. В следующем цикле лечение необходимо начинать с дозы ФСГ, ниже той, что применяли в предыдущем цикле.
Мужчины с гипогонадотропным гипогонадизмом
Фолитропин альфа назначают в дозе 150 МЕ трижды в неделю одновременно с введением чХГ в течение не менее 4 месяцев. Если по истечении этого курса у пациента не будет наблюдаться реакции, комбинированное лечение можно продолжить. Современный клинический опыт свидетельствует о том, что в случае необходимости достижения сперматогенеза лечения можно продолжать в течение не менее 18 месяцев.
Отдельные группы пациентов
Пациенты пожилого возраста
Соответствующих показаний для применения фолитропин альфа у пациентов пожилого возраста нет. Безопасность и эффективность применения фолитропин альфа для таких пациентов не была установлена.
Пациенты с нарушением функции почек или печени
Безопасность, эффективность и фармакокинетические параметры фолитропин альфа у пациентов с нарушением функции почек или печени не были установлены.
способ применения
Лекарственное средство Бемфола предназначен для подкожного введения. Первую инъекцию лекарственного средства следует проводить под непосредственным наблюдением медицинского работника.
Самостоятельное введение лекарственного средства могут проводить только хорошо мотивированы, должным образом обученные пациенты, которые в случае необходимости могут проконсультироваться со специалистом.
Предварительно наполнена ручка содержит картридж с разовой дозой лекарственного средства Бемфола, предназначен для однократного применения. Итак, пациенты должны получить четкие инструкции, чтобы не допустить неправильного применения одноразового устройства.
РЕКОМЕНДАЦИИ для самостоятельного введения лекарственных средств БЕМФОЛА С ПОМОЩЬЮ готовой к применению РУЧКИ для введения
Внимательно прочитайте инструкцию перед самостоятельным применением ручки для введения с препаратом Бемфола.
Ваш врач назначит Вам необходимую дозу определяться в международных единицах (МЕ).
Упаковка содержит предварительно наполненную ручку, предназначенную для использования только одним пациентом.
Подготовьте предварительно наполненную ручку с препаратом Бемфола и введите назначенную дозу. Следующую инъекцию следует делать в то же время на следующий день.
- Как пользоваться предварительно наполненной ручкой с препаратом Бемфола
- Изучите инструкцию перед применением предварительно наполненной ручки.
- Ручка для введения предназначена только для Вас, не позволяйте другим людям пользоваться ею.
- Цифры на дисплее означают дозу препарата в международных единицах (МЕ). Врач скажет Вам, сколько МО Вам необходимо вводить каждый день.
- Ваш врач / фармацевт расскажет Вам, сколько ручек для введения с препаратом Бемфола Вам необходимо будет использовать в течение полного курса лечения.
- Делайте себе инъекцию ежедневно в то же время.
- Перед применением предварительно наполненной ручки:
- вымойте руки
- Важно, чтобы Ваши руки и все, что Вы будете использовать при подготовке ручки для введения, были как можно чище.
- Выберите чистое место
- Подходящим местом может быть чистый стол или другая поверхность.
- Подготовка предварительно наполненной ручки к инъекции
Различные части ручки
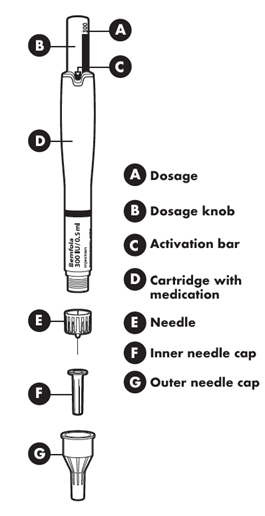
А— дозатор;
B — регулятор дози;
C - лента активации;
D - картридж с лекарственным средством;
E - игла;
F - внутренний колпачок иглы
G - внешний колпачок иглы
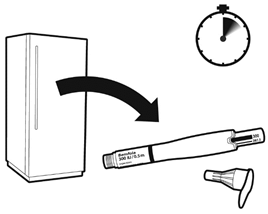
Делайте инъекцию ежедневно примерно в то же время. Достаньте ручку для ввода из холодильника за 5-10 минут до ее применения.
Примечание: убедитесь, что препарат не заморожен.
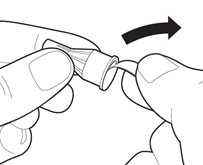
Снимите с иглы для инъекций этикетку контроля вскрытия.
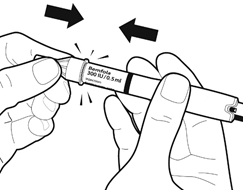
Держа ручку по бокам присоедините иглу, вдавив ее на место. НЕ прикручивают иглу. Вы услышите щелчок, когда игла надежно зафиксируется.
Внимание: присоединяя иглу, не нажимайте на регулятор дозы.
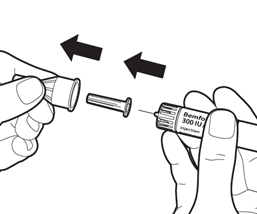
Снимите внешний колпачок иглы. Храните колпачок - он понадобится после инъекции.
Снимите внутренний колпачок иглы.
- установление дозы
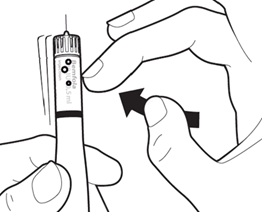
Держите ручку для ввода иглой вверх. Слегка постучите по ручке, чтобы возможные большие воздушные пузырьки поднялись вверх.
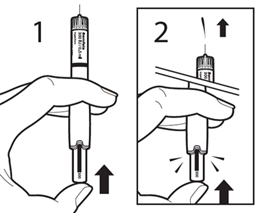
Держа ручку для ввода иглой вверх, нажмите на регулятор дозы, пока не исчезнет лента активации с маленькой стрелкой. Вы также услышите щелчок и небольшое количество жидкости высвободится из иглы (это нормально). Теперь ручка готова для установки дозы.
Если жидкость не виприсне, ручку для ввода применять нельзя.
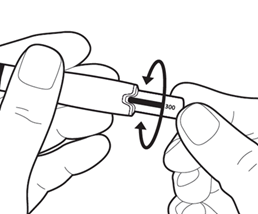
Поверните регулятор дозы, пока показатель предназначенной Вам дозы появления в окошке дисплея.
Примечание: теперь ручка для введения готова к инъекции.
Внимание: не нажимайте на регулятор дозы в данный момент.
5. Введение дозы
Теперь Вы готовы для немедленного введения инъекции. Ваш врач или медсестра уже посоветовали Вам, в участок тела делать инъекцию (например живот, передняя поверхность бедра). Чтобы минимизировать раздражение кожи, каждый день выбирайте место для инъекции.
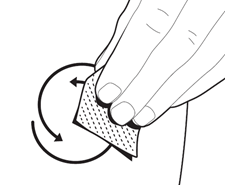
Круговыми движениями протрите кожу в месте инъекции салфеткой, пропитанной спиртом.
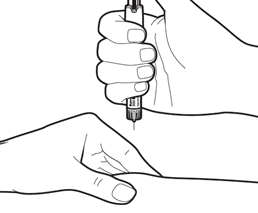
Осторожно соберите в складку кожу участка инъекции. Держите ручку примерно под прямым углом и полностью введите иглу к устойчивому положению.
Внимание: не нажимайте на регулятор дозы при введении иглы.
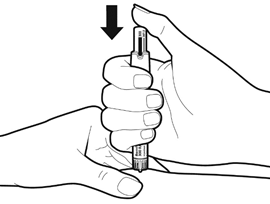
Нажмите регулятор дозы медленно и непрерывно до упора, пока индикатор дозы не исчезнет.
Выдержав не менее 5 секунд, выньте иглу из кожи.
Вытащив иглу, круговыми движениями протрите кожу спиртовой салфеткой.
6. После инъекции
Осторожно наденьте на иглу внешний колпачок.
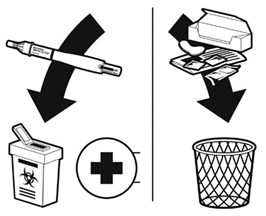
Выбросьте на помойку упаковку, внутренний колпачок иглы, наклейку, спиртовую салфетку и инструкцию по применению. Не выбрасывайте лекарственные средства в раковину, туалет бытовой свалку. Использованную ручку необходимо поместить в контейнер для острых предметов и вернуть в медицинское учреждение для правильной утилизации. Спросите своего фармацевта, как распоряжаться лекарственным средством, которым Вы больше не пользуетесь.
Примечание: в течение срока годности закрыт препарат может храниться при температуре не выше 25 ° С в течение 3 месяцев без повторного охлаждения; лекарственное средство следует утилизировать, если он не был использован по истечению 3 месяцев.
Дети
Соответствующих показаний для применения фолитропин альфа пациентам педиатрической группы нет.
Передозировка
Проявления передозировки фолитропин альфа неизвестны, однако существует возможность развития синдрома гиперстимуляции яичников (см. Раздел «Особенности применения»).
Побочные эффекты
Резюме профиля безопасности.
Наиболее распространенными побочными эффектами являются головная боль, кисты яичников и местные реакции в месте введения (например, боль, эритема, гематома, отек и / или раздражение в месте инъекции).
Часто сообщалось о случаях синдрома гиперстимуляции яичников (СГЯ) легкой или средней степени тяжести, который следует считать неотъемлемым риском процедуры стимуляции. Тяжелые формы СГЯ редкие (см. Раздел «Особенности применения»).
Очень редко возможны случаи тромбоэмболии (см. Раздел «Особенности применения»).
Для определения частоты побочных реакций используют следующие критерии:
Очень часто (≥ 1/10, возникают более чем у 1 из 10 человек).
Часто (≥ 1/100 до <1/10, возникают не более чем у 1 из 10 человек).
Редкие (от ≥ 1/1000 до <1/100, возникают не более чем у 1 из 100 человек).
Одиночные (от ≥ 1/10000 до <1/1000, возникают не более чем у 1 из 1000 человек).
Редкие (<1/10000, возникают менее чем у 1 из 10 000 человек).
лечение женщин
Со стороны иммунной системы
Редкие: реакции гиперчувствительности от легкой до тяжелой степени, включая анафилактические реакции и шок.
Со стороны нервной системы
Очень часто: головная боль.
сосудистые расстройства
Редкие: тромбоэмболия (как в сочетании с СГСЯ, так и отдельно).
Со стороны дыхательной системы, органов грудной клетки и средостения
Редкие: обострение или ухудшение астмы.
Со стороны пищеварительной системы
Часто: боль в животе, ощущение растяжения и дискомфорта в животе, тошнота, рвота, диарея.
Со стороны репродуктивной системы и молочных желез
Очень часто: кисты яичников.
Часто: СГСЯ легкой и средней степени тяжести (включая сопутствующие симптомы).
Нечасто: тяжелый СГЯ (включая сопутствующие симптомы) (см. Раздел «Особенности применения»).
Редкие: осложнения тяжелого СГЯ.
Общие нарушения и реакции в месте введения
Очень часто: реакции в месте инъекции (например боль, эритема, гематома, отек и / или раздражение в месте инъекции).
лечение мужчин
Со стороны иммунной системы
Редкие: реакции гиперчувствительности от легкой до тяжелой степени, включая анафилактические реакции и шок.
Со стороны дыхательной системы, органов грудной клетки и средостения
Редкие: обострение или ухудшение астмы.
Со стороны кожи и подкожных тканей
Часто: акне.
Со стороны репродуктивной системы и молочных желез
Часто: гинекомастия, варикоцеле.
Общие нарушения и реакции в месте введения
Очень часто: реакции в месте инъекции (например боль, эритема, гематома, отек и / или раздражение в месте инъекции).
Лабораторные и инструментальные данные
Часто: увеличение массы тела.
Сообщение о подозреваемых побочные реакции
Сообщение о подозреваемых побочных реакциях лекарственного средства имеют большое значение. Они позволяют продолжать мониторинг соотношения польза / риск лекарственного средства. Медицинских работников просят сообщать о любых подозреваемые побочные реакции, используя национальную систему информирования. Медицинским работникам следует убедиться, что торговое название и номер серии лекарственного средства указанные в сообщении о подозреваемом побочном реакцию.
Срок годности Бемфола
3 года.
После открытия лекарственное средство следует вводить немедленно.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения Бемфола
Хранить в холодильнике (2-8 ° С). Не замораживать.
К открытию в течение срока годности закрыт препарат может храниться в холодильнике при температуре не выше 25 ° С в течение 3 месяцев без повторного охлаждения. Лекарственное средство следует утилизировать, если он не был использован в течение
3 месяцев.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Несовместимость.
Не применяется.
Упаковка
По 0,125 мл или 0,25 мл, или 0,375 мл, или 0,50 мл или 0,75 мл раствора для инъекций в стеклянном картриджи, с резиновой пробкой-поршнем и резиновым диском с алюминиевым колпачком, помещенном в ручку для ввода . По 1 или 5, или 10 предварительно наполненных ручек с одноразовыми иглами (соответственно 1 или 5 или 10) и салфетками, пропитанными спиртом (соответственно 1 или 5 или 10) вместе с инструкцией по применению в картонной коробке.
Категория отпуска
По рецепту.
Производитель
ОАО «Гедеон Рихтер».
Местонахождение производителя
Н-1103, Будапешт, ул. Демреи, 19-21, Венгрия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Бемфола только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- https://www.richter.com.ua - ОАО «Гедеон Рихтер»
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
Бемфола и Алкоголь?
Ваше состояние само по себе может ухудшаться после приема спиртного, так как алкоголь расширяет сосуды и вызывает отечность. Не рекомендуем принимать алкоголь в течение всего курса приема препарата Бемфола, а также несколько дней после завершения лечения.
| Тип данных | Сведения из реестра |
| Торговое наименование: | Бемфола |
| Производитель: | ОАО «Гедеон Рихтер» |
| Форма выпуска: | раствор для инъекций в предварительно заполненной ручке по 75 МЕ (5,5 мкг) / 0,125 мл или 150 МЕ (11 мкг) / 0,25 мл или 225 МЕ (16,5 мкг) / 0,375 мл или 300 МЕ (22 мкг) / 0,5 мл или 450 МЕ (33 мкг) / 0,75 мл по 0,125 мл раствора для инъекций в предварительно заполненной ручке в стеклянном картридже; по 1 или 5, или 10 предварительно наполненных ручек с одноразовыми иглами |
| Регистрационное удостоверение: | UA/17528/01/01, UA/17528/01/02, UA/17528/01/03, UA/17528/01/04, UA/17528/01/05 |
| Дата начала: | 22.07.2019 |
| Дата окончания: | 22.07.2024 |
| МНН: | Follitropin alfa |
| Условия отпуска: | по рецепту |
| Состав: | 1 мл 600 МЕ (44 мкг) фолитропин альфа; / одна предварительно наполнена ручка содержит 75 МЕ (5,5 мкг) фолитропин альфа в 0,125 мл |
| Фармакологическая группа: | Половые гормоны и модуляторы половой системы. Гонадотропины. |
| Код АТХ: | G03GA05 |
| Заявитель: | ОАО «Гедеон Рихтер» |
| Страна заявителя: | Венгрия |
| Адрес заявителя: | Н-1103, Будапешт, ул. Демреи, 19-21, Венгрия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Да |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| G | Средства, влияющие на мочеполовую систему и половые гормоны |
| G03 | Гормоны половых желез и препараты, применяемые при патологии половой сферы |
| G03G | Гонадотропины и другие стимуляторы овуляции |
| G03GA | Гонадотропные гормоны |
| G03GA05 | Фолликулостимулирующий гормон человека (фсг, фолитропин альфа) |

