
- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Мультак инструкция по применению
Официальная инструкция лекарственного препарата Мультак таблетки 400 мг. Описание и применение Mul'tak, аналоги и отзывы. Инструкция Мультак таблетки утвержденная компанией производителем.
Состав
действующее вещество: дронедарон;
1 таблетка содержит дронедарона гидрохлорида в пересчете на дронедарон 400 мг.
Вспомогательные вещества: гипромеллоза, крахмал кукурузный, кросповидон (тип А), полоксамер, лактоза, кремния диоксид коллоидный, магния стеарат.
оболочка: гипромеллоза, титана диоксид (E 171), полиэтиленгликоль, воск карнаубский.
Лекарственная форма
Таблетки, покрытые оболочкой.
Основные физико-химические свойства: белого цвета удлиненные таблетки с пленочным покрытием, с одной стороны - гравировка 4142, с другой - двойная волнистая линия.
Фармакологическая группа
Средства, применяемые для лечения сердечно-сосудистых заболеваний. Антиаритмические средства, класса III. Дронедарон.
Код ATХ С01В D07.
Фармакологические свойства
Фармакологические.
Механизм действия. Дронедарон является мультиканальное блокиратором, который ингибирует калиевые каналы (включая IK (Ach), IKur, IKr, IKs) и таким образом продлевает потенциал действия сердечной мышцы и рефрактерные периоды (класс III). Он также ингибирует натриевые каналы (класс Ib) и кальциевые каналы (класс IV). Он является неконкурентным антагонистом адренергических рецепторов (класс II). У животных дронедарон предупреждал фибрилляции предсердий или восстанавливал нормальный синусовый ритм в зависимости от экспериментальной модели, использовавшейся. Он также предупреждал желудочковой тахикардии и фибрилляции желудочков в нескольких животных моделях. Такое действие, скорее всего, обусловлено его электрофизиологическими свойствами, которые присущи всем четырем классам по классификации Вогана-Вильямса.
Фармакодинамические свойства. В экспериментальных моделях на животных дронедарон замедляет частоту сердечных сокращений. Он удлиняет длину цикла Венкебаха и интервалы AH, PQ, QT; в то же время он не проявляет заметного влияния или незначительно удлиняет интервалы QTc, HV и QRS. Он увеличивает эффективные рефрактерные периоды (ЕРП) в предсердии, предсердно-желудочковой узле и несколько продолжает ЕРП в желудочке с минимальным обратным степенью зависимости от частоты применения.
Дронедарон снижает артериальное давление и сократительную способность миокарда (dP / dt max), не изменяя фракцию выброса левого желудочка и снижая потребление миокардом кислорода.
Дронедарон обладает сосудорасширяющим свойствами, которые более выражены относительно коронарных артерий (в связи с активацией сигнального пути оксида азота) по сравнению с периферическими артериями.
Дронедарон оказывает косвенную Антиадренергические действие; он снижает альфа-адренергичну ответ со стороны артериального давления на эпинефрин, а также бета-1 и бета-2 ответы на изопротеренол.
Клиническая эффективность и безопасность.
Снижение риска госпитализации по поводу фибрилляции предсердий (ФП) .Эффективность дронедарона в снижении риска госпитализации, обусловленной ФП, была продемонстрирована у пациентов с ФП на момент включения в исследование или в анамнезе, а также с дополнительными факторами риска, которые приняли участие в многоцентровом международном подвийнослипому рандомизированном плацебо-контролируемом исследовании ATHENA. Пациенты должны были иметь по крайней мере один фактор риска (к которым принадлежали возраст, наличие артериальной гипертензии, сахарного диабета, ранее перенесена цереброваскулярная событие, диаметр левого предсердия ≥50 мм или фракция выброса левого желудочка (ФВЛЖ) <0,40) в сочетании с фибрилляцией / трепетанием предсердий и синусовым ритмом, оба из которых были задокументированы минимум за последние 6 месяцев. Пациенты, получавшие амиодарон в предыдущие 4 недели до момента рандомизации, в исследование не включались.
Как первичная конечная точка в этом исследовании рассматривался время в первой госпитализации по сердечно-сосудистым причинам или случай летального исхода из любой причины.
Пациенты были в возрасте от 23 до 97 лет, 42% из них были в возрасте более 75 лет. 47% пациентов были лицами женского пола, и большинство участников исследования принадлежали к европеоидной расы (89%).
У большинства пациентов была артериальная гипертензия (86%) и органическое заболевание сердца (60%) (в том числе ишемическая болезнь сердца 30% застойная сердечная недостаточность (ЗСН): 30%; фракция выброса левого желудочка (ФВЛЖ) <45%: 12 %). У 25% участников была ФП на момент включения в исследование.
По результатам исследования применения дронедарона приводило к уменьшению частоты случаев госпитализации по сердечно-сосудистым причинам или летальному исходу из любой причине на 24,2% по сравнению с плацебо (p <0,0001).
Снижение частоты госпитализаций по сердечно-сосудистых причин или летальному исходу из любой причине было подобным во всех подгруппах пациентов, независимо от начальных характеристик пациентов или лекарственных средств, которые они принимали (ингибиторы АПФ или БРА II, бета-блокаторы, препараты наперстянки, статины , блокаторы кальциевых каналов, диуретики) (см. рисунок 1).
Рисунок 1. Оценка относительного риска (дронедарон 400 мг дважды в сутки по сравнению с плацебо) с 95% доверительными интервалами в соответствии с выбранными базовых характеристик - первой госпитализации по сердечно-сосудистым причинам или летальному исходу из любой причины.
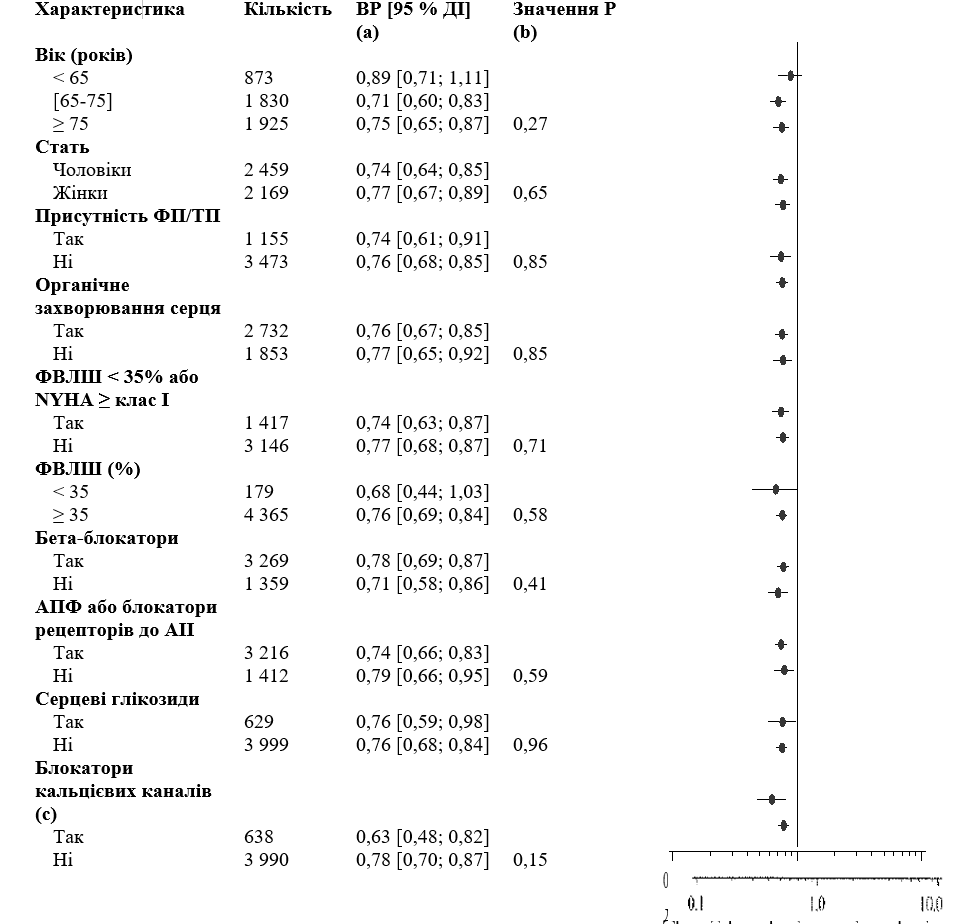
(A) определяется по модели регрессии Кокса.
(B) Значение P - взаимодействие между начальными характеристиками и показателями лечения на модели регрессии Кокса.
(C) Блокаторы кальциевых каналов с эффектами уменьшения частоты сердечных сокращений ограничиваются дилтиаземом, верапамилом и бепридилом.
Подобные результаты были получены по количеству случаев госпитализации в связи с сердечно-сосудистыми заболеваниями при уменьшении риска на 25,5% (p <0,0001).
В ходе исследования количество летальных исходов по любым причинам в группе, принимавшей дронедарон (116/2 301), и в группе, принимавшей плацебо (139/2 327), была сходной.
Поддержание синусового ритма .В исследованиях EURIDIS и ADONIS целом приняли участие 1237 пациентов с ранее перенесенным эпизодом фибрилляции или трепетание предсердий, которые были рандомизированы в амбулаторных условиях для получения или дронедарона 400 мг дважды в сутки (n = 828) или плацебо (n = 409), что назначали дополнительно к стандартным лекарственных средств (к которым принадлежали пероральные антикоагулянты, бета-блокаторы, ингибиторы АПФ или БРА II, средства длительной антитромбоцитарной терапии, диуретики, статины, препараты наперстянки и блокаторы кальциевых каналов). Пациенты перенесли хотя бы один документированный на ЭКГ эпизод фибрилляции / трепетания предсердий в течение последних 3 месяцев и имели синусовый ритм в течение не менее 1:00; наблюдение за пациентами проводилось в течение 12 месяцев. У пациентов, принимавших амиодарон, примерно через 4:00 после приема первой дозы препарата проводили ЭКГ для подтверждения удовлетворительного переносимости лечения. Другие антиаритмические препараты отменяли минимум за период времени, равный 5 периодам полувыведения этих препаратов из плазмы крови, к приему первой дозы исследовательского препарата.
Участники исследования были в возрасте от 20 до 88 лет, большинство из них принадлежали к европеоидной расы (97%) и были мужского пола (69%). Среди сопутствующих заболеваний чаще всего встречались артериальная гипертензия (56,8%) и органические заболевания сердца (41,5%), в том числе ишемическая болезнь сердца (21,8%).
По результатам как объединенных данных исследований EURIDIS и ADONIS, так и данных этих отдельно взятых исследований дронедарон последовательно отдалял наступления первого повторного эпизода фибрилляции / трепетания предсердий (первичная конечная точка). По сравнению с плацебо дронедарон уменьшал риск первого повторного эпизода фибрилляции / трепетания предсердий в течение 12 месяцев исследовательского периода на 25% (p = 0,00007). Медиана времени с момента рандомизации до первого повторного эпизода фибрилляции / трепетания предсердий в группе дронедарона составила 116 дней, что было в 2,2 раза продолжительнее, чем в группе плацебо (53 дня).
В исследовании DIONYSOS сравнивались эффективность и безопасность дронедарона (400 мг дважды в сутки) и с амиодарона (600 мг в сутки в течение 28 дней, далее по 200 мг в сутки), которые предназначались в течение 6 месяцев. Всего в исследовании приняли участие 504 пациентов с документированной ФП, которые были рандомизированы в две группы: 249 пациентов получали дронедарон и 255 пациентов получали амиодарон. Частота регистрации событий первичной конечной точки для оценки эффективности препаратов, за которые был принят первый рецидив ФП или преждевременную отличие исследовательского препарата из-за его непереносимость или недостаточной эффективности, в течение 12 месяцев составила 75% в группе дронедарона и 59% в группе амиодарона (отношение рисков (ОР ) = 1,59, p-значения по логарифмическим ранговым критерием <0,0001). Риск рецидива ФП составил 63,5% по сравнению с 42% соответственно. Рецидивы ФП (в том числе отсутствие конверсии ритма) чаще встречались в группе дронедарона, тогда как частота преждевременной отмены исследовательского препарата из-за его непереносимость была выше в группе амиодарона. Частота регистрации событий главной конечной точки для оценки безопасности препаратов, за которые было принято случаи развития определенных событий со стороны щитовидной железы, печени, легких, нервной системы, кожи, органов зрения и желудочно-кишечного тракта, а также преждевременную отличие исследовательского препарата через любой которое побочное явление, в группе дронедарона уменьшилась на 20% по сравнению с группой амиодарона (p = 0,129). Это уменьшение риска было обусловлено статистически значимым снижением частоты событий со стороны щитовидной железы и нервной системы и тенденцией к снижению частоты событий со стороны кожи и органов зрения,
В группе пациентов, принимавших дронедарон, была выше частота возникновения побочных явлений со стороны желудочно-кишечного тракта, преимущественно за счет диареи (12,9% по сравнению с 5,1%).
Пациенты с симптомами сердечной недостаточности в состоянии покоя или при минимальной нагрузке в течение предыдущего месяца или пациенты, которые были госпитализированы в связи с сердечной недостаточностью в течение предыдущего месяца . В исследовании ANDROMEDA приняли участие 627 пациентов с дисфункцией левого желудочка, которые были госпитализированы по поводу впервые диагностированной сердечной недостаточности или ухудшение течения существующей сердечной недостаточности и имели по крайней мере один эпизод одышки при минимальной физической нагрузке или в состоянии покоя (III или IV функциональный класс по NYHA) или пароксизмальной ночной одышку течение месяца перед госпитализацией.
Это исследование было остановлено досрочно в связи с замеченными различиями в количестве случаев летального исхода на фоне приема дронедарона (25 пациентов в группе дронедарона по сравнению с 12 пациентами в группе плацебо, p = 0,027) (см. Разделы «Противопоказания» и «Особенности применения »).
Пациенты с постоянной фибрилляцией предсердий.
Исследование PALLAS было рандомизированное плацебо-контролируемым исследованием, в котором изучалась клиническая пользу дронедарона 400 мг, что применяется дважды в сутки в дополнение к стандартной терапии пациентам с постоянной ФП и дополнительными факторами риска (с застойной сердечной недостаточностью ~ 9%, ишемической болезнью сердца ~ 41 %, ранее перенесенным инсультом или ТИА ~ 27%; ФВ ЛЖ ≤ 40% ~ 20,7% и пациенты ≥ 75 лет с артериальной гипертензией и сахарным диабетом ~ 18%). Исследование было преждевременно прекращено после рандомизации 3149 пациентов (плацебо = 1577; дронедарон = 1572) в связи со значительным увеличением случаев сердечной недостаточности (плацебо = 33; дронедарон = 80; ОР = 2,49 (1,66-3,74) ]; инсульта [плацебо = 8; дронедарон = 17; ОР = 2,14 (0,92-4,96)] и летальному исходу из-за сердечно-сосудистую патологию [плацебо = 6; дронедарон = 15; ОР = 2,53 ( 0,98-65,
Фармакокинетика.
Абсорбция.Дронедарон хорошо всасывается после приема вместе с пищей (по крайней мере на 70%). Однако в связи с пресистемным метаболизмом «первого прохождения» биодоступность дронедарона (что принимается во время еды) составляет 15%. Одновременный прием пищи увеличивает биодоступность дронедарона в среднем в 2-4 раза. После приема вместе с пищей пиковые плазменные концентрации дронедарона и его основного активного циркулирующего метаболита (N-дебутиловий метаболит) достигается в течение 3-6 часов. После многократного применения препарата в дозе 400 мг дважды в сутки равновесное состояние достигается в течение 4-8 дней лечения, а среднее отношение кумуляции дронедарона находится в пределах от 2,6 до 4,5. Средняя Cmax дронедарона в равновесном состоянии составляет 84-147 нг / мл, экспозиция основного N-дебутилового метаболита подобная экспозиции первичной соединения. Фармакокинетика дронедарона и его метаболита N-дебутилу меняется умеренно зависимости от дозы: двукратное увеличение дозы приводит приблизительно к 2,5-3 разового повышения значения Cmax и AUC.
Распределение. Связывания дронедарона и его N-дебутилового метаболита с белками плазмы in vitro составляет 99,7% и 98,5% соответственно и является ненасыщаемой. Оба соединения связываются преимущественно с альбумином. После введения препарата объем распределения в равновесном состоянии (Vss) находится в диапазоне от 1200 до 1400 л.
Метаболизм . Дронедарон экстенсивно метаболизируется преимущественно при участии фермента CYP 3A4 (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»). Главным путем метаболизма препарата является его N-дебутилування с образованием основного циркулирующего активного метаболита и с последующим окислением, окислительным дезаминированием с образованием неактивного метаболита - пропионовой кислоты с последующим окислением и прямым окислением. В метаболизме активного метаболита дронедарона частично участвуют МАО (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»). N-дебутиловий метаболит проявляет фармакодинамическом активность, но у 3-10 раз менее мощным, чем дронедарон. Этот метаболит принимает участие в фармакологической действия дронедарона у человека.
Вывод. После приема меченого радиоактивным изотопом препарата примерно 6% введенной дозы екскретувалися с мочой, преимущественно в виде метаболитов (в моче не было обнаружено неизмененной первичной соединения), и 84% - с калом, преимущественно в виде метаболитов. После внутривенного применения скорость выведения дронедарона из плазмы крови составляет от 130 до 150 л / час. Терминальный период полувыведения дронедарона составляет примерно 25-30 часов, а его метаболита N-дебутилу - примерно 20-25 часов. После завершения лечения Дронедарон в дозе 400 мг дважды в сутки полная элиминация дронедарона и его метаболита из плазмы происходила в течение 2 недель после последнего приема препарата.
Особые категории пациентов . Фармакокинетика дронедарона у пациентов с ФП аналогична таковой у здоровых добровольцев. На фармакокинетику дронедарона влияют такие факторы, как пол, возраст и масса тела. Но каждый из этих факторов имеет ограниченное влияние на дронедарон.
Пол . Экспозиция дронедарона и его N-дебутилового метаболита у женщин была в среднем в 1,3-1,9 раза выше по сравнению с таковой у мужчин.
Пациенты пожилого возраста . Среди всех участников клинических исследований дронедарона 73% были в возрасте от 65 лет, а 34% - в возрасте от 75 лет. У пациентов в возрасте от 65 лет экспозиция дронедарона была на 23% выше по сравнению с пациентами в возрасте до 65 лет.
Пациенты с нарушением функции печени . У пациентов с умеренной печеночной дисфункцией экспозиция несвязанного дронедарона возрастает в 2 раза. Экспозиция его активного метаболита уменьшается на 47% (см. Раздел «Способ применения и дозы»).
Влияние печеночной дисфункции на фармакокинетику дронедарона не оценивался из (см. Раздел «Противопоказания»).
Пациенты с нарушением функции почек . Влияние почечной дисфункции на фармакокинетику дронедарона НЕ оценивалась в специально спланированных для этого исследованиях. Изменения фармакокинетики дронедарона на фоне почечной дисфункции не ожидается, поскольку изменена соединение вообще не выводится с мочой и только примерно 6% дозы введенного препарата выводится с мочой в виде метаболитов (см. Раздел «Способ применения и дозы»).
Доклинические данные по безопасности . Дронедарон не проявлял ни генотоксического эффекта по результатам одного исследования in vivo (микроядерного теста у мышей) и четырех исследований in vitro .
По результатам этих исследований наблюдался рост частоты развития опухолей молочной железы у самок мышей, гистиоцитарных саркомы у мышей и гемангиомы в мезентериальных лимфоузлах у крыс, все - на фоне применения высшей из исследуемых доз препарата (что соответствовало дозе, которая обеспечивает экспозицию препарата в 5- 10 раз больше той, которая обусловлена применением терапевтической дозы препарата у человека). Гемангиомы не является предраковыми состояниями но не трансформируются в злокачественную гемангиосаркому ни у животных, ни у человека. Ни один из этих результатов не был расценен как значимый для человека.
В исследованиях хронической токсичности препарата наблюдался небольшой и оборотный фосфолипидоз (кумуляции пенистых макрофагов) в мезентериальных лимфатических узлах, преимущественно у крыс. Этот эффект рассматривался как специфический для этого вида исследовательских животных и незначительное для человека.
При применении дронедарона в высоких дозах у крыс препарат в значительной степени влиял на эмбриофетальной развитие, вызывая такие эффекты как увеличение постимплантацийних потерь эмбрионов, снижение массы тела плода и массы плаценты, а также внешние, висцеральные и скелетные пороки развития у плодов.
Клинические характеристики
Мультак Показания
Мультак® показан для поддержания синусового ритма после успешной кардиоверсии у взрослых клинически стабильных пациентов с пароксизмальной или персистирующей фибрилляцией предсердий (ФП). В связи с его профилем безопасности (см. Разделы «Противопоказания» и «Особенности применения») Мультак® следует назначать только после рассмотрения альтернативных подходов к лечению. Мультак® не следует назначать пациентам с левожелудочковой систолической дисфункцией или пациентам, страдающим сердечной недостаточностью имеют эпизоды сердечной недостаточности в анамнезе.
Противопоказания
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ.
Блокада II или III степени, полная блокада ножки пучка Гиса, дистальная блокада, дисфункция синусового узла, нарушения проводимости в предсердиях или синдром слабости синусового узла (за исключением случаев применения одновременно с функционирующим водителем ритма).
Брадикардия <50 ударов в минуту.
Постоянная фибрилляция предсердий (ФП) с длительностью ФП ≥ 6 месяцев (или неизвестной продолжительности), если врач принял решение прекратить попытки восстановления синусового ритма.
Нестабильная гемодинамика.
Сердечная недостаточность или левожелудочковая систолическая дисфункция в анамнезе или в настоящее время.
Токсическое поражение печени или легких, связанное с предыдущим применением амиодарона.
Одновременное применение с мощными ингибиторами цитохрома Р450 (CYP) 3A4, такими как кетоконазол, итраконазол, вориконазол, позаконазол, телитромицин, кларитромицин, нефазодон и ритонавир (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Лекарственные средства, вызывающие тахикардию torsades de pointes, например фенотиазины, цизаприд, бепридил, трициклические антидепрессанты, терфенадин и определенные пероральные макролиды (например эритромицин), антиаритмические средства класса I и III (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий »).
Интервал QTc, определенный с помощью формулы Базетта: ≥ 500 мс.
Тяжелая печеночная недостаточность.
Тяжелая почечная недостаточность (клиренс креатинина <30 мл / мин).
Одновременное применение дабигатрана.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Дронедарон метаболизируется CYP 3A4 (см. Раздел «Фармакокинетика»). Поэтому ингибиторы и индукторы CYP 3A4 могут взаимодействовать с Дронедарон.
Дронедарон является умеренным ингибитором CYP 3A4, слабым ингибитором CYP 2D6 и мощным ингибитором P-гликопротеинов (P-gр). В связи с этим дронедарон может взаимодействовать с лекарственными средствами, которые являются субстратами P-гликопротеинов, CYP 3A4 или CYP 2D6. Также было показано, что дронедарон и / или его метаболиты ингибируют транспортные белки семей транспортера органических анионов (OAT), транспортного полипептида органических анионов (OATP) и транспортера органических катионов (OCT) в условиях in vitro . Дронедарон не проявляет любого значимого потенциала по ингибирования CYP 1A2, CYP 2C9, CYP 2C19, CYP 2C8 и CYP 2B6.
Возможны фармакодинамические взаимодействия препарата с бета-блокаторами, блокаторами кальциевых каналов и препаратами наперстянки.
Лекарственные средства, которые индуцируют развитие torsades de pointes. Лекарственные средства, которые способствуют развитию torsades de pointes , такие как фенотиазины, цизаприд, бепридил, трициклические антидепрессанты, некоторые пероральные макролиды (например, эритромицин), терфенадин и антиаритмические средства I и III классов, противопоказаны из-за возможного риска проаритмогенного действия (см. Раздел « Противопоказания »). Следует соблюдать осторожность также при одновременном применении с бета-блокаторами или дигоксином.
Влияние других лекарственных средств на Мультак® .
Мощные ингибиторы фермента CYP 3A4 . Многократный прием кетоконазола в дозе 200 мг в сутки приводил к повышению экспозиции дронедарона в 17 раз. В связи с этим одновременное применение кетоконазола, а также других мощных ингибиторов фермента CYP 3A4, таких как итраконазол, вориконазол, позаконазол, ритонавир, телитромицин, кларитромицин или нефазодон, противопоказано (см. «Противопоказания»).
Умеренные / слабые ингибиторы фермента CYP 3A4 .
Эритромицин . Эритромицин, пероральный макролид, может индуцировать развитие torsades de pointes и поэтому противопоказан (см. Раздел «Противопоказания»). Применение повторных доз эритромицина (500 мг три раза в сутки в течение 10 дней) приводило к увеличению равновесной экспозиции дронедарона в 3,8 раза.
Блокаторы кальциевых каналов . Блокаторы кальциевых каналов, дилтиазем и верапамил, являются субстратами и / или умеренными ингибиторами фермента CYP 3A4. Кроме того, в связи с их свойствами уменьшать частоту сердечных сокращений верапамил и дилтиазем могут взаимодействовать с Дронедарон с точки зрения фармакодинамики.
Применение повторных доз дилтиазема (240 мг дважды в сутки), верапамила (240 мг 1 раз в сутки) и нифедипина (20 мг дважды в сутки) приводил к увеличению экспозиции дронедарона соответственно в 1,7, 1,4 и 1,2 раза. Дронедарон (400 мг дважды в сутки) также приводил к увеличению экспозиции блокаторов кальциевых каналов (верапамила в 1,4 раза и низолдипину в 1,5 раза). В ходе клинических испытаний 13% пациентов принимали блокаторы кальциевых каналов одновременно с Дронедарон. При этом не наблюдалось каких-либо роста риска артериальной гипотензии, брадикардии и сердечной недостаточности.
В общем через фармакокинетическое взаимодействие и возможное фармакодинамическом взаимодействие блокаторы кальциевых каналов, угнетающих функции синусового и атриовентрикулярного узлов, такие как верапамил и дилтиазем, следует с осторожностью применять вместе с Дронедарон. Эти лекарственные средства необходимо начинать применять в низких дозах, можно увеличивать путем титрования только после оценки ЭКГ. Пациентам, которые на начало применения дронедарона уже принимают блокаторы кальциевых каналов, следует выполнять ЭКГ и при необходимости корректировать дозу блокатора кальциевых каналов (см. Раздел «Особенности применения»).
Другие умеренные / слабые ингибиторы фермента CYP 3A4 . Другие умеренные ингибиторы фермента CYP 3A4 также могут увеличивать экспозицию дронедарона.
Индукторы фермента CYP 3A4 . Рифампицин (600 мг 1 раз в сутки) уменьшал экспозицию дронедарона на 80%, не влияя существенно на экспозицию его активного метаболита. В связи с этим одновременное применение рифампицина и других мощных индукторов фермента CYP 3A4, таких как фенобарбитал, карбамазепин, фенитоин или зверобой продырявленный, не рекомендуется, поскольку они уменьшают экспозицию дронедарона.
Ингибиторы моноаминоксидазы (МАО) . В исследовании in vitro ингибиторы МАО влияли на метаболизм активного метаболита дронедарона. Клиническая значимость этих данных неизвестна (см. Разделы «Особенности применения» и «Фармакокинетика»).
Влияние Мультак ® на другие лекарственные средства.
Взаимодействие с лекарственными средствами, которые метаболизируются ферментом CYP 3A4.
Статины . Дронедарон может увеличивать экспозицию статинов, которые являются субстратами фермента CYP 3A4 и / или субстратами P-gр. Дронедарон (400 мг дважды в сутки) вызывал увеличение экспозиции симвастатина и симвастатиновой кислоты соответственно в 4 и в 2 раза. Предполагается, что дронедарон также может увеличивать экспозицию ловастатина в такой же степени, как и экспозицию симвастатиновой кислоты. Наблюдалась слабое взаимодействие дронедарона с аторвастатином (которая приводила к увеличению экспозиции аторвастатина в среднем в 1,7 раза). Наблюдалась слабое взаимодействие дронедарона со статинами, которые транспортируются OATP, такими как розувастатин (которая приводила к увеличению экспозиции розувастатина в среднем в 1,4 раза).
В клинических исследованиях не было получено доказательных данных об опасности одновременного применения дронедарона и статинов, метаболизирующихся ферментом CYP 3A4. Однако поступали спонтанные сообщения о зарегистрированных случаях рабдомиолиза при применении дронедарона в комбинации со статинами (в частности симвастатином), поэтому следует с осторожностью назначать статины одновременно с препаратом.
Рекомендуются низкие начальные и поддерживающие дозы статинов согласно указанным в инструкциях для их применения, пациентам необходимо проводить мониторинг клинических признаков мышечной токсичности (см. Раздел «Особенности применения»).
Блокаторы кальциевых каналов . Взаимодействие дронедарона с блокаторами кальциевых каналов описана выше (см. Раздел «Особенности применения»).
Иммунодепрессанты . Применение дронедарона может приводить к увеличению концентраций имуносупресантив в плазме крови (такролимуса, сиролимуса, эверолимуса и циклоспорина). В случае одновременного применения с Дронедарон рекомендуется осуществлять мониторинг их концентраций в плазме крови и соответствующим образом корректировать дозировку.
Пероральные контрацептивы . У здоровых добровольцев, принимавших дронедарон (800 мг дважды в сутки) одновременно с оральными контрацептивами, уменьшение уровней этинилэстрадиола и левоноргестрела не наблюдалось.
Взаимодействие с лекарственными средствами, которые метаболизируются ферментом CYP 2D6: бета-блокаторы, антидепрессанты.
Бета-блокаторы . Соталол необходимо отменить перед началом применения препарата Мультак ® (см. Разделы «Противопоказания» и «Способ применения и дозы»). Дронедарон может повышать экспозицию бета-блокаторов, которые метаболизируются ферментом CYP 2D6. Кроме того, бета-блокаторы могут взаимодействовать с Дронедарон с точки зрения фармакодинамики. Дронедарон в дозе 800 мг в сутки повышал экспозицию метопролола в 1,6 раза, а экспозицию пропранолола - в 1,3 раза (то есть намного меньше 6-кратной разницы, которая наблюдается у медленных и быстрых метаболизаторов фермента CYP 2D6). В клинических исследованиях при применении дронедарона вместе с бета-блокаторами чаще наблюдалась брадикардия.
В общем через фармакокинетическое взаимодействие и возможное фармакодинамическом взаимодействие бета-блокаторы нужно с осторожностью применять вместе с Дронедарон. Применение этих лекарственных средств следует начинать с низких доз, которые нужно увеличивать путем титрования только после оценки ЭКГ. Пациентам, которые на начало применения дронедарона уже принимают бета-блокаторы, необходимо выполнить ЭКГ и при необходимости откорректировать дозу бета-блокатора (см. Раздел «Особенности применения»).
Антидепрессанты . Поскольку у человека дронедарон является слабым ингибитором фермента CYP 2D6, предполагается, что его взаимодействие с антидепрессантов лекарственными средствами, которые метаболизируются ферментом CYP 2D6, ограничено.
Взаимодействие с субстратами P-gр.
Дигоксин . Дронедарон (400 мг дважды в сутки) повышал экспозицию дигоксина в 2,5 раза путем ингибирования транспортера P-gр. Кроме этого препараты наперстянки могут взаимодействовать с Дронедарон с точки зрения фармакодинамики. Возможна синергическое действие на частоту сердечных сокращений и AV-проводимость. В клинических исследованиях на фоне применения дронедарона с препаратами наперстянки наблюдался рост уровней препаратов наперстянки в крови и / или увеличение частоты желудочно-кишечных расстройств, которые свидетельствовали о токсические эффекты наперстянки.
Дозу дигоксина нужно уменьшать примерно на 50%, следует осуществлять тщательный мониторинг уровня дигоксина в сыворотке крови, а также рекомендуется клинический и ЭКГ мониторинг.
Дабигатран . Когда дабигатрана этексилат в дозе 150 мг 1 раз в сутки применяли одновременно с Дронедарон в дозе 400 мг дважды в сутки, равные AUC0-24 и Cmax дабигатрана росли соответственно на 100% и 70%. Клинических данных относительно одновременного применения этих средств пациентам с ФП нет. Одновременное применение этих средств противопоказано (см. «Противопоказания»).
Взаимодействие с варфарином и лозартаном (субстратами фермента CYP 2C9).
Варфарин и другие антагонисты витамина К . Дронедарон (600 мг дважды в сутки) повышал уровень S-варфарина в 1,2 раза, не влияя на уровень R-варфарина, и международное нормализованное отношение (МНО) повышалось всего в 1,07 раза.
Однако сообщалось о случаях клинически значимого роста МНО (≥ 5 раз), что наблюдалось, как правило, в течение 1 недели после начала применения дронедарона у пациентов, принимавших пероральные антикоагулянты. В связи с этим значение МНО нужно тщательно контролировать после начала применения дронедарона пациентам, принимающим антагонисты витамина К.
Лозартан и другие БРА II (блокаторы рецепторов ангиотензина II) . Взаимодействия между Дронедарон и лозартаном не наблюдалось, а также не предвидится взаимодействия между Дронедарон и другими БРА II.
Взаимодействие с теофиллином (субстратом фермента CYP 1A2) . Дронедарон в дозе 400 мг дважды в сутки не увеличивает равновесной экспозиции теофиллина.
Взаимодействие с метформином (субстратом ОСТ1 и ОСТ2) . Взаимодействия между Дронедарон и метформином, субстратом ОСТ1 и ОСТ2, не наблюдалось.
Взаимодействие с омепразолом (субстратом фермента CYP 2С19) . Дронедарон не влияет на фармакокинетику омепразола, субстрата фермента CYP 2С19.
Взаимодействие с клопидогрелем . Дронедарон не влияет на фармакокинетику клопидогреля и его активного метаболита.
Другая информация.
Пантопразол (40 мг 1 раз в сутки), лекарственное средство, которое повышает кислотность желудочного сока, не влияя на цитохром P450, не оказывал какого-либо значимого влияния на фармакокинетику дронедарона.
Грейпфрутовый сок (ингибитор фермента CYP 3A4) . Многократный прием грейпфрутового сока по 300 мл трижды в сутки приводил к увеличению экспозиции дронедарона в 3 раза. В связи с этим пациентов следует предостеречь от употребления напитков с грейпфрутовым соком во время приема дронедарона (см. Раздел «Особенности применения»).
Особенности применения
При применении дронедарона рекомендуется осуществлять тщательный контроль путем регулярной оценки функции сердца, печени и легких (см. Ниже). В случае рецидива ФП следует рассмотреть целесообразность отмены дронедарона. Лечение Дронедарон следует прекратить, если у пациента развивается любой из состояний, которые могут привести к противопоказания (см. Раздел «Противопоказания»). Следует осуществлять контроль при одновременном применении с такими средствами, как дигоксин и антикоагулянты.
Пациенты, у которых во время лечения развивается постоянная ФП. Клиническое исследование с участием пациентов с постоянной ФП (при продолжительности ФП менее 6 месяцев) и факторами риска возникновения сердечно-сосудистых заболеваний было досрочно прекращено за чрезмерного количества случаев летального исхода по сердечно-сосудистым причинам, инсульта и сердечной недостаточности у пациентов, получавших Мультак® (см. раздел «Фармакологические»). Рекомендуется регулярно, по крайней мере 1 раз в 6 месяцев, выполнять ЭКГ. Если у пациентов, получающих лечение препаратом Мультак®, развивается постоянная ФП, то Мультак® необходимо отменить.
Пациенты с сердечной недостаточностью или левожелудочковой систолической дисфункцией в анамнезе или в настоящее время. Мультак® противопоказан пациентам с нестабильной гемодинамикой, с сердечной недостаточностью или левожелудочковой систолической дисфункцией в анамнезе или в настоящее время (см. Раздел «Противопоказания»).
У пациентов необходимо тщательно оценивать наличие симптомов застойной сердечной недостаточности. Поступали спонтанные сообщения о случаях первого возникновения или ухудшения существующей сердечной недостаточности при лечении препаратом Мультак®. Пациентам следует рекомендовать обращаться к врачу в случае развития или наличия в них признаков или симптомов сердечной недостаточности, таких как увеличение массы тела, застойные отеки или усиление одышки. В случае развития сердечной недостаточности лечения Мультак® следует прекратить.
Пациенты должны находиться под наблюдением по развитию левожелудочковой систолической дисфункции на фоне лечения. В случае развития левожелудочковой систолической дисфункции лечения Мультак® следует прекратить.
Пациенты с ишемической болезнью сердца. Следует с осторожностью применять пациентам с ишемической болезнью сердца.
Пациенты пожилого возраста. Следует с осторожностью применять препарат пациентам пожилого возраста (старше 75 лет) с многочисленными сопутствующими заболеваниями (см. «Способ применения и дозы» и «Фармакодинамическое свойства»).
Поражение печени.В течение послерегистрационного периода сообщалось о случаях гепатоцеллюлярного поражения печени, включая опасную для жизни острую печеночную недостаточность у пациентов, получавших Мультак®. Перед началом лечения Дронедарон оценку показателей функции печени нужно выполнять через 1 неделю и через 1 месяц после начала лечения, а затем повторять ежемесячно в течение шести месяцев, на 9-й и на 12-й месяцы и периодически после этого. Если уровни аланинаминотрансферазы (АЛТ) в три или более раз превышают верхнюю границу нормы (ВГН), то уровни АЛТ нужно повторно определить в течение 48-72 часов. Если по результатам повторного определения подтверждается, что уровни АЛТ в три или более раз превышают ВМН, то лечение Дронедарон следует прекратить.
Пациенты должны немедленно сообщать своему врачу о любых симптомы возможного поражения печени (стойкий, впервые обнаруженный боль в животе, потеря аппетита, тошнота, рвота, повышение температуры тела, недомогание, повышенная утомляемость, желтуха, темная окраска мочи или зуд).
Повышение уровня креатинина в плазме крови. На фоне приема 400 мг дронедарона дважды в сутки у здоровых добровольцев и у больных наблюдалось повышение уровня креатинина в плазме крови (среднее повышение - на 10 мкмоль / л). У большинства пациентов это повышение возникает вскоре после начала лечения и уровень креатинина достигает плато через 7 дней. Рекомендуется определять уровень креатинина в плазме крови перед назначением дронедарона и через 7 дней после начала приема. Если наблюдается увеличение креатининемии, то уровень креатинина в сыворотке крови необходимо оценить повторно через 7 дней. Если рост сывороточных уровней креатинина не наблюдается, этот увеличенный показатель имеет в дальнейшем использоваться как новый начальный уровень креатинина данного пациента, учитывая, что это ожидаемым для дронедарона. Если уровень креатинина в сыворотке крови продолжает расти,
Повышение уровня креатинина не должно обязательно приводить к прекращению лечения ингибиторами АПФ или блокаторами рецепторов ангиотензина II (БРА II).
В течение послерегистрационного периода сообщалось о более выраженное повышение уровня креатинина после начала применения дронедарона. В некоторых случаях также сообщалось о повышении уровня азота мочевины крови, возможно, из гипоперфузию, вторичную по отношению к развитию ЗСН (преренальная азотемия). В таких случаях лечение Дронедарон необходимо прекратить (см. Разделы «Противопоказания» и «Особенности применения»). Рекомендуется периодически контролировать функцию почек и рассмотреть необходимость проведения дальнейших исследований в случае необходимости.
Нарушение электролитного баланса. Поскольку антиаритмические лекарственные средства могут быть неэффективными или могут оказывать аритмогенное действие у пациентов с гипокалиемией, перед началом применения и во время лечения Дронедарон нужно устранить любой дефицит калия или магния.
Удлинение интервала QT. Фармакологическое действие дронедарона может вызывать умеренное удлинение интервала QТc по формуле Базетта (примерно на 10 мс), что связывается с увеличением времени реполяризации. Эти изменения связываются с терапевтическим эффектом дронедарона и не отражают его токсичности. Во время лечения рекомендуется осуществлять наблюдение за пациентом, в том числе с выполнением ЭКГ (электрокардиографии). Если интервал QTc по формуле Базетта ≥500 мс, то прием дронедарона следует прекратить (см. Раздел «Противопоказания»).
Учитывая клинический опыт, дронедарон оказывает небольшую проаритмогенное действие, и в рамках исследования ATHENA на фоне приема этого препарата наблюдалось уменьшение количества летальных исходов из-за аритмии (см. Раздел «Фармакологические»).
Однако проаритмогенного эффекты могут возникать в некоторых ситуациях, например при одновременном применении с лекарственными средствами, которые способствуют возникновению аритмии и / или нарушению электролитного баланса (см. Разделы «Особенности применения» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Со стороны респираторной системы, органов грудной клетки и средостения. В течение послерегистрационного периода сообщалось о случаях интерстициального заболевания легких, включая пневмонит и легочный фиброз. Возникновение одышки и непродуктивного кашля может быть связано с токсическим действием препарата на легкие, и таким пациентам показана тщательная оценка клинического состояния. При подтверждении токсического действия препарата на легкие его следует отменить.
Взаимодействия (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Дигоксин . Назначение дронедарона пациентам, принимающим дигоксин, приводит к повышению концентрации дигоксина в плазме крови и поэтому усиливает симптомы и признаки, связанные с токсическим действием дигоксина. Рекомендуется осуществлять клинический, ЭКГ и биологический мониторинг, а также уменьшить вдвое дозу дигоксина. Также возможна синергическое действие этих препаратов на частоту сердечных сокращений и AV-проводимость.
Одновременное применение бета-блокаторов или блокаторов кальциевых каналов , которые подавляют функции синусового и атриовентрикулярного узлов, нужно осуществлять с осторожностью. Применение этих лекарственных средств следует начинать с низких доз, которые можно увеличивать путем титрования только после оценки ЭКГ. Пациентам, которые на начало применения дронедарона уже принимают блокаторы кальциевых каналов или бета-блокаторы, необходимо выполнить ЭКГ и при необходимости откорректировать дозу.
Антикоагулянты . По клиническим рекомендациям по лечению ФП у пациентов нужна надлежащая антикоагулянтная терапия. После начала применения дронедарона пациентам, принимающим антагонисты витамина К, нужно осуществлять тщательный мониторинг международного нормализованного отношения (МНО), как указано в инструкциях к этим препаратам.
Не рекомендуется применять такие мощные индукторы CYP3А4, как рифампицин, фенобарбитал, карбамазепин, фенитоин или зверобой.
Ингибиторы МАО могут уменьшать клиренс активного метаболита дронедарона, и поэтому их следует применять с осторожностью.
С осторожностью нужно применять статины . Рекомендуются низкие начальные и поддерживающие дозы статинов, и пациентам необходимо проводить мониторинг клинических признаков мышечной токсичности.
Пациентов нужно предостеречь от употребления напитков с грейпфрутовым соком во время приема дронедарона.
Пациенты с непереносимостью галактозы. В связи с наличием в этом лекарственном средстве лактозы препарат не следует принимать пациентам с редкими наследственными нарушениями, как непереносимость галактозы, дефицит лактазы саамов или синдром мальабсорбции глюкозы-галактозы.
Применение в период беременности или кормления грудью
Беременность. До сих пор надлежащих доказательных данных по применению дронедарона беременным женщинам нет. По результатам экспериментальных исследований на животных было показано токсичность препарата по отношению к репродуктивных функций (тератогенность у животных). Поэтому дронедарон противопоказан беременным женщинам.
Женщинам репродуктивного возраста во время лечения Дронедарон следует использовать эффективные методы контрацепции.
Период кормления грудью. Неизвестно, выводится дронедарон и его метаболиты в грудное молоко. Доступные фармакодинамические / токсикологические данные исследований на животных показали наличие дронедарона и его метаболитов в грудном молоке. Риск для новорожденных / младенцев нельзя исключить. Решение о том, прекращать кормление грудью или прекращать / воздерживаться от лечения Мультак®, нужно принимать с учетом преимуществ кормления грудью для ребенка и необходимости лечения для женщины.
Фертильность. Дронедарон не влиял на фертильность в исследованиях на животных.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Влияние Мультак® на способность управлять транспортными средствами или работать с другими механизмами отсутствует или незначителен. Однако на способность управлять транспортными средствами или работать с другими механизмами могут влиять нежелательные реакции, такие как повышенная утомляемость.
Способ применения Мультак и дозы
Лечение следует начинать и проводить только под наблюдением специалиста (см. Раздел «Особенности применения»).
Лечение препаратом Мультак® можно начинать в амбулаторных условиях.
Перед началом применения препарата Мультак® следует прекратить лечение антиаритмическими средствами класса I или III (флекаинид, пропафенон, хинидин, дизопирамид, дофетилида, соталол, амиодарон).
Данные об оптимальном переходе из амиодарона на Мультак® пока ограничены. Следует иметь в виду, что действие амиодарона после прекращения его применения может продолжаться длительное время в связи с его длительным периодом полувыведения. Если предполагается переход на Мультак®, то его нужно осуществлять под наблюдением специалиста (см. Разделы «Противопоказания» и «Фармакологические»).
Взрослым рекомендуемая доза составляет 400 мг 2 раза в сутки. Применять по 1 таблетке утром и вечером во время еды.
Рекомендуется глотать таблетку целиком, запивая водой. Таблетку можно разделить на две равные части.
Не следует запивать таблетки Мультак® грейпфрутовым соком (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
В случае пропуска дозы пациенты должны принимать следующую дозу согласно определенной схеме, удваивать дозу не следует.
Лица пожилого возраста . Эффективность и безопасность применения лекарственного средства для лиц пожилого возраста, не страдали от других сердечно-сосудистых заболеваний, и молодых пациентов были одинаковыми.
Препарат следует с осторожностью назначать пациентам в возрасте от 75 лет при наличии сопутствующих заболеваний (см. Разделы «Противопоказания», «Особенности применения» и «Фармакологические»). Хотя в рамках исследования фармакокинетики с участием здоровых добровольцев экспозиция препарата в плазме крови у женщин пожилого возраста была повышенной, корректировки дозы не считается нужным (см. Разделы «Фармакологические» и «Фармакокинетика»).
Печеночная недостаточность . Мультак® противопоказан пациентам с тяжелой печеночной недостаточностью из-за отсутствия соответствующих данных. Пациентам с легкой или умеренной печеночной недостаточностью коррекция дозы не требуется (см. Раздел «Фармакокинетика»).
Почечная недостаточность. Мультак® противопоказан пациентам с тяжелой формой почечной недостаточности (клиренс креатинина (CrCl) <30 мл / мин) (см. Раздел «Противопоказания»). Пациентам с другими формами почечной недостаточности коррекция дозы не требуется (см. Разделы «Особенности применения» и «Фармакокинетика»).
Дети
Опыта применения детям и подросткам (до 18 лет) нет. Соответствующие данные отсутствуют.
Передозировка
Неизвестно, может ли дронедарон и / или его метаболиты выводиться путем диализа (гемодиализ, перитонеальный диализ или гемофильтрация).
Специфический антидот отсутствует. В случае передозировки лечение должно быть поддерживающим и направленным на облегчение симптомов.
Побочные эффекты
Профиль безопасности дронедарона в дозе 400 мг дважды в сутки для пациентов с фибрилляцией предсердий (ФП) или трепетанием предсердий (ТП) был установлен в 5 плацебо-контролируемых исследованиях. В них были рандомизированы и получили лечение в целом 6285 пациентов, 3282 из которых лечились Дронедарон по 400 мг дважды в сутки, а 2875 - получали плацебо. Средняя продолжительность лечения в этих исследованиях составила 13 месяцев. В исследовании ATHENA максимальная продолжительность периода последующего наблюдения составила 30 месяцев. Некоторые нежелательные реакции также были идентифицированы во время периода послерегистрационного надзора.
Оценка влияния таких характеристик пациентов, как пол или возраст, на частоту побочных явлений, которые возникали на фоне лечения, показала влияние пола (увеличение риска у женщин) на частоту каких-либо побочных явлений и на частоту серьезных побочных явлений.
Во время клинических исследований преждевременного прекращения лечения из-за появления побочных реакций нуждались 11,8% пациентов, получавших дронедарон, и 7,7% пациентов группы плацебо. Наиболее частой причиной прекращения терапии препаратом Мультак® были желудочно-кишечные расстройства (3,2% пациентов против 1,8% в группе плацебо). Во всех 5 исследованиях при получении дронедарона по 400 мг дважды в сутки чаще всего наблюдались такие побочные эффекты, как диарея, тошнота и рвота, повышенная утомляемость и астения.
В таблице представлены побочные реакции, классифицированные по классам систем органов. Частота возникновения определена как очень часто (≥ 1/10), часто (≥ 1/100, <1/10); нечасто (≥ 1/1000, <1/100) редко (≥ 1/10000, <1/1000); очень редко (<1/10000); неизвестно (не может быть оценено из-за отсутствия данных). В пределах каждой группы по частоте возникновения побочные эффекты представлены в порядке снижения степени их тяжести.
Системы органов | Очень часто (≥ 1/10) | Часто (От ≥ 1/100 до <1/10) | Нечасто (От ≥ 1/1000 до <1/100) | редко (От ≥ 1/10000 до <1/1000) |
Со стороны иммунной системы | Анафилактические реакции, включая ангионевротический отек | |||
Со стороны нервной системы | дисгевзия | агевзия | ||
нарушения | Застойная сердечная недостаточность (см. Ниже) | Брадикардия (см. Разделы «Противопоказания» и «Особенности применения») | ||
сосудистые расстройства | Васкулит, в том числе лейкоцитокластический васкулит | |||
Со стороны респираторной системы, органов грудной клетки и средостения | Интерстициальное заболевание легких, вклю- чаючи пневмонит и легочный фиброз (см. Ниже) | |||
Желудочно-кишечные расстройства | диарея рвота тошнота Боль в животе диспепсия | |||
гепатобилиарной системы | Отклонение от нормы показателей функции печени | Гепатоцеллюлярной поражения печени, включая опасную для жизни острую печеночную недостаточность (см. Раздел «Особенности применения») | ||
Патология кожи и подкожной ткани | высыпания (включая генерализованные, макулярные, макуло- популярный) зуд | Эритема (включая эритему и эритематозные высыпания) Экзема реакции светочувствительности аллергический дерматит Дерматит | ||
Общие нарушения и реакции в месте введения | повышенная утомляемость астения | |||
Расстройства, выявленные по результатам исследований | повышение уровня креатинина в крови * удлинение интервала QTc по формуле Базетта # |
* Повышенный уровень креатинина в крови ≥ 10% через 5 дней после начала лечения (см. Раздел «Особенности применения»).
# Удлинение интервала QTc, рассчитанного по формуле Базетта (> 450 мс у мужчин и> 470 мс у женщин) (см. Раздел «Особенности применения»).
Описание отдельных побочных реакций. В 5 плацебо-контролируемых исследованиях в группе пациентов, принимавших дронедарон, застойная сердечная недостаточность возникала с частотой, подобной такой в группе плацебо (очень часто; соответственно 11,2% и 10,9%). Этот показатель нужно рассматривать в контексте всего присущего пациентам с ФП увеличение частоты случаев сердечной недостаточности. О случаях застойной сердечной недостаточности также сообщалось по данным послерегистрационного надзора (частота неизвестна) (см. Раздел «Особенности применения»).
В ходе 5 плацебо-контролируемых исследований в 0,6% пациентов группы приема дронедарона наблюдались побочные явления со стороны легких по сравнению с 0,8% пациентов группы плацебо. О случаях интерстициального заболевания легких, включая пневмонит и легочный фиброз, сообщалось по данным послерегистрационного надзора (частота неизвестна). Часть этих пациентов ранее принимала амиодарон (см. Раздел «Особенности применения»).
Сообщение о подозреваемых нежелательные реакции. Сообщение о подозреваемых нежелательные реакции после регистрации лекарственного средства является важной процедурой. Это позволяет продолжать мониторинг соотношения польза / риск применения лекарственного средства. Медицинских работников просят сообщать о любых подозреваемые нежелательные реакции через национальную систему сообщений.
Срок годности Мультак
3 года.
Условия хранения Мультак
Хранить в недоступном для детей месте. Хранить в оригинальной упаковке при температуре ниже 30 ° С.
Упаковка
№ 60 (10 × 6): по 10 таблеток в блистере, по 6 блистеров в картонной коробке.
Категория отпуска
По рецепту.
Производитель
САНОФИ Уинтроп ИНДАСТРИА.
Заявитель.
ООО «Санофи-Авентис Украина», Украина.
Местонахождение производителя
1 ру де ля Вирж амбар ет Лаграв 33565 КАРБОН БЛАН СЕДЕКС, Франция.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Мультак только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- Санофи Уинтроп Индастриа
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Мультак |
| Производитель: | Санофи Уинтроп Индастриа |
| Форма выпуска: | таблетки, покрытые оболочкой 400 мг № 60 (10х6): по 10 таблеток в блистере, по 6 блистеров в картонной коробке |
| Регистрационное удостоверение: | UA/10412/01/01 |
| Дата начала: | 05.05.2020 |
| Дата окончания: | неограниченный |
| МНН: | Dronedarone |
| Условия отпуска: | по рецепту |
| Состав: | 1 таблетка содержит дронедарона гидрохлорида в пересчете на дронедарон 400 мг |
| Фармакологическая группа: | Средства, применяемые для лечения сердечно-сосудистых заболеваний. Антиаритмические средства, класса III. Дронедарон. |
| Код АТХ: | C01BD07 |
| Заявитель: | ООО «Санофи-Авентис Украина» |
| Страна заявителя: | Украина |
| Адрес заявителя: | Украина, 01033, г.. Киев, ул. Жилянская, 48-50 А |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| C | Средства, влияющие на сердечно-сосудистую систему |
| C01 | Кардиологические препараты |
| C01B | Антиаритмические средства i и iii класса |
| C01BD | Антиаритмические препараты iii класса |
| C01BD07 | Дронедарон |
