- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Мавенклад инструкция по применению
Официальная инструкция лекарственного препарата Мавенклад таблетки 10 мг. Описание и применение Mavenklad, аналоги и отзывы. Инструкция Мавенклад таблетки утвержденная компанией производителем.
Состав
действующее вещество: кладрибин;
1 таблетка содержит 10 мг кладрибина;
Вспомогательные вещества: гидроксипропилбетадекс, сорбит (Е 420), магния стеарат.
Лекарственная форма
Таблетки.
Основные физико-химические свойства: белые круглые двояковыпуклые диаметром 8,5 мм с тиснением «С» с одной стороны и «10» - с другой.
Фармакологическая группа
Селективные иммунодепрессанты. Кладрибин.
Код АТХ L04A A40.
Фармакологические свойства
Фармакологические.
механизм действия
Кладрибин является нуклеозидными аналогом дезоксиаденозину. Замещение на атом хлора в пуриновом кольце защищает кладрибин от расписания аденозиндезаминазы, увеличивая время внутриклеточного пребывания пролекарства кладрибина. Дальнейшее фосфорилирования кладрибина с образованием его активной формы в виде трифосфата - 2-хлордезоксиаденозин-трифосфата (Cd-ATP) - особенно эффективно достигается в лимфоцитах благодаря тому, что в них имеются постоянно высокие уровни дезоксицитидинкиназой (DCK) и относительно низкие уровни 5'-нуклеотидазы (5'-NTазы). Высокое соотношение DCK к 5'-NTазы способствует кумуляции Cd-ATP, что делает лимфоциты особенно чувствительными к клеточной смерти. Вследствие низкого соотношения DCK / 5'-NTаза другие клетки, происходящие из спинного мозга, поражаются в меньшей степени, чем лимфоциты. DCK является ферментом,
Основной механизм действия Cd-ATP, что индуцирует апоптоз, оказывает непосредственное и опосредованное влияние на синтез ДНК и функцию митохондрий. В делящихся клетках, Cd-ATP влияет на синтез ДНК путем ингибирования рибонуклеотид-редуктазы и конкурирует с дезоксиаденозин-трифосфатом за встраивания в ДНК с участием ДНК-полимеразы. В клетках, находящихся в состоянии покоя, кладрибин вызывает одноцепочечными разрыв ДНК, быстрое исчерпание никотинамид-аденин-динуклеотид, расщепление АТФ и клеточную смерть. Существует доказательство, что кладрибин также может вызвать непосредственный, зависимый и независимый от каспазы, апоптоз путем высвобождения цитохрома С и фактора, индуцирует апоптоз, в цитозоль клеток, не делятся.
Патогенез рассеянного склероза (РС) привлекает комплексный каскад явлений, в которых важную роль играют различные типы иммунных клеток, включая аутореактивные Т- и В-клетки. Механизм терапевтического действия кладрибина при РС еще полностью не изучен, но считается, что его основное влияние на В- и Т-лимфоциты прерывает каскад иммунных явлений, имеющих решающее значение для РС.
Различные уровни экспрессии DCK и 5'-NTазы в подтипы иммунных клеток могут объяснять разницу в чувствительности иммунных клеток к кладрибина. Благодаря этим уровням экспрессии клетки врожденной иммунной системы менее поражаются, чем клетки приобретенной иммунной системы.
фармакодинамические эффекты
Было показано, что кладрибин проявляет длительный эффект, преимущественно воздействуя на лимфоциты и аутоиммунные процессы, вовлеченные в патофизиологии РС.
В исследованиях наибольшая доля пациентов с лимфопенией 3 или 4 степени (от <500 до 200 клеток / мм или <200 клеток / мм) наблюдалась через 2 месяца после приема первой дозы кладрибина ежегодно, что указывает на наличие временного промежутка между пребыванием кладрибина в плазме и максимальным гематологическим эффектом.
Данные, полученные в клинических исследованиях для предложенной кумулятивной дозы 3,5 мг / кг массы тела, указывают на постепенное улучшение медианной количества лимфоцитов до нормального диапазона на 84-й неделе после приема первой дозы кладрибина (примерно через 30 недель после приема последней дозы кладрибина) . Количество лимфоцитов в более 75% пациентов возвращалась к нормальной диапазона до 144-й недели после приема первой дозы кладрибина (примерно через 90 недель после приема последней дозы кладрибина).
Лечение пероральным препаратом кладрибина приводит к быстрому уменьшению в кровотоке CD4 + и CD8 + Т-клеток. Для CD8 + T-клеток происходит менее выраженное уменьшение и быстрое восстановление, чем для CD4 + T-клеток, что приводит к временному уменьшению соотношения CD4 в CD8. Кладрибин уменьшает количество CD19 + B-клеток и клеток естественных киллеров CD16 + / CD56 +, количество которых также быстрее восстанавливается, чем количество CD4 + T-клеток.
Клиническая эффективность и безопасность
РС с рецидивирующее-ремитирующим ходом
Эффективность и безопасность кладрибина при пероральном применении оценивались в рандомизированном вдвойне-слепом плацебо-контролируемом клиническом исследовании (CLARITY) с участием 1326 пациентов с рецидивирующее-ремитирующим ходом РС. Целью исследования была оценка эффективности кладрибина по сравнению с плацебо в уменьшении пересчитанной на год частоты рецидивов (ARR) (первичная конечная точка), замедлении прогрессирования инвалидизации и уменьшении активных поражений по данным МРТ.
Пациенты принимали или плацебо (n = 437), или кумулятивную дозу кладрибина 3,5 мг / кг (n = 433) или 5,25 мг / кг массы тела (n = 456) в течение 96-недельного (2-летнего) периода исследований , состоящий из 2 лечебных курсов. Пациентов в рандомизированное способ распределяли для приема кумулятивной дозы 3,5 мг / кг в течение первого курса лечения на неделях 1 и 5 первого года и второго курса лечения на неделях 1 и 5 второго года. Пациентов в рандомизированное способ распределяли для приема кумулятивной дозы 5,25 мг / кг в течение дополнительного периода лечения на неделях 9 и 13 первого года. Большинство пациентов в группе плацебо (87,0%) и группах лечения Кладрибин в дозах 3,5 мг / кг (91,9%) и 5,25 мг / кг (89,0%) завершили полный 96-недельный период исследования.
Пациенты должны были иметь не менее 1 рецидив в предыдущие 12 месяцев. В общей исследуемой популяции медианный возраст пациентов составил 39 лет (диапазон от 18 до 65 лет), а соотношение женщин к мужчинам - примерно 2: 1 Средняя продолжительность заболевания РС перед включением в исследование составила 8,7 года, а медианный индекс базовой неврологической инвалидизации, установленный во всех группах лечения с расширенной шкале оценки степени инвалидизации Куртцке (EDSS), составил 3,0 (диапазон от 0 до 6,0). Более двух третей пациентов к исследованию не принимали препаратов, модифицирующих течение РС. Остальные пациенты ранее лечились интерфероном бета-1а, интерфероном бета-1b, глатирамера ацетата или натализумабу.
У пациентов с рецидивирующее-ремитирующим ходом РС, которые принимали кладрибин в дозе 3,5 мг / кг, наблюдалось статистически значимое улучшение по сравнению с пациентами, которые принимали плацебо, по пересчитанной на год частоты рецидивов, доли пациентов без рецидивов в течение 96 недель, доли пациентов без стойкой инвалидизации в течение 96 недель и времени до 3-месячного прогрессирования EDSS (см. таблицу 1).
Таблица 1 Клинические результаты исследования CLARITY (96 недель) | |||
Параметр | Плацебо | Кумулятивная доза кладрибина | |
3,5 мг/кг | 5,25 мг/кг | ||
Перечислена в год частота рецидивов (95% ДИ) | 0,33 (0,29; 0,38) | 0,14 (0,12; 0,17) р <0,001 * | 0,15 (0,12; 0,17) р <0,001 * |
| 57,6 % | 54,5 % | |
Доля пациентов без рецидивов в течение 96 недель | 60,9 % | 79,7 % | 78,9 % |
Время до 3-месячного прогрессирования EDSS, 10-й процентиль (месяцев) | 10,8 | 13,6 | 13,6 |
| 0,67 (0,48; 0,93) p = 0,018* | 0,69 (0,49; 0,96) p = 0,026* | |
ДИ - доверительный интервал * По сравнению с плацебо | |||
Результаты лечения Кладрибин в дозе 3,5 мг / кг статистически значимое преобладали плацебо по количеству и относительного уменьшения T1 Gd + поражений, активных T2 поражений и комбинированных неспецифических поражений на томограмме мозга в течение полных 96 недель исследования. Пациенты, принимавшие кладрибин по сравнению с группой плацебо имели относительное уменьшение на 86% среднего количества поражений T1 Gd + (откорректирована среднее количество для группы кладрибина 3,5 мг / кг и группы плацебо составила 0,12 и 0,91 соответственно), относительное уменьшение на 73% среднего количества активных T2 поражений (откорректирована среднее количество для группы кладрибина 3,5 мг / кг и группы плацебо составляла 0,38 и 1,
Ретроспективный анализ времени до 6-месячного подтвержденного прогрессирования EDSS обнаружил уменьшение на 47% риска прогрессирования инвалидизации в группе, принимавшей кладрибин в дозе 3,5 мг / кг, по сравнению с группой плацебо (коэффициент риска 0,53; 95% ДИ [0, 36; 0,79], p <0,05).
Как показано в таблице 1, выше кумулятивные дозы не предоставляли никаких клинически значимых преимуществ, но были связаны с большей частотой лимфопении степени ≥ 3 (44,9% в группе 5,25 мг / кг по сравнению с 25,6% в группе 3 5 мг / кг).
Пациенты, завершившие участие в исследовании CLARITY, могли быть включены в исследование CLARITY Extension, первичной целью которого была оценка безопасности. В этом расширенном исследовании 806 пациентов принимали либо плацебо, либо кумулятивную дозу кладрибина 3,5 мг / кг (по режиму, подобным тому, который применялся в CLARITY) в течение периода 96 недель.
Эффективность действия препарата по уменьшению частоты рецидивов и замедление прогрессирования инвалидизации у пациентов, принимавших дозу 3,5 мг / кг в течение 2 лет, поддерживалась в годы 3 и 4.
Эффективность лечения пациентов с высокой активностью заболевания
Ретроспективно был проведен анализ эффективности в подгруппах пациентов с высокой активностью заболевания, перорально принимали кладрибин в рекомендованной кумулятивной дозе 3,5 мг / кг. Эти подгруппы включали:
Пациентами с 1 рецидивом в течение предыдущего года и менее 1 поражением T1 Gd + или 9 или более поражениями T2 при терапии другими препаратами, модифицирующими течение заболевания,
Пациентами с 2 или более рецидивами в течение предыдущего года независимо от того, находились ли они на терапии препаратами, модифицирующими течение заболевания или нет.
Анализ данных, полученных в исследовании CLARITY, показал подобное влияние лечения на частоту рецидивов, причем перечислена в год частота рецидивов находилась в диапазоне от 0,16 до 0,18 в группах кладрибина и от 0,47 до 0,50 в группе плацебо (p <0,0001). По сравнению с общей популяцией наблюдался большее влияние лечения на величину периода до 6-месячного стойкой инвалидизации, когда кладрибин уменьшал риск прогрессирования инвалидизации на 82% (коэффициент риска 0,18; 95% ДИ [0,07; 0,47]). Для плацебо 10-й процентиль для прогрессирования инвалидизации был достигнут между 16 и 23 неделями, тогда как в группах кладрибина он не был достигнут в течение всего срока исследования.
Рецидивирующий РС с вторично-прогрессирующим течением
Дополнительное исследование приема кладрибина дополнительно к интерферона бета сравнению с приемом плацебо и интерферона бета также включало ограниченное количество пациентов с вторично-прогрессирующим течением РС (26 пациентов). У этих пациентов лечение Кладрибин в дозе 3,5 мг / кг привело к уменьшению пересчитанной на год частоты рецидивов по сравнению с таковой при применении плацебо (0,03 по сравнению с 0,30, соотношение риска: 0,11; p <0,05) . Между пациентами с рецидивирующее-ремитирующим РС и пациентов с рецидивирующим РС с вторично-прогрессирующим течением не наблюдалось разницы в перечисленной в год частоте рецидивов. В одной из этих подгрупп не было показано влияния препарата на прогрессирование инвалидизации.
Пациенты с вторично-прогрессирующим течением РС были исключены из исследования CLARITY. Однако ретроспективный анализ смешанных групп пациентов по исследованиям CLARITY и ONWARD, определяемых по базовым индексом EDSS ≥ 3,5 как индикатором PC с вторично-прогрессирующим течением, показал подобное уменьшение пересчитанной на год частоты рецидивов по сравнению с пациентами с индексом EDSS менее 3.
Фармакокинетика.
Кладрибин относится к пролекарства и имеет фосфорилюватися внутри клетки для того, чтобы приобрести биологической активности. Фармакокинетика кладрибина исследовалась после приема и введения пациентам с РС и пациентам со злокачественными новообразованиями, а также на системах in vitro .
абсорбция
После приема кладрибин быстро абсорбируется. Прием 10 мг кладрибина приводит к средней Cmax кладрибина в диапазоне от 22 до 29 нг / мл и соответствующего среднего значения AUC в диапазоне от 80 до 101 нг × ч / мл.
При пероральном приеме кладрибина натощак медианное значение Tmax составило 0,5 часа (диапазон от 0,5 до 1,5 часа). При приеме с жирной пищей абсорбция кладрибина происходила с задержкой (медианное значение Tmax 1,5 часа, диапазон от 1 до 3:00) и Cmax уменьшалось на 29%, тогда как значение AUC оставалось неизмененным. Биодоступность пероральной дозы 10 мг кладрибина составляла примерно 40%.
распределение
Кладрибин имеет большой объем распределения, что указывает на его экстенсивный распределение в ткани и внутриклеточное поглощение. В исследованиях было выявлено, что средний объем распределения кладрибина находится в диапазоне от 480 до 490 л. Связывание с белками плазмы составляет 20% и не зависит от концентрации кладрибина в плазме.
Распределение кладрибина через биологические мембраны осуществляется различными транспортными белками, включая ENT1, CNT3 и BCRP.
В исследованиях и n vitro было показано, что ефлюкс кладрибина лишь минимально связан с P-gp, поэтому клинически значимые взаимодействия с ингибиторами P-gp не ожидается.
Исследования и n vitro показали незначительное попадание кладрибина к гепатоцитов человека, опосредованное транспортерами.
Кладрибин имеет потенциал проникать через гематоэнцефалический барьер. Небольшое исследование с участием пациентов, страдающих раком, показало, что соотношение его концентрации в спинномозговой жидкости / плазме составляет примерно 0,25.
Кладрибин и / или его фосфорилированные метаболиты в значительной степени кумулируются и содержатся лимфоцитами человека. В условиях и n vitro было выявлено, что соотношение внутри- и внеклеточного кумуляции составляет примерно от 30 до 40 уже через 1:00 после начала экспозиции.
Метаболизм
Метаболизм кладрибина изучался у пациентов с РС после приема одной таблетки по 10 мг и разового введения дозы 3 мг. После того как приема, так и введения основным компонентом, который был обнаружен в плазме крови и мочи, была исходное соединение кладрибина. Содержание его метаболита 2-хлораденину как в плазме крови, так и мочи был несущественным. В плазме крови и мочи можно было найти только следы других метаболитов кладрибина.
В печеночных системах in vitro наблюдался незначительное метаболизм кладрибина (не менее 90% составлял неизмененный кладрибин).
Кладрибин не является значимым субстратом для ферментов цитохрома Р450 и он не оказывает значительного потенциала как ингибитор CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4. Не ожидается, что ингибирование этих ферментов или генетический полиморфизм (например CYP2D6, CYP2C9 или CYP2C19) приведет к клинически значимого влияния на фармакокинетику или экспозицию кладрибина. Кладрибин не имеет клинически значимого индуктивного влияния на ферменты CYP1A2, CYP2B6 и CYP3A4.
После попадания к клеткам-мишеням кладрибин фосфорилируется с участием DCK (а также при участии дезоксигуанозина-киназы в митохондриях) до кладрибина монофосфата (Cd-AMP), а далее - к кладрибина дифосфата (Cd-ADP) и кладрибина трифосфата (Cd-ATP) . Дефосфорилирование и дезактивация Cd-AMP катализируется цитоплазматической 5'-NTазою. В исследовании внутриклеточной фармакокинетики Cd-AMP и Cd-ATP с участием пациентов с хронической миелогенная лейкемией уровне Cd-ATP составляли примерно половину уровней Cd-AMP.
Внутриклеточный период полувыведения составлял 15 часов для Cd-AMP и 10:00 для Cd-ATP.
вывод
На основании объединенных популяционных фармакокинетических данных, собранных в различных исследованиях, медианные значения вывода составляли 22,2 л / ч для почечного клиренса и 23,4 л / ч для непочечный клиренса. Почечный клиренс превышал скорость клубочковой фильтрации, указывает на активную почечную канальцевую секрецию кладрибина.
Непочечный часть вывода кладрибина (примерно 50%) включает незначительное печеночный метаболизм и экстенсивный внутриклеточный распределение и захват активного производного кладрибина (Cd-ATP) целевым внутриклеточным компартментом (то есть лимфоцитами) с последующим выводом внутриклеточного Cd-ATP согласно жизненным циклом и путями вывода из этих клеток.
По оценке конечный период полувыведения у типичного пациента из популяции, для которой проводилась оценка фармакокинетических параметров, составляет примерно 1 сутки. Однако это не приводит к каким-либо кумуляции лекарственного средства после ежедневного приема дозы, поскольку этот период полувыведения касается лишь небольшой доли AUC.
Зависимость от дозы и времени
После приема кладрибина в дозах от 3 до 20 мг, Cmax и AUC росли в зависимости от дозы, что позволяет предположить, что для пероральных доз до 20 мг на абсорбцию не влияют процессы, которые ограничивают ее скорость или емкость.
После приема повторных доз значительной кумуляции кладрибина в плазме крови не наблюдалось. Нет указаний на то, что фармакокинетика кладрибина после повторного приема может меняться в зависимости от времени.
Отдельные группы пациентов
Оценка фармакокинетики кладрибина у пациентов с РС летнего или детского возраста не проводилась, как и у пациентов с поражением почек или печеночной функции.
Популяционный анализ кинетики не показал никакого влияния возраста (диапазон от 18 до 65 лет) или пола пациента на фармакокинетику кладрибина.
Поражение почек
Было показано, что почечный клиренс кладрибина зависит от клиренса креатинина. На основании анализа популяционной фармакокинетики, который включал данные пациентов с нормальной функцией почек и легким поражением почек, ожидается, что общий клиренс кладрибина у пациентов с легкой поражением почек (CLCR = 60 мл / мин) будет умеренно снижаться, что приведет к росту экспозиции на 25 %.
Поражение функции печени
Роль функции печени в выведении кладрибина считается незначимой.
фармакокинетические взаимодействия
Исследования лекарственных взаимодействий у пациентов с РС показало, что биодоступность 10 мг кладрибина при пероральном приеме не изменяется при одновременном применении с пантопразолом.
Клинические характеристики
Мавенклад Показания
Мавенклад® показан для лечения взрослых пациентов с рецидивирующими формами рассеянного склероза (РС) с высокой активностью заболевания, установленной на основании клинических или визуализирующих исследований.
Противопоказания
- Гиперчувствительность к действующему веществу или к любым вспомогательных веществ препарата
- инфекции с вирусом иммунодефицита человека (ВИЧ)
- активные хронические инфекции (туберкулез или гепатит)
- начало лечения Кладрибин пациентов с ослабленным иммунитетом, включая пациентов, принимающих имуносупресуючу или миелосупресуючу терапию;
- активные злокачественные новообразования
- умеренное или тяжелое поражение почек (клиренс креатинина <60 мл / мин)
- период беременности и кормления грудью.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Мавенклад® содержит гидроксипропилбетадекс, который может образовывать комплексы с другими лекарственными средствами, потенциально приводить к росту биодоступности таких препаратов (особенно лекарственных средств с низкой растворимостью). Поэтому в течение ограниченного количества дней приема кладрибина рекомендуется принимать любые пероральные лекарственные средства по меньшей мере с 3-часовым интервалом до или после приема Мавенкладу®.
Имуносупресуючи лекарственные средства
Пациентам с ослабленным иммунитетом, включая пациентов, проходящих имуносупресуючу или миелосупресуючу терапию, например, метотрексатом, циклофосфамидом, циклоспорином или азатиоприном, или тем, кто постоянно применяет кортикостероиды, противопоказано начинать лечение Кладрибин из-за риска дополнительного воздействия на иммунную систему.
Во время лечения Кладрибин можно назначать интенсивную краткосрочную терапию системными кортикостероидами.
Другие лекарственные средства, модифицирующие течение заболевания
Применение Мавенкладу® с интерфероном бета приводит к росту риска лимфопении. Безопасность и эффективность применения Мавенкладу® в комбинации с другими лекарственными средствами, модифицирующие течение РС не были установлены, и поэтому такое одновременное лечение не рекомендуется.
Гематотоксических лекарственные средства
Поскольку кладрибин индуцирует уменьшение количества лимфоцитов, может ожидаться развитие дополнительных гематологических побочных реакций при приеме кладрибина перед или одновременно с другими веществами, влияющие на гематологический профиль (такими как карбамазепин). В таких случаях рекомендуется тщательный контроль гематологических параметров.
Живые или живые атенуйованих вакцины
Лечение Мавенкладом® не следует начинать в пределах 4 - 6 недель после вакцинации живыми или живыми атенуйованих вакцинами из-за риска острого инфицирования вакциной. Во время и после лечения Кладрибин следует избегать вакцинации живыми или живыми атенуйованих вакцинами, пока количество лимфоцитов у пациента не вернется в пределы нормы.
Сильные ингибиторы транспортеров ENT1, CNT3 и BCRP
На уровне абсорбции кладрибина единственным вероятным источником взаимодействий, имеет клиническое значение, является белок резистентности рака молочной железы (BCRP или ABCG2). Ингибирования BCRP в желудочно-кишечном тракте может увеличивать перорально биодоступность и системное действие кладрибина. Известны ингибиторы BCRP, которые in vivo могут изменять фармакокинетику субстратов BCRP на 20% , включают ельтромбопаг.
Исследования in vitro указывают на то, что кладрибин является субстратом равновесного нуклеозидного (ENT1) и концентрирующего нуклеозидного (CNT3) транспортных белков. Соответственно, на биодоступность, внутриклеточный распределение и почечный клиренс кладрибина теоретически могут влиять сильные ингибиторы транспортеров ENT1, CNT3 и BCRP, такие как дилазеп, нифедипин, нимодипин, цилостазол, сулиндак и резерпин. Однако итоговый влияние, выражающееся в изменении потенциальной действия кладрибина, трудно предсказать.
Хотя клиническое значение таких взаимодействий неизвестно, во время 4- или 5-дневного лечения Кладрибин рекомендуется избегать одновременного приема сильных ингибиторов ENT1, CNT3 и BCRP. Если это невозможно, следует рассмотреть подбор альтернативных лекарственных средств для одновременного применения, которые не имеют или имеют минимальные ингибирующие свойства в отношении транспортеров ENT1, CNT3 и BCRP. Если это невозможно, рекомендуется уменьшить дозу лекарственных средств, содержащих такие соединения, в минимальной обязательной дозы, разделить прием препаратов во времени и тщательно контролировать состояние пациента.
Сильные индукторы транспортеров BCRP и P-gp
Влияние сильных индукторов ефлюксних транспортеров BCRP и P-гликопротеина (P-gp) на биодоступность и распределение кладрибина в специальных исследованиях не изучалось. При одновременном приеме сильных индукторов транспортеров BCRP (например кортикостероидов) или P-gp (например рифампицина, зверобоя продырявленного) следует учитывать возможное ослабление действия кладрибина.
гормональные контрацептивы
На сегодня неизвестно, может ли кладрибин уменьшать эффективность гормональных контрацептивов системного действия. Поэтому женщины, которые применяют гормональные контрацептивы системного действия, должны добавлять барьерные средства контрацепции во время лечения Кладрибин и в течение не менее 4 недель после приема последней дозы в каждый год лечения (см. Раздел «Применение в период беременности или кормления грудью»).
Особенности применения
гематологический мониторинг
Механизм действия кладрибина тесно связан с уменьшением количества лимфоцитов. Влияние на количество лимфоцитов является дозозависимым. В клинических исследованиях также наблюдалось уменьшение количества нейтрофилов, количества эритроцитов, гематокрита, гемоглобина и количества тромбоцитов по сравнению с базовыми значениями, хотя эти параметры обычно оставались в пределах нормы.
При приеме кладрибина перед или одновременно с другими веществами, которые влияют на гематологический профиль, можно ожидать развития дополнительных побочных реакций.
Количество лимфоцитов необходимо определять:
· Перед началом приема Мавенкладу® в год 1,
· Перед началом приема Мавенкладу® в год 2,
· Через 2 и 6 месяцев после начала лечения в каждом году лечения; если количество лимфоцитов ниже 500 клеток / мм, этот параметр следует активно контролировать до тех пор, пока значение не увеличится снова.
О принятии решения относительно лечения на основании количества лимфоцитов см. раздел «Способ применения и дозы» и подраздел «Инфекции» ниже.
инфекции
Кладрибин может ослаблять иммунную защиту организма, тем самым увеличивая вероятность инфекций. Инфекция ВИЧ, активный туберкулез и активный гепатит должны быть исключены до начала лечения Кладрибин (см. Раздел «Противопоказания»).
Во время лечения могут активироваться латентные инфекции, включая туберкулез или гепатит. Поэтому перед началом терапии в год 1 и год 2 необходимо провести проверку наличия латентных инфекций, в частности туберкулеза и гепатитов В и С. Начало лечения Мавенкладом® необходимо отложить до адекватного излечения инфекций.
У пациентов с острыми инфекциями также следует учесть возможность отсрочки начала лечения Кладрибин до тех пор, пока инфекции не будут полностью контролируемыми.
Особое внимание рекомендуется уделять пациентам, у которых нет истории контакта с вирусом ветряной оспы. Перед началом терапии Кладрибин рекомендуется провести вакцинацию пациентов с отсутствующими антителами к ветряной оспы. В таком случае начало лечения Мавенкладом® следует отложить на 4 - 6 недель, чтобы достичь полного эффекта от вакцинации.
У пациентов, принимавших кладрибин, росла частота случаев опоясывающего герпеса. Если количество лимфоцитов падает ниже 200 клеток / мм, при лимфопении 4 степени следует учесть проведения противогерпесный профилактики в соответствии с местными стандартными протоколами.
У пациентов с количеством лимфоцитов ниже 500 клеток / мм следует проводить активный мониторинг признаков и симптомов, позволяющих предположить наличие инфекции, в частности опоясывающего герпеса. Если такие признаки и симптомы наблюдаются, следует начать лечение инфекции по клиническим показаниям. Можно рассмотреть целесообразность прерывания или отсрочки лечения Мавенкладом® в надлежащее излечение инфекции.
Сообщалось о случаях прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) при применении парентеральных препаратов кладрибина у пациентов, лечили волосатоклеточный лейкоз по различным схемам лечения.
В базе данных клинических исследований применения кладрибина при РС (1976 пациентов, 8650 пациенто-лет) сообщение о ПМЛ отсутствуют. Однако перед началом лечения Мавенкладом® (обычно в пределах 3 месяцев) следует провести базовое МРТ-исследования.
злокачественные новообразования
В клинических исследованиях случаи злокачественных новообразований наблюдались чаще у пациентов, принимавших кладрибин по сравнению с пациентами, которые принимали плацебо.
Мавенклад® противопоказан пациентам с РС, имеющие активные злокачественные новообразования (см. Раздел «Противопоказания»). У пациентов с предварительным злокачественными новообразованиями перед началом лечения следует провести индивидуальную оценку преимуществ ты рисков применения Мавенкладу®. Пациентам, принимающим Мавенклад®, следует посоветовать выполнять стандартные рекомендации по обследований раком.
контрацепция
Перед началом лечения в год 1 и год 2 женщин репродуктивного возраста и мужчин, которые могут стать родителями, следует проинформировать о потенциальном серьезный риск для плода и необходимость принятия эффективных мер по контрацепции.
Женщины репродуктивного возраста должны предотвращать наступление беременности, применяя эффективные средства контрацепции во время лечения Кладрибин и по меньшей мере в течение 6 месяцев после приема последней дозы.
Пациенты-мужчины должны принимать меры для предотвращения беременности своей партнерши во время лечения Кладрибин и по меньшей мере в течение 6 месяцев после приема последней дозы.
Переливание крови
Для пациентов, которые нуждаются в переливании крови, рекомендуется проводить лучевую обработку клеточных компонентов крови перед введением для предотвращения связанных с переливанием заболеваний «трансплантат против хозяина». Рекомендуется проконсультироваться с врачом-гематологом.
Переход на и по лечению Кладрибин
Перед началом применения Мавенкладу® для пациентов, ранее принимавших иммуномодулирующие или имуносупресуючи лекарственные средства, следует учесть механизм действия и длительность эффекта этих препаратов. Потенциальный дополнительное влияние на иммунную систему также следует учитывать, если такие лекарственные средства применяются после лечения Мавенкладом®.
При переходе с другого лекарственного средства для лечения РС рекомендуется провести базовое МРТ-сканирования (см. Раздел «Инфекции» выше).
поражение печени
Хотя важность функции печени для вывода кладрибина считается незначимой, из-за отсутствия данных применение Мавенкладу® не рекомендуется пациентам с умеренным или тяжелым поражением печени (индекс Чайлд-Пью> 6).
непереносимость фруктозы
Мавенклад® содержит сорбит. Пациентам с наследственными проблемами с переносимостью фруктозы не следует принимать этот препарат.
Применение в период беременности или кормления грудью
Контрацепция у мужчин и женщин
Перед началом лечения в год 1 и год 2 женщин репродуктивного возраста и мужчин, которые могут стать родителями, следует проинформировать о потенциальном серьезный риск для плода и необходимость принятия эффективных мер по контрацепции.
У женщин репродуктивного возраста перед началом лечения Мавенкладом® в годы 1 и 2 нужно исключить беременность, а наступлению беременности следует избегать, применяя эффективные средства контрацепции во время лечения Кладрибин и в течение не менее 6 месяцев после приема последней дозы. Женщины, которые применяют гормональные контрацептивы системного действия, должны добавлять барьерные средства контрацепции во время лечения Кладрибин и в течение не менее 4 недель после приема последней дозы в каждый год лечения. Женщины, которые забеременели во время лечения Мавенкладом®, должны прекратить терапию.
Поскольку кладрибин влияет на синтез ДНК, следует ожидать его негативного влияния на гаметогенез человека. Поэтому пациенты-мужчины должны принимать меры, чтобы предотвратить наступление беременности у своей партнерши во время лечения Кладрибин и в течение не менее 6 месяцев после приема последней дозы.
беременность
Учитывая опыт применения других веществ, ингибирующих синтез ДНК у человека, кладрибин может вызывать врожденные пороки развития плода в случае приема в период беременности. В исследованиях на животных было показано репродуктивная токсичность кладрибина.
Мавенклад® противопоказан беременным женщинам (см. Раздел «Противопоказания»).
кормление грудью
Неизвестно, выделяется кладрибин в грудное молоко. Через потенциальные серьезные побочные реакции у младенцев, находящихся на грудном вскармливании, кормление грудью противопоказано при лечении Мавенкладом® и в течение 1 недели после приема последней дозы (см. Раздел «Противопоказания»).
фертильность
У мышей не наблюдалось влияния кладрибина на фертильность или репродуктивную функцию потомства, однако у мышей и обезьян наблюдалось влияние на Тестикулярная функцию.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Мавенклад® не влияет или почти не влияет на способность пациентов управлять автомобилем и работать с механизмами.
Способ применения Мавенклад и дозы
Лечение Мавенкладом® должно начинаться и проводиться под наблюдением врача, имеющего опыт лечения РС.
дозы
Рекомендуемая кумулятивная доза Мавенкладу® составляет 3,5 мг / кг массы тела в течение 2 лет и назначается в виде 1 курса лечения дозой 1,75 мг / кг ежегодно. Каждый курс лечения состоит из 2 недель лечения, один - в начале первого месяца, а другой - в начале второго месяца соответствующего года лечения. Каждый лечебный неделя состоит из 4 или 5 дней, в которые пациент принимает 10 мг или 20 мг (одну или две таблетки) в виде разовой суточной дозы в зависимости от массы тела. Дальнейшую информацию приведен в таблицах 2 и 3.
После завершения 2 курсов лечения дальнейшего лечения Кладрибин в годы 3 и 4 не требуется. Повторный начало лечения через 4 года не изучался.
Критерии для начала и продолжения терапии
Количество лимфоцитов должна быть:
· Нормальной перед началом приема Мавенкладу® в год 1,
- не менее 800 клеток / мм перед началом приема Мавенкладу® в год 2.
В случае необходимости для восстановления количества лимфоцитов курс лечения в год 2 может быть отсрочено до 6 месяцев. Если такое восстановление требует более 6 месяцев, пациент больше никогда не может принимать Мавенклад®.
распределение дозы
Распределение общей дозы в течение 2 лет лечения приведены в таблице 2. Для некоторых пациентов, несмотря на массу тела, количество таблеток может быть различной в первый и второй лечебные недели. Применение пероральных форм кладрибина пациентов с массой тела менее 40 кг не изучалось.
Таблица 2 Доза Мавенкладу® в зависимости от массы тела пациента в лечебное неделю каждый год лечения
Диапазон массы тела, кг | Доза в мг (количество таблеток по 10 мг) в лечебный неделю | |
Лечебный неделя 1 | Лечебный неделю 2 | |
от 40 до <50 | 40 мг (4 таблетки) | 40 мг (4 таблетки) |
от 50 до <60 | 50 мг (5 таблеток) | 50 мг (5 таблеток) |
от 60 до <70 | 60 мг (6 таблеток) | 60 мг (6 таблеток) |
от 70 до <80 | 70 мг (7 таблеток) | 70 мг (7 таблеток) |
от 80 до <90 | 80 мг (8 таблеток) | 70 мг (7 таблеток) |
от 90 до <100 | 90 мг (9 таблеток) | 80 мг (8 таблеток) |
от 100 до <110 | 100 мг (10 таблеток) | 90 мг (9 таблеток) |
от 110 и больше | 100 мг (10 таблеток) | 100 мг (10 таблеток) |
В таблице 3 показано, как общее количество таблеток в неделю лечения распределить по отдельным дням. Рекомендуется каждую дозу кладрибина в каждом лечебном недели принимать с интервалами 24 часа, примерно в одно и то же время дня. Если суточная доза составляет две таблетки, обе таблетки принимают вместе как одну дозу.
Таблица 3 Распределение таблеток Мавенкладу® по 10 мг по дням недели | |||||
Общее количество таблеток в неделю | День 1 | День 2 | День 3 | День 4 | День 5 |
4 | 1 | 1 | 1 | 1 | 0 |
5 | 1 | 1 | 1 | 1 | 1 |
6 | 2 | 1 | 1 | 1 | 1 |
7 | 2 | 2 | 1 | 1 | 1 |
8 | 2 | 2 | 2 | 1 | 1 |
9 | 2 | 2 | 2 | 2 | 1 |
10 | 2 | 2 | 2 | 2 | 2 |
Пропущенную дозу необходимо принять как можно скорее после выяснения пропуска в тот же день согласно режиму лечения.
Пропущенную дозу нельзя принимать вместе с последующей дозой по схеме лечения на следующий день. В случае пропущенной дозы пациент должен принять ее на следующий день и увеличить количество дней лечения в это лечебное неделю. Если пропущено две последовательные дозы, применяется такой же подход и количество дней в лечебном недели увеличивается на два дня.
Одновременное применение других пероральных лекарственных средств
В течение ограниченного количества дней приема кладрибина рекомендуется отделять прием любых других пероральных лекарственных средств от приема Мавенкладу® минимум на 3:00.
Отдельные группы пациентов
Пациенты с поражением почек
Специальных исследований у пациентов с поражением почек не проводилось.
Для пациентов с легким поражением почек (клиренс креатинина от 60 до 89 мл / мин) коррекции дозы не считается нужным.
Безопасность и эффективность применения кладрибина пациентов с умеренным или тяжелым поражением почек не изучались. Поэтому Мавенклад® противопоказан таким пациентам (см. Раздел «Противопоказания»).
Пациенты с поражением печени
Исследований у пациентов с поражением печени не проводилось.
Хотя важность функции печени в выведении кладрибина считается незначимой, из-за отсутствия данных применение Мавенкладу® не рекомендуется пациентам с умеренным или тяжелым поражением печени (индекс Чайлд-Пью> 6).
Пациенты пожилого возраста
Клинические исследования перорального применения кладрибина при РС не включали пациентов старше 65 лет, поэтому неизвестно, будут ли они отвечать на лечение иначе, чем молодые пациенты.
Пациентам пожилого возраста Мавенклад® рекомендуется применять с осторожностью, учитывая потенциально большую частоту случаев снижения печеночной или почечной функции, сопутствующие заболевания и другие виды терапии, проводятся.
способ применения
Мавенклад® предназначен для перорального применения. Таблетки следует принимать с водой и глотать не разжевывая. Таблетки можно принимать независимо от приема пищи.
Поскольку таблетки не покрытые оболочкой, их нужно глотать немедленно после извлечения из блистера, не оставлять на поверхности и не держать в руках дольше, чем это нужно для приема дозы. Если таблетка оставалась на поверхности или если разломанную или раскрошенных таблетку вынули из блистера, следует тщательно вымыть водой поверхность контакта с таблеткой.
Пациент должен принимать таблетки сухими руками, после чего руки следует тщательно вымыть.
Инструкция для самостоятельного приема пациентом таблеток Мавенклад®
- Приготовьте стакан с водой и убедитесь, что у Вас сухие и чистые руки.
- Возьмите коробку с препаратом, повернув ее к себе стороной, на которой напечатаны инструкции.
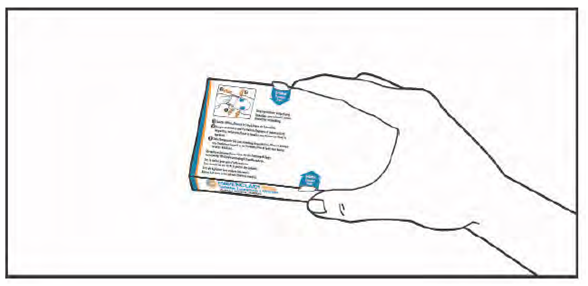
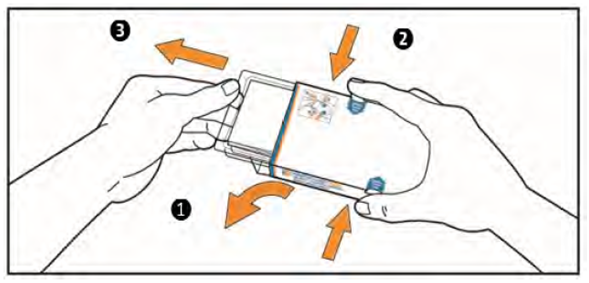
3. (1) Откройте клапан с левой стороны коробки.
(2) Одновременно нажмите на крючки на коробке с обеих сторон указательным и большим пальцами и держите их в таком положении.
(3) Потяните контурной ячейковой упаковке, пока она движется. ВНИМАНИЕ: не отключайте контурной ячейковой упаковке из коробки.
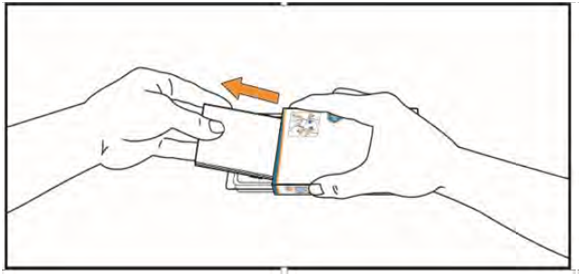
4. Извлеките из коробки инструкцию по применению. Убедитесь, что Вы внимательно ознакомились с ее содержанием, в том числе инструкции для самостоятельного приема таблеток.
5. приподнимите блистер, нажимая пальцами на отверстие в контурной ячейковой упаковке. Поместите руку под блистер и выдавите в руку 1 или 2 таблетки, как Вам назначил врач.
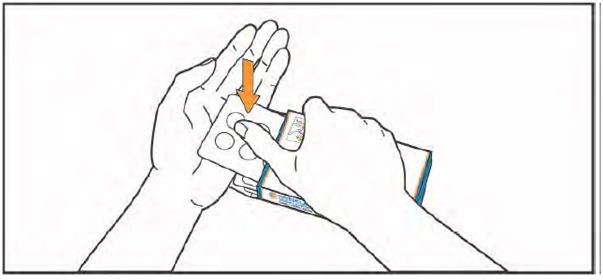
6. Примите таблетки, запивая их водой. Таблетки глотать целиком, не разжевывая и не позволяя им раствориться во рту. Контакт таблеток с кожей должен быть ограничен. Не прикасайтесь руками носа, глаз и других частей тела.
7. После приема таблеток тщательно вымойте руки водой с мылом.
8. Вложите контурной ячейковой упаковке в коробку. Храните ее в оригинальной упаковке для защиты от влаги.
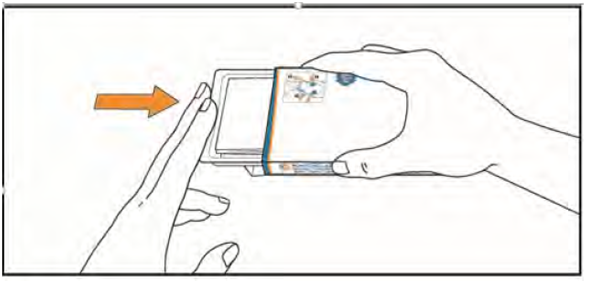
К приему следующей дозы храните таблетки в блистере. Не выдавливайте таблетки из блистера и не храните их в другом контейнере.
Дети
Безопасность и эффективность применения Мавенкладу® пациентами в возрасте до 18 лет не были установлены. Соответствующие данные отсутствуют.
Передозировка
Существует ограниченный опыт передозировки кладрибина при пероральном приеме. Известно, что лимфопения, которая развивается вследствие этого, является дозозависимым.
У пациентов с передозировкой кладрибина рекомендуется проведение особо тщательного мониторинга гематологических параметров.
Специфический антидот к кладрибина неизвестен. Лечение заключается в тщательном наблюдении за состоянием пациента и проведении соответствующих поддерживающих мероприятий. Следует учесть возможную необходимость отмены Мавенкладу®. Из-за быстрого и экстенсивный внутриклеточный и тканевый распределение, маловероятно, что кладрибин будет в значительной степени выводиться при проведении гемодиализа.
Побочные эффекты
Краткое описание профиля безопасности
Большинство клинически значимых побочных реакций, о которых сообщалось у пациентов с РС, принимавших кладрибин в рекомендованной кумулятивной дозе 3,5 мг / кг в течение 2 лет в клинических исследованиях, были представлены лимфопенией и опоясывающий герпесом. Частота случаев опоясывающего герпеса была выше в течение периода, когда наблюдалась лимфопения 3 или 4 степени (от <500 до 200 клеток / мм или <200 клеток / мм) по сравнению с тем, когда у пациентов не было лимфопении степени 3 или 4.
Перечень побочных реакций
Информация о побочных реакциях, описанные ниже, полученная на основании объединенных данных клинических исследований лечения РС пероральным препаратом кладрибина в качестве монотерапии в кумулятивной дозе 3,5 мг / кг. База данных безопасности этих исследований включает данные 923 пациентов.
Для определения частоты побочных реакций используют такую терминологию: очень часто (≥ 1/10), часто (от ≥ 1/100 до <1/10), нечасто (от ≥ 1/1000 до <1/100), редкие (от ≥ 1/10000 до <1/1000), редкие (<1/10000), частота неизвестна (не может быть установлена на основании имеющихся данных).
Инфекции и инвазии
Часто: оральный герпес, дерматомний опоясывающий герпес.
Редкие: туберкулез.
Со стороны крови и лимфатической системы
Очень распространены: лимфопения.
Распространены: уменьшение количества нейтрофилов.
Со стороны кожи и подкожной ткани
Часто: висипанння, алопеция.
Описание отдельных побочных реакций
лимфопения
В клинических исследованиях временная лимфопения 3 или 4 степени развилась у 20 - 25% пациентов, принимавших кумулятивную дозу кладрибина 3,5 мг / кг в течение 2 лет в качестве монотерапии. Лимфопения 4 степени наблюдалась менее чем у 1% пациентов. Наибольшая доля пациентов с лимфопенией 3 или 4 степени наблюдалась через 2 месяца после приема первой дозы кладрибина ежегодно (4,0% и 11,3% пациентов с лимфопенией 3 степени в год 1 и год 2 0% и 0,4% пациентов с лимфопенией 4 степени в год 1 и год 2). Ожидается, что у большинства пациентов количество лимфоцитов восстановится к нормальной или лимфопении 1 степени в течение 9 месяцев.
Для уменьшения риска развития тяжелой лимфопении количество лимфоцитов необходимо определять перед, в течение и после лечения Кладрибин, а также придерживаться строгих критериев для начала и продолжения лечения Кладрибин.
злокачественные новообразования
В клинических исследованиях и в течение длительного периода последующего наблюдения пациентов, принимавших кумулятивную дозу кладрибина 3,5 мг / кг перорально, у пациентов, лечившихся Кладрибин, явления злокачественных новообразований наблюдались чаще (10 случаев на 3414 пациенто-лет [0,29 случаев на 100 пациенто-лет]) по сравнению с пациентами, которые принимали плацебо (3 случая на 2022 пациенто-лет [0,15 случаев на 100 пациенто-лет]).
Срок годности Мавенклад
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения Мавенклад
Хранить в оригинальной упаковке для защиты от влаги.
Хранить в недоступном для детей месте.
Упаковка
По 1, 4 или 6 таблеток в алюминиевом блистере, запечатанном в картонную обложку, которую помещают в контурной ячейковой упаковке и вкладывают в картонную коробку с защитой от детей.
Категория отпуска
По рецепту.
Производитель
НерФарМа С.Р.Л. / NerPharMa S.R.L.
Местонахождение производителя
Виале Пастер 10 (р-н Нервиано), 20014 Милан (МИ), Италия /
Viale Pasteur 10 (расположение Nerviano), 20014 Милан (Мичиган), Италия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Мавенклад только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- НерФарМа С.Р.Л.
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Мавенклад |
| Производитель: | НерФарМа С.Р.Л. |
| Форма выпуска: | таблетки по 10 мг по 1, 4 или 6 таблеток в алюминиевом блистере, запечатанном в картонную обложку, которую помещают в контурной ячейковой упаковке и вкладывают в картонную коробку |
| Регистрационное удостоверение: | UA/17515/01/01 |
| Дата начала: | 17.07.2019 |
| Дата окончания: | 17.07.2024 |
| МНН: | Cladribine |
| Условия отпуска: | по рецепту |
| Состав: | 1 таблетка содержит 10 мг кладрибина |
| Фармакологическая группа: | Селективные иммунодепрессанты. Кладрибин. |
| Код АТХ: | L04AA40 |
| Заявитель: | Арес Трейдинг С.А. |
| Страна заявителя: | Швейцария |
| Адрес заявителя: | Зон Индустриель где ЛьУрьетаз, 1170 Обонн, Швейцария |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L04 | Иммунодепрессанты |
| L04A | Иммунодепрессанты |
| L04AA | Селективные иммунодепрессанты |
| L04AA40 | Кладрибин |
