- Состав
- Лекарственная форма
- Фармакологическая группа
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Взаимодействие
- Особенности применения
- Период беременности
- Управление автомобилем
- Способ применения и дозы
- Дети
- Передозировка
- Побочные эффекты
- Срок годности
- Условия хранения
- Упаковка
- Категория отпуска
- Производитель
- Местонахождение производителя
Кабаз Спал инструкция по применению
Официальная инструкция лекарственного препарата Кабаз Спал концентрат 60 мг. Описание и применение Kabaz Spal, аналоги и отзывы. Инструкция Кабаз Спал концентрат утвержденная компанией производителем.
Состав
действующее вещество: кабазитаксел;
1 флакон концентрата (1,5 мл) содержит 60 мг кабазитаксела;
Вспомогательные вещества: лимонная кислота, полисорбат 80.
1 флакон растворителя (4,5 мл) содержит этанол 96%, вода для инъекций .
Лекарственная форма
Концентрат для приготовления раствора для инфузий.
Основные физико-химические свойства:
концентрат прозрачный маслянистый раствор от желтого до коричневато-желтого цвета.
растворитель прозрачный бесцветный раствор.
Фармакологическая группа
Антинеопластические средства.
Код АТХ L01C D04.
Фармакологические свойства
Фармакологические.
Механизм действия. Кабазитаксел - противоопухолевое средство, действующий через разрушение системы микротрубочек в клетках. Кабазитаксел связывается с тубулином и способствует агрегации тубулина в микротрубочках, одновременно подавляя их дезагрегацию. Это приводит к стабилизации микротрубочек, результатом которой является торможение клеточных функций митоза и интерфазы.
Фармакодинамическая эффект. Кабазитаксел показал широкий спектр противоопухолевой активности по пересаженных мышам человеческих опухолей поздних стадий, включая человеческую глиобластому. Кабазитаксел активен в случае чувствительных к доцетаксела опухолей. Кроме того, кабазитаксел продемонстрировал активность в отношении моделей опухолей, нечувствительных к химиотерапии, включая доцетаксел.
Фармакокинетика.
Фармакокинетический анализ популяции проводили с участием 170 пациентов, включая пациентов с поздними стадиями солидных опухолей (n = 69), метастатическим раком молочной железы (n = 34) и метастатическим раком предстательной железы (n = 67). Эти пациенты получали кабазитаксел в дозе от 10 до 30 мг / м2 1 раз в неделю или 1 раз в 3 недели.
Абсорбция. После введения в течение 1:00 25 мг / м2 кабазитаксела у пациентов с гормонорезистентными метастатическим раком предстательной железы (n = 67) Cmax составляла 226 нг / мл (коэффициент вариаций (КВ): 107%) и достигалась в конце одночасовой инфузии (Tmax). Средняя AUC составляла 991 нг × ч / мл (КВ: 34%).
Значительных отклонений от пропорциональности доз при диапазоне дозирования от 10 до 30 мг / м2 у пациентов с поздними стадиями солидных опухолей (n = 126) не наблюдалось.
Распределение. Объем распределения (Vss) составлял 4870 л (2640 л / м2 для пациентов с медианным значением площади поверхности тела 1,84 м2) в стабильном состоянии.
In vitro связывание кабазитаксела с белками человеческой сыворотки крови составляло 89-92% и не было насыщаемая к концентрации 50000 нг / мл, которая охватывает максимальную концентрацию, зафиксированную в ходе клинических исследований. Кабазитаксел связывается преимущественно с альбумином человеческой сыворотки крови (82%) и липопротеидов (87,9% для ЛПВП, 69,8% для ЛПНП и 55,8% для ЛПОНП). In vitro соотношение концентраций в крови и плазме в человеческой крови колебалось от 0,9 до 0,99, указывая, что кабазитаксел был равномерно распределен между кровью и плазмой.
Метаболизм. Кабазитаксел интенсивно метаболизируется в печени (> 95%), преимущественно с участием фермента CYO3A4 (от 80% до 90%). Кабазитаксел является основной циркулирующей соединением в человеческой плазме. В плазме было выявлено 7 метаболитов (включая 3 активных метаболита, полученные в результате О-деметилирования), из которых один основной составляет 5% введенной исходного вещества. Около 20 метаболитов кабазитаксела выводятся с мочой и калом.
Исходя из данных in vitro исследований, кабазитаксел в клинически значимых концентрациях потенциально может оказать угнетающее действие на лекарственные средства, которые в основном являются субстратами CYP3A4. При этом отсутствует потенциальный риск угнетения лекарственных средств, которые являются субстратами других ферментов CYP (1A2, 2B6, 2C9, 2C8, 2C19, 2E1 и 2D6), так же, как и потенциальный риск индукции кабазитаксел препаратов, являющихся субстратами CYP1A, CYP2C9 и CYP3A . Кабазитаксел НЕ ингибировал in vitro большинство путей биотрансформации варфарина в 7-гидроксиварфарин, которая происходит с участием CYP2C9. Таким образом, ожидается фармакокинетического взаимодействия между кабазитаксел и варфарином in vivo. На кабазитаксел могут влиять мощные индукторы или ингибиторы CYP3A, поскольку кабазитаксел метаболизируется с участием CYP3A. Преднизон или преднизолон, которые вводили по 10 мг 1 раз в сутки, не влияли на фармакокинетику кабазитаксела.
In vitro кабазитаксел не подавлял белки мультимедикаментознои резистентности (MRP [Multidrug-Resistent Protein]): MRP1 и MRP2.
Кабазитаксел подавлял транспортировки Р-гликопротеина (PgP) (дигоксин, винбластин) и белки резистентности рака молочной железы (BRCP [Breast-Cancer-Resistant-Proteins]) в концентрациях, по крайней мере в 38 раз превышали те, что наблюдались в клинических условиях. Таким образом, риск взаимодействия с субстратами MRP, PgP и BCRP in vivo при дозе 25 мг / м2 маловероятно.
In vitro кабазитаксел НЕ ингибировал белки лекарственной полирезистентности (Multidrag-Resistant Proteins - MRP) MRP1 и MRP2 или транспортер органических катионов (Organic Cation Transporter - OCT1). Кабазитаксел вызывал ингибирование транспорта Р-гликопротеина (PgP) (дигоксин, винбластин), белков резистентности рака молочной железы (Breast Cancer Resistant Proteins - BCRP) (метотрексат) и полипептида-транспортера органических анионов ОАТР1В3 (ССК8) при применении препарата в концентрациях, не меньше чем в 15 раз превышали те, что используются в клинических условиях; в то же время препарат ингибировал транспортировки ОАТР1В1 (эстрадиол-17β-глюкуронид) при применении в концентрациях, только в 5 раз превышали использованы в клинических условиях. Таким образом, риск in vivoвзаимодействия с субстратами MRP, OCT1, PgP, BCRP и OATP1B3 маловероятно при применении препарата в дозе 25 мг / м3. Риск взаимодействия с транспортным белком ОАТР1В1 возможен, особенно во время инфузии (продолжительностью 1:00) и в течение 20 минут после окончания инфузии (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Вывод. После одночасовой инфузии 25 мг / м2 [14C] -кабазитакселу около 80% введенной дозы выводилось в течение 2 недель. Кабазитаксел выводится преимущественно с калом в виде многочисленных метаболитов (76% дозы) при этом выведение почками кабазитаксела и метаболитов составляет менее 4% дозы (2,3% неизмененного лекарственного средства в моче).
Кабазитаксела свойственен высокий плазменный клиренс, что составляет 48,5 л / ч (26,4 л / ч / м2 для пациентов с медианой площади поверхности тела 1,84 м2), и долгое конечный период полувыведения, который составляет 95 часов.
Особые популяции.
Пожилой возраст. В популяции фармакокинетического анализа в 70 пациентов в возрасте от 65 лет (57 пациентов в возрасте от 65 до 75 лет и 13 пациентов старше 75 лет) не выявлено влияния возраста на фармакокинетику кабазитаксела.
Дети. Безопасность и эффективность препарата у детей и подростков (в возрасте до 18 лет) не установлены.
Печеночная недостаточность. Кабазитаксел выводится из организма преимущественно за счет метаболизма в печени.
Специальное исследование, в котором приняли участие 43 онкопациентов с печеночной дисфункцией, продемонстрировало отсутствие влияния легкой (общее содержание билирубина от> 1 до ≤1,5 × ВГН или уровень АСТ> 1,5 × ВГН) или умеренной (общее содержание билирубина от> 1 , 5 до ≤3,0 × ВМН) печеночной дисфункции на фармакокинетику кабазитаксела. Максимальная переносимая доза (МПД) препарата при этом составляла 20 и 15 мг / м2 соответственно.
У трех пациентов с тяжелой печеночной дисфункцией (общее содержание билирубина> 3 ВГН) наблюдалось снижение клиренса препарата на 39% по сравнению с пациентами с легкой печеночной дисфункцией, свидетельствует о некотором влиянии тяжелой печеночной дисфункции на фармакокинетику кабазитаксела. МПД кабазитаксела у пациентов с тяжелой печеночной дисфункцией не установлена.
Учитывая данные по безопасности и переносимости у пациентов с легкой печеночной дисфункцией дозу кабазитаксела следует уменьшать (см. Разделы «Способ применения и дозы» и «Особенности применения»). Препарат противопоказан для пациентов с тяжелой печеночной дисфункцией (см. Раздел «Противопоказания»).
Почечная недостаточность. Кабазитаксел минимально выводится через почки (2,3% от введенной дозы). Популяционный фармакокинетический анализ, который был проведен среди 170 пациентов, в том числе 14 пациентов с умеренным нарушением функции почек (клиренс креатинина в пределах от 30 до 50 мл / мин) и 59 пациентов с легким нарушением функции почек (клиренс креатинина в пределах от 50 до 80 мл / мин), показал, что легкое и умеренное нарушение функции почек не мало значимого влияния на фармакокинетику кабазитаксела. Это было подтверждено специальным сравнительным фармакокинетическим исследованиям с участием пациентов с солидными злокачественными опухолями, у которых наблюдалась нормальная функция почек (8 пациентов), умеренная почечная дисфункция (8 пациентов) и тяжелая почечная дисфункция (9 пациентов) и которые получили несколько циклов кабазитаксела в виде разовых внутривенных инфузий в дозе до 25 мг / м2.
Оценка риска для окружающей среды. Результаты исследований по оценке риска для окружающей среды показали, что применение кабазитаксела не вызывает значительного риска для водной среды (см. Раздел «Особенности применения», где приведена информация по утилизации неиспользованного препарата).
Клинические характеристики
Кабаз Спал Показания
В сочетании с преднизоном или преднизолоном показан для лечения пациентов с гормонорезистентными метастатическим раком предстательной железы, ранее получавших лечение по схеме с использованием доцетаксела.
Противопоказания
Реакции гиперчувствительности к кабазитаксела и в других таксанов, любой из вспомогательных веществ или других лекарственных средств с содержанием полисорбата 80 в анамнезе.
- Количество нейтрофилов менее 1500 / мм 3.
- Тяжелая печеночная недостаточность (общее содержание билирубина> 3 × ВМН).
- Одновременное прививки вакциной против желтой лихорадки (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследованиях in vitro показали, что кабазитаксел метаболизируется с участием CYP3A (от 80% до 90%) и является ингибитором CYP3A.
Ингибиторы CYP3A. Повторное одновременное применение кабазитаксела с кетоконазолом (дозировка последнего - 400 мг в сутки), который является мощным ингибитором CYP3A, приводит к снижению клиренса кабазитаксела на 20% и, соответственно, повышает на 17% AUC. Одновременное применение препарата с мощными ингибиторами CYP3A (например кетоконазол, итраконазол, кларитромицин, индинавиром, нефазодоном, нельфинавиром, ритонавиром, саквинавиром, телитромицином, вориконазолом) приведет к повышению концентрации кабазитаксела. Таким образом, нужно избегать одновременного назначения кабазитаксела с мощными ингибиторами CYP3A. Следует с осторожностью назначать кабазитаксел одновременно с ингибиторами CYP3A умеренной силы (см. Раздел «Фармакологические свойства»).
Одновременное применение препарата с апрепитатом, умеренным ингибитором CYP3A, не влияет на клиренс кабазитаксела.
Индукторы CYP3A. Повторное одновременное применение кабазитаксела рифампицин (дозировка последнего - 600 мг в сутки), который является мощным индуктором CYP3A, приводит к повышению клиренса кабазитаксела на 21% и, соответственно, снижает на 17% AUC. Одновременное применение препарата с мощными индукторами CYP3A (например фенитоином, карбамазепином, рифампином, рифабутином, рифапентин, фенобарбиталом) приведет к снижению концентрации кабазитаксела. Таким образом, нужно избегать одновременного назначения кабазитаксела с мощными индукторами CYP3A (см. Раздел «Фармакологические свойства»). Кроме того, пациентам также нужно воздержаться от приема препаратов зверобоя продырявленного.
ОАТР1В1. Было также доказано, что in vitro кабазитаксел ингибирует транспортные белки - органические анионные транспортные полипептиды ОАТР1В1. Существует риск взаимодействия с субстратами ОАТР1В1 (например со статинами, вальзартаном, репаглинидом), в том числе во время инфузии (продолжительностью 1:00) и в течение 20 минут после окончания инфузии. Рекомендуется выдерживать 12-часовой интервал времени до инфузии и не менее 3:00 после окончания инфузии перед введением субстратов ОАТР1В1.
Вакцинации. Введение живых или живых аттенуированных вакцин пациентам, иммунитет которых ослаблен приемом химиотерапевтических препаратов может привести к серьезным или летальных инфекций. Пациентам, принимающим кабазитаксел, следует воздержаться от прививки живыми атенуйованих вакцинами. Можно вводить убиты или инактивированные вакцины, однако ответ на такую вакцину может быть слабее.
Особенности применения
Реакции гиперчувствительности. Всем пациентам перед началом инфузии препарата следует проводить премедикацию (см. Раздел «Способ применения и дозы»).
Во время первой и второй инфузий пациентов нужно тщательно наблюдать с целью выявления реакций гиперчувствительности. Реакции гиперчувствительности могут появляться в течение нескольких минут после начала инфузии препарата, поэтому средства и оборудование для лечения артериальной гипотензии и бронхоспазма должны быть начеку. Возможны тяжелые реакции, включающие генерализованное высыпание / эритема, артериальной гипотензии и бронхоспазм. Тяжелые реакции гиперчувствительности требуют немедленного прекращения введения препарата и соответствующей терапии. Пациентам, имеющим тяжелые реакции гиперчувствительности, необходимо прекратить лечение препаратом (см. Раздел «Противопоказания»).
Угнетение костного мозга. Угнетение костного мозга проявляется как нейтропения, анемия, тромбоцитопения, панцитопения (см. Ниже).
Нейтропения. Пациентам, получающим препарат, можно с профилактической целью принимать Г-КСФ в соответствии с рекомендациями Американского общества клинической онкологии (ASCO) и / или действующих рекомендаций лечебного учреждения, чтобы уменьшить риск нейтропении осложнений (фебрильной нейтропении, длительной нейтропении или нейтропенической инфекции) или для их лечения.
Целесообразно рассмотреть возможность первичной профилактики Г-КСФ для пациентов с клиническими характеристиками, которые обуславливают принадлежность этих пациентов к группе высокого риска (возраст от 65 лет, плохой функциональный статус, предыдущие эпизоды фебрильной нейтропении, наличие обширных участков облучения в прошлом, плохой алиментарный статус или другие серьезные сопутствующие заболевания) и их повышенную склонность к возникновению осложнений вследствие пролонгированного нейтропении. Доказано, что использование Г-КСФ уменьшает частоту и тяжесть нейтропении.
Нейтропения - самая частая побочная реакция на прием препарата (см. Раздел «Побочные реакции»). Обязательным является еженедельный контроль развернутого анализа крови в течение 1 цикла и перед каждым лечебным циклом, в случае необходимости дозу можно откорректировать. Необходимо снижение дозы в случае фебрильной нейтропении или длительной нейтропении, которые наблюдаются, несмотря на соответствующее лечение (см. Раздел «Способ применения и дозы»). Возобновление лечения следует рассматривать только в случае возврата числа нейтрофилов до уровня ≥1500 / мм 3 (см. Раздел «Противопоказания»).
Желудочно-кишечные расстройства. Такие симптомы как боли в животе и болезненность живота при пальпации, повышение температуры тела, стойкий запор, диарея как на фоне нейтропении, так и без нее могут быть ранними проявлениями серьезных реакций желудочно-кишечного токсичности, поэтому их следует своевременно выявлять и лечить. Может возникнуть необходимость временно отложить лечение кабазитаксел или отменить его.
Риск возникновения диареи, тошноты, рвоты, дегидратации. Если у пациентов после введения препарата развивается диарея, можно применить обычные противодиарейные средства. Следует также принять соответствующие меры с целью регидратации пациентов. Диарея может возникать чаще у пациентов, ранее получавших облучение абдоминально-тазовой области. Обезвоживания чаще наблюдается у пациентов в возрасте от 65 лет. Следует принять надлежащие меры для регидратации пациентов, а также для мониторинга и корректировки сывороточных уровней электролитов, в частности калия. При диарее ≥ III степени может потребоваться отсрочка лечения или уменьшения дозы (см. Раздел «Способ применения и дозы»). Если у пациентов появляется тошнота или рвота, можно применить обычно применяемые противорвотное средства.
Риск серьезных желудочно-кишечных реакций. У пациентов, получавших лечение кабазитаксел, регистрировались случаи кровотечений и перфораций желудочно-кишечного тракта (ЖКТ), кишечной непроходимости, колита, в том числе с летальным исходом (см. Раздел «Побочные реакции»). Рекомендуется соблюдать осторожность при лечении пациентов, у которых наблюдается высокий риск развития желудочно-кишечных осложнений: пациентов с нейтропенией, пациентов пожилого возраста, при одновременном применении нестероидных противовоспалительных препаратов (НПВП), антитромбоцитарных средств или антикоагулянтов, а также пациентов с лучевой терапией органов малого таза в анамнезе или ранее перенесенными желудочно-кишечными поражениями, например, язвами или кровотечениями ЖКТ.
Периферическая нейропатия. У пациентов, принимавших кабазитаксел, наблюдались случаи периферической нейропатии - периферической сенсорной нейропатии (например парестезии, дизестезии) и периферической моторной нейропатии. Если у пациентов, принимающих кабазитаксел, возникают такие симптомы нейропатии как боль, жжение, покалывание, онемение или общая слабость, то рекомендуется сообщить об этих симптомах врачу перед тем, как продолжать лечение. Врачи должны обследовать пациентов на наличие симптомов нейропатии или их усиление перед каждым циклом лечения. Лечение следует откладывать до уменьшения симптомов. В случае устойчивой периферической нейропатии ≥ II степени нужно уменьшить дозу кабазитаксела с 25 мг / м2 до 20 мг / м2 (см. Раздел «Способ применения и дозы»).
Анемия. У пациентов, получавших кабазитаксел, наблюдалась анемия (см. Раздел «Побочные реакции»). Необходимо проверять уровень гемоглобина и гематокрита перед началом терапии кабазитаксел и в случае наличия у пациента признаков или симптомов анемии или потери крови. Для пациентов с уровнем гемоглобина <10 г / дл рекомендуется применять данное лекарственное средство с осторожностью и при наличии клинических показаний принять надлежащие меры.
Риск почечной недостаточности. Были сообщения о нарушения со стороны почек в связи с сепсисом, выраженной дегидратацией, вызванной диареей, рвотой и обструктивными заболеваниями мочевыводящих путей. Наблюдались случаи почечной недостаточности, включая случаи с летальным исходом. Если случаются нарушения со стороны почек, следует принять соответствующие меры, направленные на определение причины, и начать интенсивное лечение пациентов.
В течение всего периода лечения кабазитаксел следует обеспечивать надлежащую гидратацию пациентов. Больные должны немедленно сообщать о любых существенных изменениях суточного объема мочи. Перед началом лечения, при каждом анализе крови и каждый раз, когда пациент сообщает об изменении объема выделенной мочи, нужно измерять сывороточные уровни креатинина. Лечение кабазитаксел нужно прекратить в случае какого-либо ухудшения функции почек до почечной недостаточности ≥ III степени за CTCAE (Общими терминологическими критериями оценки нежелательных явлений) 4.0.
Со стороны респираторной системы. Могут наблюдаться интерстициальная пневмония / пневмонит и интерстициальное заболевание легких, которые могут иметь летальный исход (см. Раздел «Побочные реакции»).
В случае развития или усиления легочных симптомов следует принять соответствующие меры, направленные на определение причины, и начать интенсивное лечение пациентов. Прерывание лечения кабазитаксел рекомендуется до установления диагноза. Раннее применение поддерживающей терапии может улучшить состояние пациента. Целесообразность восстановления лечения кабазитаксел нужно быть тщательно оценить.
Риск возникновения сердечных аритмий. Сообщалось о случаях сердечных аритмий, среди которых чаще всего наблюдались тахикардия и мерцательная аритмия (см. Раздел «Побочные реакции»).
Влияние на хрусталик . Токсические воздействия на хрусталик в клинических исследованиях не наблюдалось, но наблюдались в доклинических исследованиях в ходе исследований токсичности при повторном введены на крысах при уровнях экспозиции препарата высоких, чем уровень экспозиции при клиническом применении (отек / дегенерация пидкапсулярних волокон хрусталика наблюдались у животных, получавших препарат в дозировке 10 мг / кг / 3 недели 10 циклов). Эти влияния были частично обратно через 8 недель.
Пациенты пожилого возраста. У пациентов пожилого возраста (в возрасте ≥ 65 лет) вероятность развития определенных побочных реакций, включая нейтропению и фебрильной нейтропенией, может быть выше (см. Раздел «Побочные реакции»).
Пациенты с печеночной недостаточностью. Препарат противопоказан для пациентов с тяжелой дисфункцией печени (общее содержание билирубина> 3 × ВМН) (см. Разделы «Противопоказания» и «Фармакокинетика»). Необходимо уменьшить дозу препарата в случае легкой (общее содержание билирубина от> 1 до ≤1,5 × ВГН или уровень АСТ> 1,5 × ВМН) дисфункции печени (см. Разделы «Способ применения и дозы» и «Фармакокинетика»).
Взаимодействия. Следует избегать одновременного применения препарата с мощными ингибиторами CYP3A4, поскольку они могут приводить к повышению плазменных концентраций кабазитаксела (см. Разделы «Способ применения и дозы» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Следует избегать одновременного применения препарата с мощными индукторами CYP3A4, поскольку они могут приводить к снижению плазменных концентраций кабазитаксела (см. Разделы «Способ применения и дозы» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Вспомогательные вещества. Флакон со смесью концентрат-растворителя содержит 573,3 мг этанола 96%, что эквивалентно 14 мл пива или 6 мл вина.
Вредно для лиц, страдающих алкогольной зависимостью.
Следует учитывать при применении в группах высокого риска, в частности у пациентов с заболеваниями печени или больным эпилепсией.
Применение в период беременности или кормления грудью
Беременность. Данные по применению кабазитаксела беременным женщинам отсутствуют. В ходе исследований на животных было показано наличие токсического воздействия на репродуктивную систему при применении препарата в дозах, токсичных для материнского организма, а также обнаружено, что кабазитаксел проникает через плацентарный барьер. Как и другие цитотоксические лекарственные средства, при введении беременным женщинам кабазитаксел может проявлять вредное воздействие на плод.
Не рекомендуется применять кабазитаксел в период беременности и женщинам репродуктивного возраста, которые не используют противозачаточные средства.
Кормления грудью. Имеющиеся фармакокинетические данные, полученные в ходе исследований на животных, свидетельствуют об экскреции кабазитаксела и его метаболитов в молоко. Нельзя исключить риск для младенцев, находящихся на грудном Годованный. Кабазитаксел не следует применять в период кормления грудью.
Фертильность.В ходе исследований на животных было показано наличие влияния кабазитаксела на репродуктивную систему крыс и собак мужского пола. Таким образом, учитывая фармакологический эффект таксанов, их генотоксический потенциал и тяжелые эффекты при взаимодействии лекарственных средств данного класса, имеет влияние на фертильность в исследованиях на животных, невозможно исключить влияние на фертильность мужского пола у людей. Учитывая потенциальное влияние на мужские половые клетки и на возможную экспозицию через семенную жидкость, мужчинам, получающих лечение кабазитаксел, следует применять эффективные противозачаточные средства в течение всего периода лечения, а также рекомендуется продолжать их применение в течение 6 месяцев после введения последней дозы кабазитаксела . Принимая во внимание потенциальную экспозицию через семенную жидкость, мужчинам, получающих лечение кабазитаксел, следует избегать контакта другого лица с эякулятом на протяжении всего периода лечения. Мужчинам, которым назначено лечение кабазитаксел, рекомендуется обратиться за консультацией по поводу консервации спермы до начала лечения.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Учитывая данные из профиля безопасности, препарат может проявлять умеренное влияние на способность управлять автомобилем и работать с другими механизмами, поскольку может повлечь повышенную утомляемость и головокружение. Пациентам следует воздерживаться от управления автотранспортом и работы с механизмами, если во время лечения у них наблюдаются эти побочные реакции.
Способ применения Кабаз Спал и дозы
Применение препарата возможно только в специализированных учреждениях, где проводят лечение цитотоксическими препаратами, а его введение осуществляют исключительно под наблюдением врача, имеющего опыт проведения противоопухолевой химиотерапии. Нужно обеспечить наличие средств и оборудования для лечения тяжелых реакций гиперчувствительности, например артериальной гипотензии и бронхоспазма (см. Раздел «Особенности применения»).
Премедикация. Чтобы уменьшить риск аллергических реакций и их тяжесть, следует применять премедикацию, вводя внутривенно такие лекарственные препараты крайней мере за 30 минут перед каждым применением препарата:
- антигистаминные препараты (дексхлорфенирамин 5 мг или дифенгидрамин 25 мг или эквивалент)
- кортикостероиды (дексаметазон 8 мг или эквивалент);
- антагонисты Н2-рецепторов (ранитидин или эквивалент) (см. раздел «Особенности применения»).
В случае необходимости рекомендуется профилактическое пероральное или внутривенное введение противорвотное средств.
На протяжении всего лечения следует обеспечить надлежащую гидратацию пациентов, чтобы предотвратить осложнения, в частности почечной недостаточности.
Дозировки. Рекомендуемая доза для взрослых составляет 25 мг / м2, которую следует вводить в виде одночасовой инфузии 1 раз в 3 недели в комбинации с пероральным приемом преднизона или преднизолона по 10 мг ежедневно в течение периода лечения.
Коррекция дозы. Дозировка следует изменить, если у пациента развиваются побочные реакции (см. Таблицу 1).
Таблица 1. Рекомендуемая коррекция доз при развитии побочных реакций у пациентов, получающих препарат
побочные реакции | коррекция дозы |
Длительная нейтропения ≥ III степени (более 1 недели), несмотря на соответствующее медикаментозное лечение, которое включает применение гранулоцитколониестимулюючого фактора (G-CSF). | Отсрочить лечение, пока количество нейтрофилов составит> 1500 клеток / мм 3, после чего уменьшить дозу препарата с 25 мг / м2 до 20 мг / м2. |
Фебрильная нейтропения или нейтропеническая инфекция. | Отсрочить лечение к улучшению или выздоровления и пока количество нейтрофилов составит> 1500 клеток / мм 3, после чего уменьшить дозу препарата с 25 мг / м2 до 20 мг / м2. |
Диарея ≥ III степени или стойкая диарея, несмотря на соответствующее медикаментозное лечение, коррекцию водного и электролитного баланса. | Отсрочить лечение к улучшению или выздоровления, после чего уменьшить дозу препарата с 25 мг / м2 до 20 мг / м2. |
Периферическая нейропатия ≥ II степени. | Отсрочить лечение к уменьшению или исчезновению проявлений побочной реакции, после чего уменьшить дозу кабазитаксела с 25 мг / м2 до 20 мг / м2. |
Прекратить лечение препаратом, если у пациента продолжают наблюдаться любые из определенных реакций при дозе 20 мг / м2.
Особые группы пациентов.
Пациенты с печеночной недостаточностью. Кабазитаксел значительной степени метаболизируется в печени. У пациентов с легкой дисфункцией печени (общее содержание билирубина превышает верхнюю границу нормы (ВГН) от> 1 до ≤1,5 раза или уровень АСТ> 1,5 × ВМН) необходимо уменьшить дозу кабазитаксела до 20 мг / м2. Применение кабазитаксела пациентам с легкой дисфункцией печени требует осторожности и тщательного контроля показателей безопасности.
У пациентов с умеренной дисфункцией печени (общее содержание билирубина от> 1,5 до ≤3,0 × ВМН) максимальная переносимая доза (МПД) препарата составляла 15 мг / м2. Если предусмотрено лечения у пациентов с умеренной дисфункцией печени, доза кабазитаксела должна превышать 15 мг / м2. Однако пока доступны ограниченные данные по эффективности лечения на фоне применения такой дозы препарата.
Кабазитаксел не допускается применять пациентам с тяжелой дисфункцией печени (общее содержание билирубина> 3 × ВМН) (см. Разделы «Противопоказания», «Особенности применения» и «Фармакокинетика»).
Пациенты с нарушением функции почек. Кабазитаксел минимально выводится через почки. У пациентов с нарушением функции почек, не требующие гемодиализа, коррекции дозы препарата не показано. У пациентов в терминальной стадии заболевания почек (клиренс креатинина (CLCR) <15 мл / мин / 1,73 м2), учитывая их состояние и ограниченный объем доступных данных, необходимо применять препарат с осторожностью и осуществлять тщательный контроль во время лечения (см . разделы «Особенности применения» и «Фармакокинетика»).
Пациенты пожилого возраста. Рекомендации по специальной коррекции дозы препарата для пациентов пожилого возраста отсутствуют (см. Также разделы «Побочные реакции», «Особенности применения», «Фармакокинетика»).
Одновременное применение лекарственных средств. Следует избегать одновременного применения лекарственных средств, которые являются мощными индукторами или ингибиторами CYP3A (см. Разделы «Особенности применения» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Дети. Безопасность и эффективность применения препарата детям и подросткам не установлены.
Способ применения.
Меры предосторожности, которые следует принять перед манипуляциями с лекарственным средством или его введением. С препаратом должен работать только персонал, специально обученный работе с цитотоксическими средствами. Беременных работников не следует допускать к манипуляциям с препаратом. Особые меры предосторожности по манипуляций с лекарственным средством описаны в разделе «Особые меры предосторожности при утилизации и другие манипуляции с препаратом».
Инструкции по приготовлению препарата и его введения представлены в разделе «Особые меры предосторожности при утилизации и другие манипуляции с препаратом».
Особые меры предосторожности при утилизации и другие манипуляции с препаратом. Как и с любым другим противоопухолевым средством, следует быть осторожным при работе и приготовления растворов, применять герметизирующие устройства, индивидуальное защитное снаряжение (например перчатки) и осуществлять подготовительные манипуляции. В случае контакта с кожей на любом этапе работы следует немедленно тщательно промыть ее водой с мылом. В случае попадания препарата на слизистые оболочки следует немедленно тщательно промыть их водой.
Любой неиспользованный препарат или остаточный материал следует утилизировать в соответствии с существующими требованиями.
Двухшаговый процесс растворения нужно проводить с соблюдением правил асептики при приготовлении раствора для инфузий.
Концентрат для приготовления раствора для инфузий всегда следует разводить полным содержанием флакона с растворителем, который поставляется в комплекте, прежде чем добавлять препарат в инфузионных растворов.
Перед началом смешивания и разведения препарата внимательно и ПОЛНОСТЬЮ следует прочитать этот раздел. Для получения готового к применению раствора препарата необходимо выполнить его разведения в два этапа. Следует соблюдать инструкции по приготовлению раствора, приведенных ниже.
Примечание. Флакон с концентратом препарата 60 мг / 1,5 мл (объем наполнения: 73,2 мг кабазитаксела / 1,83 мл), и флакон с растворителем (объем наполнения: 5,67 мл) содержат излишки жидкостей, необходимо для компенсации потери этих жидкостей в процессе приготовления раствора. Такой избыточный объем наполнения позволяет после добавления ВСЕГО содержимого флакона с растворителем, поставляется в комплекте, получить раствор, содержащий 10 мг / мл кабазитаксела.
Для приготовления раствора для инфузий необходимо в асептических условиях выполнить разводку в два этапа согласно приведенным ниже указаниям.
Этап 1. Первое разведение концентрата для приготовления раствора для инфузий с помощью растворителя, поставляемый в комплекте.
Этап 1.1. Флакон с концентратом и флакон с растворителем, поставляется в комплекте, осматривают визуально. Концентрированный раствор должен быть прозрачным.
флакон с концентратом (60 мг у 1,5 мл) |
| флакон с растворителем |
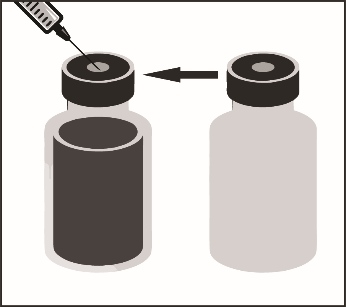
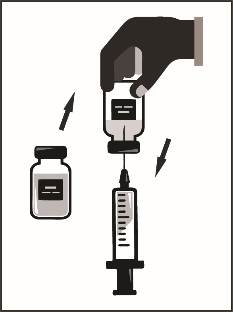
Этап 1.2. В асептических условиях с помощью шприца с иглой отобрать все содержимое флакона с растворителем, частично наклонив флакон.
флакон с растворителем |
|
Этап 1.3. Ввести весь объем растворителя в соответствующий флакон с концентратом. При введении растворителя следует по возможности свести к минимуму пенообразования. Для этого растворитель следует вводить медленно, направляя струю на внутреннюю стенку флакона с концентратом. После разведения полученный раствор содержит 10 мг / мл кабазитаксела.
смесь концентрата с растворителем, 10 мг/мл |
| флакон с растворителем |
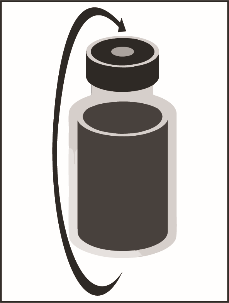
Этап 1.4. Вытянуть шприц с иглой и осторожно перемешать содержимое флакона, переворачивая его в руках до получения прозрачного однородного раствора. Это может занять примерно 45 секунд.
смесь концентрата с растворителем, 10 мг/мл |
|
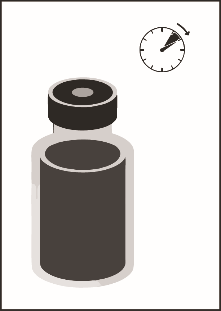
Этап 1.5. Раствора дать постоять около 5 минут, после чего следует убедиться, что он является однородным и прозрачным. Пена может сохраняться даже после этого периода времени, это вполне нормально.
смесь концентрата с растворителем, 10 мг/мл |
|
Эта полученная смесь концентрат-растворителя содержит 10 мг / мл кабазитаксела (по крайней мере 6 мл объема, который можно извлечь). Сразу после этого (не позднее чем через 1:00) необходимо выполнить второй разведения согласно указаниям раздела «Этап 2».
Для приготовления предназначенной пациенту дозы может потребоваться больше чем один флакон смеси концентрата с растворителем.
Этап 2. Второе (финальное) разведение для получения готового к применению раствора для инфузий.
Этап 2.1. В асептических условиях отобрать необходимое количество смеси концентрата с растворителем (10 мг / мл кабазитаксела) с помощью градуированного шприца с иглой. Например, для приготовления дозы 45 мг понадобится 4,5 мл смеси концентрата с растворителем, подготовленной в соответствии с указаниями раздела «Этап 1».
После приготовления предварительно разбавленного раствора, как это описано в разделе «Этап 1», на стенках флакона может оставаться пена, поэтому при отборе из него раствора желательно погружать иглу шприца глубоко в раствор.
смесь концентрата с растворителем, 10 мг/мл |
|
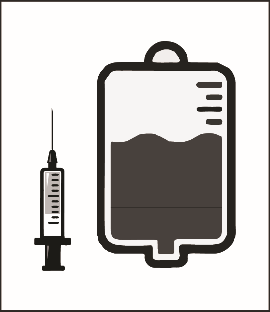
Этап 2.2. Вводить препарат в стерильный инфузионный контейнер, не содержит поливинилхлорида (ПВХ), в котором находится или 5% раствор глюкозы для инфузий, или раствор хлорида натрия для инъекций 9 мг / мл (0,9%). Концентрация раствора для инфузий должна составлять от 0,10 мг / мл до 0,26 мг / мл.
необходимое количество смеси концентрата с растворителем |
| 5% раствор глюкозы для инфузий или раствор хлорида натрия для инъекций 9 мг / мл (0,9%) |
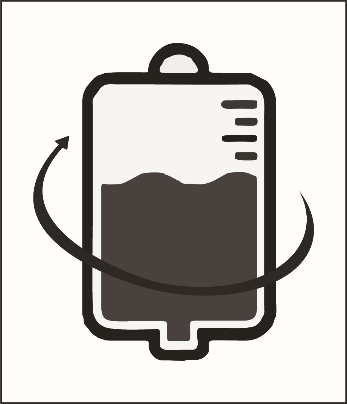
Этап 2.3. Отделить шприц и перемешать содержимое инфузионного пакета или флакона, покачивая его в руках.
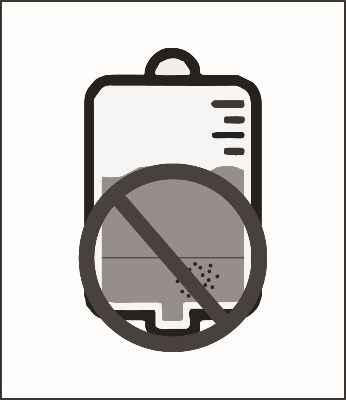
Этап 2.4. Перед применением этого раствора для инфузий, как и всех парентеральных лекарственных средств, необходимо осмотреть его визуально. Раствор, в котором был обнаружен осадок, применять не следует.
Каждый флакон концентрата содержит 60 мг кабазитаксела в 1,5 мл номинального объема (фактический объем наполнения: 73,2 мг кабазитаксела / 1,83 мл). Такой объем наполнения был специально предусмотрен, чтобы компенсировать потерю жидкости в процессе приготовления премикса. Этот избыточный объем позволяет после разведения полным содержанием флакона с растворителем для препарата, поставляемого в комплекте, получить минимальный объем премикса, изымаемого 6 мл, в котором будет содержаться 10 мг / мл препарата соответствует заявленной количества - 60 мг в одном флаконе.
Номинальный объем каждого флакона растворителя - 4,5 мл (фактический объем наполнения - 5,67 мл). Такой объем наполнения был специально предусмотрен при разработке формы выпуска этого лекарственного средства, и этот избыточный объем позволяет после добавления всего содержимого флакона с растворителем к содержимому флакона с концентратом для приготовления раствора препарата получить премикс с концентрацию 10 мг / мл препарата.
Раствор для инфузий должен быть использован сразу. Однако при соблюдении условий хранения, описанных в разделе «Срок годности», раствор пригоден к применению в течение еще некоторого периода времени. Перед применением готового раствора для инфузий, как и всех парентеральных лекарственных средств, необходимо осмотреть его визуально. Поскольку данный раствор является перенасыщенным, со временем он может кристаллизоваться. Такой раствор не пригоден к применению и должно быть утилизирован.
Во время выполнения инфузии рекомендуется использовать встроенный фильтр с номинальным диаметром пор 0,22 мкм (который также могут указывать 0,2 мкм).
Не следует использовать инфузионные контейнеры, содержащие ПВХ, или инфузионные системы, содержащие полиуретан, для приготовления и введения препарата.
Не следует смешивать препарат с любыми другими лекарственными средствами, кроме указанных выше.
Весь неиспользованный объем лекарственного средства и отходы следует утилизировать в соответствии с местными требованиями.
Дети
Безопасность и эффективность применения препарата у детей в возрасте до 18 лет не установлены.
Передозировка
Известных антидотов к препарату нет. Ожидаемые осложнения передозировки могут включать обострения побочных реакций в виде угнетение костного мозга и желудочно-кишечных расстройств. В случае передозировки пациента следует госпитализировать в специализированный стационар и оставить под наблюдением. Как можно скорее после обнаружения передозировки пациенту следует начать терапию с применением Г-КСФ. Необходимо также принять другие соответствующие симптоматических мероприятий.
Побочные эффекты
Краткое описание профиля безопасности.
Безопасность применения препарата в сочетании с преднизоном или преднизолоном оценивалась в 371 пациента с гормонорезистентными метастатическим раком предстательной железы, получавших 25 мг / м2 препарата 1 раз в 3 недели в ходе рандомизированного открытого контролируемого исследования фазы ИИИ. Пациенты получили в среднем по 6 курсов препарата.
К наиболее частым (≥ 10%) побочных реакций всех степеней принадлежали анемия (97,3%), лейкопения (95,7%), нейтропения (93,5%), тромбоцитопения (47,4%) и диарея (46,6% ). Частыми (≥ 5%) побочными реакциями ≥ III степени в группе пациентов, принимавших препарат, были нейтропения (81,7%), лейкопения (68,2%), анемия (10,5%), фебрильная нейтропения (7,5 %), диарея (6,2%).
68 пациентов (18,3%), принимавших препарат, прекратили лечение из-за побочных реакции. Наиболее частой побочной реакцией, которая привела к прекращению приема препарата, была нейтропения.
Список побочных реакций в виде таблицы.
Побочные реакции представлены в таблице 2 по классам систем органов MedDRA и частоты их возникновения. Выраженность побочных реакций определялась согласно CTCAE 4,0 (степень ≥ ИИИ = G ≥ 3). Частоту определены следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 - <1/10), нечасто (≥ 1/1000 - <1/100), редкие (≥ 1/10000 - <1 / 1000), очень редкие (<1/10000), неизвестно (невозможно определить, исходя из доступных данных).
Таблица 2. Зафиксированные побочные реакции и нарушения со стороны крови при применении в комбинации с преднизоном или преднизолоном в исследовании TROPIC (n = 371)
система органов | побочные реакции | Все степени n (%) | степень ≥ III n (%) | |
очень часто | Часто | |||
Инфекционные и паразитарные заболевания | септический шок | 4 (1,1) | 4 (1,1) | |
сепсис | 4 (1,1) | 4 (1,1) | ||
целлюлит | 6 (1,6) | 2 (0,5) | ||
Инфекция мочевыводящих путей | 27 (7,3) | 4 (1,1) | ||
Грипп | 11 (3) | 0 | ||
Цистит | 10 (2,7) | 1 (0,3) | ||
Инфекция верхних дыхательных путей | 10 (2,7) | 0 | ||
опоясывающий герпес | 5 (1,3) | 0 | ||
Кандидоз | 4 (1,1) | 0 | ||
Со стороны крови и лимфатической системы | Нейтропенияa * | 347 (93,5) | 303 (81,7) | |
Анемияa | 361 (97,3) | 39 (10,5) | ||
Лейкопенияa | 355 (95,7) | 253 (68,2) | ||
Тромбоцитопенияa | 176 (47,4) | 15 (4) | ||
фебрильная нейтропения | 28 (7,5) | 28 (7,5) | ||
Со стороны иммунной системы | гиперчувствительность | 5 (1,3) | 0 | |
Метаболические и алиментарные расстройства | анорексия | 59 (15,9) | 3 (0,8) | |
обезвоживание | 18 (4,9) | 8 (2,2) | ||
гипергликемия | 4 (1,1) | 3 (0,8) | ||
гипокалиемия | 4 (1,1) | 2 (0,5) | ||
Со стороны психики | беспокойство | 11 (3) | 0 | |
спутанность сознания | 5 (1,3) | 0 | ||
Со стороны нервной системы | дисгевзия | 41 (11,1) | 0 | |
периферическая нейропатия | 30 (8,1) | 2 (0,5) | ||
Периферическая сенсорная нейропатия | 20 (5,4) | 1 (0,3) | ||
головокружение | 30 (8,1) | 0 | ||
Головная боль | 28 (7,5) | 0 | ||
Парестезия | 17 (4,6) | 0 | ||
летаргия | 5 (1,3) | 1 (0,3) | ||
гипестезия | 5 (1,3) | 0 | ||
Желудок | 4 (1,1) | 1 (0,3) | ||
Со стороны органов зрения | конъюнктивит | 5 (1,3) | 0 | |
слезящиеся глаза | 5 (1,3) | 0 | ||
Со стороны органов слуха и равновесия | Шум в ушах | 5 (1,3) | 0 | |
Головокружение | 5 (1,3) | 0 | ||
Со стороны сердца * | мерцательная аритмия | 4 (1,1) | 2 (0,5) | |
тахикардия | 6 (1,6) | 0 | ||
Со стороны сосудов | артериальная гипотензия | 20 (5,4) | 2 (0,5) | |
Тромбоз глубоких вен | 8 (2,2) | 7 (1,9) | ||
артериальная гипертензия | 6 (1,6) | 1 (0,3) | ||
ортостатическая гипотензия | 5 (1,3) | 1 (0,3) | ||
приливы | 5 (1,3) | 0 | ||
ощущение жара | 4 (1,1) | 0 | ||
Со стороны респираторной системы, грудной клетки и средостения | одышка | 44 (11,9) | 5 (1,3) | |
Кашель | 40 (10,8) | 0 | ||
Боль в области ротоглотки | 13 (3,5) | 0 | ||
пневмония | 9 (2,4) | 6 (1,6) | ||
Со стороны ЖКТ | диарея | 173 (46,6) | 23 (6,2) | |
тошнота | 127 (34,2) | 7 (1,9) | ||
рвота | 84 (22,6) | 7 (1,9) | ||
Запор | 76 (20,5) | 4 (1,1) | ||
Боль в животе | 43 (11,6) | 7 (1,9) | ||
диспепсия | 25 (6,7) | 0 | ||
Боль в верхних отделах живота | 20 (5,4) | 0 | ||
геморрой | 14 (3,8) | 0 | ||
Гастроэзофагеальная рефлюксная болезнь | 12 (3,2) | 0 | ||
ректальное кровотечение | 8 (2,2) | 2 (0,5) | ||
Сухость во рту | 8 (2,2) | 1 (0,3) | ||
вздутие живота | 5 (1,3) | 1 (0,3) | ||
Со стороны кожи и подкожной клетчатки | алопеция | 37 (10) | 0 | |
сухость кожи | 9 (2,4) | 0 | ||
эритема | 5 (1,3) | 0 | ||
Со стороны опорно-двигательного аппарата и соединительной ткани | Боль в спине | 60 (16,2) | 14 (3,8) | |
Артралгия | 39 (10,5) | 4 (1,1) | ||
Боль в конечностях | 30 (8,1) | 6 (1,6) | ||
спазмы мышц | 27 (7,3) | 0 | ||
миалгия | 14 (3,8) | 1 (0,3) | ||
Мышечно-скелетные боли в груди | 11 (3) | 1 (0,3) | ||
Боль в боковых отделах живота | 7 (1,9) | 3 (0,8) | ||
Со стороны почек и мочевых путей | Острая почечная недостаточность | 8 (2,2) | 6 (1,6) | |
почечная недостаточность | 7 (1,9) | 6 (1,6) | ||
дизурия | 25 (6,7) | 0 | ||
почечная колика | 5 (1,3) | 1 (0,3) | ||
гематурия | 62 (16,7) | 7 (1,9) | ||
полакиурия | 13 (3,5) | 1 (0,3) | ||
гидронефроз | 9 (2,4) | 3 (0,8) | ||
задержка мочеиспускания | 9 (2,4) | 3 (0,8) | ||
недержание мочи | 9 (2,4) | 0 | ||
обструкция мочеточника | 7 (1,9) | 5 (1,3) | ||
Со стороны репродуктивной системы и молочных желез | Боль в области таза | 7 (1,9) | 1 (0,3) | |
Общие нарушения и реакции в месте введения | повышенная утомляемость | 136 (36,7) | 18 (4,9) | |
астения | 76 (20,5) | 17 (4,6) | ||
пирексия | 45 (12,1) | 4 (1,1) | ||
периферические отеки | 34 (9,2) | 2 (0,5) | ||
Воспаление слизистой оболочки | 22 (5,9) | 1 (0,3) | ||
боль | 20 (5,4) | 4 (1,1) | ||
Боль в груди | 9 (2,4) | 2 (0,5) | ||
отеки | 7 (1,9) | 1 (0,3) | ||
Озноб | 6 (1,6) | 0 | ||
общее недомогание | 5 (1,3) | 0 | ||
результаты исследований | Уменьшение массы тела | 32 (8,6) | 0 | |
Повышение уровня аспартатаминотрансферазы | 4 (1,1) | 0 | ||
Повышение уровня трансаминаз | 4 (1,1) | 0 | ||
a По результатам оценки лабораторных показателей.
* См. детальное описание ниже.
Нейтропения и сопутствующие клинические проявления. Частота нейтропении ≥ III степени на основе лабораторных данных составила 81,7%. Частота побочных реакций нейтропении с клиническими проявлениями и фебрильной нейтропении составила соответственно 21,3% и 7,5%. Нейтропения была частой побочной реакцией, которая приводила к прекращению приема препарата (2,4%). Нейтропенической осложнения включали нейтропенической инфекции (0,5%), нейтропенический сепсис (0,8%) и септический шок (1,1%), которые в некоторых случаях приводили к летальному исходу. Доказано, что применение гранулоцитарного колониестимулирующего фактора (Г-КСФ) уменьшает частоту и тяжесть нейтропении (см. Разделы «Способ применения и дозы» и «Особенности применения»).
Со стороны сердца и аритмии.Среди нарушений со стороны сердца у пациентов, принимавших кабазитаксел, чаще наблюдались случаи всех степеней тяжести. Из этих случаев у 6 пациентов (1,6%) возникали сердечные аритмии ≥ III степени. Частота тахикардии в группе лечения кабазитаксел составила 1,6%, при этом не зарегистрировано ни одного случая тахикардии ≥ III степени. Частота возникновения мерцательной аритмии в группе лечения кабазитаксел составила 1,1%. В группе лечения кабазитаксел чаще наблюдались случаи сердечной недостаточности, при этом о сроке развития этого осложнения сообщали у 2 пациентов (0,5%). Один пациент в группе кабазитаксела умер за сердечной недостаточности. Сообщалось о летальную фибрилляции желудочков у одного пациента (0,3%) и остановку сердца у 2 пациентов (0,5%). Ни один из случаев не был отнесен врачом-исследователем в таких,
Другие отклонения от нормы лабораторных показателей. Частота анемии ≥ III степени, повышение уровня АСТ, АЛТ и билирубина, исходя из анализа отклонений от нормы лабораторных показателей, составляли соответственно 10,5%, 0,7%, 0,9% и 0,6%.
Желудочно-кишечные расстройства. Сообщалось о случаях развития колита, энтероколита, гастрита, нейтропенического энтероколита. Также наблюдались случаи развития желудочно-кишечного кровотечения и перфорации, паралитического и механической кишечной непроходимости (см. Раздел «Особенности применения»).
Со стороны респираторной системы. Были зарегистрированы случаи интерстициальной пневмонии / пневмонита и интерстициального заболевания легких, которые могут иметь летальный исход, частота возникновения неизвестна (см. Раздел «Особенности применения»).
Дети (см. Раздел «Способ применения и дозы»).
Пациенты пожилого возраста. С 371 пациента, принимавших препарат в ходе исследования рака предстательной железы, возраст 240 пациентов был 65 лет, включая 70 пациентов в возрасте от 75 лет.
Сообщение о нижеприведенные побочные реакции были на 5% и более частыми среди пациентов в возрасте от 65 лет по сравнению с молодыми пациентами: повышенная утомляемость (40,4% по сравнению с 29,8%), нейтропения (24,2% по сравнению с 17,6% ), астения (23,8% по сравнению с 14,5%), гипертермия (14,6% по сравнению с 7,6%), головокружение (10,0% по сравнению с 4,6%), инфекции мочевыводящих путей (9, 6% по сравнению с 3,1%) и дегидратация (6,7% по сравнению с 1,5%).
У пациентов в возрасте ≥ 65 лет по сравнению с молодыми пациентами была выше частота побочных реакций по степени тяжести ≥ ИИИ: нейтропения, определенная на основе отклонения от нормы лабораторных показателей (86,3% по сравнению с 73,3%), нейтропения с клиническими проявлениями ( 23,8% по сравнению с 16,8%) и фебрильная нейтропения (8,3% по сравнению с 6,1%) (см. разделы «Способ применения и дозы» и «Особенности применения»).
Срок годности Кабаз Спал
Распакованные флаконы - 2 года.
После открытия. Флаконы с концентратом и растворителем следует использовать немедленно после открытия. Если препарат не использовали сразу же после открытия, то ответственность за продолжительность и условия хранения открытых флаконов несет пользователь.
После первоначального разведения концентрата растворителем. Показано, что раствор после начального разведения оставался химически и физически стабильным в течение 1:00 при условии хранения при температуре окружающей среды 15-30 ° C. С точки зрения микробиологии разведенный растворителем концентрат следует использовать немедленно. Если его не использовали немедленно после приготовления, то ответственность за продолжительность и условия хранения несет пользователь. Обычно разбавленный растворителем концентрат можно хранить в течение не более 24 часов при температуре 2-8 ° C, кроме случаев, когда разведение происходило в контролируемых и валидизированных асептических условиях.
После окончательного разведения в пакете / флаконе для инфузий. Показано, что инфузионный раствор оставался химически и физически стабильным на протяжении 8:00 (включая 1:00 инфузии) при условии хранения при температуре окружающей среды и в течение 48 часов при хранении инфузионных растворов охлажденным.
С точки зрения микробиологии инфузионный раствор следует использовать немедленно. Если инфузионный раствор не использовали сразу после приготовления, то ответственность за продолжительность и условия хранения несет пользователь. Обычно инфузионный раствор можно хранить в течение не более 24 часов при температуре 2-8 ° C, кроме случаев, когда разведение происходило в контролируемых и валидизированных асептических условиях.
Условия хранения Кабаз Спал
Хранить в оригинальной упаковке при температуре не выше 30 ° С. Не замораживать. Хранить в недоступном для детей месте.
Условия хранения после разведения - см. раздел «Срок годности».
Несовместимость. Всегда следует разбавлять препарат предоставленным в комплекте растворителем перед добавлением его к инфузионных растворов. Это лекарственное средство нельзя смешивать с другими лекарственными средствами, за исключением указанных в разделе «Особенности применения».
Не использовать поливинилхлоридные инфузионные контейнеры и полиуретановые инфузионные наборы для приготовления и введения инфузионного раствора.
Упаковка
По 1,5 мл концентрата во флаконе, по 4,5 мл растворителя во флаконе; по 1 флакону с концентратом и по 1 флакону с растворителем в контурной пластиковой ячеистой упаковке в картонной коробке.
Категория отпуска
По рецепту.
Производитель
SP Akur Labs Pvt. ООО.
Местонахождение производителя
Плот № 12 Биотек Парк Фейз 2, Лалгади Малакпет, Шамирпет (М), Медхал достать, Телангана, 500101, Индия.
Заявитель.
PP Фармасьютикалз Прайвет Лимитед.
Местонахождение заявителя.
С-158, Окла Индастриал Эриа, Фейз - И Нью Дели ДЛ 110020, Индия.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Кабаз Спал только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание: Перевод на русский язык, выполнен редакторской командой Tabletki.info.
Авторское право:
- СП Акура Лабс ПВТ. Лтд.
- http://www.drlz.com.ua - Государственный реестр ЛС Украины
| Тип данных | Сведения из реестра |
| Торговое наименование: | Кабаз Спал |
| Производитель: | СП Акура Лабс ПВТ. Лтд. |
| Форма выпуска: | концентрат для приготовления раствора для инфузий 60 мг в 1,5 мл 1 флакон с концентратом и 1 флакон с растворителем по 4,5 мл в контурной пластиковой ячеистой упаковке в картонной коробке |
| Регистрационное удостоверение: | UA/18251/01/01 |
| Дата начала: | 17.08.2020 |
| Дата окончания: | 17.08.2025 |
| МНН: | Cabazitaxel |
| Условия отпуска: | по рецепту |
| Состав: | 1 флакон концентрата (1,5 мл) содержит 60 мг кабазитаксела |
| Фармакологическая группа: | Антинеопластичес средства. |
| Код АТХ: | L01CD04 |
| Заявитель: | PP Фармасьютикалз Прайвет Лимитед |
| Страна заявителя: | Индия |
| Адрес заявителя: | С-158, Окла Индастриал Эриа, Фейз - И Нью Дели ДЛ 110020, Индия |
| Тип ЛС: | Обычный |
| ЛС биологического происхождения: | Нет |
| ЛС растительного происхождения: | Нет |
| Гомеопатическое ЛС: | Нет |
| Тип МНН: | Моно |
| Досрочное прекращение | Нет |
| Код ATХ | Название группы |
| L | Антинеопластические и иммуномодулирующие средства |
| L01 | Противоопухолевые препараты |
| L01C | Алкалоиды растительного происхождения и другие препараты природного происхождения |
| L01CD | Таксаны |
| L01CD04 | Кабазитаксел |