Мієломна хвороба
Етіологія
Мієломна хвороба (множинна мієлома, плазмоцитома, хвороба Рустиць- кого—Калера) — це хронічна лейкемія, що виникає з клітин — попередниць В-лімфоцитів, які диференціюються до плазмоцитів, здатних секретувати парапротеїни — патологічні імуноглобуліни.
Частота мієломної хвороби в країнах Європи та США становить 0,9—1,0 на 100 000 населення. Протягом останніх десятиліть відзначено абсолютне повсюдне зростання частоти захворювання не лише внаслідок поліпшення діагностики, а й через загальні зміни структури захворюваності та летальності.
Мієломна хвороба розвивається переважно в зрілому і похилому віці, більшість випадків припадає на вік 50—65 років. Рідше зустрічаються випадки мієломної хвороби в осіб віком до 40 років і понад 75 років. Частота захворювання в чоловіків і жінок приблизно однакова.
Етіологія мієломної хвороби, як і інших гемобластозів, невідома.
Патогенез
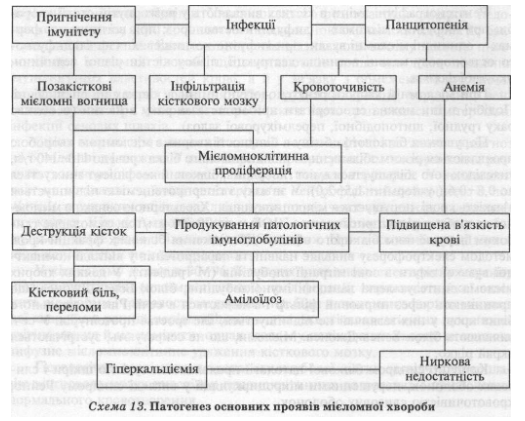
У патогенезі мієломної хвороби провідним є розвиток мієлом- ноклітинної (плазмоклітинної) проліферації в кістковому мозку з дифузною або вогнищевою його інфільтрацією, пригніченням нормального кровотворення, появою вогнищ мієломного росту в органах (печінці, селезінці, лімфатичних вузлах).
Особливістю пухлинних плазматичних (мієломних) клітин є їх здатність синтезувати патологічні імуноглобуліни — парапротеїни — і виділяти їх у кров. Парапротеїни належать до глобулінової фракції сироваткових білків і виявляються при електрофоретичних дослідженнях у вигляді вузької смуги моноклонового білка в зоні міграції у-а2-глобулінів (М-градієнт). Імунохімічне дослідження дає змогу визначити тип секретованого мієломними клітинами патологічного імуноглобуліну. Як правило, при мієломній хворобі секретується IgG (у 55—65 % випадків), рідше — IgA, IgD, IgE. У деяких хворих мієломні клітини виробляють легкі ланцюги імуноглобуліну — білок Бенса-Джонса, що в міру надходження у кров фільтрується нирками і виділяється із сечею. Секреція парапротеїнів мієломними клітинами зумовлює розвиток при мієломній хворобі синдрому білкової патології, що виявляється насамперед мієломною нефропатією, а також параамілоїдозом.
Крім синтезу парапротеїнів, мієломні клітини продукують остеокластак- тивний фактор, тому в зонах мієломного росту відбувається деструкція кісток з появою кісткових дефектів. Ці зміни виявляють під час рентгенографії кісток. Передусім деструктивні процеси розвиваються в плоских кістках і хребцях, іноді — у проксимальних відділах трубчастих кісток. Часто ускладненнями таких змін є патологічні переломи кісток. Унаслідок ураження кісток порушується кальцієвий обмін.
З розвитком захворювання, збільшенням маси пухлинних клітин у кістковому мозку пригнічується нормальне кровотворення, знижується продукування еритроцитів, гранулоцитів, тромбоцитів, виникають гнійно-септичні і геморагічні ускладнення (схема 13).
Патологічна анатомія
При патологоанатомічному дослідженні виявляють характерну картину кісткових уражень: розм’якшення кісток, поява ділянок деструкції кісткової тканини, переломів. Нерідко вузли плазмоцитоми утворюють значні кісткові дефекти. Описано випадки мієломної хвороби з вираженим остеосклерозом, що поєднується з типовими остеолітичними змінами.
Плазмоклітинну інфільтрацію виявляють у селезінці, лімфатичних вузлах, печінці, нирках, легенях, серцевому м’язі, травному каналі. Завдяки спеціальному фарбуванню в ділянці мієломних пухлинних вузлів і в тканинах виявляють відкладення параамілоїду.
Виражені зміни, що характерні для мієломної нефропатії, виявляють у нирках: закупорювання канальців гіаліновими циліндрами, відкладення параамілоїду, інтерстиційний фіброз, нефрокальциноз.
Класифікація. Класифікація мієломної хвороби грунтується на клініко- анатомічних даних. Розрізнюють такі форми мієломної хвороби:
1) солітарна (вогнищева, вузлувата) мієлома:
а) кісткова;
б) позакісткова;
2) множинна мієлома:
а) дифузна;
б) дифузно-вогнищева;
в) множинно-вогнищева.
Крім того, на основі імунохімічного дослідження виділяють клас і тип секретованих мієломою імуноглобулінів і розрізнюють IgG, IgA, IgD, IgE, BJ (Бенса-Джонса) мієломи.
Клінічна картина і діагностика
Клінічна картина мієломної хвороби відрізняється різноманітністю клінічних проявів і зумовлена поширеністю, локалізацією і характером мієломних розростань, ступенем порушення білкового обміну й ураження нирок. Характерними синдромами є: кістково-больовий, синдром білкової патології, нирковий, анемічний, гарячковий.
Захворювання найчастіше проявляється більш-менш вираженим різким болем в певному відділі скелета залежно від локалізації мієломатозних вузлів: у ребрах, хребті, груднині, стегні. Іноді біль настільки невизначений і непостійний, що не викликає постійної уваги. Лише коли біль стає інтенсивні- шим, посилюється при будь-якому фізичному напруженні, виникає потреба детально обстежити хворого. Оскільки біль нерідко має корінцевий характер, починають лікувати ймовірний радикуліт. Часто з’являється болючість у суглобах, що симулює поліартрит. Здебільшого плазмоцитомні розростання локалізуються в тілах хребців, ребрах, кістках черепа, верхній третині стегнової кістки. Руйнування хребців, уражених мієломою, призводить до здавлення нервових корінців спинного мозку з розвитком парезів, паралічів. Характерна форма уражених хребців — сплощуючись, вони стають подібними до риб’ячих. Унаслідок множинних переломів ребер і груднини може розвинутися деформація грудної клітки. Біль у кістках часто буває настільки нестерпним, що різко обмежує рухливість хворих і вони змушені перебувати в ліжку.
Рентгенографічні зміни в кістках виявляють у розгорнутій стадії хвороби: при дифузних мієломах — дифузний остеопороз; при вогнищевих формах — одиничні мієломні вузли; при дифузно-вогнищевих — на тлі дифузного остеопорозу наявні вогнища деструкції, лізису кістки різної величини, округлої форми.
При мієломній хворобі рентгенологічні зміни в кістках не специфічні. Подібні зміни можна спостерігати при метастазах раку в кістки (особливо раку грудної, щитоподібної, передміхурової залоз).
Порушення білкового обміну в більшості хворих з мієломною хворобою проявляються різким збільшенням рівня загального білка крові до 110—140 г/л, унаслідок чого збільшується вміст глобулінів, білковий коефіцієнт знижується до 0,8—0,6 ( у нормі - 1,5—2,0). У зв’язку з гіперпротеїнемією підвищується в’язкість крові, порушується мікроциркуляція. Характерною ознакою мієломної хвороби є різке прискорення ШОЕ — до 70—80 мм/год, зумовлене глибоким порушенням білкового обміну. Дослідження білкових фракцій крові методом електрофорезу виявляє наявність парапротеїнів у вигляді компактної вузької смуги в зоні міграції глобулінів (М-градієнт). У деяких хворих мієлома синтезує легкі ланцюги імуноглобулінів, білок Бенса-Джонса, що проникають через нирковий фільтр і з’являються в сечі. Рівень загального білка крові у них зазвичай не підвищується, але зростає протеїнурія. У сечі виявляють білок Бенса-Джонса. Мієломи, що не секретують, зустрічаються вкрай рідко.
Клінічно синдром білкової патології проявляється сухістю шкіри і слизових оболонок, порушеннями мікроциркуляції у вигляді синдрому Рейно, кровоточивістю слизових оболонок.
Розвиток нефротичного синдрому (мієломної нефропатії) зумовлений парапротеїнемією. В основі ниркової недостатності лежить висхідний нефросклероз, причиною якого є реабсорбція білка Бенса-Джонса, закупорювання білковими масами канальців з розвитком вогнищ внутрішньонирко- вого гідронефрозу, загибеллю нефронів. Крім того, наявні кальциноз нирок, амілоїдоз строми, лейкемічна мієломна інфільтрація. Клініка мієломної нефропатії характеризується наростанням стійкої протеїнурії та прогресуванням ниркової недостатності з розвитком олігурії, анурії, азотемічної коми. Часто таких хворих спостерігають з приводу ймовірного хронічного нефриту і діагноз мієломної хвороби ставлять уже тоді, коли з’являються патологічні переломи.
Розвиток анемічного синдрому характерний для всіх форм мієломної хвороби, але особливо виражений при дифузній мієломі, а також у термінальній стадії.
Гарячковий синдром виявляють у більшості хворих з мієломною хворобою, підвищення температури тіла має інтермітувальний характер і, як правило, не супроводжується пітливістю. У деяких випадках мієлома починається гарячкою зі стійким перебігом, що не піддається дії антибактеріальної терапії.
Характерною рисою мієломної хвороби є прогресивне зниження синтезу нормальних імуноглобулінів. Унаслідок цього розвивається синдром недостатності антитіл, який проявляється підвищеною схильністю хворих до бактеріальних інфекцій. Багато клініцистів відзначають високу частоту пневмоній при мієломній хворобі, що виникають не лише внаслідок зниження імунологічних властивостей крові, а й у зв’язку з обмеженням дихальних екскурсій легень через ураження ребер, груднини, хребців, порушення вентиляції легень. При мієломній хворобі також часто трапляються бактеріальні інфекції сечових шляхів.
Зміни в крові при мієломній хворобі не специфічні і встановити діагноз на їх підставі не можна. У всіх хворих з прогресуванням захворювання розвивається нормохромна анемія, зазвичай гіпорегенераторна. У лейкопоезі змін не відзначають, іноді спостерігають нейтрофільний лейкоцитоз з помірним зрушенням уліво, можлива поява одиничних пухлинних плазматичних клітин. Кількість тромбоцитів у нормі і з перебігом захворювання зменшується. ШОЕ різко збільшена в 70 % хворих. При мієломі Бенса-Джонса збільшення ШОЕ не спостерігають.
У кістковому мозку в 90—96 % хворих виявляють специфічну картину мієломноклітинної (плазмоклітинної) проліферації, вираженість якої залежить від форми і тривалості захворювання. При вогнищевих формах мієломної хвороби в ранній період збільшення кількості плазматичних пухлинних клітин можна й не помітити, однак згодом у нелікованих хворих виявляють дифузне мієломноклітинне ураження кісткового мозку.
Гістологічне дослідження трепанату клубової кістки засвідчує гіперплазію кісткового мозку внаслідок плазмоклітинних розростань і пригнічення нормального кровотворення.
Діагностика мієломної хвороби ґрунтується на виявленні пухлинного плазмоклітинного проліферативного процесу в кістковому мозку (не менш ніж 15 % плазматичних пухлинних клітин у стернальному пунктаті, плаз- моклітинна проліферація при гістологічному дослідженні кісткового мозку) і виявленні продукту синтезу пухлинних клітин — патологічного імуноглобуліну в сироватці крові або в сечі.
Крім того, перед початком лікування кожному хворому з мієломною хворобою проводять низку обов’язкових досліджень, що дає змогу визначити поширеність процесу, локалізацію зон деструкції кістки, вираженість білкової патології і функціональний стан нирок:
1) рентгенографія кісток скелета (плоских кісток, епіфізів трубчастих);
2) дослідження рівня загального білка крові, електрофоретичне дослідження білкових фракцій, визначення кількості білка в М-градієнті;
3) загальний аналіз сечі, за наявності протеїнурії — визначення білка Бенса-Джонса в сечі, електрофорез білків концентрованої сечі;
4) загальний аналіз крові;
5) визначення рівня сечовини, креатиніну, сечової кислоти, кальцію в крові;
6) визначення концентраційної здатності нирок за Зимницьким.
Для уточнення класу і типу патологічних імуноглобулінів необхідно зробити імуноелектрофорез сироватки крові з моноспецифічними антисироватками проти важких і легких ланцюгів імуноглобулінів.
Диференціальна діагностика
Мієломну хворобу слід диференціювати з хворобою Вальденстрема, що також перебігає з парапротеїнемією. Для хвороби Вальденстрема характерна лімфоїдна проліферація в кістковому мозку і моноклонова макроглобулінемія в крові — IgM, тоді як при мієломній хворобі визначають плазмоклітинну проліферацію. Імунохімічне дослідження з набором антисироваток проти важких і легких ланцюгів імуноглобулінів дає змогу остаточно розмежувати мієломну хворобу і макроглобулінемію Вальденстрема.
Мієломну хворобу слід відрізняти від моноклонових гаммапатій, що часто спостерігаються при пухлинах, хворобах сполучної тканини, цирозах печінки, а також можуть зустрічатися як конституціонально-вікова форма в людей похилого віку. Наявність моноклонової гаммапатії без плазмоклітинної проліферації в кістковому мозку не є доказом мієломної хвороби. При моноклоновій гаммапатії рівень парапротеїнів у крові підвищений незначно і не має тенденції до збільшення, вміст нормальних імуноглобулінів достатній, показники крові в нормі. При мієломній хворобі спостерігається прогресивне збільшення кількості парапротеїнів у крові, пропорційно збільшенню пухлинної маси, одночасно знижується вміст нормальних імуноглобулінів. Для остаточного вирішення діагностичного питання необхідні повторні пункції кісткового мозку і трепанобіопсії в динаміці. Іноді лише багаторічне спостерігання хворого дає змогу переконатись у доброякісності моноклонової гаммапатії.
У деяких випадках виникає потреба провести диференціальну діагностику мієломної хвороби і метастазів раку в кістки. В обох випадках провідним клінічним синдромом може бути кістковобольовий, а дані рентгенографії кісток не мають диференціально-діагностичної цінності. Для підтвердження діагнозу мієломної хвороби потрібно дослідити стернальний пунктат і зробити електрофорез білків сироватки крові. Критеріями діагнозу мієломної хвороби є:
1) плазмо клітинна пухлинна інфільтрація в кістковому мозку;
2) наявність парапротеїнів у крові або сечі.
Лікування
Сучасне лікування мієломної хвороби включає застосування цитостатичної і променевої терапії, кортикостероїдних і анаболічних гормонів, хірургічних і ортопедичних методів, лікувальної фізкультури, плазма- ферезу.
При вогнищевих (солітарних) мієломах показане хірургічне видалення пухлини з наступною променевою терапією. При дифузних і дифузно-вогнищевих формах мієломної хвороби основним методом лікування є цитостатична і променева терапія.
Використовують алкеран (мелфалан) усередину в дозі 10 мг через день, курсова доза — 150—200 мг. Препарат має виражену мієлотоксичність, лікування слід проводити під суворим контролем показників крові, насамперед кількості лейкоцитів.
Циклофосфан уводять внутрішньом’язово по 200—400 мг щодня або через день, курсова доза — 8—10 г.
Одночасне призначення преднізолону в невеликих дозах (15—20 мг на добу) підвищує ефективність хіміотерапії, блокує остеоліз; показане в лікуванні гіперкальціємії.
До комплексу лікувальних заходів включають анаболічні гормони (ретаболіл, неробол). Інтервали між курсами на початку становлять 1,5—2 міс. Після досягнення стабілізації процесу їх можна збільшити до 3—4 і навіть 6 міс. Ефективність терапії оцінюють за клінічними даними (зменшення болю в кістках, поліпшення загального стану хворих) і зниженням рівня парапротеїнів у крові (або в сечі).
У разі резистентності до лікування необхідно застосовувати поліхіміоте- рапію, яку проводять короткими ударними курсами. До схеми поліхіміотерапії, крім алкерану і циклофосфану, включають вінкристин, адріабластин, натулан.
Не слід призначати поліхіміотерапію хворим на цитопенію, азотемію та з інфекційно-запальними процесами.
Променеву терапію при множинній мієломі застосовують за наявності різко вираженого болю, деструкції і компресії тіл хребців з корінцевим синдромом, великих вогнищ’кісткової деструкції, на тлі яких можуть виникнути патологічні переломи. Радикальними вважають дози 40—50 Гр на вогнище.
У лікуванні ниркової недостатності використовують гідратацію, діуретики, вилуговування, протиазотемічні препарати — гемодез, леспенефрил, ентеросорбенти. Показаний плазмаферез з видаленням 500-700 мл плазми 2 рази на тиждень, гемосорбція, гемодіаліз.
Усім хворим з мієломною хворобою, у тому числі і лежачим, показана лікувальна фізкультура, рекомендують максимальну фізичну активність, що забезпечує навантаження на опорні частини скелета. Для зменшення кісткової резорбції показані біфосфонати (бонефос, аредіа, зомета), кальцитонін, вітамін Е під неухильним контролем рівня кальцію в крові.
Прогноз. Тривалість життя хворих з мієломною хворобою залежить від чутливості пухлини до цитостатичних препаратів, адекватності застосованого лікування, вираженості ниркової недостатності.
Сучасна терапія дає змогу подовжити життя хворих до 50 міс з моменту встановлення діагнозу. Працездатність хворих різко обмежується або зовсім втрачається.
Причиною смерті, як правило, бувають ниркова недостатність або інфекційні ускладнення.
Подальша інформація
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин. Інформація призначена тільки для медичних фахівців.