- Склад
- Лікарська форма
- Фармакотерапевтична група
- Фармакологічні властивості
- Клінічні характеристики
- Показання
- Протипоказання
- Взаємодія з іншими засобами
- Особливості застосування
- У період вагітності
- При керуванні автомобілем
- Спосіб застосування та дози
- Діти
- Передозування
- Побічні реакції
- Термін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
- Виробник
- Місцезнаходження виробника
Увага! Срок дії реєстраційного посвідчення UA/18362/01/01 закінчився 01.04.2023
Аккофіл інструкція із застосування
Офіційна інструкція лікарського засобу Аккофіл розчин 480 мг/0,5 мл. Опис та застосування Akkofіl, аналоги та відгуки. Інструкція Аккофіл розчин затверджена виробником.
Склад
діюча речовина: філграстим (Г-КСФ) (з використанням генетично модифікованих бактерій Е.соli); Г-КСФ — рекомбінантний людський гранулоцитарний колонієстимулюючий фактор;
допоміжні речовини: кислота оцтова льодяна, натрію гідроксид в перерахунку на натрій 0.02 мг, сорбіт (Е 420) 25 мг, полісорбат 80, вода для ін’єкцій.
Лікарська форма
Розчин для ін’єкцій в попередньо заповнених шприцах. Аккофіл 30: 1 попередньо заповнений шприц (0,5 мл) містить ЗО млн ОД (300 мкг) філграстиму; Аккофіл 48: 1 попередньо заповнений шприц (5 мл) містить 48 млн ОД (480 мкг) філграстиму.
Фармакотерапевтична група
Код АТС: L03AA02.
Фармакологічні властивості
Аккофіл є біоподібним.
Філграстим — це високоочищений неглікозильований білок, що складається з 175 амінокислот. Філграстим отримують із штамів Е. соїі, що була генетично модифікована шляхом додаванням гена, що кодує людський гранулоцитарний колонієстимулюючий фактор. Аккофіл — це лікарський засіб, виготовлений біологічними/біотехнологічними методами, що в основному нагадує еталонний препарат філграстиму, який вже дозволений (біоподібний). У чотирьох різних дослідженнях фази І на здорових добровольцях Аккофіл та еталонний препарат філграстиму показали порівнянну фармакокінетику (біоеквівалентність) після одноразового внутрішньовенного та підшкірного введення, а також після багаторазового підшкірного введення; їх фармакодинаміка була також порівнянною щодо абсолютної кількості нейтрофілів як для Стах, так і для AUCt (ІС до 95% між 80-125°%).
Під час дослідження фази III, що включало 110 пацієнтів (ПП), які страждають на рак молочної залози (стадія Ila, ІІЬ або Ilia) та отримують хіміотерапію ТАС, Аккофіл показав клінічну ефективність, порівнянну з результатами, опублікованими для еталонного препарату філграстим, що стосується первинного критерію «кількість днів з вираженою нейтропенією (<0,5 * 10 9/л), а також інші вторинні критерії оцінки. Механізм дії Людський гранулоцитарний колонієстимулюючий фактор — глікопротеїн — регулює створення функціонально активних нейтрофільних гранулоцитів та їх вихід у кров з кісткового мозку. Фармакодинаміка. Філграстим значно збільшує кількість нейтрофільних гранулоцитів у периферичній крові вже протягом перших 24 годин після введення та одночасно призводить до деякого збільшення кількості моноцитів.
У деяких пацієнтів з важкою хронічною нейтропенією філграстим також може незначно підвищити кількість циркулюючих еозинофілів та базофілів до нормальних значень. У деяких пацієнтів спостерігається еозинофілія або базофілія ще до початку лікування. Збільшення кількості нейтрофільних гранулоцитів при застосуванні препарату в діапазоні рекомендованих доз залежить від величини дози їх функціональні властивості нормальні або посилені, про що свідчать результати дослідження хемотаксису і фагоцитозу. Застосування філграстиму, як первинне, так і після хіміотерапії, активує клітини-попередники гемоцитів периферичної крові (КПГПК). Периферичні стовбурові клітини крові (ПОКИ) можна забирати у хворого і вводити йому після лікування цитостатиками у високих дозах або замість пересадки кісткового мозку або як доповнення до неї. ПОКИ також можна вводити як підтримку після (високо) мієлосупресивної цитотоксичної хіміотерапії.
Введення КПГПК прискорює відновлення кровотворення, зменшує небезпеку геморагічних ускладнень і потребу у переливанні тромбоцитарної маси. У здорових донорів доза філграстиму, що становить 10 мкг на кілограм маси тіла на добу, що вводиться підшкірно протягом 4 — 5 днів поспіль, дає в більшості випадків вихід >4 * 10 6 CD34 + клітин на кілограм маса тіла реципієнта після двох лейкоферезів. Після лікування філграстимом кількість нейтрофілів у крові зменшується приблизно на 50% через 1-2 дні, і повертається до нормальних значень через 1-7 днів. Лікування філграстимом призводить до значного зниження захворюваності, тяжкості та тривалості як нейтропенії, так і фебрильних епізодів, які часто спостерігаються після лікування цитостатичною хіміотерапією або апластичною хіміотерапією з подальшою трансплантацією кісткового мозку.
Пацієнтів під хіміотерапією, які також отримували філграстим, потрібно госпіталізувати рідше та на коротший термін. Крім того, їм можна рідше використовувати антибіотики, ніж пацієнтам, які пройшли хіміотерапію без додаткового лікування. Лікування філграстимом значно скорочує тривалість фебрильної нейтропенії, застосування антибіотиків та госпіталізацію після індукційної хіміотерапії у пацієнтів з гострим мієлоїдним лейкозом. Поява лихоманки та зафіксованих інфекцій за таких умов не зменшувалася. Ефективність Г-КСФ ще не встановлена у пацієнтів, які внаслідок зменшення спинального резерву вже мають лейкопенію до початку лікування (наприклад, після великої променевої терапії та/або повторних циклах хіміотерапії). У цих пацієнтів лікування Г-КСФ не може тимчасово замінити звичайне коригування доз хіміотерапії.
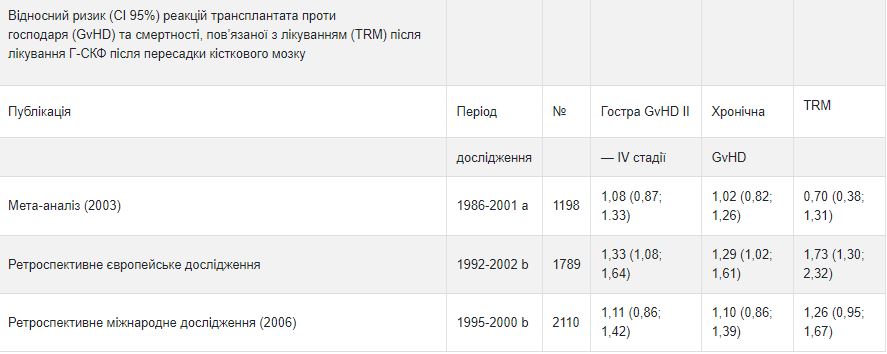
У ретроспективному європейському дослідженні було вивчено використання Г-КСФ після алогенної трансплантації кісткового мозку у пацієнтів з гострою лейкемією. В ньому зазначено, що використання Г-КСФ пов’язане з підвищеним ризиком реакції «трансплантат проти господаря» (GvHD), смертності, пов’язаної з лікуванням (TRM) та смертності. Інше міжнародне ретроспективне дослідження пацієнтів з гострим або хронічним мієлоїдним лейкемією не виявило впливу на GvHD, TRM та смертність. Мета-аналіз досліджень з алогенної трансплантації, в тому числі результати дев’яти проспективних рандомізованих досліджень, восьми ретроспективних досліджень та одного контрольного випадку, не виявив впливу на ризик виникнення гострої реакції GvHD або ранньої смертності внаслідок лікування.
а Аналіз включав дослідження, пов’язані з трансплантацією кісткового мозку в цей період; в деяких дослідженнях застосовували GM-CSF (фактор, що стимулює колонію гранулоцитів- макрофагів).
b Аналіз включав пацієнтів, які отримували трансплантацію кісткового мозку в цей період.
Лікування філграстимом дітей або дорослих з важкою хронічною нейтропенією (тяжка спадкова, періодична або ідіопатична нейтропенія) викликає збільшення абсолютної кількості нейтрофілів в периферичній крові, а також зниження інфекцій та їх наслідків. Застосування філграстиму у ВІЛ-інфікованих пацієнтів утримує кількість нейтрофілів у межах норми, дозволяючи вводити противірусні препарати та/або інші мієлосупресивні препарати у звичайній дозі. Немає жодних доказів того, що проліферація ВІЛ стимулюється у пацієнтів, інфікованих вірусом та яких лікують філграстимом. Як і інші гемопоетичні фактори росту, Г-КСФ виявив in vitro стимулюючу дію на ріст ендотеліальних клітин людини.
Фармакокінетика. Абсорбція Існує позитивна лінійна кореляція між дозою та сироватковою концентрацією філграстиму, незалежно від того, вводять філграстим внутрішньовенно або підшкірно. Максимальні концентрації’ філграстиму в сироватці між 5 та 1840 нг/мл були продемонстровані після введення разових доз у межах від 1,7 до 69,0 мкг на кілограм маси тіла (коротка 30-хвилинна в/в інфузія). Після підшкірного введення рекомендованої дози вимірювали сироваткові концентрації до максимум 118 нг/мл і вони залишалися вище 10 нг/мл протягом 8-16 годин. Обчислений обсяг розподілу в крові становив приблизно 150 мл/кг. Виведення Кліренс філграстиму має кінетику першої ступеня після підшкірного та внутрішньовенного введення. Загальний визначений кліренс становив 0,6 мл/хв/кг.
Середній період напіввиведення становив приблизно 3,5 год. Під час безперервних вливань філграстиму протягом 28 днів у пацієнтів, які мали аутотрансплантат кісткового мозку, не було даних про накопичення продукту, період напіввиведення залишався порівнянним. Фармакокінетичний профіль, встановлений при концентрації 0,96 мг/мл, представляє незначну різницю, пов’язану з концентрацією, порівняно з нижчими концентраціями 0,6 мг/мл та 0,3 мг/мл. Ця різниця не впливає на загальну фармакодинамічну відповідь (вимірюється відповідно до реакції нейтрофілів).
Кінетика для певних груп пацієнтів. Пацієнти з нирковою і печінковою недостатністю
У дослідженні, в якому брали участь 12 пацієнтів з різним ступенем ниркової функції, спостерігали підвищення С та AUC, а також зменшення обсягу розподілу та кліренсу у суб’єктів із кінцевою стадією ниркової хвороби порівняно зі здоровими добровольцями та пацієнтами із помірною нирковою недостатністю. Оскільки середні профілі АНК були однаковими між різними ступенями ниркової функції, у тому числі у пацієнтів із кінцевою стадією ниркової хвороби, коригування дози філграстиму не потрібне для пацієнтів з порушенням функції нирок.
Результати дослідження 12 пацієнтів з порушеннями роботи печінки показують, що фармакокінетика та фармакодинаміка філграстиму є порівнянними у суб’єктів із порушеннями роботи печінки та у здорових осіб. Тому коригування дози не потрібно пацієнтам з порушеннями роботи печінки. Доклінічні дані Експресія рецепторів фактора росту гранулоцитів (Г-КСФ) була спостережена у певних злоякісних клітинах. Не можна виключити, що філграстим може виступати фактором росту при деяких видах пухлин. Канцерогенний потенціал філграстиму не вивчений. Філграстим не індукував генетичні мутації бактерій, ні за наявності, ні за відсутності ферментної системи, що метаболізує препарат. Філграстим не мав помітного впливу на фертильність самця чи самки щура або на час гестації самок у дозі до 500 мкг/кг.
Клінічні характеристики
Аккофіл Показання
Аккофіл показаний для: • зменшення тривалості і тяжкості нейтропенії у пацієнтів (дорослих та дітей), які отримують інтенсивну мієлосупресивну хіміотерапію цитотоксичними препаратами з приводу злоякісних новоутворень (за винятком хронічного мієлолейкозу та мієлодиспластичного синдрому). Для дітей, що страждають на гостру мієлоїдну лейкемію, не проводилося рандомізованого дослідження, однак є послідовні неконтрольовані чи нерандомізовані дослідження; • для зменшення тривалості нейтропенії у хворих, які отримують високодозову хіміотерапію цитотоксичними препаратами з наступною аутологічною або алогенною трансплантацією кісткового мозку; • для мобілізації периферичних стовбурових клітин крові (ПСКК); • для тривалого використання для збільшення кількості нейтрофільних гранулоцитів та зменшення інфекцій у дітей та дорослих, які перенесли клінічно значущі інфекції протягом останніх 12 місяців та тричі задокументованої нейтропенії АНК <0,5 * 109/л, в умовах вродженої, циклічної або важкої ідіопатичної нейтропенії; • лікування стійкої нейтропенії (абсолютною кількістю нейтрофілів 51,0 х 109/л) у пацієнтів з розгорнутою стадією ВІЛ-інфекції для зниження ризику бактеріальних інфекцій, коли інші методи лікування нейтропенії недоречні.
Протипоказання
Підвищена чутливість до діючої речовини чи до будь-яких допоміжних речовин.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Особливості застосування
Підвищена чутливість Повідомлялося про випадки реакцій підвищеної чутливості, включаючи анафілаксію, у пацієнтів, які отримували філграстим під час початкового чи подальшого лікування. Пацієнтам з клінічно значимою підвищеною чутливістю до Аккофіл прийом препарату слід припинити. Не слід призначати Аккофіл пацієнтам з історією підвищеної чутливості до філграстиму та пегфілграстиму. Побічні реакції з боку легень Повідомлялося про побічні реакції з боку легень, зокрема про інтерстиціальну пневмонію після введення Г-КСФ. Ризик може бути збільшений у пацієнтів з недавньою історією легеневих інфільтратів або пневмонії. Поява легеневих розладів, таких як кашель, лихоманка та диспное, пов’язаних з рентгенологічними ознаками легеневих інфільтратів, а також погіршення функції легенів можуть бути першими ознаками гострого респіраторного дистрес-синдрому (ГРДС).
Прийом Аккофіл слід припинити та розпочати відповідне лікування. Гломерулонефрит Повідомлялося про гломерулонефрит у пацієнтів, які отримували філграстим та пегфілграстим. Зазвичай ці випадки зникають після зменшення дози або після припинення лікування філграстимом та пегфілграстимом. Рекомендується контроль показників сечі. Синдром капілярного витоку Повідомлялося про синдром капілярного витоку, який може загрожувати життю, якщо лікування затягується, після введення факторів росту гранулоцитарної лінії. Стан характеризується гіпотензією, гіпоальбумінемією, набряком та гемоконцентрацією. Пацієнти, що мають симптоми синдрому капілярного витоку, повинні перебувати під ретельним контролем та отримувати стандартне симптоматичне лікування, в тому числі й інтенсивну терапію (див. ПОБІЧНІ РЕАКЦІЇ).
Спленомегалія та розрив селезінки Після введення філграстиму пацієнтам та здоровим донорам повідомлялося про випадки спленомегалії, які, як правило, розвивалися безсимптомно, та випадки розриву селезінки. Деякі випадки розриву селезінки були летальними 3 цієї причини слід ретельно контролювати розмір селезінки (наприклад, за допомогою клінічного обстеження, УЗД). Пацієнтів, які скаржаться на біль у верхній лівій частині живота та/або у лівому плечі, слід перевірити на наявність збільшення розмірів селезінки або розриву селезінки. Встановлено, що зниження дози філграстиму сповільнює або зупиняє перебіг спленомегалії у пацієнтів з важкою хронічною нейтропенією. Для 3% пацієнтів була необхідна спленектомія. Ріст злоякісних клітин Гранулоцитарні фактори росту можуть сприяти росту in vitro не тільки мієлоїдних, а й немієлоїдних клітин. Оскільки клітини немієлоїдної пухлини також можуть експресувати рецептори Г-КСФ, слід припинити терапію Г-КСФ у пацієнтів з недостатньою реакцією на хіміотерапію.
Хронічний мієлоїдний лейкоз або мієлодиспластичний синдром. Безпека та ефективність філграстиму для пацієнтів з мієлодиспластичним синдромом або хронічним мієлоїдним лейкозом не визначені. Застосування Аккофілу при цих захворюваннях не показано. Особливу обережність слід проявляти при встановленні діагностичного розмежування гострої трансформації хронічного мієлоїдної лейкемії та гострої мієлобластної лейкемії. Тромбоцитопенія У пацієнтів, які отримували філграстим, спостерігали тромбоцитопенію. Кількість тромбоцитів слід ретельно контролювати, особливо протягом перших тижнів лікування Аккофілом. Тимчасове припинення або зменшення дози Аккофіл слід розглянути для пацієнтів з важкою хронічною нейтропенією, у яких розвивається тромбоцитопенія (кількість тромбоцитів <100*109/л). Лейкоцитоз Лейкоцитоз 100*109/л або більше спостерігався періодично у пацієнтів, які приймали філграстим у дозах, що перевищують 0,3 млн ОД (3 мкг) на кілограм на добу. Не зафіксовано жодних побічних реакцій, безпосередньо пов’язаних із цим ступенем лейкоцитозу. Однак через ризики лейкозу слід регулярно перевіряти формулу лейкоцитів через регулярні проміжки часу.
Якщо кількість лейкоцитів перевищує 50*109/л після очікуваного надиру (найнижчий показник), слід негайно припинити прийом Аккофіл. Крім того, якщо кількість лейкоцитів перевищує 70*109/л під час прийому Аккофіл для мобілізації ПСКК, необхідно припинити прийом Аккофіл. Тимчасовий лейкоцитоз (кількість лейкоцитів >50*109/л) спостерігався у 41% обстежених здорових донорів. Кількість лейкоцитів >75*109/л виявлено у 2% здорових донорів. Імуногенність Як і для всіх терапевтичних білків, існує потенційний ризик імуногенності. Частота вироблення антитіл до філграстиму становить менше 1% у більш, ніж 1000 суб’єктів, які отримували філграстим під час клінічних досліджень, проведених Amgen; однак ці антитіла не були пов’язані з нейтралізуючою дією або з небажаними клінічними наслідками. Аортит Повідомлялося про аортит після введення Г-КСФ у здорових осіб та онкологічних хворих. Серед симптомів були: підвищення температури, біль у животі, нездужання, біль у спині та посилення маркерів запалення (наприклад, С-реактивний білок та кількість лейкоцитів). У більшості випадків аортит діагностували за допомогою КТ та знімали його після припинення лікування Г-КСФ (див. також ПОБІЧНІ РЕАКЦІЇ). Гематурія та протеїнурія Гематурія та протеїнурія спостерігалися у невеликої кількості пацієнтів. Аналізи сечі слід робити регулярно.
ЗАСТЕРЕЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ ЩОДО СУПУТНІХ ЗАХВОРЮВАНЬ Остеопороз Контроль щільності кісток рекомендується пацієнтам, у яких вже є остеопороз і які протягом шести місяців безперервно приймали Аккофіл, оскільки випадки остеопорозу спостерігалися під час тривалого лікування. Особливі запобіжні заходи для пацієнтів із серповидноклітинною анемією За даними публікацій, велика кількість лейкоцитів несприятлива для пацієнтів, які страждають серповидноклітинною анемією. З цієї причини лікар повинен призначати Аккофіл надзвичайно обережно для цих пацієнтів і ретельно контролювати відповідні лабораторні показники. Він повинен брати до уваги можливий зв’язок зі спленомегалією та вазооклюзійними кризами. Повідомлялося про кризу серповидноклітинної анемії, яка в деяких випадках виявилася смертельною при застосуванні філграстиму такими пацієнтами. Лікар повинен бути обережним при призначенні Аккофіл пацієнтам із серпоподібною ознакою або серповидноклітинною анемією. Алергія на латекс Захисний ковпачок містить природний каучук, який може викликати алергічну реакцію. Непереносимість фруктози Аккофіл містить сорбіт. Тому пацієнтам з рідкісною спадковою непереносимістю фруктози не слід застосовувати даний препарат. Натрій Аккофіл містить менше 1 ммоль (23 мг) натрію в 1 попередньо наповненому шприці (0,5 мл розчину для ін’єкцій), тобто він по суті є «безнатрієвим».
ЗАСТЕРЕЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ ЩОДО ХІМІОТЕРАПІЇ Ризик, пов‘язаний з підвищенням дози хіміотерапії. Аккофіл не слід застосовувати для збільшення дозування цитотоксичної хіміотерапії, що перевищує рекомендований режим дозування. Необхідно вжити спеціальних заходів обережності щодо лікування пацієнтів, які отримують хіміотерапію у високих дозах, оскільки, з одного боку, досі не було продемонстровано покращення реакції пухлин на таке лікування, а з іншого — хіміотерапія з високою дозою може призвести до посилення токсичних ефектів, включаючи вплив на серце, легені, нервову систему та шкіру (див. професійну інформацію про застосовувані хіміотерапії). Хіміотерапія при затримці міслосупресії Даних про ефективність філграстиму в хіміотерапії, що викликає затримку мієлосупресії — нітрозуреями або мітоміцином С, в тому числі введення мієлосупресивних доз антиметаболітів, таких як 5-FU або цитозин — арабінозид все ще недостатньо. Вплив хіміотерапії на еритроцити та тромбоцити Аккофіл значно знижує частоту тяжкої та фебрильної нейтропенії. Однак для пацієнтів, які отримували лікування схемою мієлотоксичної хіміотерапії, існує ризик розвитку тромбоцитопенії та анемії. Тому рекомендується регулярно перевіряти кількість тромбоцитів і гематокрит. Особлива обережність потрібна при застосуванні разом з хіміотерапевтичними засобами (комбінована або монотерапія), які, як відомо, викликають важку тромбоцитопенію. Тромбоцитопенія Пацієнти, які отримують Аккофіл після високих доз мієлосупресивної хіміотерапії, можуть мати підвищений ризик розвитку тромбоцитопенії.
РЕКОМЕНДАЦІЇ ЩОДО КОНТРОЛЮ ФОРМУЛИ КРОВІ Лікування препаратом Аккофіл не запобігає виникненню тромбоцитопенії та анемії’ при прийомі мієлосупресивних препаратів. Оскільки під час лікування Аккофілом такі лікарські засоби в принципі можуть вводити пацієнтам у великих дозах або у великих кількостях, ризик тромбоцитопенії та анемії також може зростати. Рекомендується регулярно контролювати показники крові. Анемія та транзиторний ріст мієлоїдних стовбурових клітин — це інші гематологічні прояви, які також потребують ретельного моніторингу (див. розділ ЗАСТЕРЕЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ ЩОДО ЗАГАЛЬНИХ РИЗИКІВ ТА ПОБІЧНИХ ЕФЕКТІВ, Тромбоцитопенія та ЗАСТЕРЕЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ ЩОДО ХІМІОТЕРАПІЇ).
Інфекції, які можуть викликати мієлосупресію Причиною нейтропенії може бути умовно-патогенна інфекція, наприклад, комплекс Mycobacterium avium, який проникає в кістковий мозок, або злоякісне утворення, наприклад, лімфома. Пацієнтам, які страждають від інфекції, що пронизує кістковий мозок, або від раку, слід додатково розглядати основну патологію на додаток до лікування нейтропенії препаратом Аккофіл. Механізм дії філграстиму на нейтропенію стосовно зазначених клінічних випадків недостатньо відомий.
ОСОБЛИВІ КА ТЕГОРІЇ ПАЦІЄНТІВ/СПЕЦИФІЧНІ ПОКАЗАННЯ Особливі заходи безпеки у пацієнтів, які проходять мобілізацію ПСКК Оцінка кількості мобілізованих периферичних стовбурових клітин крові При проведенні оцінки кількості ПСКК, мобілізованих у хворих, які отримали терапію із застосуванням Аккофіл, особливу увагу слід приділяти методу кількісного визначення. Результати проточного цитометричного аналізу кількості С034+-клітин значно відрізняються залежно від застосованої методології визначення. Отже, слід з обережністю ставитися до результатів визначення їх кількості, отриманих в інших лабораторіях. Результати статистичного аналізу взаємозв’язку кількості введених СО34+-клітин та швидкості нормалізації кількості тромбоцитів після проведення хіміотерапії із застосуванням високих доз хіміопрепаратів свідчать про складну, але постійну залежність.
Рекомендації стосовно необхідності забезпечення мінімального вмісту на рівні > 2,0 * 10 6 CD34+ клітин/кг ґрунтуються на опублікованих даних про досвід адекватного відновлення гематологічних показників. При рівні, що перевищує мінімальний рекомендований, спостерігається швидша нормалізація, при рівні, меншому за рекомендований, — триваліша. Мобілізація Немає жодного рандомізованого порівняння двох рекомендованих методів мобілізації (філграстим окремо, або в поєднанні з міслосупресивною хіміотерапією) в межах однієї популяції пацієнтів. Ступінь варіації між окремими пацієнтами та між лабораторними аналізами CD34+ клітин означає, що безпосереднє порівняння різних досліджень ускладнене. Тому важко рекомендувати оптимальний метод. Вибір методу мобілізації слід розглядати в зв’язку з загальними цілями лікування для окремого пацієнта. Попереднє лікування цитотоксичними засобами та мобілізація ПСКК У хворих, яким раніше проводили інтенсивну мієлосупресивну терапію, на тлі застосування препарату Аккофіл для мобілізації ПСКК може не відбуватися збільшення кількості ПСКК до рекомендованого мінімального рівня (≥2,0*106CD34+ клітин/кг). Деякі цитотоксичні засоби проявляють особливу токсичність відносно клітин-попередників гемопоезу та негативно впливають на їх мобілізацію.
Тривале застосування препаратів мелфалан, карбоплатин або кармустин (BCNU) перед мобілізацією клітин-попередників може призвести до погіршення результатів. Однак одночасне застосування цих препаратів з філграстимом ефективне при мобілізації ПСКК. Якщо планується трансплантація ПСКК, рекомендується провести мобілізацію стовбурових клітин на ранній стадії лікування хворого. Особливу увагу слід звернути на кількість клітин-попередників, активованих у таких хворих до застосування препаратів хіміотерапії у високих дозах. Якщо результати мобілізації відповідно до вищенаведених критеріїв недостатні, слід розглянути застосування альтернативних методів лікування, які не потребують використання клітин-попередників. Особливі заходи безпеки для здорових донорів, які проходять мобілізацію ПСКК Мобілізація ПСКК здорових донорів впливає на стан їхнього здоров’я і застосовується винятково для отримання алогенних стовбурових клітин для трансплантації. Донори, яким проводять мобілізацію ПСКК для трансплантації, повинні відповідати стандартним вимогам за клінічними показниками та результатами лабораторних аналізів, що висуваються до донорів стовбурових клітин. Якщо необхідно провести більше одного лейкаферезу, перед аферезом слід звернути особливу увагу донорам, кількість тромбоцитів яких становить <100 * 109/л. Як правило, не слід проводити аферез, якщо кількість тромбоцитів становить <75*109/л.
Транзиторна тромбоцитопенія (кількість тромбоцитів <100 х 109/л) після введення філграстиму та лейкаферезу спостерігалася у 35% пацієнтів. Про деякі випадки зниження кількості тромбоцитів <50x109/л було повідомлено. Лейкаферез не слід проводити донорам, які потребують антикоагулянтної терапії або з порушеннями гемостазу. Подальше введення філграстиму слід скасувати або зменшити його дозу у випадках зростання лейкоцитів до рівня, що перевищує 70 х 109/л. Моніторинг стану донорів, які отримують Г-КСФ для мобілізації ПСКК, слід продовжувати до нормалізації гематологічних показників. У здорових донорів дані про тривалий прийом обмежені. У період постмаркетингових досліджень надходили повідомлення про випадки побічних явищ з боку легенів (кровохаркання, інфільтрація легенів) у здорових донорів. Визначення довготривалої безпеки препарату при введенні донорам триває.
Протягом періоду моніторингу до 4 років не повідомлялося про аномальне кровотворення у здорових донорів. Ризик сприяння утворенню злоякісних клонів мієлоїдних клітин не виключений. Для забезпечення тривалого моніторингу безпеки рекомендується систематично повідомляти і реєструвати дані про донацію кожної стовбурової клітини та фіксувати їх. Спеціальні запобіжні заходи для реципієнтів алогенних ПСКК, мобілізованих введенням Аккофіл Дані свідчать про те, що імунологічній взаємодії алогенних ПСКК і реципієнта властивий більший ступінь ризику розвитку гострої та хронічної реакції «трансплантат проти хазяїна» порівняно з трансплантацією кісткового мозку (див. ХАРАКТЕРИСТИКИ/ВПЛИВ).
Особливі запобіжні заходи у пацієнтів з важкою спадковою, періодичною або ідіопатичною нейтропенією Безпека та ефективність філграстиму не були встановлені для новонароджених та для пацієнтів з автоімунною нейтропенією. Аккофіл не слід застосовувати пацієнтам з важкою вродженою нейтропенією, у яких розвивається лейкемія або виявляються ознаки прогресування лейкемії. Трансформація у лейкоз або передлейкоз Особлива обережність необхідна при діагностиці тяжкої хронічної нейтропенії, щоб диференціювати її від інших гематологічних захворювань, таких як апластична анемія, мієлодисплазія та мієлолейкоз
До початку лікування слід провести розгорнутий аналіз крові з визначенням лейкоцитарної формули і кількості тромбоцитів, а також визначити морфологічну картину кісткового мозку і каріотип. Виникнення мієлодиспластичного синдрому (МДС) або лейкемії у пацієнтів з тяжкою хронічною нейтропенією, які брали участь у клінічних дослідженнях результатів застосування філграстиму, спостерігається рідко (12,1% випадків протягом 5 років). Вказані порушення спостерігалися лише у пацієнтів зі спадковою нейтропенією. МДС та лейкемія є частими ускладненнями захворювання, їх зв’язок із терапією із застосуванням філграстиму є непевним. Приблизно у 12% пацієнтів (без цитогенетичних порушень до початку терапії) за результатами наступних аналізів спостерігались відхилення, у тому числі моносемія. Невідомо, чи підвищує довготривала терапія із застосуванням філграстиму у пацієнтів з тяжкою хронічною нейтропенією ризик цитогенетичних порушень, МДС або трансформації захворювання на лейкемію. Морфологічне та цитогенетичне обстеження кісткового мозку пацієнтів слід проводити регулярно, з інтервалом приблизно кожні 12 місяців. Особливі запобіжні заходи для пацієнтів з ВІЛ-інфекцією Кількість клітин крові Необхідно ретельно контролювати абсолютну кількість нейтрофілів (АКН), особливо протягом перших тижнів терапії препаратом Аккофіл.
Залежно від умов, у деяких хворих може спостерігатися дуже швидке і значне збільшення АКН при перших введеннях Аккофіл. Протягом перших днів застосування препарату рекомендується щодня визначати АКН. У подальшому АКН слід перевіряти мінімум 2 рази на тиждень протягом перших 2 тижнів і потім кожного тижня або через тиждень протягом усього курсу підтримуючої терапії. У разі перерви у застосуванні препарату Аккофіл в дозі 300 мкг/доба у хворих під час лікування може спостерігатися значне коливання АКН. З метою визначення мінімального рівня АКН (надира) рекомендується проводити контроль загального аналізу крові перед кожним введенням препарату Аккофіл. Особливі популяції пацієнтів Досвід пацієнтів з важкими порушеннями функції печінки та/або нирок є обмеженим (див. ФАРМАКОКІНЕТИКА та ДОЗУВАННЯ/ СПОСІБ ЗАСТОСУВАННЯ).
Вплив філграстиму у пацієнтів зі значним зменшенням кількості мієлоїдних кпітин- попередників ще не вивчено. Оскільки Аккофіл діє в основному на дозрівання попередників нейтрофілів і, таким чином, збільшує кількість нейтрофілів у крові, його вплив може бути зменшений у пацієнтів із низькою кількістю попередників (наприклад, у пацієнтів, які пройшли променеву терапію або інтенсивну попередню хіміотерапію).
ЗАСТЕРЕЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ ЩОДО ДІАГНОСТИКИ
Сканування кісток Збільшення гемопоетичної активності кісткового мозку у відповідь на лікування факторами росту пов’язане з тимчасовими аномальними результатами скануваннями кісток. Це явище необхідно враховувати при інтерпретації результатів сканування.
Застосування у період вагітності або годування груддю
Вагітність Безпека філграстиму для вагітних не встановлена. У літературі є повідомлення про те, що філграстим проходить плацентарний бар’єр у вагітних. За результатами досліджень на тваринах виявлена репродуктивна токсичність. У кроликів, які отримували високі дози (набагато вище, ніж звичайне клінічне опромінення), що призводить до токсичності для матері, спостерігається підвищена частота ембріональної летальності. Препарат Аккофіл не рекомендується застосовувати у період вагітності, окрім випадків нагальної потреби. Годування грудьми Невідомо, чи проникає філграстим та його метаболіти у грудне молоко людини, тому цей препарат не вводять вагітним жінкам. Отже ризик для немовлят не можна виключити. Тому необхідно прийняти рішення стосовно припинення грудного вигодовування або застосування філграстиму з врахуванням користі грудного вигодовування для дитини і користі терапії для жінки.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Аккофіл має незначний вплив на здатність керувати автомобілем та іншими машинами. Після прийому Аккофіл може виникнути запаморочення (див. Розділ ПОБІЧНІ РЕАКЦІЇ). Досліджень стосовно впливу на швидкість реакції при керуванні автотранспортом або іншими механізмами не проводилось.
Спосіб застосування Аккофіл та дози
Пацієнти, які отримують цитотоксичну хіміотерапію з приводу злоякісних захворювань.
Дозування
Рекомендована доза Аккофіл становить 0,5 млн ОД (5 мкг) на кілограм маси тіла на добу. Лікування з Аккофіл слід починати не раніше, ніж через 24 години після призначення цитотоксичної’ хіміотерапії. Вміст одного попередньо наповненого шприца Аккофіл 30 (60 млн ОД/мл) відповідає добовій дозі, необхідній для пацієнта вагою 60 кг. Вміст одного попередньо наповненого шприца Аккофіл 48 відповідає добовій дозі, необхідній для пацієнта вагою 96 кг:
Тривалість лікування
Щоденне введення Аккофіл слід продовжувати до тих пір, поки очікувана кількість нейтрофілів не нормалізується після перевищення найнижчого числа нейтрофілів (надир). Після стандартної хіміотерапії, призначеної при солідних пухлинах, лімфомах та лімфоїдних лейкеміях, тривалість лікування може становити до 14 днів. Після індукційного та консолідаційного лікування гострого мієлоїдного лейкозу тривалість лікування може бути значно довшою (до 38 днів), залежно від типу, дози та режиму дозування цитотоксичної хіміотерапії.
У пацієнтів, які отримують цитотоксичну хіміотерапію, як правило, спостерігається короткотривале збільшення кількості нейтрофілів через 1-2 дні після початку лікування. Однак, щоб забезпечити тривалий терапевтичний успіх, прийом Аккофіл не слід переривати до того, як очікуваний надир (найнижчий показник) буде перевищений і кількість нейтрофілів нормалізується. Не рекомендується передчасне припинення лікування з Аккофіл, тобто до досягнення очікуваного надиру (найнижчого показника). Лікування слід припинити, коли кількість нейтрофілів досягла 1,0 * 109/л, після перевищення надиру (найнижчої норми). Спосіб застосування Аккофіл можна вводити як щоденну підшкірну ін’єкцію, так і 30-хвилинну щоденну внутрішньовенну інфузію після розведення в 5% розчині глюкози (див. Інструкції для розчинення в розділі СПЕЦІАЛЬНІ ПРИМІТКИ).
У більшості випадків кращим є підшкірне введення. Результати одного з досліджень дозволяють припустити, що внутрішньовенне введення може скоротити тривалість дії. Клінічне значення цього спостереження у разі повторного введення не встановлено. Пацієнти, які отримували цитотоксичну хіміотерапію, після якої відбулася трансплантація кісткового мозку Дозування Початкова рекомендована доза Аккофіл становить 1,0 млн ОД (10 мкг) на кілограм маси тіла на добу. Першу дозу Аккофіл слід ввести не раніше, ніж через 24 години після введення цитотоксичної хіміотерапії, але не пізніше, ніж через 24 години після пересадки кісткового мозку. Тривалість лікування Ефективність та безпеку застосування Аккофіл, що використовувався протягом 28 днів за цим показанням, не встановлено.
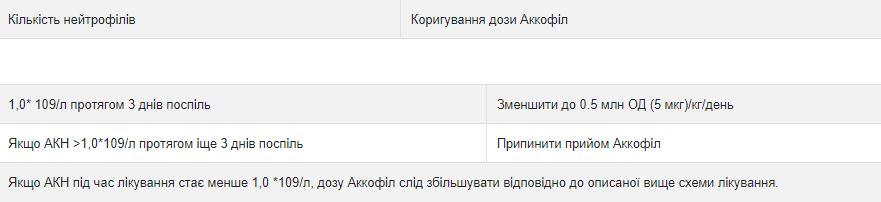
Коригування дози
Після того, як найнижчий показник нейтрофілів (надир) пройшов, добову дозу Аккофіл слід скоригувати відповідно до схеми, залежно під зміни формули крові:
АКН = абсолютна кількість нейтрофілів Спосіб застосування Аккофіл вводять у вигляді 30-хвилинної або 24-годинної внутрішньовенної інфузії, або у вигляді 24-годинної безперервної підшкірної інфузії. Аккофіл повинен бути розведений у 20 мл 5% розчину глюкози (див. Інструкції щодо розчинення у розділі СПЕЦІАЛЬНІ ПРИМІТКИ).
Мобілізація периферичних стовбурових клітин крові (ПСКК). Мобілізація периферичних стовбурових клітин крові у пацієнтів, які отримують мієлосупресивну терапію з подальшим аутологічним переливанням ПСКК, з трансплантацією кісткового мозку або без неї, або у пацієнтів, які проходять апластичну терапію з подальшою пересадкою ПСКК. Дозування Рекомендована доза Аккофіл становить 1,0 млн ОД (10 мкг) на кілограм маси тіла на добу протягом 5-7 днів поспіль. Тривалість лікування Однієї-двох процедур лейкаферезу на 5 та 6 день, зазвичай, достатньо.
При інших обставинах може бути необхідним додатковий лейкаферез. Прийом Аккофіл слід продовжувати до останнього лейкаферезу. Спосіб застосування Аккофіл вводять у вигляді безперервної 24-годинної підшкірної інфузії або у вигляді одноразової підшкірної ін’єкції. Перед інфузією, Аккофіл повинен бути розведений у 20 мл 5% розчину глюкози (див. Інструкції щодо розчинення у розділі СПЕЦІАЛЬНІ ПРИМІТКИ). Мобілізація ПСКК після мієлосупресивної хіміотерапії Дозування Рекомендована доза Аккофілу становить 0,5 млн ОД (5 мкг) на кілограм маси тіла на добу з першого дня після закінчення хіміотерапії, допоки кількість нейтрофілів не повернеться до норми після очікуваного надиру (найнижчої кількості).
Лейкаферез повинен відбуватися в період, коли абсолютна кількість нейтрофілів (АНК) змінюється з <0,5*109/л до >5,0*109/л. У пацієнтів, які раніше не проходили інтенсивної хіміотерапії, одного лейкаферезу часто буває достатньо. В інших випадках рекомендується додатковий лейкаферез. У хворих, яким раніше проводили інтенсивну хіміотерапію, на тлі застосування препарату Аккофіл для мобілізації ПСКК може не відбуватися збільшення кількості ПСКК до рекомендованого мінімального рівня (загальний мінімальний приріст від лейкаферезу: >10 а 30* 104 GM—CFC/кг або >1 а 2,5* 106 СО34+клітин/кг). Спосіб застосування Аккофіл вводять підшкірно.
Мобілізація ПСКК у здорових донорів перед алогенною трансплантацією ПСКК Мобілізацію кпітин-попередників слід проводити лише під наглядом центрів, що мають досвід збору кпітин-попередників від здорових донорів. Дозування Рекомендована доза Аккофіл становить 1 млн ОД (10 мкг) на кілограм маси тіла на добу протягом 4-5 днів поспіль. Лейкаферез необхідно починати на 5 день та продовжувати до 6 дня, якщо необхідно, щоб зібрати кількість 4 * 106 CD34+ клітин на кілограм маси тіла реципієнта. Безпека та ефективність введення Аккофіл здоровим донорам віком до 16 та від 60 років не оцінювались. Спосіб застосування Аккофіл вводять підшкірно.
Пацієнти з тяжкою спадковою, періодичною або ідіопатичною нейтропенією (ТХН) Дозування Спадкова нейтропенія: початкова рекомендована доза Аккофіл становить 1,2 млн ОД (12 мкг) на кілограм маси тіла на добу, у вигляді єдиної дози або декількох. Ідіопатична і періодична нейтропенія: рекомендована початкова доза Аккофіл становить 0,5 млн ОД (5мкг) на кілограм маси тіла на добу, у вигляді єдиної дози або декількох. Коригування дози У кожного пацієнта дозу необхідно встановлювати індивідуально, щоб досягти мінімальної АНК в 1,5 * 109/л. Для підтримання необхідної кількості нейтрофілів потрібне тривале щоденне введення препарату. Дозу слід подвоїти, якщо через 1-2 тижні не досягнуто цільового значення АНК 1,5*10э/л, і зменшити вдвічі, якщо АНК перевищує 10*109/л.
Швидше збільшення дози показано для пацієнтів з важкими інфекціями. Дози, що перевищують 14,5 млн ОД (145 мкг) на кілограм маси тіла на добу, є безпечними і добре переносяться. Спосіб застосування Аккофіл вводять підшкірно. Пацієнти з ВІЛ-інфекцією Дозування Відновлення кількості нейтрофілів Рекомендована початкова доза Аккофіл — 0,1 млн ОД/кг (1 мкг/кг) маси тіла на добу зі збільшенням дози до 0,4 млн ОД (4 мкг/кг) маси тіла на добу до нормалізації кількості нейтрофілів (АКН > 2,0 х Ю9/л. У клінічних дослідженнях більше 90% пацієнтів відреагували на цю дозу, і їх нейтропенія нормалізувалася протягом 2 днів (в середньому). У рідкісних випадках (<10% пацієнтів) для відновлення кількості нейтрофілів доза препарату може бути збільшена до 1,0 млн ОД/кг (10 мкг/кг маси тіла на добу).
Підтримання нормальної кількості нейтрофілів Як тільки нейтропенія відновлюється, слід визначити найефективнішу мінімальну дозу для підтримки нормального кількості нейтрофілів. Підтримуюча доза становить 300 мкг/добу 2-3 рази на тиждень за альтернативною схемою (через добу). Залежно від АНК пацієнта, може знадобитися додаткове коригування дози для утримання кількості нейтрофілів вище 2,0*10э/л. Під час клінічних досліджень необхідно було вводити 300 мкг на добу від 1 до 7 днів на тиждень, щоб підтримувати АНК вище 2,0 * 109/л; середня тривалість введення цієї дози становила 3 дні на тиждень. Тривале застосування препарату може бути необхідним для підтримання АНК 2,0*109/л. Спосіб застосування Аккофіл вводять підшкірно.
Спеціальні рекомендації при дозуванні
Літні пацієнти Особливих рекомендацій щодо застосування препарату Аккофіл пацієнтами літнього віку немає. Пацієнти з печінковою або нирковою недостатністю Дослідження результатів прийому філграстиму пацієнтами із вираженою нирковою або печінковою недостатністю показали, що фармакокінетичний та фармакодинамічний профілі практично схожі на ті, що спостерігаються у здорових осіб (див. ФАРМАКОКІНЕТИКА). Корекція дози для таких пацієнтів не потрібна.
Діти
Рекомендації щодо дозування для педіатричних пацієнтів, які отримують мієлосупресивну цитотоксичну хіміотерапію, або для педіатричних пацієнтів з важкою спадковою, періодичною або ідіопатичною нейтропенією такі ж, як і для дорослих. Дані клінічних досліджень педіатричних пацієнтів показують, що безпека та ефективність філграстиму порівнянна у дорослих та дітей, які пройшли мієлосупресивну хіміотерапію. 65% пацієнтів, які брали участь у клінічних дослідженнях з приводу важкої хронічної нейтропенії, були молодше 18 років. Лікування філграстимом у цій віковій групі, до якої в основному входили пацієнти з вродженою нейтропенією, виявилося ефективним. Що стосується педіатричних пацієнтів, які лікували важку хронічну нейтропенію, то не було виявлено різниці щодо профілю безпеки препарату порівняно з дорослими.
Передозування
Симптоми передозування філграстиму невідомі. Пацієнти з вираженою хронічною нейтропенією, які отримували дози, що перевищують 14,5 млн ОД (145 мкг) на кілограм маси тіла на день, не мали патологічних симптомів. У пацієнтів, які отримували цитотоксичну хіміотерапію з пересадкою кісткового мозку, було показано, що дози до 7,0 млн ОД (70 мкг) на кілограм маси тіла добре переносяться. При передозуванні через 1-2 дні після припинення лікування препаратом кількість нейтрофілів зазвичай знижується на 50%, а через 1-7 днів повертається до норми.
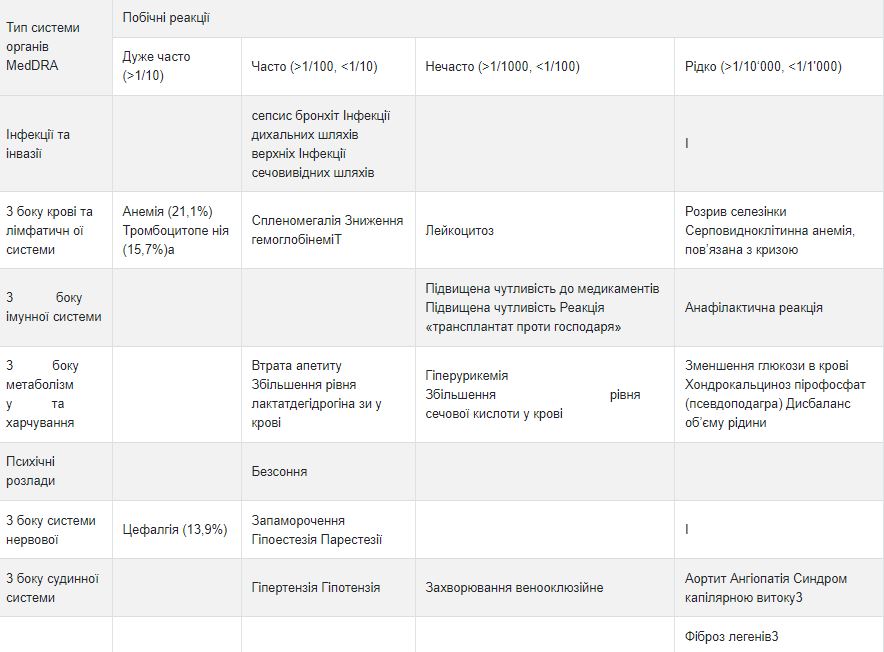
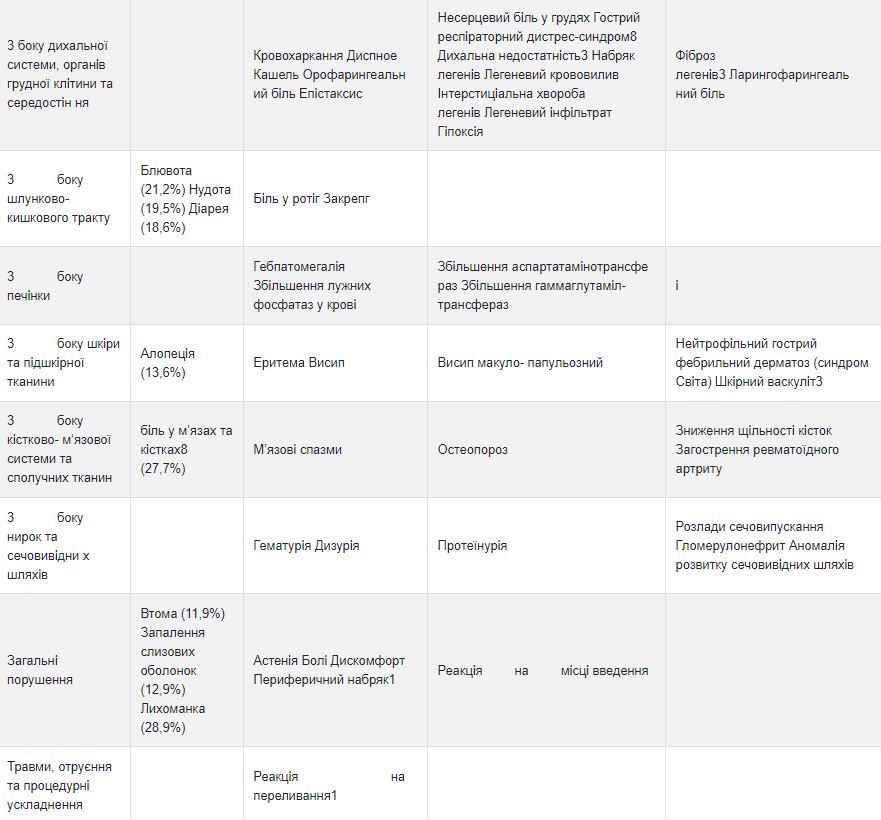
Побічні реакції
Список побічних реакцій
Клінічні дослідження Аккофіл не показали різниці між профілем безпеки Аккофіл та еталонним препаратом філграстим. Дані, наведені в таблиці нижче, стосуються побічних реакцій, повідомлених у клінічних дослідженнях із застосуванням еталонного препарату філграстиму та у контексті спонтанного повідомлення. У межах кожної групи частоти побічні реакції представлені у порядку зменшення тяжкості.
б Повідомлялося про випадки GvHD та смертей у пацієнтів після алогенної трансплантації кісткового мозку.
с В тому числі біль у кістках, біль у спині, артралгія, міалгія, біль у кінцівках, болі в опорно- руховому апараті, болі в опорно-руховому апараті у грудях, біль у шиї.
г Побічні реакції з найбільшою частотою захворювання у пацієнтів, які отримували філграстим порівняно з плацебо та пов’язані з наслідками основного злоякісного утворення або цитотоксичною хіміотерапією.
Опис вибраних побічних реакцій
Реакції підвищеної чутливості до ліків Повідомлялося про реакції підвищеної чутливості, включаючи анафілаксію, висип, кропив’янку, ангіоневротичний набряк, задишку та гіпотензію під час першого лікування та під час продовження лікування, під час клінічних досліджень та післямаркетингового досвіду. В цілому про такі симптоми повідомлялося частіше після IV введення. Іноді повторне введення препарату призводить до повторного виникнення симптомів, що говорить про причинно- наслідкові зв’язки. Аккофіл слід відмінити у разі сильної алергічної реакції. Побічні реакції з боку легень Про випадки легеневих побічних реакцій, включаючи інтерстиціальну пневмонію, легеневий набряк та легеневі інфільтрати, повідомлялося в клінічних та післямаркетингових дослідженнях. Деякі з цих випадків призвели до дихальної недостатності або гострого респіраторного дистрес-синдрому (ГРДС), які можуть мати летальний результат (див. ПОПЕРЕДЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ).
Синдром капілярного витоку Повідомлялося про синдром капілярного витоку після використання факторів росту з лінії гранулоцитів. Ці явища, як правило, з’являються у пацієнтів із запущеними злоякісними патологіями, сепсисом, які отримували багаторазову хіміотерапію або перенесли аферез після мобілізації ПСКК (див. ПОПЕРЕДЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ). Спленомегалія та розрив селезінки Після прийому філграстиму спостерігали спленомегалію та розрив селезінки. Деякі випадки розриву селезінки виявилися смертельними (див. ПОПЕРЕДЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ). Лейкоцитоз та тромбоцитопенія Після прийому філграстиму спостерігалися випадки лейкоцитозу та тромбоцитопенії (див. ОПЕРЕДЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ).
Серповиднокпітинна анемія Постмаркетингові звіти про ізольовані серповидноклітинні кризи надходили про пацієнтів із серповидноклітинною ознакою або серповиднокпітинною анемією (див. ПОПЕРЕДЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ). Шкірний васкуліт Повідомлялося про шкірний васкуліт у пацієнтів, які отримували філграстим. Діти і підлітки Дані клінічних досліджень у дітей та підлітків показують, що безпека та ефективність філграстиму порівнянна у дорослих та дітей, які отримують цитотоксичну хіміотерапію, що дозволяє припустити, що немає вікової різниці у фармакокінетиці філграстиму. Єдиним систематично повідомленим побічним ефектом був м’язово-скелетний біль, який не відрізняється від досвіду дорослого населення. Недостатньо даних для подальшої оцінки використання Аккофілу у дітей та підлітків. Інші особливі групи пацієнтів
Літні пацієнти Жодної суттєвої різниці в безпеці чи ефективності не спостерігалося між людьми старше 65 років та молодшими дорослими (> 18 років), які отримували цитотоксичну хіміотерапію. Клінічний досвід не виявив різниці у відповідях, отриманих у пацієнтів літнього та молодшого віку. Недостатньо даних для оцінки використання Аккофілу у літніх людей за іншими затвердженими показаннями.
Діти та підлітки з НКС Повідомлялося про зниження щільності кісткової тканини та остеопороз у дітей та підлітків із важкою хронічною нейтропенією, що хронічно лікувались філграстимом.
Термін придатності Аккофіл
Умови зберігання Аккофіл
Зберігати в холодильнику (2-8 °С). Випадкове потрапляння Аккофіл до температур нижче температури замерзання не має негативного впливу на стабільність продукту. Зберігати в недоступному для дітей місці. Зберігати в оригінальній упаковці, захищати від світла. Протягом терміну придатності лікарський засіб можна вийняти з холодильника та зберігати один раз при кімнатній температурі (не вище 25 °С) протягом не більше 15 днів. Після закінчення цього часу ліки більше не слід повертати в холодильник і їх слід утилізувати. Фізико-хімічна стійкість розведеного розчину для інфузії була продемонстрована протягом 24 годин при температурі від +2 °С до +8 °С. З мікробіологічної точки зору продукт слід використовувати негайно. Якщо його не використати негайно, відповідальність за термін придатності та умови зберігання несе виключно користувач. Якщо розведення не проводиться в контрольованих та затверджених асептичних умовах, розчин не слід зберігати більше 24 годин при температурі від +2°С до +8 °С.
Упаковка
По 0,5 мл у попередньо наповненому шприці з ін'єкційною голкою, з захисним кожухом; по 1 попередньо наповненому шприцу у блістері, по 5 блістерів зі спиртовими серветками у картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Аккорд Хелскеа Лімітед.
Місцезнаходження виробника
Перший поверх, Сейдж Хаус, 319 Піннер Роуд, Херроу, НА1 4HF, Велика Британія/
Ground Floor, Sage House, 319 Pinner Road, Harrow, HA1 4HF, United Kingdom.
Подальша інформація
Пам'ятайте, зберігайте ці та всі інші ліки в недоступному для дітей місці, ніколи не передавайте свої ліки іншим і використовуйте Аккофіл тільки за призначенням.
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин.
Увага! Ця інструкція для медичного застосування лікарського засобу є офіційною інструкцією виробника Аккорд Хелскеа Лімітед.
Авторське право:
- https://www.accord-healthcare.com - Аккорд Хелскеа Лімітед
| Тип даних | Відомості з реєстру |
| Торгівельне найменування: | Аккофіл |
| Виробник: | Аккорд Хелскеа Лімітед |
| Форма випуску: | розчин для ін'єкцій, 480 мг/0,5 мл, по 0,5 мл у попередньо наповненому шприці з ін'єкційною голкою, з захисним кожухом; по 1 попередньо наповненому шприцу у блістері, по 5 блістерів зі спиртовими серветками у картонній коробці |
| Реєстраційне посвідчення: | UA/18362/01/01 |
| Дата початку: | 06.10.2020 |
| Дата закінчення: | 01.04.2023 |
| Міжнародне непатентоване найменування: | Filgrastim |
| Умови відпуску: | за рецептом |
| Склад: | 1 попередньо заповненений шприц (0,5 мл) містить: філграстим 480 мг |
| Фармакотерапевтична група: | Колонієстимулюючі фактори. Філграстим. |
| Код АТС: | L03AA02 |
| Заявник: | Аккорд Хелскеа АГ |
| Країна заявника: | Швейцарія |
| Адреса заявника: | Вурматштрасе 23, 4103 Ботмінген, Швейцарія |
| Тип ЛЗ: | Звичайний |
| ЛЗ біологічного походження: | Нi |
| ЛЗ рослинного походження: | Нi |
| Гомеопатичний ЛЗ: | Нi |
| Тип МНН: | Моно |
| Дострокове припинення | Нi |
| Код ATC | Назва групи |
| L | Антинеопластичні та імуномодулюючі засоби |
| L03 | Імуностимулятори |
| L03A | Імуностимулятори |
| L03AA | Колоністимулюючі фактори |
| L03AA02 |
Філграстим
|