Классификация болезней оперированного желудка
Операции резекции желудка и различные варианты ваготомии очень распространены. В большинстве случаев после этих операций не возникает заметных нарушений функций органов пищеварения, но у части больных появляются функциональные и органические расстройства как в системе пищеварения, так и в других системах организма. Частота этих расстройств неодинакова не только в разных странах, но и в отдельных лечебных учреждениях. Практически почти полный отказ от операций гастро-энтеростомии, совершенствования методики и широкое внедрение в практику более физиологических операций селективной ваготомии позволили в последние годы уменьшить количество осложнений, связанных с этими вмешательствами.
Под термином "болезни оперированного желудка" подразумевают заболевания, развивающиеся вследствие проведенных на желудке операций, то есть появляются новые болезни и причиной их развития служат хирургические вмешательства, направленные на ликвидацию болезни, была до операции (язвенной болезни, доброкачественной или злокачественной опухоли). Следует дифференцировать болезни оперированного желудка и послеоперационные осложнения.
Предложено много классификаций указанных расстройств, но для применения в клинической практике наиболее приемлемой является классификация болезней оперированного желудка, которая приведена ниже.
Классификация болезней оперированного желудка
Пострезекцийни расстройства
Функциональные расстройства:
• демпинг-синдром
• гипергликемический синдром
• гипогликемический синдром
• пострезекцийна (агастральна) астения
• функциональный синдром приводящей петли
• гастроэзофагеальный рефлюкс
• щелочной рефлюкс-гастрит
• пищевая аллергия
• невротические состояния. Органические поражения:
• пептическая язва анастомоза
• хронический анастомозита
• желудочно-ободовокишкова свищ
• механический синдром приводящей петли
• рубцовая деформация и сужение анастомоза
• пострезекцийни сопутствующие заболевания (панкреатит, гепатит, энтерит, холецистит, рефлюкс-эзофагит и др.).
• постастрорезекцийна анемия
• технические ошибки первичной операции. Смешанные поражения:
• сочетание органических и функциональных расстройств. Постваготомични расстройства
Функциональные расстройства:
• демпинг-синдром
• гипогликемический синдром
• функциональная диарея
• нарушение функции кардиальной части желудка
• гастроэзофагеальный рефлюкс
• рефлюкс-гастрит
• гастростаз.
• дуоденостаз
• синдромы недостаточности пищеварения и всасывания
• импотенция
• сочетание нескольких расстройств. Органические поражения:
• рецидив язвенной болезни
• органический демпинг-синдром
• органические нарушения функции кардиального сфинктера
• рубцовая деформация и сужение в зоне анастомоза или пластика
• технические ошибки первичной операции
• желчнокаменная болезнь
• постфундапликацийний синдром
• хронический панкреатит
• рак желудка.
По срокам возникновения
• ранние (до 1 мес после операции)
• ближайшие (1-6 мес после операции)
• поздние (свыше 6 мес после операции).
Клинические проявления и терапевтическая тактика при отдельных пострезекцийних и постваготомичних расстройствах
С функциональных осложнений резекции желудка чаще всего наблюдают демпинг-синдром. В это понятие иногда включают также гипо-и гипер-гликемический синдромы, постгастрорезекцийну астению. Однако, по мнению большинства клиницистов, такое широкая трактовка термина "демпинг-синдром" оправдано.
Демпинг-синдром (синоним - еюнальний гиперосмолярное синдром) возникает после употребления легкоусвояемой пищи (углеводов) и проявляется комплексом нейровегетативных, вазомоторных и кишечных расстройств. Для больных с этим синдромом характерны бледность или гиперемия лица, общая слабость организма, потливость, головокружение, иногда рвота и понос, которые возникают через 10-15 мин после еды, диспепсические явления, тахикардия, артериальная гипотензия, изменения на ЭКГ (снижение зубца Т, расширение комплекса QRS).
Механизм возникновения поносов, скорее, такой: потребленная пища очень быстро переходит из культи желудка в тонкую кишку. Вследствие этого в последний образуется высокое осмотическое давление, а затем в просвет тощей кишки переходит значительная часть жидкости из кровяного русла. Эта жидкость и потребленная пища растягивают кишку, вследствие чего рефлекторно усиливается кишечная моторика и возникают вазомоторные нарушения вплоть до уменьшения кровоснабжения головного мозга.
Имеют значение:
• дегрануляция энтерохромаффинных клеток (ЕС1), что является важной составляющей APUD-системы кишок с освобождением мотилину, что стимулирует перистальтику, а также повышением секреции серотонина и гистамина; энтерохромаффинных клеток особенно много в начальном отделе (40 см) тощей кишки, где имеется градиент их активности
• при введении глюкозы (и других легкоусвояемых веществ) кишечные ворсинки расширяются, деформируются, на них образуются трещины и укорочение
• эти изменения и гиперосмия энтероцитов - источник патологической импульсации в ЦНС с возбуждением вегетативных центров четвертого желудочка и последующей эфферентной импульсацией на "периферию"
• изменение функции надпочечников ведет к выбросу адреналина, норадреналина, повышение уровня серотонина, кининов, субстанции Р (вазоактивного пептида), нарушение пищеварительной функции печени, поджелудочной железы, кишечника
• гипергликемия приводит к дальнейшему снижению уровня глюкозы и глюкозурии за счет повышенного выброса инсулина
• возникают функциональная мезентериальных гиперемия (вследствие повышения выделения холецистокинина, секретина, панкреозимин) и перераспределение крови с развитием гиповолемии.
Частота развития демпинг-синдрома во многом зависит от размеров желудочно-кишечного анастомоза и составляет от 10 до 20% от общего числа прооперированных.
Клиническая картина
• слабость, возникающая во время и после еды
• ощущение жара, гипергидратация, сонливость, шум в ушах, дрожание конечностей (при этом больные вынуждены лечь)
• приступы сопровождаются тахикардией, одышкой, головной болью, полиурией, парестезиями
• иногда возникают тошнота, изжога и отрыжка (рвота не свойственно)
• приступ сопровождается урчанием в животе и поносом конце приступа
• развитие приступа провоцирует молочная, углеводная пища
• после приступа - разбитость, слабость, снижение работоспособности, раздражительность, апатия, снижение либидо.
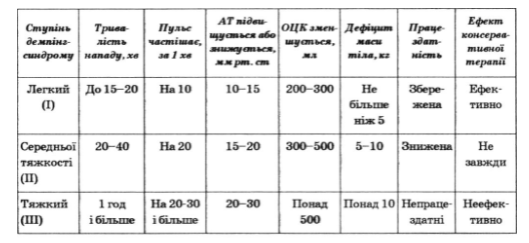
За ходом демпинг-синдром делится на три степени тяжести (табл. 37).
Таблица 37
Степени тяжести демпинг-синдрома
Лечение
Консервативное лечение применяют при легкой и средней степени тяжести, при тяжелом - больного готовят к операции.
Рекомендуется соблюдение диетического режима с общей энергетической ценностью около 3000 ккал, который предусматривает потребление пищи, богатой белками, витамины, минеральные соли, с нормальным содержанием жиров: исключают легкоусвояемые углеводы (из углеводов назначают сорбит по 3-5 г в день), пищу следует употреблять небольшими порциями, часто (5-6 раз в сутки), лежа на левом боку. Перед едой некоторым больным вводят атропин, апрофен, пла-тифилин или применяют действие электростимуляторов.
Медикаментозное лечение включает:
- седативное терапию (валериана, транквилизаторы, иногда - нейролептики)
- терапию (соляная кислота с пепсином, желудочный сок, в случае поноса - кальция карбонат или белая глина)
- антагонисты серотонина - дезерил (уменьшает интенсивность падения объема циркулирующей плазмы), резерпин и немелин
- инсулин (5-8 ЕД за 15 мин до еды внутримышечно) или букарбан (по 0,5 г внутрь); ингибитор МАО - прениламин
- гормоны анаболизма (ретаболил, неробол, метиан-дростенолон)
- гемотрансфузии, плазмотрансфузии витаминов В, С и А, рутина, в случае нарушения электролитного баланса - полиэлектролитных смеси, калий и железо.
Многие клиницисты считают гипергликемический синдром вариантом еюнального гиперосмотическим синдрома. Он развивается у больных, перенесших резекцию желудка, после еды с большим содержанием легкоусвояемых углеводов.
Вследствие быстрого перехода этих углеводов в тонкую кишку, всасывание, в частности глюкозы, значительно ускоряется. Это приводит к возникновению гипергликемии,. Характерные признаки появляются через 10-20 мин после еды: выделение горячего пота, большого количества густой слюны, сердцебиение, тошнота, ощущение жара, резкая слабость, головокружение, покраснение лица, повышение артериального давления, отрыжка, урчание в животе, понос.
Больным с Гипергликемический синдромом следует рекомендовать принимать пищу часто, малыми порциями, значительно ограничив количество углеводов в пищевом рационе (прежде легкоусвояемых). В частности, сахар можно заменить на сорбит или ксилит. В связи с повышенной возбудимостью этой категории больных им назначают седативные средства (бром, валериана, пустырник, жидкий экстракт пассифлоры и др.) и транквилизаторы.
Гипергликемический синдром , который очень быстро возникает после еды, богатой углеводами, через 2-4 ч может измениться на гипогликемический, но степень проявления каждого из них может быть различным.
Гипогликемический синдром развивается по типу ваготоничного кризис. При этом гипергликемия, вызванная быстрым всасыванием углеводов, приводит к компенсаторного поступления в кровь инсулина, который снижает уровень глюкозы в крови. Чем быстрее падает этот уровень, то значительнее будут проявления гипогликемического синдрома, тогда как абсолютные величины уровня гипогликемии имеют меньшее значение.
Степени тяжести гипогликемического синдрома.
И степень - симптомы появляются через 2-2,5 часа 2-3 раза в неделю, больные могут их не замечать
II степень - симптомы появляются 2-3 раза в неделю, больные знают их и стремятся питаться чаще. Нередко гипогликемический синдром сочетается с другими тяжелыми синдромами
III степень - признаки болезни обнаруживаются ежедневно. Через нападении заставляет прекратить работу и лечь, больные вынуждены питаться очень часто, постоянно носить с собой сахар и хлеб.
гипогликемического синдрома характерны: дрожь, холодный пот, слабость, головокружение, "волчий" голод, боль в подложечной области, бледность, артериальная гипотензия, брадикардия, боль за грудиной, шум в ушах. При тяжелых формах данного синдрома могут наблюдаться возбуждение, помрачение сознания, дезориентация или, наоборот, сонливость и даже обмороки, судороги. Больные с легкими формами этого синдрома могут быть возбужденными, у них появляются чувство голода, слабость, артериальная гипотензия, тахикардия. Иногда гипогликемический синдром может развиться не после употребления "пищи, а в случае большого перерыва между едой или вследствие значительной физической нагрузки. При этом варианте облегчения возникает после еды. Для гипогликемического синдрома, в отличие от гипергликемического, характерно преобладание парасимпатической иннервации.
Чтобы оборвать гипогликемический криз, следует рекомендовать пищу, содержащую много углеводов, легко всасываются, но при этом следует следить, чтобы гипогликемический синдром не изменился Гипергликемический. С целью предотвращения развития гипогликемии больным со склонностью к ее возникновению рекомендуют есть часто (до 6 раз в сутки), малыми порциями, избегая потребление легкоусвояемых углеводов. Количество углеводов в пищевом рационе надо увеличивать постепенно и очень осторожно-до 250-300 г в сутки. Количество сахара, которую можно употреблять такому больному, устанавливают индивидуально. Исключают сладкие блюда, изделия из сдобного теста. Рекомендуют мясо, овощи, фрукты, не содержащие глюкозы, молочные продукты. Показаны также физиотерапевтические процедуры, которые действуют седативно (теплые ванны, электрофорез брома и кальция за Вермеля или Щербаком, электросон), а также иглоукалывание. Из лекарственных средств показаны вегетативные гармонизатора, седативные препараты, транквилизаторы.
В происхождении пострезекци йного рефлюкс-гастрита играет роль заброса кишечного содержимого с желчью в желудок. Желчь влияет на слизистую оболочку желудка, этому способствует также прекращение выработки гастрина после удаления дистальной части желудка. Пострезекцийний рефлюкс-гастрит чаще всего развивается после операции резекции желудка по Билльрот II (рис. 102).
Клинически рефлюкс-гастрит оказывается тупой болью в подложечной области, чувством горечи и сухости во рту, отрыжкой, снижением аппетита. При фибро-гастродуоденоскопии обнаруживают картину атрофии слизистой оболочки культи желудка с признаками воспаления.
Рефлюкс-эзофагит возникает вследствие недостаточной замыкающий функции кардии. Как правило, его сопровождает рефлюкс-гастрит. Кишечное содержимое с примесью желчи забрасывается в пищевод, возникает щелочной рефлюкс-эзофагит.
Он проявляется ощущением боли или жжения за грудиной. Указанные признаки появляются обычно после еды, но могут быть и не связаны с потреблением пищи. Часто беспокоят сухость и горечь во рту, ощущение "застревания" пищи в горле, чувство "комка". Диагноз рефлюкс-эзофагита подтверждается при эзофагоскопии. В некоторых случаях ре-флюксий-эзофагит может осложняться сте-нозуванням пищевода.
Агастральна астения возникает вследствие нарушения пищеварительной функции желудка, поджелудочной железы, печени и тонкой кишки.
Патогенез
После резекции желудка его культя теряет свою функцию, прогрессирует атрофия слизистой, выпадает трофическая роль гастрина и других гормонов пищеварительного тракта. Отсутствие в соке соляной кислоты приводит к дисбактериозу, развития проксимальной микробной контаминации ЖКТ (микрофлора, в том числе и патогенная, дистальных отделов заселяет проксимальные), холецистита, дуоденита, приводит к снижению дезинтоксикационной функции печени, развития гепатита. пища поступает в кишки ферментативно необработанной. В двенадцатиперстной кишке в недостаточном количестве производятся секретин и хо-лецистокинин, вследствие чего нарушается функциональная активность печени и поджелудочной железы. В тонкой кишке прогрессирует хронический энтерит (с развитием отека стромы ворсинок, инфильтрацией лимфоьиднои ткани, десквамацией эпителия слизистой оболочкой), нарушение функции энтеро-цитив, секреции и всасывания различных веществ (мальабсорбции). Все это приводит к нарушению обмена белков, жиров, углеводов, микроэлементов и витаминов. Из-за прогрессирования белковых порУшен больной теряет массу тела. Возникает дефицит витаминов группы В и D, рибофлавина, никотиновой кислоты. Нарушения обмена витамина D, кальция и фтора приводит к развитию ос-теопороза и артропатий. Возникает гипохромная анемия (железо-и билководефи-цитна). В скелетных и непосмугованих мышцах прогрессируют процессы атрофии, дистрофии и нарушения иннервации.
Клиническая картина
Больные предъявляют жалобы на слабость, отеки, прогрессивную кахексии, поносы, наличие кожных изменений и эндокринных нарушений. Могут возникать: асцит, анасарка, олигурия и анурия. Имеют место анорексия, которая изменяется булемией, глоссит, фарингит, эзофагит, хейлоз. На коже появляется сыпь (симметричная пурпура), пигментация, телеангиоэктазии. Может развиться эндокринопатия с женским типом оволосения, ломкостью волос, импотенция. Время отмечают изменения психики. Формируется вторичная имунопатия с развитием различных инфекционных процессов, в частности туберкулеза.
Степени тяжести агастральнои астении: 1) легкая (незначительные проявления) 2) средней тяжести (поносы, отеки, потеря белка, жиров, анемия); 3) тяжелая (кахексия, авитаминоз, остеопороз).
Консервативное лечение включает диетотерапию, переливание крови, плазмы, белков, жиров, углеводов, витаминов, электролитов. Назначают анаболические стероиды - анабол, неробол, ретаболил, феноболил, метиландростенолон. еду сочетают с употреблением раствора соляной кислоты, пепсина и ферментов.
При тяжелой астении проводят оперативное вмешательство, в основе которого лежит включение в пассаж двенадцатиперстной кишки, увеличение емкости желудка, замедление его опорожнения.
После резекции желудка у 12% больных довольно часто развивается синдром пищевой аллергии, который в 20-30% случаев носит алиментарно-аллергический характер. Аллергенами выступают яйца, молоко, рыба, клубники, томаты, какао, шоколад и другие продукты.
Лечение
Лечение состоит в исключении из пищевого рациона продуктов, вызывающих или могут повлечь аллергические реакции, а также в назначении соответствующих антиаллергических препаратов (кальция хлорида или глюконата, димедрола, супрастина, кортикостероидов). У некоторых больных проводят специфическую десенсибилизацию возрастающими дозами непереносимого продукта.
У больных, перенесших резекцию желудка, еще чаще, чем при язвенной болезни, наблюдают невротическое состояние, преимущественно астенический, ипохондрический, тревожно-депрессивный синдромы. Ярко невротическое состояние проявляется после еды, хотя в целом астенический синдром и вегетативные расстройства довольно постоянны.
Среди болезней оперированного желудка значительное место занимают органические пост-резекционной расстройства. Так, довольно часто (до 5-10%) наблюдают пептической язвой анастомоза. Возникновению ее способствуют также наличие гиперсекреции и гиперхлоргидрией, повышения тонуса блуждающего нерва, нарушение евакуа-ной функции желудка, дистопия слизистой оболочки антрального отдела. Как рецидивная язва культи, так и пептическая язва анастомоза могут возникнуть и через несколько месяцев после операции, и через много лет. Если клиническая картина язвенной болезни сохраняется сразу после операции абсолютно неизменной, то вероятна наличие нераспознанной во время операции язвы.
пептическая язва анастомоза (рис. 103) чаще диагностируют у мужчин. Билль при ней очень интенсивный, локализуется в пупочной области. Он возникает не только после еды, но и ночью, иррадиирует в левое подреберье, левую лопатку. Кроме боли наблюдаются рвота (иногда кровавая), мелена, изжога за грудиной, которая является проявлением рефлюкс-эзофагита. При пальпации отмечают болезненность в пупочной области. Могут быть понос или запор, похудения. При возникновении осложнений язвенной болезни анастомоза появляются признаки гастродуоденальной кровотечения (около 2/3 больных), перитонита (перфорация, 6-9% больных), желудочно-ободочной свища.
Диагностика предусматривает выполнение рН-метрии (с проведением тестов Кея, Холландера, атропинового пробы), определение в крови пепсиногена-I. Уточнению диагноза помогают проведения фиброгастродуоденоскопия и рентгенологического исследования желудка. Для уточнения диагноза синдрома Цоллингера-Эллисона показано сканирования культи желудка и двенадцатиперстной кишки радиоизотопом "Тс, проведения исследования с помощью ядерно-магнитного резонанса, компьютерной томографии и определения уровня гастрина в крови.
Решающее значение для распознавания язвенной болезни анастомоза имеет эзофагогастроскопия, проявляющий язвенный дефект в области анастомоза и часто катаральный или эрозивный рефлюкс-эзофагит.
Клиническое течение этой язвы тяжелое. Она быстро становится каллезная, может пенетруваты в близлежащие органы (брыжейку, поджелудочную железу, поперечную ободочную кишку) с образованием свища между желудком, пустой и поперечной ободочной кишкой. Для последней характерны рвота калом, профузный понос, уменьшение массы тела, анемизация, дегидратация. Диагноз подтверждается рентгенологическим исследованием.
Консервативное лечение пептических язв анастомоза малоэффективно. Основным методом лечения является операция, объем которой зависит от характера предыдущего вмешательства и язвенного дефекта, выявленного во время пред-и интраоперационного обследования.
При синдроме Цоллингера-Эллисона показана резекция поджелудочной железы гормонопродукувальною опухолью, при другой локализации - ее удаления. Если гормонально-активную опухоль не найдено, то в некоторых случаях показана гастрэктомия.
Рецидивы язвы в культе желудка наблюдают редко (чаще после операции по методу Билльрот II в модификации Финстерера и Полиа-Рейхеля, реже - после операции по методу Билльрот I). Как правило, они возникают у больных язвенной болезнью дуоденальной локализации, в которых вследствие недостаточной за обягом резекции желудка сохраняется высокая кислотность желудочного содержимого.
Синдром приводящей петли анастомоза (рис. 104). В состав приводящей петли входят двенадцатиперстная кишка и начальный отдел тощей кишки - от пидвишувальнои связи двенадцатиперстной кишки (связи Трейтца) до гастро-ентеростомозу. Частота этого синдрома, по данным разных авторов, колеблется в очень широких пределах (от 3 до 40%). Синдром приводящей петли часто может развиваться в ранний послеоперационный период, в течение первого месяца, и тогда он чаще всего обусловлен механическими причинами (перегиб, сращения, интермитивна инвагинация приводящей петли в культю желудка или в отводную петлю, атония двенадцатиперстной кишки).
Клиническая картина острой непроходимости приводящей петли: боль в подложечной области, правом подреберье, тошнота, рвота. Нарастает интоксикация, воспалительный синдром. При пальпации живота в надчеревьи и правом подреберье определяют болезненность, оказывается напряжение мышц брюшной стенки. При некрозе двенадцатиперстной кишки и ее перфорации возникает клиника распространенного перитонита. При вовлечении в процесс желчного пузыря и поджелудочной железы возникает опоясывающая боль, появляются признаки желтухи и холангита. На обзорной рентгенограмме брюшной полости обнаруживают затмение, пневматоз кишечной петли отмечают длительное задержание контраста при выполнении холеграфия. Лечение - срочная операция (летальность достигает 25%).
Кроме острого может наблюдаться хронический синдром приводящей петли, которая обычно развивается в более поздние сроки после операции (через год и позже). Выделяют механический и функциональный разновидности этого синдрома. Возникновение первого вызывают механические препятствия, которые мешают опорожнению приводящей петли (сращения, спайки, перегиб), второй является следствием функциональных нарушений: гипотонии двенадцатиперстной кишки, приводящей петли, сфинктера Одди и желчного пузыря, которые могут сочетаться со спазмом стомы и выводного кишки.
В случае легкого течения хронического синдрома приводящей петли отмечают лишь тошноту, срыгивание желчью и изредка рвота небольшим количеством желчи, которое возникает через 0,5-2,5 часа после еды. При синдроме средней тяжести после еды возникает боль в области правого подреберья, часто интенсивный, рвота желчью, слабость, снижение работоспособности, потеря массы тела.
Для тяжелой формы заболевания характерны боли в правом подреберье, рвота желчью почти после каждого приема пищи, значительное уменьшение массы тела, слабость. Проявления синдрома приводящей петли усиливаются при эмоциональном возбуждении, потреблении молока и кисломолочных продуктов, жирных и сладких блюд. После рвоты и в положении больного на левом боку боль уменьшается, а иногда даже проходит. В кишках усиливаются процессы брожения, что приводит к развитию метеоризма, брюзжание.
Указанные симптомы позволяют лишь заподозрить синдром приводящей петли. Окончательный диагноз устанавливают с помощью рентгенологического исследования: барий, проникшего в ведущую петлю, задерживается там надолго. При хроническом синдроме приводящей петли наблюдается нарушение функции печени и поджелудочной железы.
Основные принципы лечения: частое питание мелкими порциями, ограничение жиров. После еды больному следует некоторое время полежать на правом боку. Пациентам с тяжелой формой синдрома приводящей петли показано оперативное лечение (дуоденоеюностомия, реконструктивные операции).
Хронический гастрит культи желудка может быть и до операции, но в некоторых случаях он развивается или ход его ухудшается после операции вследствие забрасывания желчи в желудок (рефлюкс- гастрит), развития ахлоргидрии, размножения в желудке бактериальной флоры (в частности Helicobacter pylori). На клиническую картину хронического гастрита культи может наслаиваться симптоматика, присущая синдрома малого желудка: ощущение полноты, давления и распирания в подложечной области и сытости после употребления даже небольшого количества пищи, а также отрыжка, тошнота. Слизистая оболочка культи желудка постепенно атрофируется, развиваются очаги кишечной метаплазии. Следствием этого является возникновение у большинства больных устойчивой ахлоргидрии, снижение образования пепсина. Эвакуация содержимого культи ускоряется. Одновременно с атрофией слизистой оболочки могут проявляться эрозии, особенно в области анастомоза. Эрозии могут быть как поверхностные, так и глубокие, с фибринозные наслоениями.
Атрофический хронический гастрит в культе желудка может много лет трансформироваться в полипоз или рак (через 15 лет - в 3% больных). Нередко они не дают ярких субъективных симптомов, но если опухоль расположена близко к анастомоза, то она может нарушать эвакуацию желудочного содержимого. При рентгенологическом и эндоскопическом исследовании часто трудно отличить рак от псевдоопухоли, в этом случае помогает биопсия. Нередко рак культи распознают поздно, когда проведение радикальной операции невозможно.
Хронический анастомозита, еюнит, энтерит, колит. При наличии анастомоза больные жалуются на изжогу, спазматический боль в верхней части живота, иногда - рвота (особенно после употребления вина, сахара, кислой пищи). Решающее значение для распознавания анастомозита имеет гастроскопия. Отграничить органические и функциональные изменения кишечника после резекции желудка очень тяжело, чаще всего они сочетаются.
дискинезии кишечника без органических изменений наблюдают довольно редко. Характерны такие морфологические и функциональные изменения кишечника: 1) ускорение прохождения пищи по тонкой кишке, сочетающаяся со спастическими сокращениями ее, 2) атрофия слизистой оболочки, образование псевдокист в отводной петли 3) подострый и хронический еюнит с атрофическими изменениями слизистой оболочки или без них (в последнем случае при электронной микроскопии иногда обнаруживают ультраструктурные изменения в микроворсинки и митохондриях) 4) чрезмерное заселение верхнего отдела тонкой кишки патогенными или условно-патогенными бактериями (стафилококки, протей, кишечная палочка, в частности ее патогенные штаммы, дрожжевые грибы, дипло-, стрептококки и другие бактерии, в частности анаэробные). Частота и интенсивность этого заселения коррелирует со степенью снижения кислотности желудочного сока, достигая максимума при ахлоргидрии.
Воспалительные изменения происходят не только в тонкой, но и в толстой кишке. После резекции желудка нередко развиваются органические и функциональные поражения печени, желчных путей и поджелудочной железы, которые иногда выходят на первое место в клинической картине. Часто наблюдается обострение заболеваний, которые были до операции, или усиление присущих язвенной болезни органических и функциональных изменений органов пищеварения. Нарушаются основные функции печени и поджелудочной железы, развивается жировая дистрофия печени и, чаще всего, ультраструктурные изменения гепатоцитов, развивается холецистит, дискинезия желчных путей. Эти изменения обусловлены дисбактериозом, нарушения секреции холецистокинина и секретина слизистой оболочкой двенадцатиперстной кишки, нарушением нормального состава желчи и ее стазом вследствие расстройства нервно-гуморальной регуляции.
Клиническая картина энтерита характеризуется вздутием живота, болью в области пупка, урчанием в животе, болезненность при пальпации, спастическими сокращениями участков тонкой и толстой кишки. При колите наблюдают поносы, чередующиеся с запорами, изменение характера стула.
Лечение - консервативное (диета, антибактериальные препараты, ферментные средства, вещества еубиотичнои действия на микробную экосистему кишок).
Развитие хронического гепатита связан с удлинением латентного периода выделения желчи после резекции желудка, застоем в приводной петли, воспалительными и застойными изменениями в ней и в зоне большого сосочка двенадцатиперстной кишки. Нередко диагностируют пострезекцийний гепатит, в 4-20% случаев приводит к циррозу печени.
Лечение пострезекцийного гепатита - консервативное (диета, гепатотропные средства, инфузионная терапия, витамины, спазмолитики, желчегонные, физиотерапия).
Коррекция функциональных расстройств желчных путей заключается в соблюдении диетического режима (диеты № 5а и 5), беззондового дренажа желчных путей назначении желчегонных средств, тепловых процедур.
Наряду с поражением гепатобилиарной системы обнаруживают патологические изменения поджелудочной железы. Операционная травма может привести к развитию как острого панкреатита и панкреонекроза, так и хронического панкреатита. Возникновению последнего способствуют повышению давления в двенадцатиперстной кишке, атония сфинктера Одди, нарушения питания, нарушения функции печени и желчных путей. Основными проявлениями панкреатита является нарушение внешнесекреторной функции поджелудочной железы, которые в наибольшей мере проявляются в раннем послеоперационном периоде, а позже уменьшаются и даже исчезают. Одновременно с уменьшением секреции, снижением активности панкреатических ферментов, диспанкреатизм могут появляться нарушения внут-ришньосекреторнои функции поджелудочной железы.
Различают хронический рецидивирующий, латентный и болевой панкреатит. Рецидивирующий панкреатит проявляется периодическими обострениями, болью в подложечной области с иррадиацией в спину, левое плечо, повышением уровня амилазы в крови и моче, воспалительным диспепсическим синдромами. Болевой панкреатит проявляется непрерывным болью в животе, похуданием, астеническим синдромом. Латентная форма хронического панкреатита проявляется признаками экскреторной (ферментной) и инкреторной (сахарный диабет) недостаточности.
Лечение хронического пострезекцийного панкреатита аналогичное таковому при других формах хронического панкреатита - диета, заместительная, ферментная терапия, физиотерапевтические процедуры и т.д.. Лечение других постгастрорезек-ных синдромов улучшает течение панкреатита. В редких случаях показано оперативное лечение (при развитии кист, полной окклюзии протоков поджелудочной железы, малигнизации).
Рефлюкс-эзофагит особенно часто наблюдают после тотальной резекции желудка. Наиболее характерными его симптомами являются изжога, боль за грудиной, регургитация горького и кислого желудочного содержимого, особенно в положении лежа.
Частым осложнением резекции желудка бывает пострезекцийна дистрофия.
Постгастрорезекцийна анемия развивается у 10-15% больных, оперированных по методу Билльрот II, и встречается в двух вариантах: гипохромная железодефицитная анемия и гиперхромной В 12 - дефицитная анемия.
Патогенез железодефицитной анемии связан с нарушением ионизации и резорбции железа вследствие ахлоргидрии, ускоренного пассажа по тонкой кишке и атрофического энтерита, а также с кровотечениями, нередко скрытыми, с септических язв анастомоза.
К развитию В 12 -дефицитной анемии приводят резкое уменьшение выработки внутреннего фактора Кастла после удаления антрального отдела желудка, развитие атрофии слизистой оболочки тонкой кишки и дисбактериоза.
Дифференциальная диагностика анемий основывается на изучении периферической крови и костного мозга. В периферической крови при железодефицитной анемии наблюдается гипохромия эритроцитов и микроцитоз, а при В 12 -дефицитной анемии - гиперхромия и макроцитоз. В мазке костного мозга при В 12 -дефицитной анемии обнаруживают мегалобластоьидний тип кроветворения.
Лечение гипохромной железодефицитной анемии проводят препаратами железа. Обычно назначают внутрь железосодержащие препараты (фероплекс, ферамид, тардиферон) с одновременным употреблением аскорбиновой кислоты в суточной дозе 0,2-0,3 г. Парентеральная терапия препаратами железа показана только в случае непереносимости препаратов железа, применяемых внутрь, и их неэффективности.
Лечение больных В 12 -дефицитную анемию начинают с ежедневного введения витамина 12 (по 100-200 мкг) и продолжают до ретикулоцитного кризис (повышение количества ретикулоцитов в периферической крови более чем в 10 раз), что обычно наступает на 5-й день лечения. В дальнейшем, до наступления гематологической ремиссии (обычно 4-5 нед) препарат вводят в тех же дозах через день, а в дальнейшем - 2 раза в месяц. Лечение витамином В 12 следует сочетать с назначением фолиевой кислоты внутрь по 0,001-0,002 г З раза в день.
Метаболические нарушения развиваются чаще после резекции желудка, что значительно нарушает функциональный синергизм органов пищеварительной системы. В патогенезе этих нарушений, очевидно, существенную роль играет не только удаление значительной части органа, но и выключение пассажа через двенадцатиперстную кишку, если резекция выполнена по методу Билльрот II. Метаболические нарушения могут сопровождать вышеперечисленные расстройства, будто вплетаясь в их клиническую картину, или, иногда, иметь самостоятельное значение. Ярчайшим проявлением метаболических нарушений в клинике является дефицит массы тела. Уменьшение массы тела ниже нормальной или невозможность набрать дооперационную массу отмечают примерно в 1/4 оперированных.
Среди многих причин этих нарушений можно отметить уменьшение объема пищи, непереносимость отдельных продуктов, нарушение абсорбции жира и белка, усвоение витаминов и минеральных веществ. Все это достаточно демонстративно, когда оперированные больные страдают выраженную диарею, гиповитаминозы, костную патологию (остеопороз или остеомаляция).
Лечение метаболических нарушений является сложной проблемой и в его основе должна лежать диетотерапия. В тяжелых случаях показано стационарное лечение (специальные высококалорийные диеты, заместительная терапия, андрогены).
Повышенная восприимчивость к инфекционным заболеваниям. Высокая резекция желудка зачастую приводит к реактивации туберкулеза легких, который был у больного ранее, или повышает предрасположенность к этому заболеванию. Это обстоятельство следует всегда иметь в виду, решая вопросы диагностики и лечения постгастрорезекцийних нарушений, особенно если у больных имеются выраженные расстройства питания и дефицит массы. Указания на туберкулез в анамнезе является веским основанием для выбора рационального способа операции при язвенной болезни, обеспечит должной мерой предотвращения тяжелых расстройств питания в послеоперационный период (например, пилороплас-тика с ваготомией).
После резекции желудка довольно часто (до 10% всех случаев) развиваются перигастрит и перивисцерит, что обусловлено: 1) обострением после операции перигастрита, который осложняет течение язвенной болезни, 2) травматизацией и инфицированием во время операции, 3) рецидивами язвенной болезни; 4) воспалительными изменениями в области анастомоза.
Для перивисцериту характерен постоянный длительная боль в животе, которая усиливается во время резких движений, трясьбы. При объективном исследовании отмечают гиперестезия в зонах Захарьина-Геда. У больных с перигастрита зона тимпанический звук над культей желудка может достигать правой пригрудниннои, а иногда - даже правой среднеключичной линии, одновременно распространяясь вверх. При повторном обследовании через несколько дней конфигурация и размеры этой зоны существенно не меняются (симптом Стражеско). При пальпации живота, особенно глубокой, отмечают болезненность. Периодически наблюдают повышение температуры тела до субфебрильных величин. Перивисцерит может вызвать появление признаков частичной кишечной непроходимости, что требует повторного оперативного вмешательства и приведет к дальнейшему прогрессированию спаечного процесса. При перигастрита рентгенологическое исследование выявляет деформацию культи желудка, уменьшение подвижности петель кишечника и распространения выше места сужения.
Опухоли оперированного желудка. Рак желудка или желудочно-кишечного анастомоза у больных язвенной болезнью, перенесших резекцию желудка или гастроэнтеростомией, случается редко.
Рак культи желудка чаще развивается после резекции желудка по Билльрот II, чем за Билльрот И, что связывают с рефлюксом желчи в желудок. Определенную роль в развитии рака культи желудка играет также анаэробная флора, превращает нитраты пищи в канцерогенные нитрозамины. Рак культи желудка развивается через 20-25 лет после резекции желудка, но возможен и более раннее развитие. Как правило, опухоль располагается в области гастроентероанасто-Минздрава, а затем распространяется вдоль малой кривизны желудка до кардиального отдела.
Однако некоторые ученые считают, что у больных, перенесших резекцию желудка, есть факторы образованию рака. К ним относятся отсутствие соляной кислоты, наличие у этих больных атрофического гастрита.
Основными симптомами рака культи желудка являются:
• постоянная боль в подложечной области
• выраженное чувство тяжести в надчеревьи после "еды, отрыжка тухлым
• уменьшение или полное исчезновение аппетита
• прогрессивное похудание больного
• нарастание слабости
• развитие анемии
• постоянно положительная реакция Грегерсена.
Рак культи желудка имеет форму полипа или язвы. Для ранней диагностики рака культи желудка чрезвычайно важно своевременно проводить фиброезогас-тродуоденоскопию с обязательной биопсией слизистой оболочки желудка.
Благодаря радикальной операции некоторые больные с опухолью культи желудка или желудочно-кишечного анастомоза выздоравливают. Для правильного и своевременного диагностирования заболевания следует тщательно и вдумчиво анализировать всю получаемую информацию: анамнестические данные, жалобы, общее состояние, данные лабораторно-рентгенологических и эндоскопических исследований.
Больной после резекции желудка должны находиться на диспансерном наблюдении и проходить ФЭГДС 1-2 раза в год. В дальнейшем ФЭГДС проводят с появлением или усилением "желудочных" жалоб.
Диагностика опухолей оперированного желудка связана со значительными трудностями, поскольку симптоматика рака желудка может сочетаться с клинической картиной других болезней оперированного желудка и таким образом ослабить онкологическую настороженность врача. Различные деформации, вызванные спайками, рубцами или наложенным анастомозом, делают рентгенологическую диагностику малоэффективной. Гастроскопия также не всегда дает достоверные данные.
В клинической картине преобладают явления дискомфорта, потеря аппетита, нарастание слабости, отрыжка воздухом, рвота и тошнота, которых не было у больного длительное время после перенесенной операции. Болевой синдром обычно вызывается сочетанием опухоли с хроническим панкреатитом или пептической язвой. Отмечается выраженный дефицит массы тела (10-14 кг), умеренная гипохромная анемия (НЬ в среднем 100 г /л), увеличение СОЭ. Часто имеющаяся клиническая картина непроходимости отвода?? Рекордного петли опухолевой природы. Всего сочетание ахлоргидрии, анемии и общего ослабления организма позволяют установить опухолевую природу заболевания.
Постваготомични синдромы возникают у 15-20% оперированных и связанные с тактическими и техническими ошибками: до, во время и после операции.
Дооперационные ошибки:
1) при установлении показаний к операции (выполнение ваготомией при наличии значительных анатомо-морфологических изменений в пилородуоденальной зоне, при синдроме Цоллингера-Эллисона)
2) при определении сроков выполнения органосохраняющую операций (парасимпатическая денервация желудка при наличии язв больших размеров, выраженного воспалительного процесса в тканях, прилегающих к зоне язвы).
Интраоперационные причины:
1) ошибки техники парасимпатической денервации желудка и выполнения операций дренирование желудка (ранения смежных органов, повреждения сосудов брюшной полости)
2) неучет вариантов ветвления блуждающих нервов.
Послеоперационные причины постваготомичних синдромов (ранние, ближайшие и поздние) в ранний послеоперационный период связан с:
1) ошибками техники операции (кровотечение в брюшную полость, перитонит, отек пищевода или сжатия его гематомой, некроз стенки желудка и пищевода, кровотечение из эрозированных сосуды на дне пенетрацийнои язвы двенадцатиперстной кишки и т.д. )
2) неадекватным ведением послеоперационного периода (неэффективная декомпрессия желудка и стимуляция моторики кишечника).
В ближайший срок после операции болезни ваготомичного желудка, как правило, обусловлены гипомоторикою желудка или двенадцатиперстной кишки (га-стро-и дуоденостаз), гипермоторикою тонкой кишки (демпинг-синдром), дис - координацией двигательной активности желудка и кишечника (диарея, дуоденогастраль-ный рефлюкс).
В отдаленный период постваготомични синдромы вызываются преимущественно неадекватной или неполной ваготомией, дуоденогастральным рефлюксом, недостаточным дренированием желудка и др..
органосохраняющую операции могут приводить к развитию раннего и позднего демпинг-синдрома.
Ранний демпинг-синдром занимает второе место среди патологических состояний у лиц, перенесших ваготомия.
Клиническая картина постваготомичного демпинга не отличается от той, которую наблюдают у больных после резекции желудка. Вместе постваготомичний демпинг-синдром характеризуется более легким течением. С увеличением сроков послеоперационного периода прослеживается тенденция к уменьшению его клинических проявлений, вплоть до полного исчезновения.
Диагностика постваготомичного демпинг-синдрома основывается на анализе его клинической картины, результатов рентгенологических и эндоскопических исследований и обьективизуеться провокационным тестом с глюкозой. Проба считается положительной, когда после употребления больным 150 мл 20% раствора глюкозы уровень глюкозы в крови увеличивается по сравнению с нормой в среднем на 10-15%.
Лечение демпинг-синдрома после ваготомии преимущественно консервативное. Рекомендуется медленное, малыми порциями еды с ограничением количества простых углеводов. У большинства больных с легким течением демпинг-синдрома соблюдения таких рекомендаций позволяет избавиться от него. Больным с тяжелым течением демпинг-синдрома назначают препараты, которые улучшают пищеварение и всасывание пищи, замедляют эвакуацию из желудка и моторику кишечника. С этой целью пациенты получают сок подорожника, плантаглюцид, пепсидил, кислоту хлорную разведенную, ферментативные средства (фестал, панкреатин, панзинорм и др.).. Используют также холиноблокаторы - атропина сульфат (0,5-0,75 мл 0,1%, раствор вводят внутримышечно за 10-15 мин до еды), гастроцепин (25 мг 2-3 раза в день за 20-30 мин до еды в течение 2-4 нед). У пациентов с астеническим синдромом целесообразно применять ципрогептадин (перитол) по 4 мг перорально 2-3 раза в день за 15-30 мин до еды. При демпинг-синдроме, который сочетается с депрессивным состоянием, назначают циклический антидепрессант амитриптилин, который имеет холе-ноблокувальну способность. Амитриптилин употребляют внутрь по 12,5-25 мг 1-2 раза в день до еды. Доказано положительный результат при демпинг-синдроме реасексу (содержит дифеноксилат и атропин) и лоперамида (имодиуму) - по 1/2 таблетки 1-2 раза в день перед завтраком и обедом в течение 2-3 нед). В комплекс консервативных мероприятий включают и препарат L-ДОФА (леводопа) - 125 мг за 15 мин до еды 2 раза в день, который положительно влияет на нарушенную при демпинг-синдроме нейрогуморальную регуляцию благодаря увеличению синтеза в ЦНС дофамина. Консервативные мероприятия позволяют устранить проявления демпинга легкой степени и значительно улучшить состояние больных при демпинг-реакции средней и тяжелой степеней. В исключительных случаях тяжелого постваготомичного демпинг-синдрома, что сопровождается истощением пациентов и нарушением работоспособности, показано оперативное лечение.
Диарея относится к специфическим осложнений ваготомии, чаще развивается после стволовой ваготомии и реже - после селективной проксимальной ваготомии - в 2-10% случаев. Возникновение ее связывают с усилением моторики кишечника, что сопровождается ускореннымнием пассажа пищи по пищеварительному тракту.
Легкие формы диареи обычно не требуют специального лечения, со временем они претерпевают обратное развитие и легко корректируются диетой. Больным с течением средней тяжести и тяжелым назначают препараты, нормализующие моторику пищеварительного тракта (бензогексоний, церукал, ганглерон, реглан), снижают абсорбцию желчных солей в кишечнике (холестирамин), антихолинергические средства (атропин, скополамин, препараты белладонны), ферментные препараты (фестал , панзинорм). Выраженную антидиарейное действием обладают дифеноксикислоты (реасек) и опиоды (имодиум). Эти препараты применяют по 2-3 таблетки в день в течение 3-10 дней до достижения эффекта. При наличии дисбактериоза проводят его коррекцию. При отсутствии эффекта от консервативного лечения некоторые хирурги предлагают оперативное вмешательство.
гастростаза характеризуется нарушением моторно-эвакуаторной функции желудка и является специфическим постваготомичним синдромом, который наблюдается в 2-23% пациентов.
Чаще гастростаз появляется у лиц, оперированных по поводу поздних стадий стеноза, потому что у них уже до операции является нарушение моторной функции желудка. Чаще развития гастростаза способствуют повреждения нерва Латарже при СПВ, аностомозиты, дуоденостаз, перигастрит, высокое расположение пилородуоденальной перехода вследствие особенностей анатомического развития гастродуоденальной системы на фоне ослабления двигательной активности ваготомичного желудка, сужение или полное срастание ОГА.
Диагностика гастростаза и его причин основывается на анализе жалоб, данных анамнеза, результатов рентгенологического, фиброгастроскопичного и электронов рогастрографичного методов исследований. Желудок при гастростаза перерозтяг-нуть, атонический, содержит большое количество слизи и пищи. Как в области тела желудка, так и в пилороантрального отдела наблюдают скопление газов. Вероятной информацию о степени гастростаза дает прослеживание эвакуации бариевой взвеси из желудка через 6, 12, 24 часов.
Инструментальный метод исследования позволяет отдифференцировать функциональный гастростаз от органического. Так, проводя рентгенологическое исследование, следует иметь в виду, что органический гастростаз сопровождается усилением перистальтики и отсутствием эвакуации из желудка в любом положении больного. Функциональный гастростаз характеризуется свободным опорожнением желудка от бариевой взвеси преимущественно в положении пациента лежа на правом боку. При фиброгастроскопии у лиц с органической гастропатии определяют сужение участка анастомоза (анастомозита), повышенное скопление пищеводного химуса в двенадцатиперстной кишке (органический дуоденостаз), а при функциональном гастростаза - атонию желудочной стенки, выраженную антиперистальтику двенадцатиперстной кишки. Регистрация биоэлектрической активности желудка обнаруживает резкое снижение всех параметров электро-гастрограм в случае функциональной гастроплегии и повышения их - у пациентов с органической гастропатии.
Лечение гастростаза проводят комплексно, с учетом его причин. Применяют постоянную фракционную или временную (2-3 раза в сутки) декомпрессию желудка. Сроки декомпрессии определяются скоростью восстановления моторно-эвакуаторной функции желудка. Назначают церукал (1 мл внутримышечно 1-3 раза в день), бензогексоний (0,5-1 мл 2,5% раствора внутримышечно 1-3 раза в день), питуитрин (1 мл подкожно 1-3 раза в день ), прозерин (1 мл 0,05% раствора 1-3 раза в день). Вводят полийонни растворы, соли калия, хлоридов, 10% раствор ксилита (0,5 мл на 1 кг массы тела). Эффективным методом лечения гастростаза является стимуляция двигательной активности желудка диадинамические и синусоидальные токами, йонофорез ацетилхолина.
В случае значительного расширения желудка, атонии и истончение его стенки при гастростаза любого генеза лучшим методом операции является резекция желудка. При значительном риска операции в такой ситуации возможно выполнение дренирующих операций на желудке.
Профилактика гастростаза заключается в правильном выполнении операции, проведении комплекса консервативных мероприятий, направленных на восстановление двигательной функции ваготомованого желудка с 1-го дня послеоперационного периода.
Проявления большинства постваготомичних расстройств подобные тем, которые наблюдают после резекции желудка. После селективной проксимальной ваготомии рецидив язвенной болезни возникает в 4-14% случаев. С усовершенствованием оперативной техники этот процент уменьшается и увеличивается промежуток времени от оперативного вмешательства до возникновения рецидива (сейчас он колеблется в пределах 1-8 лет). В отличие от рецидивной язвы после резекции желудка постваготомична рецидивная язва часто имеет малосимптомно и даже асимптомного течение. После консервативного лечения она рубцуется у 80% пациентов и только 20% больных нуждаются в повторной операции (реваготомия, резекция или пилоропластики).
Желудочно-пищеводный рефлюкс-эзофагит, который часто сопровождает язвенную болезнь, особенно дуоденальной локализации, после операции селективной проксимальной ваготомии вследствие снижения кислотности желудочного содержимого в большинстве случаев вылечивается, потому рефлюкс-эзофагит, проявляемый после этой операции, скорее всего, был и до нее. Для лечения желудочно-пищеводного рефлюкс-эзофагита приме?? Овують соответствующий диетический режим, прокинетики (см. "Гастроэзофагальный рефлюксная болезнь").
Рефлюкс-гастрит возникает в 5-35% оперированных после резекции, ваготомии, гастроэнтеростомией и сфинктеропластикы результате заброса дуоденальной желчи в желудок и воздействия на его слизистую оболочку солей желчных кислот, ферментов поджелудочной железы , лизолецитин. Последний разрушает клетки эпителия путем удаления из их структуры липидов, приводя к обратной диффузии Н + и поступления Na + , вызываемую к образованию в желудке эрозий и язв. Щелочная среда способствует активному росту микрофлоры, активируя поражения слизистой оболочки бактериальным эндотоксином.
Клиническая картина . Больного беспокоят отрыжка, боль в надчеревьи, рвота желчью, потеря массы тела. Возникают анемия, гипо-, ахлоргидрия. Диагностика основывается на фиброгастродуоденоскопия с биопсией слизистой оболочки. Гистологическое исследование биоптатов выявляет хроническое воспаление слизистой оболочки с явлениями метаплазии и уменьшением количества обкладкових клеток.
При постваготомичному рефлюкс-гастрите существенно снижается базальная и стимулированная секреция соляной кислоты. При эндоскопическом исследовании в желудке обнаруживают повышенное количество желчи, отмечают отек, гиперемию и кровоточивость слизистой оболочки. Лабораторное исследование свидетельствует о наличии в желудочном соке компонентов дуоденального содержимого.
Лечение щелочного постваготомичного рефлюкс-гастрита заключается в уменьшении или устранении ДГР, сокращении времени контакта дуоденального содержимого со
желудочной стенкой. Применяют средства, стимулирующие трофические процессы в слизистой оболочке желудка (гастрофарм по 2,6 г 3 раза в день за 30 мин до еды, метилурацил по 0, 25 мг 3 раза в день после еды), производят цитопротекторное действие (сукральфат 6 г день), ускоряют эвакуацию желудочного содержимого (метоклопрамид), связывают желчные кислоты (холестирамин) и другие.
В случае неэффективности консервативного лечения показана реконструкция гастроэнтероанастомоза.
Рефлюкс-эзофагит - осложнения ваготомии, обусловлено нарушением замыкающий функции кардии, обнаруживают в 3-37% пациентов. В более 6% больных причиной его развития является грыжа пищеводного отверстия диафрагмы и недостаточность замыкательной функции кардии. Вследствие регургитации желудочного содержимого происходит повреждение слизистой оболочки пищевода различной степени выраженности.
При постваготомичному рефлюкс-эзофагит больные жалуются на боль за грудиной, изжогу, горечь во рту, сдерживания, регургитацию во время сна. В случае прогрессирования заболевания присоединяется дисфагия, связанная со спазмом или стриктурой пищевода, воспалением окружающих тканей.
Диагностика рефлюкс-эзофагита носит комплексный характер, она включает данные клиники и специальные методы исследования (лабораторные, эндоскопические, рентгенологические).
Лечение заболевания у большинства пациентов консервативное, направлено на улучшение моторики ЖКТ и трофики пораженных тканей. При отсутствии эффекта, наличии грыжи пищеводного отверстия диафрагмы применяют операцию восстановления замыкающий функции кардии.
Дуоденостаз - редкое осложнение ваготомии. Причинами поствагото-мической дуоденостазом является недиагностированной к операции хроническое нарушение дуоденальной проходимости, артерио-мезентеральных компрессия ДПК, рубцовый процесс в области дуоденоеюнального перехода или его высокое стояние, инверсия двенадцатиперстной кишки. В отдельных случаях дуоденостаз развивается вследствие технических погрешностей во время операции: повреждение кишечной стенки, чрезмерной мобилизации двенадцатиперстной кишки по мохер, неправильного выполнения дренирующих операций на желудке.
Специфические клинические проявления постваготомичного дуоденостазом отсутствуют. Больных беспокоят чувство тяжести, полноты в надчеревьи и правом подреберье, горечь во рту, тошнота, рвота с примесью желчи.
Диагностика дуоденостазом основывается на лабораторно-инструментальных методах исследования. Наиболее информативным является рентгеноскопия (графия) желудка и двенадцатиперстной кишки, благодаря которым проявляют значительное расширение последней с длительным задержании в ней контрастной взвеси.
Лечение дуоденостазом чаще консервативное. Однако оно не всегда эффективно, поэтому по строгим показаниям выполняются операции. Предпочтение отдают резекции желудка с наложением гастроэнтероанастомоза "конец в бок" за Ру или резекции дуоденального угла (операция Робинсона).
Образование камней в желчном пузыре после ваготомии регистрируют в 0,9 - 1,2% случаев независимо от вида парасимпатической денервации желудка. У одних пациентов конкременты в желчном пузыре клинически не проявляются, в других - приводят к развитию приступа острого холецистита или холецис-топанкреатиту.
Образование камней в желчном пузыре связывают с его постваготомич-ной атонией и застоем желчи.
Ведение пациентов с постваготомичним холецистолитиаз зависит от клинических проявлений заболевания. Если наличие камней не проявляется соответствующими симптомами, показано диспансерное наблюдение. В случае развития хронического калькулезного холециститету выполняют плановую операцию. Лечение острого калькулезного постваготомичного холецистита осуществляется в соответствии с общепринятой тактики.
В 0,5-20% случаев после ваготомии, преимущественно стволовой и селективной, могут возникать синдромы мальдигестии (недостаточности пищеварения) и мальабсорбции (недостаточности всасывания). Синдромы обусловлены постваготомичним дефицитом пищеварительных ферментов, изменением структуры пустой и подвздошной кишок, нарушением транспортных механизмов, двигательной функции кишечника, развитием кишечной патогенной микрофлоры.
Синдром характеризуется ощущением тяжести в животе, его вздутие, урчание, жидким стулом, слабостью, повышенной утомляемостью. В отдельных случаях отмечают трофические расстройства кожи, волос, ногтей.
Как правило, у лиц с постваготомичним синдромом мальабсорбции есть определенные нарушения полостного и мембранного пищеварения, а также всасывание в дооперационный период. Эти изменения констатируют по данным определения активности ферментов полостного и мембранного пищеварения с одновременным изучением всасывающей функции тонкой кишки (D-ксилозним тестом). Обычно у лиц с указанными синдромами отмечают резкое угнетение полостного и мембранного пищеварения. В 80-87% случаев всасывания нарушается как в проксимальных, так и в дистальных отделах тонкой кишки. В отличие от демпинг-синдрома и диареи синдром недостаточности пищеварения с увеличением срока наблюдения не имеет тенденции к обратному развитию.
Лечение больных с синдромами мальдигестии и мальабсорбции начинается с консервативных мероприятий: назначение диеты с повышенным содержанием белков, жиров, углеводов, коррекции нарушений водного и электролитного обмена кислотно-щелочного состояния, проведения заместительной терапии (желудочный сок, соляная кислота, фестал, панкреатин, панзинорм). Неэффективность длительной терапии, тяжесть клинических проявлений синдромов является показанием к оперативному вмешательству - тонкокишечной гастродуоденопластикы.
Частота дисфагии после операций ваготомии колеблется от 2 до 30%. В последние годы количество этих осложнений значительно уменьшилось, что связано преимущественно с отказом от стволовой ваготомии и заменой ее селективной проксимальной ваготомии (перерезания ветвей блуждающего нерва, стимулирующих продукцию соляной кислоты и иннервирует кардиальный отдел желудка, тогда как иннервация антрального отдела сохраняется). Но даже при стволовой ваготомии дисфагия обычно является не постоянным, а лишь интермитив-ным симптомом, или спонтанно исчезает через несколько лет после операции, или подвергается консервативной терапии.
Причинами ранней дисфагии является травма и отек стенки пищевода и на-вколостравохиднои ткани, нарушение функции кардиального угнетение вследствие денервации. Ранняя дисфагия обычно не достигает тяжелой степени и самостоятельно проходит через 1-2 мес. Развитие дисфагии в более отдаленные от ваготомии сроки связывают с фиброзом в зоне операции и стенозированием дистального отдела пищевода. Поздняя дисфагия бывает более выраженной и устойчивой.
При дисфагии легкой степени рентгенологическими и эндоскопическими методами обычно не удается выявить никаких патологических изменений в пищеводе. В тяжелых случаях рентгенологически выявляют субстенотични расширения и задержания бариевой взвеси в дистальном отделе пищевода, а эндоскопически - рефлюкс-эзофагит.
Кратковременная дисфагия раннего послеоперационного периода не требует специального лечения. При неврозах назначают транквилизаторы и седативные средства. При стойкой дисфагии, возникшая в поздний период, нередко приходится прибегать к бужирование пищевода.
Специфическим осложнением ваготомии является ощущение наполненности в области надчеревья, возникающая сразу после еды. Этот симптом наблюдается в трети случаев, и появляется он сразу после операции. Его возникновение объясняется как потерей проксимальной частью денервованого желудка способности к адаптогенного расслабления, так и торможением эвакуации не только твердой, но и жидкой пищи. Этот симптом обычно поддается консервативному лечению, заключается в частом потреблении "пищи мелкими порциями, употреблении внутрь и в инъекциях метоклопрамида (церукал, реглан), домперидона (мотилиуму), цизаприда (координакса) иногда проводят промывание желудка.
Диарея нередко появляется неожиданно, иногда провоцируется потреблением молочной пищи и углеводов. В легких случаях - жидкий стул до 2-3 раз в день в течение нескольких дней. В более тяжелых случаях - дефекация до 10 раз в сутки, а в период обострения затягивается до 1 мес и более.
Лечение. При обострении - диета № 46 и 4в, после нормализации стула - полноценное питание с исключением продуктов, которые плохо переносятся больным. Для замедления кишечной пропульсия назначают ре-асек или имодиум течение 5-7 дней. С целью улучшения пищеварения используют ферменты поджелудочной железы; лучше переносятся препараты чистого панкреатина, которые не содержат желчных кислот.
Демпинг-синдром. После селективной проксимальной ваготомии, особенно при применении дренирующих операций, развивается у 10-15% больных.
Однако тяжелые формы синдрома Спостеригають очень редко. Чаще всего он связан с ошибками во время операции, прежде всего с повреждением заднего ствола блуждающего нерва. Причины развития постваготомичного демпинг-синдрома те же, что и постгастрорезекцийного, - ускоренное опорожнение желудка, повышение осмотического давления в тонкой кишке, быстрое всасывание углеводов с последующим избыточным образованием инсулина, раздражения рецепторного аппарата тонкой кишки, что приводит к выделению биологически активных веществ.
Диагностика и лечение постваготомичного демпинг-синдрома см.. "Пост-гастрорезекцийний демпинг-синдром".
Диарею после операции селективной проксимальной ваготомии наблюдают редко. Чаще всего она обусловлена повреждением ствола блуждающего нерва во время операции. Патогенетическими механизмами такой диареи является повышение выработки желчных кислот, особенно урео-и хенодезоксихолевой, поэтому положительный эффект достигается при соблюдении бесмолочной диеты и назначение холестирамина, антацидных препаратов, содержащих гидрат оксида алюминия, а также кальция карбоната, белой глины. Для подавления микробной гиперколонизации назначают антибиотики.
Нарушение функции кардии проявляется симптомами ахалазии и рефлюкс-эзофагита и обычно протекает легко. Лечение - консервативное (диетотерапия, лекарственные препарты).
Нарушение опорожнения желудка проявляется клиникой гастростаза. Иногда (кроме функционального компонента) причиной его служит формирование "каскадного" желудка (3-4%). В случае нарушения техники фундопликации при СПВ может произойти сужение желудка в средней и верхней трети. Важное значение в диагностике имеет рентгенологическое исследование.
Если желудок имеет вид песочных часов с выраженным нарушением эвакуации содержимого, показана операция (резекция желудка).
Нарушение моторики билиарной системы и желчнокаменная болезнь чаще возникают после стволовой ваготомии - дискинезия за атоническим типом (пузырь Ашофф, атония сфинктера Одди и гипотония желчного пузыря).
Лечение - консервативное . При желчнокаменной болезни показана операция (открытая или лапароскопическая холецистэктомия).
В послеоперационный период проводят профилактику пареза кишечника (декомпрессия желудка, церукал, прозерин, гипертонический раствор натрия хлорида внутривенно, клизмы), пневмонии (ЛФК, массаж грудной клетки, дыхательная гимнастика), тромбоэмболических осложнений (раннее вставание, эластичное бинтование нижних конечностей, контроль за состоянием свертывающей системы крови, введение антикоагулянтов). Питание - с момента устранения пареза желудка и кишечника, чаще всего с 3-го дня (последовательно назначают стол № 1а, 16 и 1). Продолжительность временной нетрудоспособности зависит от характера влияния послеоперационного периода и составляет в среднем 8-12 нед. Больной должен находиться на диспансерном наблюдении.
Дальнейшая информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам. Информация предназначена только для медицинских специалистов.